色谱-质谱联用法识别饮用水中新型含氮消毒副产物氯代亚胺
宋亚丽,邓 靖,冯 娇,马晓雁,李青松
(1.浙江科技学院建筑工程学院,浙江 杭州 310023;2.浙江工业大学建筑工程学院,浙江 杭州 310014;3.厦门理工学院水资源环境研究所,福建 厦门 361005)
色谱-质谱联用法识别饮用水中新型含氮消毒副产物氯代亚胺
宋亚丽1,邓靖2,冯娇2,马晓雁2,李青松3
(1.浙江科技学院建筑工程学院,浙江 杭州310023;2.浙江工业大学建筑工程学院,浙江 杭州310014;3.厦门理工学院水资源环境研究所,福建 厦门361005)
近年来,以氨基酸为前体物的含氮氯代消毒副产物成为饮用水安全保障研究领域的热点问题,其中氯代亚胺是具有嗅味特征的含氮消毒副产物,化学结构为R-CH=NCl。本研究基于气相色谱-质谱(GC/MS)法和高效液相色谱-质谱(HPLC/MS)法,鉴定识别了源于苯丙氨酸(phenylalanine, Phe)等氯代亚胺类消毒副产物;通过GC/MS谱图对其他未知消毒副产物进行定性分析,解析了苯丙氨酸氯消毒过程的转化规律。结果表明:在氯化过程中,缬氨酸(valine, Val)可生成异丙基氯代亚胺(isobutyrochloraldimine)副产物;苯丙氨酸可生成氯代苯乙亚胺(chlorophenylacetaldimine)、苯乙醛(phenylacetaldehyde)和二苯基吡啶(2,6-diphenylpyridine)等副产物;其反应途径为Phe与氯反应进行一氯取代和二氯取代生成氯代Phe和二氯代Phe,二氯代Phe能分解生成氯代苯乙亚胺类物质。采用液液萃取-HPLC分离提纯氯代苯乙亚胺,以GC/MS定量分析饮用水中氯代亚胺类消毒副产物的含量水平。结果发现,在某城市4座水厂的出厂水中均检出氯代苯乙亚胺,浓度为5.03~11.26 μg/L。这说明原水中存在氨基酸类溶解性有机氮时,消毒过程会产生氯代亚胺类消毒副产物,导致饮用水存在此类消毒副产物的污染风险。
饮用水;氨基酸;含氮消毒副产物;异丙基氯代亚胺;氯代苯乙亚胺
人类生产、生活过程中排放废物的增多,引起水源中污染物种类激增,导致水源的污染愈演愈烈。由于制水工艺控制有机污染能力有限,饮用水中消毒副产物(disinfection by-products, DBPs)的检出种类越来越多。目前确定的DBPs只是冰山一角,且多以含碳天然有机物为前体物进行因果溯源和定性。但实际上,水中含氮有机物也是有机污染的重要组成部分,且含氮DBPs(nitrogen disinfection byproducts, N-DBPs)与C-DBPs在结构和特性上明显不同。含氮有机物中的氨基酸是最常见的天然有机物,Hagedorm等[1]调查表明,地表水中可溶性含氮有机物中的氨基酸可达75%。氨基酸作为DBPs前体物的一种,在消毒过程中产生的副产物更为复杂,毒性更强,诸如卤乙腈(haloacetonitriles, HANs)、卤代硝基甲烷(halonitromethanes, HNMs)、亚硝胺(nitrosamines)、卤代乙酰胺(haloacetamides, HAcAms)等[2-8]。水体富营养化加剧,各地藻华爆发,由此引发的生物源性氨基酸释放,以及城市污水排放等外源性输入是水环境中氨基酸的主要来源。
目前,我国水厂普遍采用氯系氧化剂作为消毒剂,在氯杀菌的同时可与原水中天然存在的有机物和环境污染有机物反应产生多种氯代消毒副产物,其中有些副产物具有生物毒性,有些副产物具有降低水质的特性(如产生嗅味等)。Froese等[9-10]阐明了饮用水经氯消毒后,水中存在的多种氨基酸可产生多种短链醛;除此之外,在高Cl/N的氯化条件下,氨基酸还可能成为另外一类嗅味消毒副产物——N-氯代亚胺(N-chloroaldimine, R-CH=NCl)的前体物。从结构上看,N-氯代亚胺的碳氮双键为极性不饱和键,比碳氧双键难断裂,因此亚胺的活性低于相应的醛酮,但在亚胺氮原子上连接的吸电子取代基可增强碳氮双键的亲电性。与氯胺相比,N-氯代亚胺可稳定存在于自来水中,其半衰期与环境温度有关,20 ℃时的半衰期为50 h,15 ℃时的半衰期为几百小时,这使其足以稳定存在并到达管网末稍[11]。
作为氯消毒副产物,N-氯代亚胺的研究起源于污水处理过程[11]。随着水源中含氮有机物污染的日益严重,Freuze和Brosillon等[12-14]对氯代亚胺的研究从污水消毒副产物领域转移到饮用水领域。现已报道的文章均以配水试验为主,探讨了氨基酸为前体物时此类含氮氯消毒副产物的产生,而关于饮用水消毒副产物N-氯代亚胺的研究尚未见报道。
本研究拟采用气相色谱-质谱(GC/MS)联用技术分析氨基酸氯化过程中的消毒副产物,结合高效液相色谱(HPLC)分离提纯,液液萃取-GC/MS对苯丙氨酸主要消毒副产物苯乙亚胺进行定量分析,考察饮用水氯代亚胺类消毒副产物的污染现状,以进一步补充饮用水氯消毒风险的相关内容,为解决供水安全问题提供技术支持。
1 实验部分
1.1仪器
TSQ MS高效液相色谱-质谱联用仪,配有Luna C18毛细管柱(150 mm×2.1 mm×5 μm)和Focus-DSQ Ⅱ气相色谱-质谱联用仪:均为美国Thermo Scientific公司产品;GC-2014 GC-ECD气相色谱仪,RTX-5MS毛细管柱(30 m×0.25 mm×0.25 μm),RTX-5毛细管柱(30 m×0.25 mm×0.25 μm):均为日本Shimadu公司产品;N-EVAP-111氮吹仪:美国Organomation公司产品;Nanopure超纯水器:美国Barnstead公司产品。
1.2试剂及材料
缬氨酸(99%)、苯丙氨酸(98.5%)、甲醇(99.9%,色谱纯)、乙腈(99.9%,色谱纯)、氯仿(99.8%,色谱纯)、无水硫酸钠(99.0%):美国Fisher Scientific公司产品;氯酸钠(8.25%):美国Clorox公司产品;磷酸氢钾(98.0%)、磷酸二氢钾(98.0%):美国Alfa Aesar公司产品;实验用水:18 MΩ·cm超纯水。实验所用玻璃器皿均经超声并以去离子水洗涤,烘干备用。
1.3实验条件
1.3.1GC/MS条件进样口温度150 ℃,不分流进样;升温程序:初始温度30 ℃,保持10 min,以5 ℃/min升温至100 ℃,保持10 min,以10 ℃/min升温至150 ℃,保持2 min。质谱接口温度250 ℃,EI源,离子源温度280 ℃,全扫描模式,质量扫描范围m/z25~300。
1.3.2HPLC/MS条件流动相:纯水+1%甲酸(A),乙腈+1%甲酸(B);梯度洗脱程序:0~10 min、95%A(5%B),10~15 min、5%A(95%B),16~20 min、95%A(5%B)。电喷雾离子化电离源(ESI),喷雾电压3 000 V,离子传输毛细管温度350 ℃,鞘气压力207 kPa,质量扫描范围m/z100~1 500,扫描时间0.3 s。
1.4实验步骤
采用次氯酸钠作为消毒剂,氯消毒实验前确定有效氯浓度。所有的氨基酸氯化反应均在250 mL容量瓶中进行,反应物的氯氮比为2.0,反应溶液均采用磷酸盐缓冲溶液调节pH为7.0,置于冰水浴中搅拌反应10 min。反应后的混合液经氯仿萃取,无水硫酸钠干燥后进行GC/MS和HPLC/MS分析。
2 实验结果
2.1缬氨酸氯代消毒副产物分析及生成途径
Brosillon等[14]通过顶空-气质联用确定了缬氨酸(valine, Val)、亮氨酸(leucine, Leu)、异亮氨酸(isoleucine, Ile)、苯丙氨酸(phenylalanine, Phe)等氯化副产物,阐明了Val可产生N-氯代异丁基亚胺。本实验将缬氨酸(1.17 g)与次氯酸(有效氯浓度0.02 mol/L)于100 mL缓冲液中反应10 min,反应混合液经氯仿提纯,GC/MS进样分析,可确定产物氯代异丁基亚胺(chloroisobutaldimine)的保留时间为9.46 min,其色谱图示于图1。由于C=N键相对于R-C和N—Cl稳定,电子轰击分子过程中容易导致C=N两侧R-C和N—Cl的断裂,从而形成氯代异丁基亚胺特征碎片m/z70和m/z43,其质谱图示于图2。
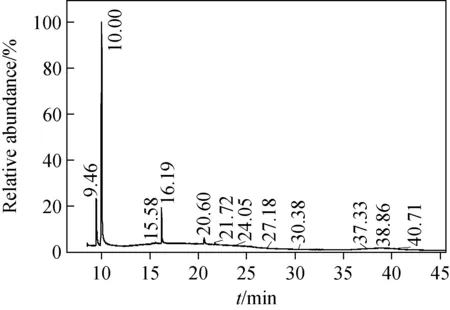
图1 缬氨酸氯代消毒副产物色谱图Fig.1 Chromatogram of chlorinated by-product originated form valine
2.2氯代苯乙亚胺的鉴定与生成途径分析
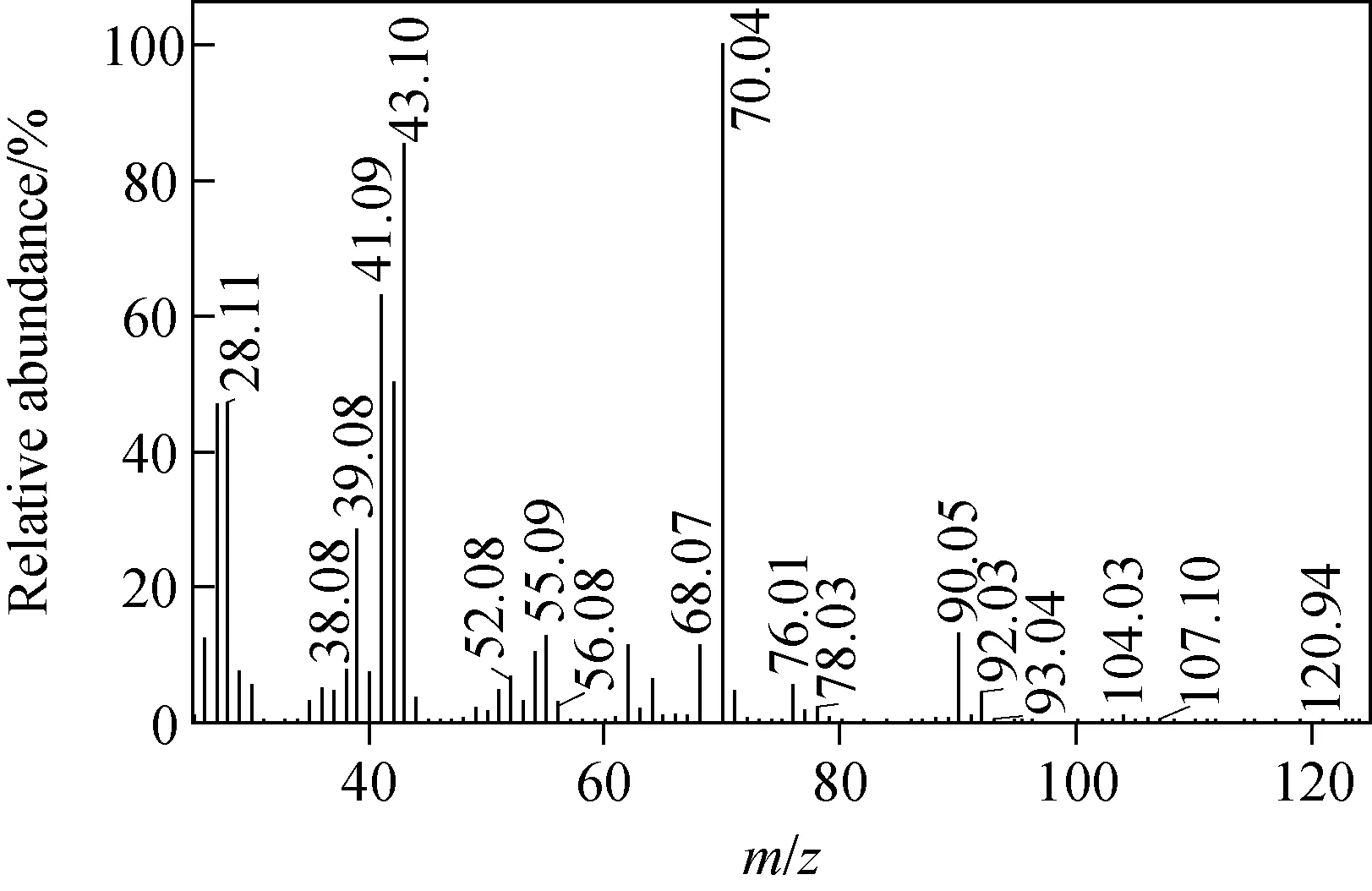
图2 氯代异丁基亚胺质谱图Fig.2 Spectrum of chloroisobutaldimine
苯丙氨酸(phenylalanine, Phe)的消毒副产物主要有3种,其色谱图示于图3a。物质1的保留时间为8.90 min,与GC/MS质谱库中苯乙醛(phenylacetaldehyde)的标准质谱图一致,因此确定该物质为苯乙醛,其质谱结构示于图4a。物质2的保留时间为10.75 min,根据文献[3]描述应为氯代苯乙亚胺(chlorophenylacetaldimine),但经NIST标准图库检索,结果却为苯乙腈(phenylacetonitrile)。为进一步鉴别该物质,进行了苯乙腈标准品GC/MS分析对比和Phe氯消毒副产物HPLC/MS分析。苯乙腈标准品的色谱图示于图3b,其保留时间为20.04 min,与图3a中消毒副产物2的保留时间不同,但副产物2与苯乙腈具有类似的质谱图(相似度低于20%),在电子轰击条件下可产生相似的碎片。为了进一步鉴定识别副产物2,将Phe消毒副产物经HPLC/MS分析,结果示于图5。由图5可知,在m/z153.00~155.00扫描范围内,保留时间为15.716 min的物质峰明显增大,且在该峰的质谱图中,m/z153.99∶m/z155.97=3∶1,说明该物质中含氯原子,且该分子质量与氯代苯乙亚胺(chlorophenylacetaldimine)相符。结合GC/MS分析结果,确定消毒副产物2为氯代苯乙亚胺。物质3的保留时间为23.86 min,经检索为2,6-二苯基吡啶(2, 6-diphenylpyridine),其质谱结构示于图4c。
Phe与氯的反应过程复杂,涉及取代、水解、缩合等反应,典型的反应路径示于图6。Phe与氯反应首先生成氯胺类物质,当Cl/N较低时,发生水解反应,生成醛类物质;当Cl/N较高时,氯胺可进一步被氯化,经缩合等反应生成腈、氯代亚胺。苯乙醛的生成途径有两种:一种是氯代Phe在HClO的作用下分解脱去HCl和CO2生成亚胺中间体,进一步水解得到苯乙醛;另一种是由二氯代Phe分解脱去HCl和CO2生成亚胺中间体,最终生成苯乙醛。二氯代Phe在HClO的作用下分解脱去HCl和CO2生成亚胺中间体N-氯代苯乙亚胺,中间体在HClO的作用下可进一步生成含氰基的苯乙腈(phenylacetonitrile)。Panzella等[8]研究表明:Phe与NaClO反应除生成常见的醛、腈和氯代亚胺类副产物外,还可生成吡啶类物质;与Phe同为芳香族氨基酸的酪氨酸(Tyr)与NaClO发生齐齐巴宾(chichibabin)缩合反应可生成3,5 -二(4-羟基苯基)吡啶。
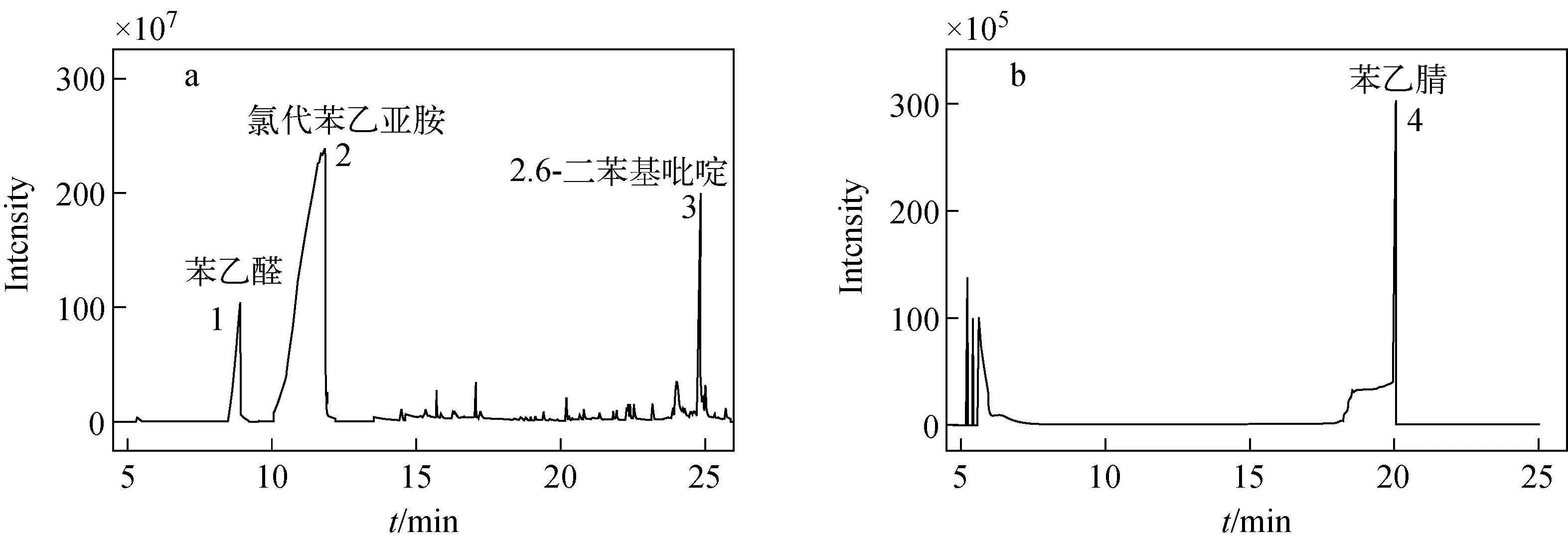
图3 Phe氯消毒副产物(a)及苯乙腈标准品(b)的色谱图Fig.3 Chromatogram comparison of phenylacetonitrile (standard) (a) and chlorinated byproducts (b) of phenylalanine
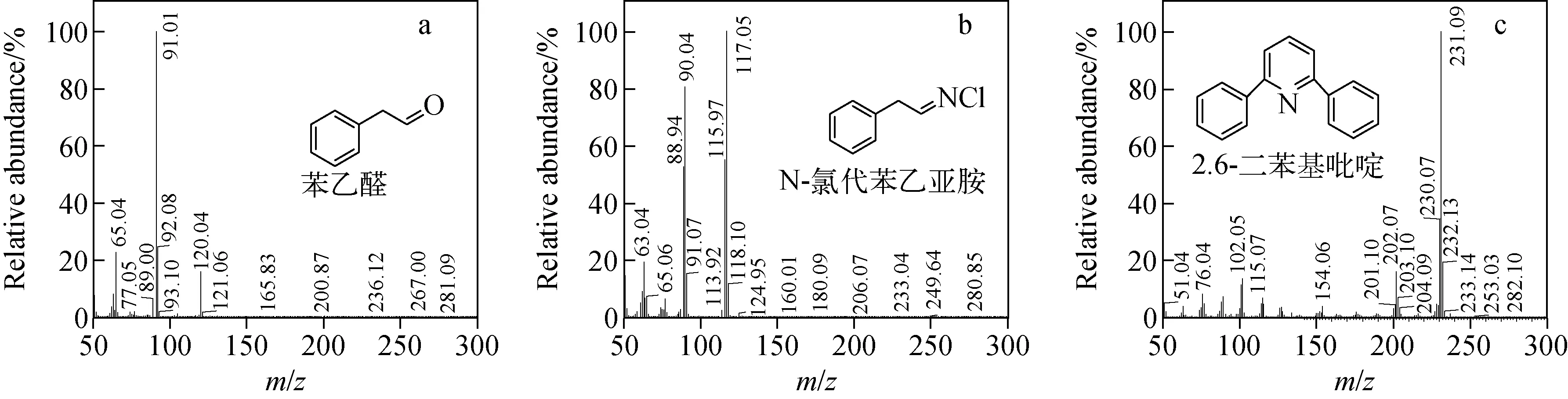
图4 Phe氯消毒主要副产物的质谱图Fig.4 Spectrums of main byproducts of phenylalanine

注:a.总离子流色谱图;b.选择离子扫描色谱图;c.质谱图图5 消毒副产物2的HPLC/MS分析结果Fig.5 Chromatograms of disinfection byproducts 2 by HPLC/MS

图6 Phe氯化产物反应途径[15-18] Fig.6 Hypothesized formation pathways of chlorinated byproducts from phenylalanine[15-18]
2.3南方某市自来水中氯代苯乙亚胺的检测
GC条件:柱温40 ℃;进样口温度150 ℃;升温程序:初始温度40 ℃,保持5 min,以10 ℃/min升至200 ℃,保持5 min;接口温度250 ℃;ECD检测器温度300 ℃;氯代苯乙亚胺出峰时间13.58 min。
将氨基酸氯化提纯制得的7.07 g/L氯代苯乙亚胺标样直接溶于1 mL甲醇,制得氯代苯乙亚胺储备液。采用纯水稀释配制46.2~770 μg/L一系列梯度浓度标准溶液,取100 mL各标准溶液,加入2 mL正己烷,以1 500 r/min液液萃取15 min,静置,取上层有机相。有机相萃取液采用GC-ECD检测,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,线性相关系数R2为0.995 6,检测限为2.5 μg/L。2015年8月取南方某市多个饮用水厂的出厂水,液液萃取进行水样富集预处理,用GC-ECD检测实际水样中氯代苯乙亚胺浓度,结果列于表1。
南方某市4座水厂以地表河流为水源,水处理工艺各不相同,但供水前均进行加氯消毒。以4座饮用水厂为考察目标,调查了出厂水中氯代苯乙亚胺的存在水平,水厂2和水厂4的水样检测色谱图示于图7。结果表明,由于地表水源暴露及接纳污染,原水有机污染指标相对较高,出厂水中均检出氯代苯乙亚胺,含量水平为5.03~11.26 μg/L,相对于其他含氮氯系消毒副产物而言[19-21],存在含量偏高的现象。
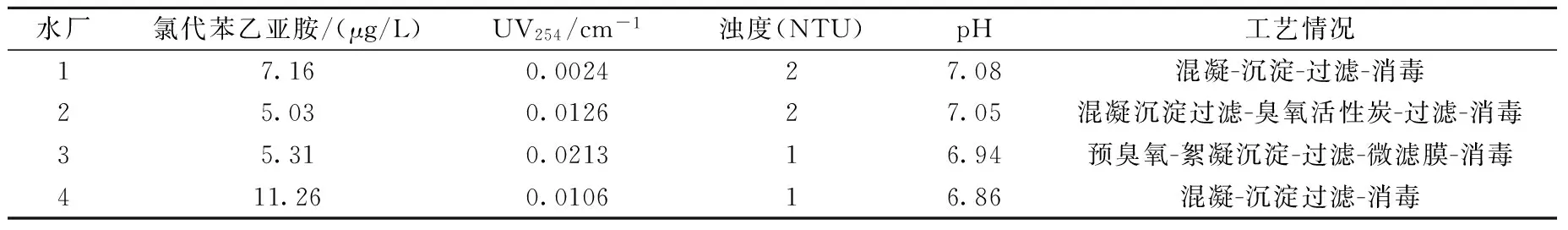
表1 某市水厂出厂水中氯代苯乙亚胺含量
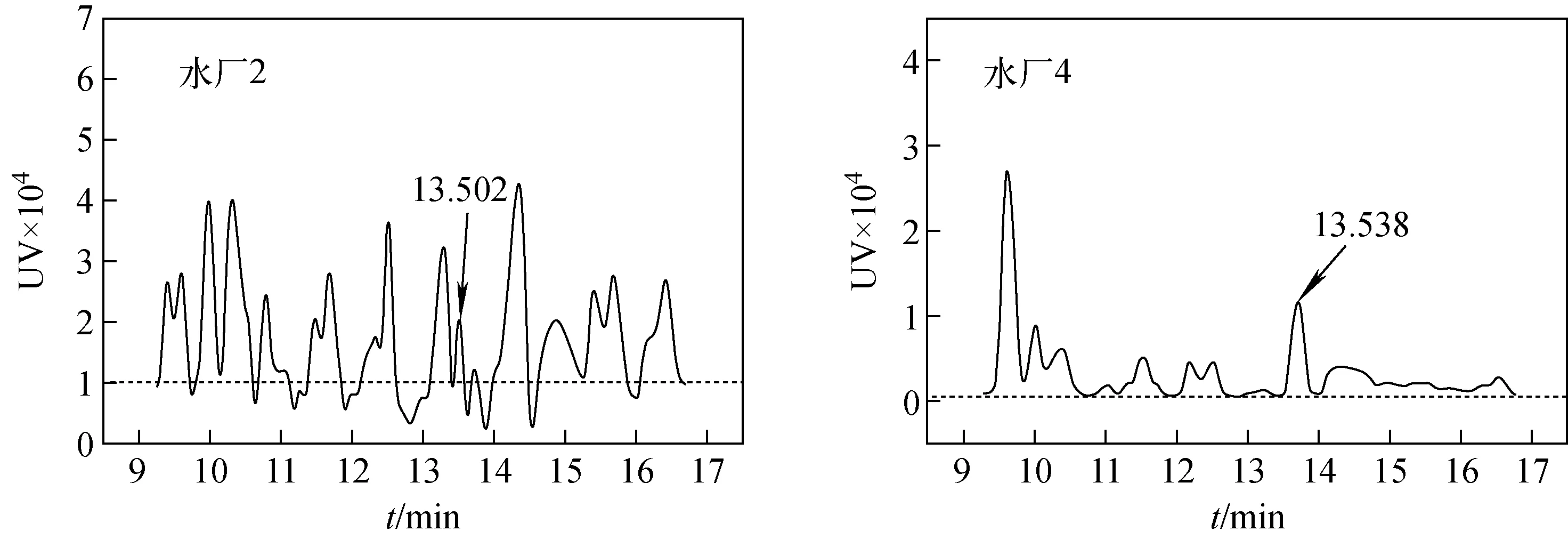
图7 某水厂出厂水中氯代苯乙亚胺色谱图Fig.7 Chromatogram of chlorophenylacetaldimine in finished water of certain waterworks
3 结论
本研究建立了水环境中含氮消毒副产物的GC/MS及HPLC/MS分析方法,鉴定并分析了以氨基酸为前体物的氯代亚胺类消毒副产物。氨基酸为前体物的新型氯代亚胺类含氮消毒副产物,包括缬氨酸氯化生成的异丙基氯代亚胺副产物,苯丙氨酸氯化生成的氯代苯乙亚胺。通过分析南方某市水厂的出厂水,检出的氯代苯乙亚胺浓度为5.03~11.26 μg/L,说明国内供水系统中存在氯代亚胺类消毒副产物污染。有关氯代亚胺类消毒副产物的嗅味、毒性等特征还需进一步研究。
[1]FRANK H, PATRICK S, PETER W, et al. Export of dissolved organic carbon and nitrogen from gleysol dominated catchments-the significance of water flow paths[J]. Biogeochemistry, 2000, 50(2): 137-161.
[2]MARK M G, ELIZABETH W D, McCALLA K, et al. Haloacetonitrilesvs. regulated haloacetic acids: Are nitrogen-containing DBPs more toxic?[J] Environmental Science and Technology, 2007, 41(2): 645-651.
[3]CHU W H, GAO N Y, DENG Y, et al. Precursors of dichloroacetamide, an emerging nitrogenous DBP formed during chlorination or chloramination[J]. Environmental Science and Technology, 2010, 44(10): 3 908-3 912.
[4]CHU W H, GAO N Y, DENG Y, et al. Formation of nitrogenous disinfection by-products from pre-chloramination[J]. Chemosphere, 2011, 85(7): 1 187-1 191.
[5]YANG L Y, KIM D, UZUN H, et al. Assessing trihalomethanes (THMs) and N-nitrosodimethylamine (NDMA) formation potentials in drinking water treatment plants using fluorescence spectroscopy and parallel factor analysis[J]. Chemosphere, 2015, 121: 84-91.
[6]YANG X, SHEN Q Q, GUO W H, et al. Precursors and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination[J]. Chemosphere, 2012, 88(1): 25-32.
[7]YANG X, CHII S, PAUL W. Factors affecting formation of haloacetonitriles, haloketones, chloropicrin and cyanogen halides during chloramination[J]. Water Research, 2007, 41(6): 1 193-1 200.
[8]YU Y, RECKHOW D A. Kinetic analysis of haloacetonitrile stability in drinking waters[J]. Environmental Science and Technology, 2015, 49(18): 11 028-11 036.
[9]FROSES K L, WOLANSKI A, HRUDEY S E. Factors governing odorous aldehyde formation as disinfection by-products in drinking water[J]. Water Research, 1999, 33(6): 1 355-1 364.
[11]INGRID F, STÉPHEN B, DORINE H, et al. Odorous products of the chlorination of phenylalanine in water: Formation, evolution, and quantification[J]. Environmental Science and Technology, 2004, 38(15): 4 134-4 139.
[12]INGRID F, STPHEN B, ALAIN L, et al. Effect of chlorination on the formation of odorous disinfection by-products[J]. Water Research, 2005, 39(12): 2 636-2 642.
[13]INGRID F, STÉPHEN B, JÉRÉMY A, et al. Impact of UV-irradiation on the formation of odorous chloroaldimines in drinking water[J]. Chemosphere, 2006, 63(10): 1 660-1 666.
[14]STEPHAN B, MARGUERITE L, EMILIE R, et al. Analysis and occurrence of odorous disinfection by-products from chlorination of amino acids in three different drinking water treatment plants and corresponding distribution networks[J]. Chemosphere, 2009, 77(8): 1 035-1 042.
[15]刘芸, 付荣恕. 氨基酸氯化消毒副产物的生成机理研究[J]. 山东林业科技,2010,40(1):86-88.
LIU Yun, FU Rongshu. Formation and mechanism of by-products during amino acids chlorination[J]. Journal of Shandong Forestry Science and Technology, 2010, 40(1): 86-88(in Chinese).
[16]CONYERS B, SCULLY F E. N-chloroaldimines. 3. chlorination of phenylalanine in model solutions and in a wastewater[J]. Environmental Science and Technology, 1993, 27(2): 261-266.
[17]WU Q Y, HU H Y, ZHAO X, et al. Characterization and identification of antiestrogenic products of phenylalanine chlorination[J]. Water Research, 2010, 44(12): 3 625-3 634.
[18]PANZELLA L, DI DONATO P, COMES S, et al. Remarkable chichibabin-type cyclotrimerisation of 3-nitrotyrosine, tyrosine and phenylalanine to 3, 5-diphenylpyridine derivatives induced by hypochlorous acid[J]. Tetrahedron Letters, 2005, 46(38): 6 457-6 460.
[19]KRASNER S W, WEINBERG H S, RICHARDSON S D, et al. Occurrence of a new generation of disinfection by-products[J]. Environmental Science and Technology, 2006, 40(23): 7 175-7 185.
[20]GOSLAN E H, KRASNER S W, VILLANUEVA C M, et al. Disinfection by-product occurrence in selected European waters[J]. Joural of Water Supply Research and Technology-AQUA, 2014, 63(5): 379-390.
[21]BOND T, HUANG J, TEMPLETON M R, et al. Occurrence and control of nitrogenous disinfection by-products in drinking water-A review[J]. Water Research, 2011, 45(15): 4 341-4 354.
Indentification of New Nitrogenous Disinfection By-products Chlorophenylacetaldmine in Drinking Water by Chromatogram Coupled with Spectrum
SONG Ya-li1, DENG Jing2, FENG Jiao2, MA Xiao-yan2, LI Qing-song3
(1.SchoolofCivilEnginneeringandArchitecture,ZhejiangUniversityofScienceandTechnology,Hangzhou310023,China; 2.CollegeofCivilEngineeringandArchitecture,ZhejiangUniversityofTechnology,Hangzhou310014,China; 3.WaterResourcesandEnvironmentalInstitute,XiamenUniversityofTechnology,Xiamen361005,China)
Nitrogenous disinfection byproducts (N-DBP) in drinking water attract more and more attention, among which chloraldimines are one kind of off-flavor N-DBP generated from different kinds of amino acids, posing the general chemical structure as R-CH=NCl. Based on GC/MS and HPLC/MS, chloroaldmines originated from valine and phenylalanine were identified. The other unknown by-products of phenylalanine were identified by GC/MS and the transformation pathway of phenylalanine was proposed. The results show that chlorination of valine (Val) can induce isobutyrochloraldimine, while phenylalanine (Phe) can induce chlorophenylacetaldimine, phenylacetaldehyde and 2, 6-diphenylpyridine. Phe reacts with chlorine to produce chlorophenylalanine and dichlorophenylalanine, which can decompose and transform to phenylacetaldehyde. Dichlorophenylalanine can also produce N-chlorophenylacetaldimine. HPLC coupled with liquid-liquid extraction was emplyed to purify chlorophenylacetaldimine, and GC/MS was used to determine the concentration. Occurrence of chlorophenylacetaldimine was measured, and the concentration ranged from 5.03-11.26 μg/L in four drinking water treatment plants of a certain city. Results show that the contamination risk of chloroaldmine exists in drinking water.
drinking water; amino acid; nitrogenous disinfection byproducts; isobutyrochloraldimine; chlorophenylacetaldimine
2015-09-22;
2015-12-21
国家自然科学基金项目(51208468,51378446);浙江省自然科学基金项目(LY16E080007);浙江省环境科学与工程重中之重开放基金(20130307);江苏省环境工程重点实验室开放基金(Zd131202)资助
宋亚丽(1974—),女(汉族),吉林人,副教授,从事饮用水微量有机污染控制研究。E-mail: yali_song@sina.com
马晓雁(1978—),女(汉族),山东人,副教授,从事饮用水安全保障技术研究。E-mail: mayaner620@163.com
O657.63
A
1004-2997(2016)02-0156-07
10.7538/zpxb.2016.37.02.0156

