低氧诱导因子-1α诱导分化的骨髓间充质干细胞复合纳米人工骨修复兔桡骨缺损
黄江鸿 杨雷 廖福朋 段莉 陈洁琳 王大平 熊建义
·实验研究论著·
低氧诱导因子-1α诱导分化的骨髓间充质干细胞复合纳米人工骨修复兔桡骨缺损
黄江鸿杨雷廖福朋段莉陈洁琳王大平熊建义
目的探讨低氧诱导因子-1α(hypoxia⁃inducible factor⁃1α,HIF⁃1α)诱导分化的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)复合纳米羟基磷灰石(nano⁃hydroxyapatite,nano⁃HA)人工骨修复兔桡骨缺损的效果。方法取兔胫骨的骨髓分离培养并鉴定BMSCs;制备携带HIF⁃1α的慢病毒表达系统,感染BMSCs后与nano⁃HA共培养得到HIF⁃1α⁃eGFP/BMSCs/nano⁃HA人工骨材料。将30 只2月龄新西兰大白兔随机分为3组,每组10只,均通过手术截骨后制成桡骨骨缺损模型,实验组填充HIF⁃1α⁃eGFP/BMSCs/nano⁃HA人工骨材料,对照组填充BMSCs/nano⁃HA,空白组不填充任何材料。于术后4、8、12周摄X线片观察骨缺损处,并于术后12周获得兔桡骨的大体标本和病理切片,比较桡骨缺损的愈合情况。结果经鉴定,分离培养得到的BMSCs形态良好,高表达CD90、CD105;所有实验动物的桡骨中段缺损模型均构建成功,通过对实验兔的大体标本、X线片及病理切片进行比较分析,实验组和对照组的骨缺损均有所修复,但实验组的新骨形成量更大,骨缺损修复能力优于对照组,空白组骨缺损区未能得到修复。结论HIF⁃1α诱导分化的BMSCs与nano⁃HA复合制成的HIF⁃1α⁃eGFP/BMSCs/nano⁃HA复合人工骨具有良好的骨缺损修复能力,可能成为一种理想的骨缺损修复材料。
低氧诱导因子;间充质干细胞;羟基磷灰石;骨代用品
骨缺损是临床上常见的一种疾病,主要表现为骨结构的完整性被破坏,是目前骨科临床治疗的难题之一。创伤、感染、肿瘤、骨髓炎手术清创以及各种先天性疾病是导致骨缺损的主要原因[1]。如何对各种原因引起的骨缺损进行有效的修复是现阶段研究的主要方向。
低氧诱导因子-1(hypoxia⁃inducible factor⁃1,HIF⁃1)是Semenza等[2]于1992年发现的一种氧依赖转录激活因子,通过与低氧反应元件(HRE)结合,引发下游基因转录,通过对其下游靶基因的诱导表达,调控血管生成、能量代谢、细胞增殖迁移分化等反应[3,4]。大量体外和体内实验研究报道都证实了HIF ⁃1α在促进血管化及成骨化方面有着积极的作用。张劲娥等[5]构建了野生型和点突变型HIF⁃1α基因慢病毒真核表达载体,并转染兔骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),发现其转染后可促进兔BMSCs成骨基因的表达。Ding等[6]将HIF⁃1α基因转染到BMSCs中,并移植入早期激素性股骨头坏死家兔模型中,结果表明HIF⁃1α基因转染可提高离体骨髓细胞成骨相关基因mRNA的表达,在体外增强成骨细胞的活性,在体内增强血管生成活性,说明HIF⁃1α转基因自体骨髓干细胞转移可以促进激素性股骨头坏死区的修复。
BMSCs是存在于骨髓中的一类非造血干细胞,在一定条件下可定向分化为多种细胞,如脂肪细胞、软骨细胞或成骨细胞等[7⁃9]。纳米羟基磷灰石(nano⁃hydroxyapatite,nano⁃HA)是目前应用广泛的一种生物活性材料,具有良好的骨传导性和生物相容性。本研究将重组HIF⁃1α慢病毒质粒感染BMSCs后,与nano⁃HA人工骨复合培养,使骨修复材料具备良好骨传导和骨诱导性能,并通过动物实验对复合人工骨的修复能力进行检测,以此解决人工骨修复材料在骨缺损区与周边自体骨之间有效“骨整合”的难题,从而为临床修复骨缺损提供一些实验依据。
材料与方法
一、材料与试剂
慢病毒HIF⁃1α表达质粒、293T细胞、nano⁃HA人工骨(孔隙直径为150~300 μm、孔隙率为92%以上)由深圳市第二人民医院组织工程实验室制备提供;新西兰大白兔,雄雌不限,2月龄(2 kg左右),由深圳市疾病预防控制中心提供。
Lenti⁃Pac HIV表达包装试剂盒(GeneCopoeia公司,美国),H⁃DMEM培养基、PBS缓冲液(HyClone公司,美国),Opti⁃MEMI、0.25%Trypsin⁃EDTA、胎牛血清(FBS)、双抗(青霉素+链霉素)、噻唑蓝、二甲基亚砜(Gibco公司,美国),Anti⁃CD90/FITC、Anti⁃CD105/ FITC、Anti⁃CD45/FITC、Anti⁃CD34/FITC、维生素C、3-甘油磷酸钠、地塞米松、胰岛素、戊巴比妥钠、番红、素木精、快绿(Sigma公司,美国)。
二、兔BMSCs的分离、培养和鉴定
1.分离和培养新西兰大白兔静脉注射2%戊巴比妥钠,全身麻醉,局部去毛、消毒,于兔后腿股骨大转子处行骨髓穿刺,将5 ml注射器预装0.1 ml肝素,抽取约3 ml骨髓。离心、洗涤。将洗涤后的细胞悬液加入5 ml含有10%FBS、1%双抗的H⁃DMEM培养液中,置于直径75 mm的培养皿中,5%CO2和37℃培养箱中培养。48 h后首次换液,之后每2~3 d换液1次。
2.形态鉴定待贴壁生长的细胞集落达到85% ~90%融合时,用0.25%胰酶消化细胞,按1∶2比例传代培养,每2~3 d换液1次,倒置显微镜下观察细胞形态。
3.表面标记鉴定取第3代生长状态良好、处于对数生长期的兔BMSCs。洗涤,离心,计数,将细胞浓度调整为5×106个/ml。取100 μl细胞悬液,分别加入20 μlanti⁃CD90/FITC、Anti⁃CD105/FITC、Anti⁃CD45/FITC、Anti⁃CD34/FITC,避光室温孵育20 min,PBS液洗涤细胞,1 000 r/min,离心5 min。加入PBS液400 μl,重悬细胞,流式细胞仪进行检测,使用Beckman Coulter软件采集数据。
三、慢病毒包装及滴度测定
取长势良好、对数期生长的293T细胞,37℃、5%CO2饱和湿度条件下接种、孵育。取HIF⁃1α质粒10 μl,按Lenti⁃Pac HIV表达包装试剂盒步骤操作。48 h后收集培养基,离心除去细胞杂质碎片,即获得包含慢病毒载体颗粒的培养基溶液。
采用PEG法浓缩病毒颗粒,并测定病毒滴度,病毒滴度=感染细胞数×GFP阳性率×病毒稀释倍数/病毒量。
四、HIF⁃1α慢病毒质粒转染兔BMSCs
(1)取生长状况良好、处于对数生长期的BM⁃SCs,消化,反复吹打制成细胞悬液。
(2)将细胞悬液接种在6孔板中,调整每孔细胞数约为5×104个,置于37℃、5%CO2细胞培养箱中培养;待细胞融合度约为85%时进行下一步操作。
(3)用24孔板预实验,设置MOI值(病毒与需要感染的细胞数的比值)分别为1、2、5、10、20、50、100的7个感染组,确定最佳MOI值为50 TU/cell。
(4)根据病毒滴度配置相应浓度的病毒稀释液和对照eGFP的病毒稀释液。
(5)转染前吸弃各组培养液,PBS清洗1次。实验组中加入2 ml病毒稀释液,对照组中加入2 ml eGFP病毒稀释液,空白组中加入2 ml培养液,常规培养孵育48 h。
(6)倒置荧光显微镜下观察细胞转染情况。
五、复合人工骨材料制备
(1)将nano⁃HA人工骨材料大小裁剪为8 mm× 3 mm×3 mm大小,在75%乙醇内浸泡30 min,PBS中浸泡1 h,上述过程重复3次,紫外线下照射1 h。
(2)将消毒后的nano⁃HA浸润在含兔BMSCs培养基的6孔板内24 h,以充分湿润材料表面及内部。
(3)取转染HIF⁃1α后的BMSCs,消化,离心,沉淀,用培养基重悬细胞,将细胞浓度调整至1×105个/ ml,接种到6孔板中已润湿的nano⁃HA材料表面。置于细胞培养箱中培养2 h后将材料翻面再次接种细胞,每次接种时nano⁃HA材料要求被细胞悬液浸透。置于培养箱中继续培养,制备得到HIF⁃1α⁃eGFP/BMSCs/nano⁃HA复合人工骨。
(4)同理,将未转染HIF⁃1α的BMSCs种植到na⁃no⁃HA表面,得到BMSCs/nano⁃HA复合人工骨。
六、不同人工骨修复兔桡骨骨缺损
采用随机数字表法将30只健康2月龄新西兰大白兔平均分为3组(实验组、对照组和空白组)。
所有实验兔于实验前禁食8 h,经耳缘静脉缓慢注射3%戊巴比妥钠(1 ml/kg)行全身麻醉。在无菌手术台上常规固定实验兔,备皮消毒和铺巾,分别取其双耳桡侧皮肤表面中段作1.5 cm纵行切口,仔细分离皮下组织,充分暴露桡骨干。于中段用线锯截骨后制成1.0 cm桡骨骨缺损模型,实验组植入HIF⁃1α⁃eGFP/BMSCs/nano⁃HA复合人工骨,对照组植入BMSCs/nano⁃HA复合人工骨,空白组不植入。予生理盐水反复冲洗术区,彻底止血,肌肉组织包埋,逐层缝合创口,加压包扎无菌敷料。麻醉清醒后分组放入兔笼,单笼饲养,自由活动。术后对所有实验兔肌注双抗,2×105U/次,1次/d,共3 d。无菌饲料室温喂养,洁净饮水,自由活动。
观察各组实验兔术后的饮食、活动、步态及伤口感染、愈合情况,于术后12周取标本时观察植入材料表面情况、骨缺损处的骨痂形成、断端髓腔再通情况。术后4、8、12周分别对所有实验兔的手术部位进行X线检查,观察材料吸收和骨愈合情况。于术后12周,用空气栓塞法处死实验兔,手术取出双侧桡骨标本。截取骨缺损修复处及上下缘约5 mm正常桡骨组织,福尔马林固定,依次进行脱钙、脱水、透明、包埋等常规骨质切片处理,每组5个样本,HE染色,观察关节骨缺损处骨痂形成及骨材料降解情况。
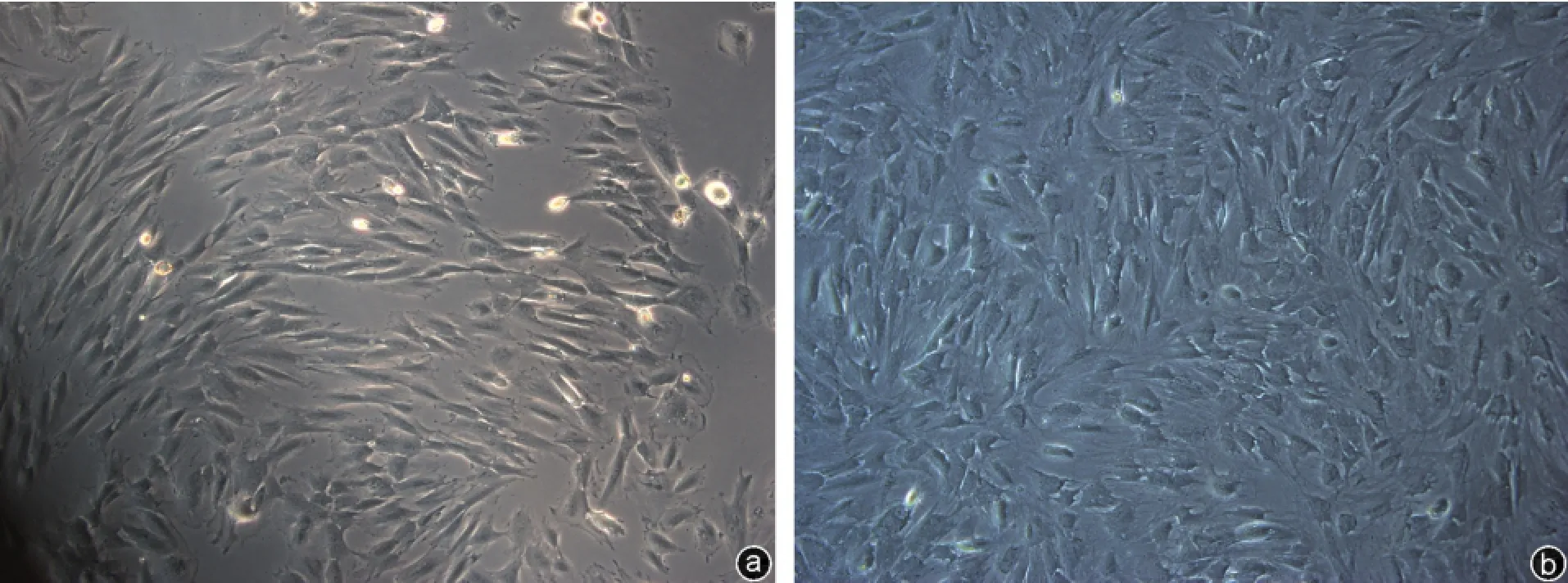
图1 倒置显微镜(×100)下,第1代BMSCs(a)和第3代BMSCs(b)的形态
结果
一、慢病毒包装
以慢病毒Lenti⁃HIF⁃1α⁃eGFP和Lenti⁃Pac HIV混合包装质粒为载体成功感染293T细胞,收集、浓缩、量化,得出病毒滴度为7.8×109IU/ml。
二、兔BMSCs的鉴定
经全骨髓贴壁法原代培养获得的兔BMSCs,细胞生长状态良好,有生长晕,立体感强,细胞生长达90%融合时,表现为平行或漩涡状分布。在倒置显微镜下,BMSCs形态均一,呈梭形(图1)。
流式细胞仪检测结果显示第3代BMSCs表面强表达特异性抗原CD90、CD105(阳性率为99.3%,图2a),不表达造血干细胞表面特异性抗原CD34、CD45(图2b),表明BMSCs培养成功。
三、慢病毒载体感染BMSCs的效率
用50 MOI病毒感染BMSCs,48 h后,倒置荧光显微镜下观察,约有80%细胞荧光表达呈阳性(图3),表明细胞的感染效率为80%左右。
四、实验兔的一般情况
所有实验动物的桡骨中段缺损模型均构建成功,每组动物术后一周活动较少,1周后活动、饮食均恢复正常,精神状态活跃,伤口愈合良好,皮下和肌肉组织无充血、肿胀、渗出、伤口感染,植入材料无裸露,正常肢体活动较好,无跛行,无实验动物死亡。
五、大体标本形态观察
术后12周获得3组兔的桡骨标本。实验组材料完全降解,被骨痂及骨组织填充,形成骨性连接,表面连续平整,骨缺损基本修复(图4a);对照组材料部分降解,缺损区充满骨痂组织,与正常骨组织连接较紧密,界面不明显,骨缺损部分修复(图4b);空白组可见两断端骨质硬化,未见明显骨痂生长,与尺骨部分连接,骨缺损未能得到修复(图4 c)。
六、X线表现
1.实验组4周时材料部分降解,薄云雾状阴影出现在正常骨组织连接处,边界变模糊,周围骨痂形成量多(图5a);8周时材料大部分降解,与骨质交界处结合更紧密,分界不清、模糊,并可见较高密度骨痂影,大量骨痂生成,新骨向中央处生长(图5b);12周时材料完全降解,长出新生骨组织,骨髓腔再通,骨折线融合,骨缺损基本修复(图5 c)。
2.对照组4周时材料少部分降解,与正常骨组织边界模糊,有小片的云雾状阴影,骨痂形成量少(图5 d);8周时材料降解不多,骨缺损部位连接少量骨痂(图5 e);12周时材料部分降解,边界模糊,缺损区形成分布不均匀的连续性骨痂,骨髓腔部分再通,骨缺损处部分修复(图5 f)。
3.空白组12周时骨缺损区无骨性连接,仅见断端少量骨痂样阴影,部分与尺骨相接,形成骨不连,骨髓腔未通,骨缺损未能修复(图5 g)。
七、组织切片表现

图2 流式细胞仪检测结果显示:第3代BMSCs表面强表达特异性抗原CD90、CD105(a),不表达造血干细胞表面特异性抗原CD34、CD45(b)

图3 Lenti⁃HIF⁃1α⁃eGFP感染兔BMSCs 48 h后,普通显微镜视野(×200,a)及荧光显微镜视野(×200,b),约有80%细胞荧光表达呈阳性
1.实验组植入材料完全降解,皮质骨形成,分布稍不规则,可见大量成骨细胞及少量纤维结缔组织,骨髓腔重新贯通,可见部分骨髓组织生成,有多量脂肪组织,骨缺损基本修复(图6a)。
2.对照组植入材料部分降解,少量新生骨组织填充缺损区,骨髓腔未完全形成,缺损部分修复(图6b)。
3.空白组骨缺损区仅有少量骨痂及纤维结缔组织生成,髓腔两端封闭,骨缺损未能修复(图6 c)。

图4 术后12周,观察组标本新骨形成,材料完全吸收,骨缺损基本修复(a);对照组标本中材料部分降解,骨缺损部分修复(b);空白组标本中两断端骨质硬化,骨缺损未修复(c)

图5 各组实验兔桡骨不同时间点的X线片
讨论
一、HIF⁃1α基因在骨缺损修复中的成骨作用
HIF⁃1α是HIF⁃1的活性亚基,同时又作为HIF⁃1的调节亚基,其空间构象稳定性及其转录活性与细胞内氧浓度有关[10,11]。作为一种非常有效的细胞因子,HIF⁃1α通过调控其下游基因的表达,促进血管生成、加速成骨细胞的转移,并提供养分促使干细胞成骨分化。HIF⁃1α可直接或间接促进成骨因子(如BMP2)生成,促进血管内皮细胞的黏附和新生血管形成,促进BMSCs的细胞增殖和分化,在骨缺损的成骨细胞修复过程中发挥重要作用。
二、BMSCs的成骨诱导分化作用
BMSCs为多向分化潜能的干细胞,可诱导成骨、成软骨,来源广泛、取材方便,对动物体产生的创伤小,操作简便,易分离培养,在体外仍可保持多分化的潜能,植入缺损部位可高度增殖且不引起免疫排斥反应,可诱导分化成骨、软骨、血管等多种组织,从而参与骨缺损的修复以及组织的再生,是目前骨组织工程中的较为理想的种子细胞[12]。
本研究通过直接离心贴壁分离培养BMSCs,光镜和电镜下观察BMSCs的生长、传代以及与材料黏附情况,从细胞形态观察和流式细胞仪检测细胞表面抗原两方面进行鉴定。结果显示从新鲜兔骨髓穿刺液中分离培养获得的细胞具有BMSCs的一般生物学特性[13,14]:细胞为典型的梭形或多角形,呈漩涡状贴壁生长,高表达间充质干细胞的特异性抗原CD90、CD105,阴性表达CD34、CD45。
三、HIF⁃1α⁃eGFP/BMSCs/nano⁃HA的修复力
骨移植材料的转归取决于材料自身性质、与新生骨质及周围组织的相互作用。移植材料的骨传导作用在骨缺损修复过程发挥起关键作用[17]。即移植材料作为类似桥梁支架作用,为周围的血管和细胞生长提供平台,随着新骨组织形成、移植材料也逐渐被降解吸收。骨修复材料移植后,在体内发生一系列组织及生物学改变[18]:①机体骨床的微小血管向骨修复材料内部生长,同时促进周围的BMSCs向支架内迁徙、增殖;②骨修复材料表面附着的BMSCs与机体内的BMSCs共同参与造骨过程;③骨修复材料随着组织的生长,在细胞及内环境作用下逐渐分解并吸收,而在缺损部位形成的新骨组织也逐渐替代骨修复材料,完成骨质的连续性和重新塑形。
本研究中,实验组的X线结果显示nano⁃HA人工骨材料完全降解,单纯的nano⁃HA本身为不可降解材料,但是nano⁃HA与BMSCs复合则形成了可吸收的nano⁃HA人工骨材料,由于nano⁃HA具有良好的生物相容性,有利于BMSCs细胞黏附和细胞因子等物质的亲和。而且nano⁃HA具有庞大粗糙的表面积,为BMSCs细胞的黏附、增殖和分化提供了良好的场所,有助于HIF⁃1α及其下游基因的持续表达。再者nano⁃HA的多孔结构有利于血管的生产和伸展,促进BMSCs细胞的迁移、增殖,并保证营养物质的传输和废物的排泄通畅,为细胞在材料内生长及表达HIF⁃1α提供了营养支持。正是因为nano⁃HA的孔隙结构以及纳米材料本身所特有的“纳米效应”,极大地增加了材料的表面积,为骨基质的形成以及钙盐沉积提供了良好的支架结构,所以构建的nano⁃HA人工骨在体内逐渐被新生骨组织降解吸收,从而达到修复骨缺损的良好效果[19]。
HIF⁃1α⁃eGFP/BMSCs/nano⁃HA复合人工骨材料,通过无机成分nano⁃HA,增加复合材料的骨传导性能。首先机体新生骨痂、微小血管通过爬行作用将人工骨包裹,使之起到充填和连接骨缺损的作用。其次人工骨中的空隙多孔结构有利于周围的细胞、毛细血管的附着和增生,逐渐分化为新骨组织,同时nano⁃HA逐渐分解,最终被新骨组织替代。HIF ⁃1α⁃eGFP/BMSCs成分主要通过HIF⁃1α促进BMSCs向成骨细胞分化,同时调控其下游基因的表达,利于骨缺损处的成骨分化及血管再生,为BMSCs提供良好的细胞外环境,促进骨缺损修复。

图6 各组实验兔的组织病理切片(HE染色,×100)
[1]Macchiarini P,Jungebluth P,Asnaghi MA,etal.Clinical transplan⁃tation ofa tissue⁃engineeredairway[J].Lancet,2008,372(9655):2023⁃2030.
[2]Semenza GL,Wang GL.A nuclear factor inducedby hypoxia via de novo protein synthesisbinds to the human erythropoietin gene enhancerata site required for transcriptionalactivation[J].Mol Cellbiol,1992,12(12):5447⁃5454.
[3]Chen K,Shi P,Teh TK,etal.In vitro generation ofa multilayered osteochondral construct withan osteochondral interface using rab⁃bitbone marrow stromal cellsanda silk peptide⁃based scaf⁃fold[J].J Tissue Eng Regen Med,2013.[Epubahead of print]
[4]LinbN,Whu SW,Chen CH,etal.Bone marrow mesenchymal stem cells,platelet⁃rich plasmaand nanohydroxyapatite⁃type I col⁃lagenbeads were integral parts ofbiomimeticbone substitutes forbone regeneration[J].J Tissue Eng Regen Med,2013,7(11):841⁃854.
[5]张劲娥,王淑红,张忻,等.低氧诱导因子1α慢病毒载体转染骨髓间充质干细胞的成骨基因表达[J].中国组织工程研究,2014,18(1):57⁃62.
[6]Ding H,Gao YS,Hu C,etal.HIF⁃1α transgenicbone marrow cells can promote tissue repair in cases of corticosteroid⁃induced osteo⁃necrosis of the femoral head in rabbits[J].PLoS One,2013,8(5):e63628.
[7]Huri PY,Huri G,Yasar U,etal.Abiomimetic growth factor deliv⁃ery strategy for enhanced regeneration of iliac crest defects[J].biomed Mater,2013,8(4):045009.
[8]Kim TH,Oh SH,Chun SY,etal.Bone morphogenetic proteins⁃im⁃mobilized polydioxanone porous particlesasanartificialbone graft[J].Jbiomed Mater Resa,2014,102(5):1264⁃1274.
[9]Song X,Liu S,Qu X,etal.BMP2and VEGF promoteangiogenesisbut retard terminal differentiation of osteoblasts inbone regenera⁃tionby up⁃regulating Id1[J].Actabiochimbiophys Sin(Shang⁃hai),2011,43(10):796⁃804.
[10]Xia Y,Choi HK,Lee K.Recentadvances in hypoxia⁃inducible fac⁃tor(HIF)⁃1 inhibitors[J].Eur J Med Chem,2012,49(1):24⁃40.
[11]Liu D,Hu L,Zhang Z,etal.Construction of humanbMP2⁃IRES⁃HIF1αmuadenovirus expression vectorand its expression in mes⁃enchymal stem cells[J].Mol Med Rep,2013,7(2):659⁃663.
[12]Löfgren H,Engquist M,Hoffmann P,etal.Clinicaland radiolog⁃ical evaluation of Trabecular Metaland the Smith-Robinson tech⁃nique inanterior cervical fusion for degenerative disease:a pro⁃spective,randomized,controlled study with 2⁃year follow⁃up[J]. Eur Spine J,2010,19(3):464⁃473.
[13]Chae KS,Kang MJ,Lee JH,etal.Opposite functions of HIF⁃α iso⁃forms in VEGF inductionby TGF⁃β1 under non⁃hypoxic condi⁃tions[J].Oncogene,2011,30(10):1213⁃1228.
[14]李秀森,郭子宽,杨靖清.骨髓间充质干细胞的生物学特性[J].解放军医学杂志,2000,25(5):346.
[15]Escors D,Breckpot K.Lentiviral vectors in gene therapy:their cur⁃rent statusand future potential[J].Arch Immunol Ther Exp(Warsz),2010,58(2):107⁃119.
[16]Schambacha,Zychlinski D,Ehrnstroemb,etal.Biosafety fea⁃tures of lentiviral vectors[J].Hum Gene Ther,2013,24(2):132⁃142.
[17]Webster TJ,Ergun C,Doremus RH,etal.Enhanced osteoclast⁃like cell functions on nanophase ceramics[J].Biomaterials,2001,22(11):1327⁃1333.
[18]Murphy WL,Simmons CA,Kaigler D,etal.Bone regeneration viaa mineral substrateand inducedangiogenesis[J].J Dent Res,2004,83(3):204⁃210.
[19]Kaigler D,Wang Z,Horger K,etal.VEGF scaffolds enhancean⁃giogenesisandbone regeneration in irradiated osseous defects[J]. Jbone Miner Res,2006,21(5):735⁃744.
HIF⁃1α⁃inducedbone marrow mesenchymal stem cells combined with complex nano⁃artificialbone re⁃pairing rabbitbone defects.
HUANG Jianghong,Y
ANG Lei,LIAO Fupeng,DUAN Li,CHEN Jielin,WANG Daping,XIONG Jianyi.National Key Orthopaedic Department,Shenzhen Second People's Hospital;Shenzhen Tissue Engineering Key Laboratory,Shenzhen 518035,China
XIONG Jianyi,E⁃mail:jianyixiong@126.com
ObjectiveTo investigate the effect of theartificialbone which composedby hypoxia⁃inducible factor⁃1α(HIF⁃1α)⁃inducedbone marrow mesenchymal stem cells(BMSCs)and nano⁃hydroxyapatite (nano⁃HA)in repairing rabbit radius defect.MethodsThebMSCs were isolated from the tibia of rabbits,cul⁃turedand identified.The lentivirus of HIF⁃1α was preparedand HIF⁃1α⁃eGFP/BMSCs/nano⁃HAartificialbone material was producedby co⁃culturingbMSCs infected with HIF⁃1α lentivirusand nano⁃HA.Thirty New Zea⁃land white rabbits were divided into 3 groupsat random.The radialbone defect model was establishedby surgi⁃cal osteotomy.The radius defects in experimental group were filled with HIF⁃1α⁃eGFP/BMSCs/nano⁃HA,those in control group withbMSCs/nano⁃HA,and those inblank group with nothing.Thebone defect was observedat 4th,8thand 12th weekafter operationby X⁃ray examination,and the healing of radial defect was compared grosslyand pathologicallyat 12th weekafter operation.ResultsThebMSCs had good formand high expres⁃sion of CD90and CD105.The radialbone defect models were successfully constructed.Thebone defects in ex⁃perimental groupand control group healed to some extent,but the newbone formation in the experimental group was greater,and the repairability wasbetter than in the control group.ConclusionThe HIF⁃1α⁃eGFP/BM⁃SCs/nano⁃HA compositeartificialbone processesa goodability to repair thebone defect,and is expected tobe⁃comean ideal material for repairingbone defect.
Hypoxiainducible factor;Mesenchymal stem cells;Hydroxyapatites;Bone substitutes
·骨科护理·
10.3969/j.issn.1674⁃8573.2016.03.013
深圳市科技研发资金项目(CXZZ20140813160132596,JCYJ20130401112820839)
518035广东深圳,深圳市第二人民医院骨科、深圳市组织工程重点实验室
熊建义,E⁃mail:jianyixiong@126.com
2015⁃09⁃04)