血清游离脂肪酸代谢及成分变化与2型糖尿病患者大血管并发症的关系
李 哲,王瑞英,张志成
血清游离脂肪酸代谢及成分变化与2型糖尿病患者大血管并发症的关系
李 哲,王瑞英,张志成
目的 探讨2型糖尿病(type 2 diabetes mellitus,T2DM)患者血清游离脂肪酸(free fatty acid,FFA)与大血管病变的关系。方法 选取河北医科大学第二附属医院2010年12月—2012年1月住院的T2DM患者173例;其中,无大血管病变T2DM 36例[A组,年龄(55.7±5.9)岁],并发1种大血管病变59例[B组,年龄(56.7±9.7)岁],并发2种大血管病变58例[C组,年龄(58.3±7.4)岁],并发3种及3种以上大血管病变20例[D组,年龄(59.8±8.9)岁]及正常对照组41例健康人[N组,年龄(54.2±7.4)岁],采用气相色谱外标定法,进行血清FFA含量和成分的测定。结果 T2DM患者总脂肪酸(total fatty acid,TFA)、饱和脂肪酸(saturated fatty acid,SFA)、多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)均显著升高(P<0.05)。SFA中软脂酸(C16∶0)、硬脂酸(C18∶0)、二十四烷酸(C24∶0)在T2DM患者中明显升高(C16∶0、C18∶0 P<0.01,C24∶0 P<0.05)。单不饱和脂肪酸(monounsaturated fatty acid,MUFA)中油酸(C18∶1)显著升高(P<0.05)。PUFA中亚油酸(C18∶2)显著升高(P<0.01),二十二碳六烯酸下降明显(P<0.01)。大血管病变组组间脂肪酸成分比较,TFA、MUFA、SFA及C16∶0、C18∶0、C18∶1在A组、B组、C组、D组中随血管病变严重程度显著升高。两两比较:C组和D组的C16∶0、C18∶0、C18∶1及SFA、MUFA、TFA均较A组显著升高(P<0.05);C组的C18∶0、D组C18∶1和MUFA较B组高(P<0.05)。结论 T2DM患者体内脂肪酸成分的改变是脂代谢紊乱早期指标之一,并参与大血管病变的发生。
2型糖尿病;脂代谢紊乱;游离脂肪酸;大血管病变
[Abstract]Objective To discuss the relationship between the serum free fatty acid(FFA)composition and macrovascular complications in type 2 diabetes mellitus(T2DM).Methods One hundred and seventy-three cases of T2DM patients in the second hospital of hebei medical university between December 2010 and January 2012 were selected,and divided into four groups.Group A,36 cases,without macrovascular complications in T2DM patients,the age was(55.7±5.9)years old. Group B,59 cases,with 1 kind of macrovascular complications in T2DM patients,the age was(56.7± 9.7)years old.Group C,58 cases,with 2 kinds of macrovascular complications in T2DM patients,the age was(58.3±7.4)years old.Group D,20 cases,with 3 kinds of macrovascular complications in T2DM patients,the age was(59.8±8.9)years old.Fourty one healthy people were compared as normal group,group N,the age of(54.2±7.4)years old.Tested the serum FFA content and composition by gas chromatography of external standard method.Results Levels of total fatty acids(TFA),saturated fatty acids(SFA),polyunsaturated fatty acids(PUFA)in diabetes patients were significantly higher than those in the healthy control(P<0.05).The palmitic acid(C16∶0),stearic acid(C18∶0),lignoceric acid(C24∶0)levels were significantly increased in the diabetes(C16∶0,C18∶0,P<0.01,C24∶0(P<0.05).Oleic acid(C18∶1)level and linoleic acid (C18∶2)level were significantly higher than the normals(P<0.05).Docosahexaenoic acid level was decreased significantly(P<0.01).The total fatty acids,C16∶0,C18∶0,C18∶1 levels in groupA,group B,group C,group D were remarkable correlated with the severity of vascular lesions. Conclusion For type 2 diabetic patients,the change of free fatty acids component,as an early index of lipid metabolic disorder,was closely related to large vascular lesions.
1 资料与方法
1.1研究对象 选取河北医科大学第二附属医院2010年12月—2012年1月住院的T2DM患者173例,均符合1999年世界卫生组织糖尿病诊断标准;其中,男性100例、女性73例,年龄34~93(56.7± 10.9)岁。根据有无大血管并发症进行分组:A组为单纯T2DM患者无大血管病变36例,男性24例、女性12例,年龄(55.7±5.9)岁;B组为合并1种大血管病变患者59例,男性36例、女性23例,年龄(56.7±9.7)岁;C组为合并2种大血管病变58例,男性31例、女性27例,年龄(58.3±7.4)岁;D组为合并3种及3种以上大血管病变20例,男性9例、女性11例,年龄(59.8±8.9)岁;正常对照组(N组)为健康查体无异常发现且无糖尿病家族史41例,男性25例、女性16例,年龄39~75(54.2±7.4)岁。
1.1.1判断标准 具有下列至少1项者确定为糖尿病合并大血管病变[2]:①冠心病,具有冠心病或心肌梗死病史,经心电图、动态心电图、冠状动脉造影等确诊为冠心病;②脑血管病变,经头CT或MRI检查确诊为脑梗死或脑出血;③周围血管病变,间歇性跛行、疼痛、严重供血不足致坏疽,下肢血管或颈动脉彩色多普勒超声检查示动脉粥样硬化斑块形成或血栓形成;④高血压,原有高血压病史或3次非同日血压值达到或超过140/90 mmHg。
1.1.2排除标准 近2周有急性感染性疾病、肝功能异常、尿毒症、甲状腺疾病、酮症或酮症酸中毒者。所有患者4周内均未应用降脂药物。
1.2方法
1.2.1研究方法 所有受试者测量身高、体质量,计算体质指数(body mass index,BMI)和体脂百分比(percentage of body fat,PBF)。BMI=体质量/身高2(kg/m2),PBF=1.2×BMI+0.23×年龄-A(男性16.2、女性5.4)[3-4]。血压测定:以不同日同时间3次血压取平均值。
所选受试者于空腹8~12 h后采肘静脉血10 mL。4 mL血样本放置30 min以上凝结后,以5 000 r/min,离心10 min,将分离后的血清用离心管分装密封后,置于-70℃冰箱保存,用于脂肪酸成分的测定。血脂采用美国Beckman LX20自动生化分析仪检测。
1.2.2脂肪酸测定 待测血浆3 mL经提取、酯化后进样1 μL,气相色谱仪(美国Agilent7890A)进行分离与测定。脂肪酸甲酯标准品为美国Sigma公司产品。聚乙二醇柱Agilent DB-WAX(30 m×0.53 mm× 1.0 μm),柱温初始150℃(1 min),以10℃/min速度升至190℃(58 min)、再以20℃/min升至230℃(20 min),载气为氮气,流速80 cm/s,分流比10∶1,外标法定量。脂肪酸测定有总脂肪酸(total fatty cuid,TFA),饱和脂肪酸(saturated fatty acid,SFA)如软脂酸(C16∶0)、硬脂酸(C18∶0)、花生酸(C20∶0)、二十二烷酸(C22∶0)、二十四烷酸(C24∶0),多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)如亚油酸(C18∶2)、亚麻酸(C18∶3)、花生四烯酸(C20∶4)、二十碳五烯酸(C20∶5)、二十二碳六烯酸(C22∶6),单不饱和脂肪酸(monounsaturated fatty acid,MUFA)如棕榈酸(C16∶1)、油酸(C18∶1)。
1.3统计学处理 应用SPSS 19.0软件,计量资料用均数±标注差(±s)表示,2组间比较采用t检验,多组之间比较采用方差分析,非正态分布资料转化为对数后进行统计;计数资料比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1一般资料 N组和T2DM各组在年龄和性别构成上差异无统计学意义(P>0.05)。A组、B组、C组、D组BMI均较N组升高(P<0.05)。B组、C组、D组体脂百分比较N组和A组升高(P<0.01)。见表1。
2.2一般临床指标 T2DM患者收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)均较N组明显升高(P<0.01);C组、D组与A组比较SBP明显升高(P<0.01);C组、D组较B组SBP明显升高(P<0.01)。见表1。
T2DM组三酰甘油、总胆固醇、低密度脂蛋白均较N组增加(P<0.01)。大血管病变各组组间比较,三酰甘油差异无统计学意义。D组的总胆固醇较C组下降,差异有统计学意义(P<0.01)。C组的低密度脂蛋白仅较A组升高(P<0.05)。高密度脂蛋白在A组、B组、C组、D组中呈下降趋势,两两比较差异无统计学意义(P>0.05)。见表1。
表1 各组相关资料(±s)

表1 各组相关资料(±s)
注:与N组比较,※P<0.05,*P<0.01;与A组比较,#P<0.01,★P<0.05;与B组比较,△P<0.01;与C组比较,☆P<0.01
组别 年龄(岁)BMI (kg/m2)PBF (%)SBP (mmHg)DBP (mmHg)三酰甘油(mmol/L)总胆固醇(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)N组54.2±7.4 22.9±1.0 27.8±2.8 113.9±7.1 73.3±4.0 1.1±0.3 3.9±0.7 1.4±0.3 2.2±0.6 A组55.7±5.9 25.2±1.0※ 28.8±2.2 136.3±4.4* 89.6±4.6* 1.5±0.5* 4.8±0.5* 1.4±0.2 2.6±0.3*B组56.7±9.7 26.4±0.8* 33.3±2.3*# 141.8±5.8* 95.4±3.9* 1.6±0.4* 4.7±0.3* 1.4±0.1 2.7±0.3*C组58.3±7.4 26.1±1.0* 35.5±2.2*# 150.4±5.6*#△ 100.4±3.5* 1.8±0.6* 5.0±0.0* 1.3±0.1 3.0±0.3*★D组59.8±8.9 26.7±2.4* 36.8±4.5*# 166.1±6.7*#△ 109.1±2.9* 1.9±0.4* 4.4±0.4*☆ 1.2±0.1 2.6±0.4*
2.3脂肪酸成分
2.3.1健康体检者与T2DM患者脂肪酸成分 与N组比较,T2DM患者TFA、SFA、MUFA、PUFA均升高,其中TFA(P<0.01)、SFA(P<0.05)、PUFA(P<0.01)差异有统计学意义。SFA中C16∶0、C18∶0、C24∶0在T2DM中明显升高(C16∶0、C18∶0 P<0.01, C24∶0 P<0.05);MUFA中C18∶1显著升高(P<0.05);PUFA中亚油酸C18∶2显著升高(P<0.01);而C18∶3、C20∶5、C22∶6在T2DM各组中则呈下降趋势,其中C22∶6下降明显(P<0.01);其余脂肪酸成分虽在T2MD各组中呈升高趋势,但差异无统计学意义(表2)。
表2 正常对照组与T2DM组FFA(±s,mmol/L)
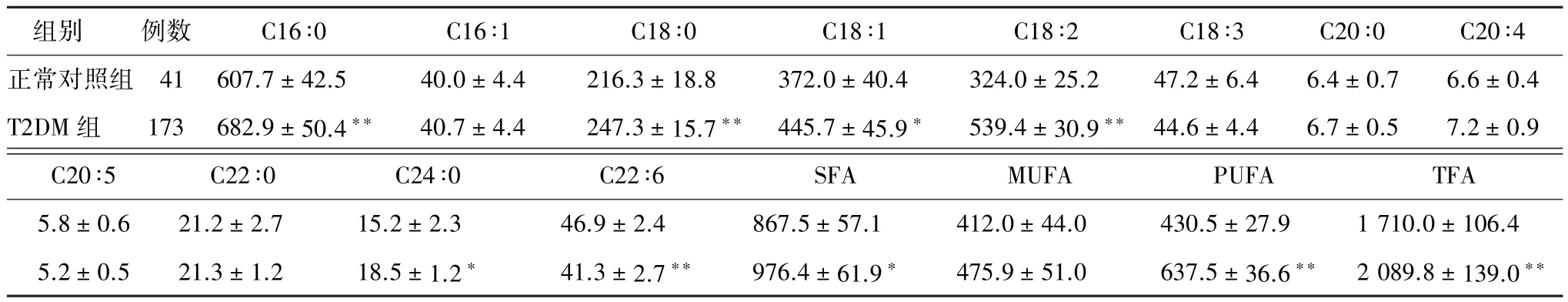
表2 正常对照组与T2DM组FFA(±s,mmol/L)
注:与正常组比较,*P<0.05,**P<0.01
组别 例数 C16∶0 C16∶1 C18∶0 C18∶1 C18∶2 C18∶3 C20∶0 C20∶4正常对照组 41 607.7±42.5 40.0±4.4 216.3±18.8 372.0±40.4 324.0±25.2 47.2±6.4 6.4±0.7 6.6±0.4 T2DM组 173 682.9±50.4** 40.7±4.4 247.3±15.7** 445.7±45.9* 539.4±30.9** 44.6±4.4 6.7±0.5 7.2±0.9 C20∶5 C22∶0 C24∶0 C22∶6 SFA MUFA PUFA TFA 5.8±0.6 21.2±2.7 15.2±2.3 46.9±2.4 867.5±57.1 412.0±44.0 430.5±27.9 1 710.0±106.4 5.2±0.5 21.3±1.2 18.5±1.2* 41.3±2.7** 976.4±61.9* 475.9±51.0 637.5±36.6** 2 089.8±139.0**
2.3.2大血管病变组脂肪酸成分 TFA、SFA、MUFA 及C16∶0、C18∶0、C18∶1在A组、B组、C组、D组中随血管病变严重程度显著升高。两两比较:C组及D组的C16∶0、C18∶0、C18∶1及SFA、MUFA、TFA均较A组显著升高(P<0.05)。C组的C18∶0、D组C18∶1和MUFA较B组高(P<0.05);其余各组之间比较差异均无统计学意义(P>0.05)。见表3。
表3 T2DM各组FFA成分变化(±s,mmol/L)

表3 T2DM各组FFA成分变化(±s,mmol/L)
注:与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05
组别 例数 C16∶0 C16∶1 C18∶0 C18∶1 C18∶2 C18∶3 C20∶0 C20∶4 A组 36 569.3±65.54 36.1±6.9 215.3±22.9 332.8±63.2 510.7±54.4 42.2±7.5 6.6±0.8 6.8±0.7 B组 59 656.0±117.8 37.8±8.5 231.7±32.9 446.2±93.9 541.6±73.9 47.6±9.6 6.6±0.78 7.2±0.9 C组 58 728.3±70.22* 43.4±7.8 270.9±25.7*# 458.9±68.0* 546.5±42.0 42.1±6.3 6.6±0.8 7.2±0.6 D组 20 816.9±121.75** 48.6±13.3 275.4±36.8* 602.7±153.1**# 563.0±69.8 41.9±10.9 7.3±1.4 7.2±1.1 C20∶5 C22∶0 C24∶0 C22∶6 SFA MUFA PUFA TFA 5.2±0.9 20.2±2.1 16.6±2.9 40.2±4.8 828.1±73.4 368.9±66.4 605.1±63.4 1 802.1±156.2 5.9±1.3 21.3±2.5 20.0±2.1 40.3±5.7 938.3±147.8 484.0±101.3 642.6±87.6 2 064.9±325.1 4.7±0.6 22.4±1.8 18.3±2.1 42.0±4.1 1 044.7±87.7* 502.3±74.5* 642.6±49.3 2 189.6±190.3*4.6±1.4 20.2±2.9 18.3±2.6 43.4±7.2 1 136.9±133.1** 651.2±158.1**# 660.2±49.3 2 448.3±334.8**
3 讨论
2002年McGarry[5]就提出T2DM糖代谢紊乱的根源是脂代谢紊乱,认为循环中FFA浓度过高以及细胞内(主要是肌细胞、肝细胞和胰岛β细胞)脂质过多,既可导致β细胞分泌胰岛素功能缺陷,又可产生胰岛素抵抗,即FFA的“脂毒性”作用。在T2DM家系研究中发现,在T2DM患者一级亲属血糖正常时已存在FFA、三酰甘油升高脂代谢紊乱,并有胰岛素抵抗及β细胞功能受损[6]。此外,FFA水平升高可导致线粒体功能失调,氧化磷酸化障碍,使活性氧簇生成增多,激活蛋白激酶C、丝裂原活化蛋白激酶和核因子-κB等的表达,启动一系列的炎性反应和细胞凋亡程序,造成血管内皮的损害[7-8]。血浆中长期低水平的FFA浓度有助于改善肥胖及T2DM患者线粒体功能,增加胰岛素敏感性[9]。
脂肪酸分为SFA和不饱和脂肪酸,SFA是构成脂质的基本成分之一,一般多见的有辛酸、癸酸、月桂酸、豆蔻酸、C16∶0、C18∶0、花生酸。不饱和脂肪酸主要包括MUFA和PUFA,食物脂肪中MUFA主要有C18∶1,PUFA有C18∶2、C18∶3、C20∶4等。正常人体内主要存在8种脂肪酸[10],月桂酸、豆蔻酸、C16∶0、C18∶0、C18∶1、C18∶2、C20∶4、C20∶5,人体不能合成C18∶2和C18∶3,必须从膳食中补充即人体所需的必需脂肪酸;其中,C18∶2最为重要,它在一定程度上可替代或节约C18∶3,人体可利用C18∶2 及C18∶3合成n-6系脂肪酸C20∶4及n-3系脂肪酸C22∶6、C20∶5。而对于T2DM患者体内脂肪酸成分的报道,国内外学者的报道略有差异,可能与血清中FFA受地区、种族及膳食结构饮食习惯等因素影响较大,且与研究者所测定脂肪酸的种类及方法不同有所差异。本研究中T2DM患者所测TFA、SFA和PUFA均较N组升高,C16∶0、C18∶0、C18∶1、C18∶2、C24∶0在T2DM患者中明显升高(除C18∶1和C24∶0 P<0.05外,其余P<0.01);而C18∶3、C20∶5、C22∶6 在T2DM各组中则呈下降趋势,其中C22∶6下降明显(P<0.01);其余脂肪酸成分虽在T2DM各组中呈升高趋势,但差异无统计学意义(P>0.05),与国内学者报道基本一致[11-12]。
研究表明,不同脂肪酸对于人体的功能是不同的,在进食大量SFA后肝脏的3-羟基-3-甲基戊二酰辅酶A还原酶的活性增高,使胆固醇合成增加。SFA摄入量过高是导致血胆固醇、三酰甘油、低密度脂蛋白升高的主要原因,而高胆固醇、高血脂及高水平低密度脂蛋白是导致动脉硬化的主要因素[13]。而MUFA可以降低血胆固醇、三酰甘油和低密度脂蛋白。PUFA可以合成C22∶6、C20∶5、C20∶4,n-3系、n-6系脂肪酸可以增加肝脏低密度脂蛋白受体表达,加速低密度脂蛋白经受体的代谢,从而降低血清胆固醇和低密度脂蛋白的含量,促进体内SFA代谢的作用,防止脂肪在血管壁的沉积,预防动脉粥样硬化[14]。不同脂肪酸对人血管内皮细胞(vascular endothelial cells,VEC)增殖和凋亡的影响也是不同的。国内学者研究发现,SFA中的C16∶0、C18∶0、C24∶0可使VEC生长受抑制,随浓度升高细胞凋亡增加;不饱和脂肪酸中的C18∶1、C18∶2低浓度时对VEC凋亡及生长周期影响不大,但高浓度>400 μmol/L时可诱导凋亡[15]。研究认为,VEC凋亡可能是动脉硬化病理发生的早期事件,VEC凋亡影响内皮损伤修复功能,同时还会增加斑块不稳定性、促进血栓形成[16]。
本研究中在大血管病变各组间比较发现TFA、MUFA、SFA及C16∶0、C18∶0、C18∶1随血管病变严重程度呈递进性升高,可能与C16∶0和C18∶1降低内皮细胞一氧化氮合成酶活性引起血管收缩、舒张障碍,并呈剂量-时间依赖性地诱导内皮细胞凋亡有关[17-20];SFA尤其是C16∶0刺激促炎症因子单核细胞趋化蛋白-1和细胞间黏附分子-1的分泌引起内皮细胞功能紊乱有关[21-22]。糖尿病患者中含量最多的PUFA和C18∶2较正常人升高,内皮细胞培养显示C18∶2能够增加人主动脉内皮细胞通透性促炎性和致动脉粥样硬化[14],与国内学者李嘉强等[4]报道一致。在T2DM血管病变各组中C18∶2虽然有随血管病变严重程度升高的趋势,但差异无统计学意义(P>0.05)。对于保护血管内皮的n-3系脂肪酸C18∶3、C20∶5和C22∶6在T2DM血管病变各组中也没有呈现明显的下降趋势,可能与C18∶2、C18∶3为必需脂肪酸;C20∶5和C22∶6又作为C18∶3的合成产物,受不同受试者饮食摄入的不同影响较大有关。
糖尿病是目前严重危害人民生活健康的疾病之一,大部分糖尿病患者最终死于糖尿病并发症。在T2DM患者中,罹患心血管疾病风险是非T2DM的2~6倍,卒中发生风险是非T2DM的3倍,外周血管病变的患病率则高达19.4%~20.6%。在糖尿病患者糖代谢异常之前往往出现脂代谢异常,而脂肪酸水平的升高往往又先于其他血脂指标,了解T2DM患者体内脂肪酸成分的改变可以先于血脂异常前通过给予脂肪酸干预或饮食指导,如通过增加n-3系或n-6系脂肪酸或调整SFA及不饱和脂肪酸膳食比例改善T2DM患者的脂代谢紊乱,并对其大血管病变早期进行预防性治疗。
[1]Ma S,Yang D,Li D,et al.Oleic acid induces smooth muscle foam cell formation and enhances atherosclerotic lesion development via CD36[J].Lipids Health Dis,2011,10: 53.
[2]Papa G,Degano C,Iurato MP,et al.Macrovascular complication phenotypes in type 2 diabetic patients[J].Cardiovasc Diabetol,2013,12:20.
[3]Moon JH,Kim JS.The cutoff value in body fat percentage for increased risk of metabolic syndrome in elderly people with normal body weight[J].J Korean Geriatr Soc,2015,19(1):16-24.
[4]李嘉强,戴颖秀,刘玉敏,等.糖尿病及高危人群血清游离脂肪酸成分分析[J].中国公共卫生,2006,22(6): 690-692.
[5]McGarry JD.Banting lecture 2001:dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J].Diabetes,2002,51(1):7-18.
[6]Brassard P,Frisch F,Lavoie F,et al.Impaired plasma nonesterified fatty acid tolerance is an early defect in the natural history of type 2 diabetes[J].J Clin Endocrinol Metab,2008,93(3):837-844.
[7]Johnson EL.Glycemic variability in type 2 diabetes mellitus:oxidative stress and macrovascular complications[J]. Adv Exp Med Biol,2012,771:139-154.
[8]Jakuš V,Sándorová E,Kalninová J,et al.Monitoring of glycation,oxidative stress and inflammation in relation to the occurrence of vascular complications in patients with type 2 diabetes mellitus[J].Physiol Res,2014,63(3):297-309.
[9]Daniele G,Eldor R,Merovci A,et al.Chronic reduction of plasma free fatty acid improves mitochondrial function and whole-body insulin sensitivity in obese and type 2 diabetic individuals[J].Diabetes,2014,63(8):2812-2820.
[10]冯婷,杨波,张祥迅,等.毗格列酮治疗对2型糖尿病患者血清游离脂肪酸成分的影响[J].中华内分泌代谢杂志,2008,24(2):178-179.
[11]宋光耀,马慧娟,叶蔚,等.不同糖耐量人群血浆脂肪酸谱与胰岛素抵抗[J].中华内分泌代谢杂志,2004,20(3): 197-199.
[12]楼大钧,朱麒钱,茅小燕,等.新诊断2型糖尿病患者血清磷脂脂肪酸谱与血脂代谢有关[J].中华内分泌代谢杂志,2009,25(2):176-178.
[13]Lin SH,Chang DK,Chou MJ,et al.Peptide inhibitors of human HMG-CoA reductase as potential hypocholesterolemia agents[J].Biochem Biophys Res Commun,2015,456 (1):104-109.
[14]Brousseau ME,Ordovas JM,Osada J,et al.Dietary monounsaturated and polyunsaturated fatty acids are comparable in their effects on hepatic apolipoprotein mRNA abundance and liver lipid concentrations when substituted for saturated fatty acids in cynomolgus monkeys[J].J Nutr,1995,125(3):425-436.
[15]张文杰,史英钦,宋光耀,等.不同的脂肪酸对人血管内皮细胞增殖和凋亡的影响[J].中国老年学杂志,2005,25(11):1312-1314.
[16]李蓉,蔡辉.内皮细胞凋亡与动脉粥样硬化关系的研究进展[J].中国老年学杂志,2012,32(12):2649-2652.
[17]Halle M,Eriksson P,Tornvall P.Effects of free fatty acids and a triglyceride-rich fat emulsion on endothelial nitric oxide synthase[J].Eur J Clin Invest,2005,35(2):154-155.
[18]Hennig B,Watkins BA.Linoleic acid and linolenic acid: effect on permeability properties of cultured endothelial cellmonolayers[J].Am J Clin Nutr,1989,49(2):301-305.
[19]苏进,刘瑞,杨波,等.葡萄糖及游离脂肪酸对人血管内皮细胞凋亡的影响[J].生物医学工程学杂志,2006,23 (1):170-174.
[20]Yamagishi S,Okamoto T,Amano S,et al.Palmitate-induced apoptosis of microvascular endothelial cells and pericytes[J].Mol Med,2002,8(4):179-184.
[21]Sozer V,Himmetoglu S,Korkmaz GG,et al.Paraoxonase,oxidized low density lipoprotein,monocyte chemoattractant protein-1 and adhesion molecules are associated with macrovascular complications in patients with type 2 diabetes mellitus[J].Minerva Med,2014,105(3):237-244.
[22]Shikama Y,Aki N,Hata A,et al.Palmitate-stimulated monocytes induce adhesion molecule expression in endothelial cells via IL-1 signaling pathway[J].J Cell Physiol,2015,230(3):732-742.
Serum free fatty acid metabolism and composition in type 2 diabetic mellitus patients with macrovascular complications
LI Zhe1,WANG Ruiying2,ZHANG Zhicheng1
(1.Department of Intensive Care Unit,Navy General Hospital,Beijing 100048,China;2.Department of Endocrinology,the Second Affiliated Hospital of Hebei University,Shijiazhuang Hebei 050000,China)
R587.1
B
2095-3097(2016)04-0219-05
10.3969/j.issn.2095-3097.2016.04.008
100048北京,海军总医院重症医学科(李 哲,张志成);050000河北石家庄,河北医科大学第二医院内分泌科(王瑞英)
[Key words]Type 2 diabetes mellitus(T2DM);Lipid metabolic disorder;Free fatty acid (FFA);Macrovascular disease
糖尿病大血管病主要指糖尿病导致或合并的冠心病、脑血管病及外周血管疾病,是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的主要死因之一。动脉内皮细胞功能紊乱和血管平滑肌细胞增生是动脉粥样硬化形成和发展的重要病理机制。游离脂肪酸(free fatty acid,FFA)是T2DM胰岛素抵抗和动脉粥样硬化形成和发展的重要致病因素,FFA通过多种途径诱导动脉内皮细胞功能紊乱和血管平滑肌细胞增生,促进动脉粥样硬化的发生和发展[1]。作者通过测定T2DM患者血清中FFA成分的变化探讨其与糖尿病大血管病变的关系,为早期诊断及预防性治疗提供理论依据。
(2015-05-26 本文编辑:冯 博)

