微小核糖核酸-21对乳腺癌MCF-7细胞反转录富含半胱氨酸蛋白表达的调节研究
郑志伟,赵树林,杨钰贤,朱辉德,朱志伟,陈 蕾
·基础研究·
微小核糖核酸-21对乳腺癌MCF-7细胞反转录富含半胱氨酸蛋白表达的调节研究
郑志伟,赵树林,杨钰贤,朱辉德,朱志伟,陈 蕾
目的 探讨乳腺癌MCF-7细胞中微小核糖核酸-21(microRNA-21,miR-21)对反转录富含半胱氨酸蛋白(reversion inducing cysteine rich protein with Kazal motifs,RECK)表达的调控作用。方法 将miR-21模拟物、miR-21抑制物及模拟物阴性对照、抑制物阴性对照各组瞬时转染到MCF-7细胞中,48 h后通过荧光定量聚合酶链反应检测miR-21在细胞的表达情况,蛋白质印迹法检测转染后RECK表达水平变化。结果 细胞转染48 h后,miR-21抑制物组和miR-21模拟物组miR-21的表达分别与转染空白对照组比较差异有统计学意义(P<0.001),转染miR-21抑制物组miR-21的表达明显下降,转染miR-21模拟物组miR-21的表达明显上调;细胞转染miR-21各组后RECK表达差异有统计学意义(P<0.01),miR-21抑制物组相对其阴性对照组,RECK表达明显上升(P<0.001);miR-21模拟物组相对其阴性对照组,RECK表达明显下降(P<0.001)。结论miR-21可以抑制乳腺癌MCF-7细胞RECK表达,可能成为判断乳腺癌患者预后的评价指标及肿瘤治疗的新靶点。
乳腺癌;微小核糖核酸-21;反转录富含半胱氨酸蛋白
[Abstract]Objective To explore the effects of microRNA-21(miR-21)on the expression of reversion inducing cysteine rich protein with Kazal motifs(RECK)in MCF-7 cells.Methods
MCF-7 cells were cultured in vitro and transfected with miR-21 mimics and miR-21 inhibitor by cationic-mediated transfected.The total RNA and protein were extracted from the culture cells after transfected forty-eight hours.The expression of miR-21 and RECK levels were detected by fluorescent quantitative PCR and Western blotting.Results The miR-21 expression was significantly changed after forty-eight hours transfected(P<0.001),miR-21 expression decreased significantly in miR-21 inhibitor group while miR-21 expression increased significantly in miR-21 mimics group. The RECK was significantly changed after transfected(P<0.001),RECK expression increased significantly in miR-21 inhibitor group(P<0.001)while RECK expression decreased significantly in miR-21 mimics group(P<0.001).Conclusion miR-21 can inhibit the expression of RECK in breast cancer cells,and it may be a new target to judge the prognosis of breast cancer patients and the new target of tumor therapy.
[Key words]Breast cancer;MicroRNA-21(miR-21);Reversion inducing cysteine rich protein with Kazal motifs(RECK)
乳腺癌是女性最常见的恶性肿瘤之一。城市地区女性乳腺癌每年新发病例约15.8万,占全部女性癌症发病的19.47%,发病率为46.74/10万,位居女性肿瘤发病之首。2011年中国女性乳腺癌发病人数约24.9万,发病率37.86/10万,近10年乳腺癌病死率呈上升趋势[1]。微小核糖核酸-21(microRNA-21,miR-21)是miRNAs家族成员之一,miR-21高表达与乳腺癌临床分期、淋巴结转移、浸润等恶性行为具有正相关性,因而进一步开展miR-21对乳腺癌分子生物学调控的研究。通过生物信息学软件TargetScan预测,反转录富含半胱氨酸蛋白(reversion inducing cysteine rich protein with Kazal motifs,RECK)基因有可能是其调节的靶基因之一。RECK基因是一种新型基质金属蛋白酶抑制剂。研究发现,RECK基因作为新型的肿瘤转移抑制基因,能够有效地抑制肿瘤的侵袭与转移[2-3]。有临床研究进一步证明,RECK基因表达水平的高低与许多恶性肿瘤患者的预后密切相关[4]。尽管生物信息学分析提示miR-21对RECK基因的表达可能有调控作用,但两者间的明确关系目前尚鲜见报道。因此,本研究拟通过在乳腺癌细胞MCF-7中上调和下调miR-21表达,观察miR-21 对RECK表达的影响,明确miR-21对RECK表达的调控作用,为进一步研究miR-21调控的靶基因及其生物学机制提供实验室依据。
1 材料与方法
1.1主要试剂和仪器 达尔伯克改良伊格尔培养基[Dulbecco’s modified Eagle’s medium,DMEM,赛默飞世尔生物化学制品(北京)有限公司],胎牛血清(美国Invitrogen公司),胰酶(杭州吉诺生物医药技术有限公司),miR-21引物(苏州吉玛基因股份有限公司),Trizol试剂(美国 Invitrogen公司),Prime-Script反转录试剂盒[天根生化科技(北京)有限公司],SYBR®Premix[天根生化科技(北京)有限公司],胰蛋白酶乙二胺四乙酸溶液(0.05%胰蛋白酶+ 0.1 mmol/L乙二胺四乙酸,美国HyClone公司),Lipofectamin2000转染试剂(美国Invitrogen公司),聚丙烯酰胺凝胶电泳凝胶配置试剂盒(江苏碧云天公司),蛋白标准品(德国Thermo公司),牛血清白蛋白(美国Sigma-Aldrich公司),细胞总蛋白裂解试剂盒(德国Thermo公司),Bradford法蛋白定量试剂盒[天根生化科技(北京)有限公司],miR-21抑制物、miR-21模拟物(上海吉玛制药技术有限公司),RECK一抗(美国ProteinTech公司),β-肌动蛋白一抗(美国Millipoer公司),异硫氰酸荧光素标志二抗(抗兔,美国Immunology Consultants Laboratory,Inc),X线片显影液、定影液(上海冠龙照相器材公司)。超净工作台(美国Nuaire公司),6孔板、培养瓶、冻存管(美国Corning Incorporated公司),倒置显微镜(日本Olympus公司),BP61电子天平(德国Sartorius),二氧化碳(CO2)培养箱(美国Thermo Electron Corporation),AvantiTM30低温高速离心机(美国Beckman公司),普通聚合酶链反应(polymerase chain reaction,PCR)仪(德国Eppendorf公司),Engine Opticon 2荧光定量仪(美国MJ Research公司),VE-180垂直电泳槽(上海天能科技有限公司),VE-186转移电泳槽(上海天能科技有限公司),DY-B1脱色摇床(上海沪西仪器厂)。
1.2方法
1.2.1细胞培养 MCF-7细胞株由本实验室冻存细胞库中复苏培养。细胞用含10%胎牛血清的DMEM,在37℃、5%CO2培养箱常规培养,细胞铺满瓶底80%~90%时进行常规传代。
磷酸盐缓冲液漂洗后加入每瓶0.5 mL的0.25%胰酶,37℃孵育消化1min,用5mL冲洗培养基(DMEM 含5%胎牛血清)冲洗并终止消化,转移至15 mL离心管中,1 200 r/min,4℃离心5 min。细胞悬液按5× 105/mL置于6孔板中培养,当细胞达到50%~70%融合时进行实验。
1.2.2细胞转染实验
1.2.2.1干扰序列设计合成 采用化学合成的miR-21抑制物和miR-21模拟物分别用于抑制和上调MCF-7细胞的miR-21的表达,观察其对MCF-7细胞RECK的影响。RNA单链寡核苷酸由苏州吉玛基因股份有限公司化学合成。
miR-21抑制物序列:5′-UCAACAUCAGUCUGA UAAGCUA-3′;抑制物阴性对照序列:5′-CAGUACUU UUGUGUAGUACAA-3′;miR-21模拟物序列:正义链5′-UAGCUUAUCAGACUGAUGUUGA-3′,反义链5′-AA CAUCAGUCUGAUAAGCUAUU-3′;模拟物阴性对照序列:正义链5′-UUCUCCGAACGUGUCACGUTT-3′,反义链5′-ACGUGACACGUUCGGAGAATT-3′。
1.2.2.2转染效率检测 转染前1 d,取对数生长期细胞,胰酶消化,DMEM悬浮细胞至密度为1× 105/mL,铺板于6孔板中,每孔1 mL,补加DMEM至2 mL,37℃、5%CO2培养箱中培养。培养24 h后,6孔板换培养基,采用Lipofectamin2000介导转染miR-21抑制物,按照表1进行转染。具体操作严格按照说明书进行,6 h后荧光显微镜下观察结果并记录。

表1 转染剂量
1.2.2.3细胞转染 在荧光显微镜下观察,20 pmol转染效率可达到70%以上,选择20 pmol的miRNAs作为实验用量。分别将miR-21抑制物、抑制物阴性对照、miR-21模拟物、模拟物阴性对照各组转染到6孔培养板MCF-7细胞中,未经任何处理的为空白对照组。于37℃、5%CO2培养箱中培养,48 h后分别以Trizol试剂和蛋白裂解液提取细胞中总RNA和总蛋白。实时荧光定量PCR检测干扰后细胞miR-21的表达水平,采用参照基因△Ct法分析,以U6看家基因表达PCR的Ct值作为相对标准,目的基因信使RNA(messenger RNA,mRNA)相对表达水平计算公式:2-Δ(目的基因Ct-内参基因Ct)。
1.2.2.4蛋白质印迹法检测转染后MCF-7细胞内RECK表达水平 细胞转染48 h后,在每孔细胞中加入全蛋白裂解液裂解细胞获得蛋白,总蛋白样品各20 μg和5×磷酸盐缓冲液混匀后,100℃沸水煮5 min。裂解上清用二辛可宁酸试剂盒定量蛋白量,制备12%的分胶液,微量加样器上样20 μg总蛋白,300 mA转膜90 min,5%脱脂奶粉/含吐温-20的三羟甲基氨基甲烷缓冲液(Tris-buffered saline with Tween-20,TBST)室温,摇床缓慢摇动,封闭60 min,洗膜3次,用稀释比例为1∶1 000的RECK一抗孵育,4℃过夜,TBST洗膜3次、每次10 min。用辣根过氧化物酶标志的异硫氰酸荧光素标志二抗(抗兔)1∶5 000孵育,摇床缓慢摇动,室温60 min。用TBST洗膜3次、每次10 min,暗室下电化学发光显色、曝光,观察结果。
将完成显影的胶片扫描,以TIF格式储存,Fluor Chem 8900软件分析印迹条带灰度,记录平均灰度值。以目的蛋白RECK条带平均灰度值/β-actin平均灰度值作为目的蛋白表达的相对高低值。
1.3统计学处理 应用SPSS 13.0软件,计量资料用均数±标准差(±s)表示,多组间差异采用单因素方差分析,采用LSD进行多重比较,若方差不齐则采用Brown-Forsythe近似方差分析,P<0.05为差异有统计学意义,统计检验均为双侧概率检验。
2 结果
2.1miR-21转染效率 转染到细胞中带绿色荧光标志的miR-21抑制物在细胞质中显示绿色荧光,在用1 μL Lipofectamin2000转染20 pmol miR-21抑制物时,效率即可达到70%左右(图1)。
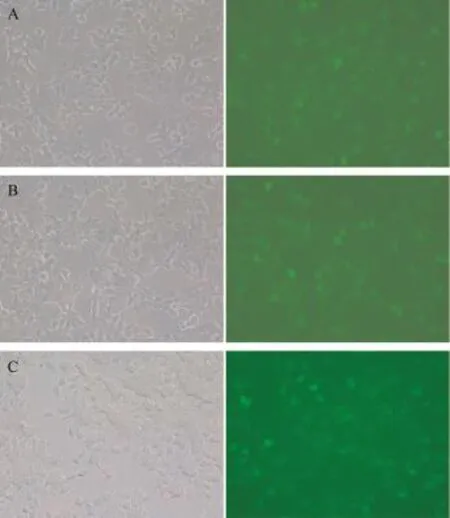
图1 荧光标志检测miR-21抑制物转染效率(×200)
2.2细胞转染后miR-21的表达 通过细胞转染,抑制和上调MCF-7细胞的miR-21表达,转染48 h后,miR-21抑制物组和miR-21模拟物组miR-21的表达分别与转染空白对照组相比差异有统计学意义(F分别为30.79、139.68,P<0.001),转染miR-21抑制物组miR-21的表达明显下降,转染miR-21模拟物组miR-21的表达明显上调(表2)。
2.3蛋白质印迹法检测细胞转染后RECK的表达miR-21抑制物组与抑制物阴性对照组比较,RECK表达明显上升(F=93.76,P<0.01);miR-21模拟物组与模拟物阴性对照组比较,RECK表达明显下降(F=82.63,P<0.01)。蛋白质印迹法检测相对表达量和条带分别见表2和图2。
表2 细胞转染后miR-21及RECK表达(±s)
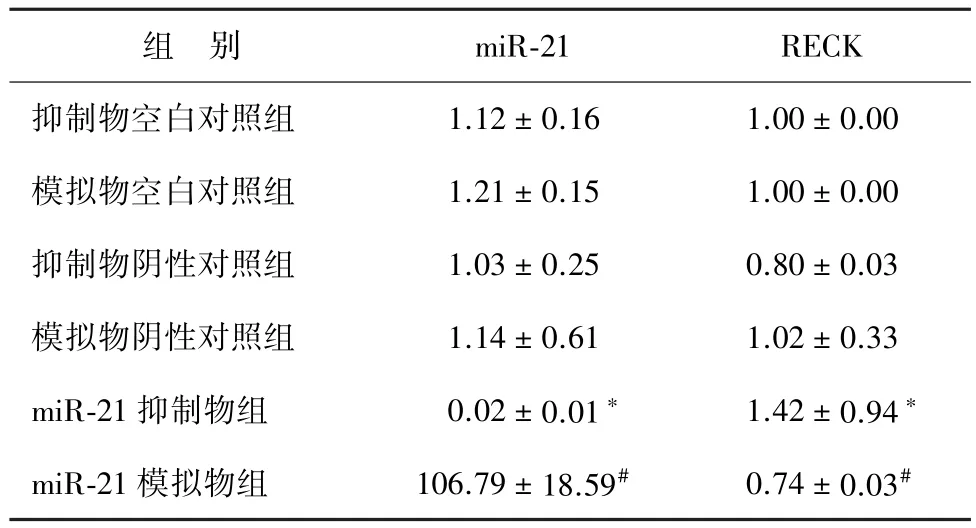
表2 细胞转染后miR-21及RECK表达(±s)
注:与抑制物阴性对照组比较,*P<0.001;与模拟物阴性对照组比较,#P<0.001
组 别 miR-21 RECK抑制物空白对照组 1.12±0.16 1.00±0.00模拟物空白对照组 1.21±0.15 1.00±0.00抑制物阴性对照组 1.03±0.25 0.80±0.03模拟物阴性对照组 1.14±0.61 1.02±0.33 miR-21抑制物组 0.02±0.01* 1.42±0.94*miR-21模拟物组 106.79±18.59# 0.74±0.03#
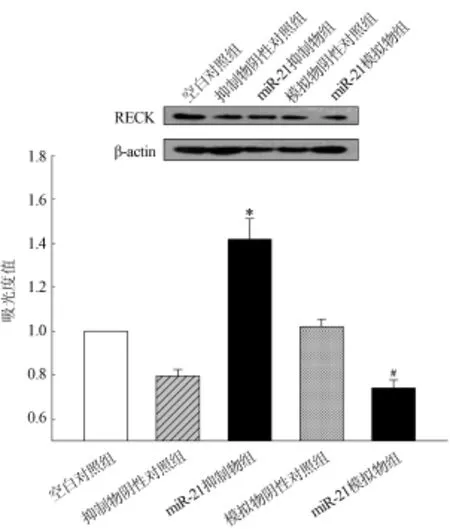
图2 干扰miR-21表达后细胞RECK表达(±s,n=3)
3 讨论
乳腺癌是女性高发的恶性肿瘤之一,远处转移是患者致死的最重要原因。乳腺癌的转移是一个多基因参与、通过多步骤完成的复杂过程,其具体机制尚未明确。miRNAs是近年发现的一类长度约22个核苷酸非编码小分子RNA,通过靶mRNA降解或抑制其翻译来调节靶基因的表达,在细胞的分化、增殖、迁移、侵袭和转移、个体发育、机体代谢,以及肿瘤、病毒感染多种疾病中都具有重要作用[5]。
RECK基因是新发现的一种膜表面糖蛋白,该基因位于9p13-p12。研究证实,RECK基因的表达与胃癌、食管癌、乳腺癌的预后具有相关性,RECK基因表达阴性的预后较差,反之RECK基因表达阳性的预后较好[6]。因此,RECK是一种抑癌基因,可负向调控肿瘤的转移或侵袭。
miRNAs调控基因表达的机制之一是通过与靶基因mRNA的3′端非翻译区相结合,通过降解靶基因mRNA起到生物学调节功能的作用。作者通过在线的生物信息学预测软件,发现miR-21 5′端的种子序列可以与RECK 3′-非翻译区靶向互补,因此推测RECK可能是miR-21调节的靶基因之一。有研究表明,RECK基因表达水平与乳腺癌细胞侵袭力存在相关性,RECK基因的表达可以作为乳腺癌患者预后的一个指标[7]。基于RECK基因在肿瘤组织的表达可以影响肿瘤侵袭、转移和血管生成,所以影响RECK基因的表达,有望成为在预防和治疗肿瘤侵袭和转移的新靶点。
miR-21在多种实体肿瘤及非实体肿瘤中均呈现高表达,在乳腺癌中也不例外[8-9]。越来越多的研究发现,miR-21不仅在肿瘤发生中起类似癌基因的作用,更重要的是其参与肿瘤的侵袭和转移。Yan等[10]发现乳腺癌中miR-21高表达,且与乳腺癌的临床病理特征如分期、淋巴结转移显著相关。Petrovic′等[11]也发现高侵袭性乳腺癌患者miR-21呈现高表达,miR-21的高表达有可能成为乳腺癌高侵袭性的独立分子标志物,且miR-21高表达与乳腺癌临床分期、淋巴结转移、浸润等恶性行为具有正相关性,因而进一步研究miR-21如何通过分子调节机制来对乳腺癌的侵袭起预测作用。
欣喜的是在TargetScan中发现miR-21 5′端的种子序列可以与RECK 3′-非翻译区靶向互补,RECK基因有可能是miR-21调节的靶基因之一。本实验通过设计miR-21模拟物、miR-21抑制物、模拟物阴性对照、抑制物阴性对照各组瞬时转染到MCF-7细胞中,48 h后通过荧光定量PCR检测miR-21在细胞的表达情况,发现转染miR-21抑制物组miR-21的表达明显下降,转染miR-21模拟物组miR-21的表达明显上调。确认细胞中miR-21干扰表达成功后,提取细胞蛋白,通过蛋白质印迹法检测细胞转染后RECK的表达,发现miR-21抑制物组RECK表达有明显上调趋势,miR-21模拟物组RECK表达明显下降趋势。因此,有理由推断,RECK基因有可能是miR-21调节的靶基因之一,miR-21可以作为乳腺癌诊断预后分析的标志物,也可能成为治疗的新靶点之一。
[1]陈万青,郑荣寿.中国女性乳腺癌发病死亡和生存状况[J].中国肿瘤临床,2015,42(13):668-674.
[2]Noda M,Oh J,Takahashi R,et al.RECK:a novel suppressor of malignancy linking oncogenic signaling to extracellular matrix remodeling[J].Cancer Metastasis Rev,2003,22(2/3):167-175.
[3]Takagi S,Simizu S,Osada H.RECK negatively regulates matrix metalloproteinase-9 transcription[J].Cancer Res,2009,69(4):1502-1508.
[4]Stenzinger A,von Winterfeld M,Rabien A,et al.Reversioninducing cysteine-rich protein with Kazal motif(RECK)expression:an independent prognostic marker of survival in colorectal cancer[J].Hum Pathol,2012,43(8):1314-1321.
[5]Rupaimoole R,Calin GA,Lopez-Berestein G,et al.miRNA deregulation in cancer cells and the tumor microenvironment[J].Cancer Discov,2016,6(3):235-246.
[6]孙晓宏,陈玲,庞作良.抑癌基因RECK转录mRNA在食管癌中的表达及临床意义[J].中国老年学杂志,2013,33(10):2262-2263.
[7]孙涛,姜大庆,李金鸣,等.人乳腺癌细胞RECK基因的表达及检测[J].中国肿瘤临床,2006,33(22):1288-1290.
[8]Petrovic′N.miR-21 might be involved in breast cancer promotion and invasion rather than in initial events of breast cancer development[J].Mol Diagn Ther,2016,20(2): 97-110.
[9]Zhang C,Liu K,Li T,et al.miR-21:a gene of dual regulation in breast cancer[J].Int J Oncol,2016,48(1):161-172.
[10]Yan LX,Huang XF,Shao Q,et al.MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage,lymph node metastasis and patient poor prognosis[J].RNA,2008,14(11):2348-2360.
[11]Petrovic′N,Mandušic′V,Stanojevic′B,et al.The difference in miR-21 expression levels between invasive and non-invasive breast cancers emphasizes its role in breast cancer invasion[J].Med Oncol,2014,31(3):867.
MicroRNA-21 regulates expression of reversion inducing cysteine rich protein with Kazal motifs in MCF-7 cells
ZHENG Zhiwei1,ZHAO Shulin1,YANG Yuxian2,ZHU Huide1,ZHU Zhiwei1,CHEN Lei2
(1.Department of Pharmacy,Cancer Hospital of Shantou University Medical College,Shantou Guangdong 515041,China;2.Department of Gastroenterology,Cancer Hospital of Shantou University Medical College,Shantou Guangdong 515041,China)
R737.9
A
2095-3097(2016)04-0198-05
10.3969/j.issn.2095-3097.2016.04.002
汕头大学医学院附属肿瘤医院青年科研基金资助项目(2013A004);广东省乳腺癌诊治研究重点实验室种子基金资助项目(2012A061400018);汕头市科技计划资助项目(汕市财教〔2013〕244号)
515041广东汕头,汕头大学医学院附属肿瘤医院药学部(郑志伟,赵树林,朱辉德,朱志伟),消化肿瘤内科(杨钰贤,陈 蕾)
陈 蕾,E-mail:zhiweizheng@126.com
(2016-04-11 本文编辑:徐海琴)

