薰衣草叶子化学成分分析与抗氧化活性*
李紫薇, 张 艺,欧阳艳,李双双,刘 冲
(伊犁师范学院新疆自治区教育厅普通高等学校重点实验室,新疆 伊宁 835000)
薰衣草叶子化学成分分析与抗氧化活性*
李紫薇, 张艺,欧阳艳,李双双,刘冲
(伊犁师范学院新疆自治区教育厅普通高等学校重点实验室,新疆伊宁835000)

薰衣草叶;化学成分;抗氧化活性

1 实 验
1.1材料与仪器
石油醚(AR),天津市北联精细化学品开发有限公司;乙酸乙酯(AR),成都市科龙化工试剂厂;正丁醇(AR),天津市福晨化学试剂厂;无水乙醇、甲醇(AR),天津市科盟化工工贸有限公司;氯仿(AR),天津市北联精细化学品开发有限公司;1,1-二苯基-2-2-苦基肼自由基(AR),梯希爱上海化成工业发展有限公司;ABTS(AR),上海金穗生物科技有限公司;抗坏血酸(AR),天津光友精细化工研究所;维生素E(AR),北京鼎国生物技术有限公司。
UV-2500紫外可见分光光度计,日本岛津公司;VOS-60A冷冻干燥箱,施都凯仪器设备有限公;KQ-300GVDV三频恒温数控超声波清洗器,昆山市超声仪器有限公司;RE-52系列旋转蒸发仪,上海亚荣生化仪器厂。
实验用去离子水。薰衣草叶产自新疆伊犁,薰衣草叶经阴干粉碎,过60目筛,冷藏备用。
1.2实验方法
1.2.1薰衣草叶提取物化学成分定性实验
按照天然药物化学成分的系统预实验方法[5]设计流程,以去离子水、无水乙醇、石油醚、乙酸乙酯为溶剂,得薰衣草叶不同溶剂提取物,对伊犁产薰衣草叶子中的化学成分进行初步定性研究[6-9],每个检测做4个重复。

表1 提取液定性实验
1.2.2抗氧化活性实验的提取物制备
准确称取薰衣草叶粉末80.0000 g,在超声波辅助下用体积分数95%乙醇及体积分数60%乙醇依次各提取2次,合并提取液,真空过滤,减压浓缩(40 ℃)得到浸膏,用去离子水定容至100 mL,然后依次分别用100 mL的石油醚萃取(6次)、乙酸乙酯萃取(3次)、正丁醇萃取(3次),剩余部分为水层,分别减压浓缩得到浸膏,冷冻干燥后得石油醚提取物、乙酸乙酯提取物、正丁醇提取物、水提取物。配制适宜浓度供试液,冷藏保存备用。
1.2.3清除DPPH·实验
依次移取10.00 mg/mL石油醚提取物试液0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mL分别置10 mL比色管中,用无水乙醇定容至刻度线,依次得到0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mg/mL溶液。按上述方法操作,配制相同系列浓度的乙酸乙酯提取物溶液和正定醇提取物溶液。参考文献方法[3],分别测定不同浓度提取物、VC对DPPH·清除能力。每个检测做4个重复,取其平均值。
1.2.4清除ABTS+·实验
分别配制0.03、0.05、0.08、0.10、0.20、0.30、0.40、0.50、0.60、0.70 mg/mL不同溶剂提取物溶液及相应质量浓度的VC、VE溶液。
参照Ozcan·Erel提出的用H2O2/ABTS+·/醋酸盐缓冲溶液体系[10]。用pH 3.6醋酸钠盐缓冲液将278 μL过氧化氢稀释到1000 mL(2 mmol/L);以该过氧化氢溶液为溶剂配制10 mmol/L ABTS+·溶液,室温放置1 h,溶液呈蓝绿色,冷藏备用[11]。取一定体积10 mmol/L的ABTS+·溶液,用醋酸钠盐缓冲液稀释到吸光度为0.70±0.02(734 nm)。取1.00 mL样品溶液,加入4.00 mL ABTS+·溶液,准确震荡30 s,在30 ℃下测定6 min内反应溶液吸光度。计算清除率[7]。每个检测做4个重复,取其平均值。
1.2.5清除·OH实验
分别配制0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mg/mL不同溶剂提取物溶液及相应质量浓度的VC溶液。取4.50 mmol/L FeSO4溶液1.00 mL,加入1.00 mL 4.50 mmol/L水杨酸-乙醇溶液1.00 mL、提取物溶液1.00 mL、1.00 mL 4.40 mmol/L H2O2。37 ℃水浴中反应0.5 h,在 510 nm 处测定吸光值,计算清除率[3]。每个检测做4个重复,取其平均值。
取3.00 mL Tris-HCl缓冲液(pH 8.2),加入0.50 mL不同浓度供试液,30 ℃水浴保温20 min,加入7 mmol/L邻苯三酚溶液3.00 mL,反应4 min后加入1.00 mL浓HCl终止反应,420 nm 处测吸光度值,计算清除率[3]。每个检测做4个重复,取其平均值。
1.2.7FRAP还原法实验
分别配制0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mg/mL不同溶剂提取物溶液及相应质量浓度的VC溶液。移取提取物溶液及VC溶液各2.50 mL,分别加入0.20 mol/L磷酸钠缓冲溶液(pH6.6)2.50 mL和10.00 mg/mL铁氰化钾溶液2.50 mL。50 ℃保温20 min,再加入0.10 g/mL 2.50 mL三氯乙酸溶液,离心10 min(650 r/min)。移取上层溶液5.00 mL,分别加入5.00 mL去离子水和1 mg/mL氯化铁溶液1.00 mL,混合均匀,在700 nm处测定吸光度。每个检测做4个重复,取其平均值。
2 结果与讨论
2.1薰衣草叶化学成分定性实验
由实验结果可知,伊犁产薰衣草叶子中含有多糖、有机酸、鞣质、酚类、甾体、萜类、香豆素、内酯类、黄酮类化合物及挥发油等成分。
2.2提取物对DPPH·的清除作用
在实验质量浓度范围内,不同溶剂提取物都表现出较强的抗氧化活性,其对DPPH·的清除作用随提取物的浓度增大而增大。由图2可知,当浓度为1.00 mg/mL时,薰衣草叶不同溶剂提取物DPPH·的清除作用的大小顺序为:VC≈乙酸乙酯提取物>正丁醇提取物>石油醚提取物≈水提取物。即乙酸乙酯提取物所表现的DPPH·清除效果最好,相当于VC清除能力的99.56%,水提取物的清除率相当于VC的84.45%。

图2 提取物对DPPH·的清除作用
2.3提取物对ABTS+·的清除作用
在抗氧化物质的作用下,ABTS自由基阳离子被部分清除,绿色逐渐减弱,溶液吸光度降低。由图3可知,当提取物浓度为0.70 mg/mL时,薰衣草叶子的不同溶剂提取物对ABTS+·清除能力大小顺序为:VE>乙酸乙酯提取物>VC≈水提取物>正丁醇提取物>石油醚提取物。即乙酸乙酯提取物所表现的ABTS+·清清除率相当于VE的97.85%,石油醚提取物的清除率相当于VE的55.71%。
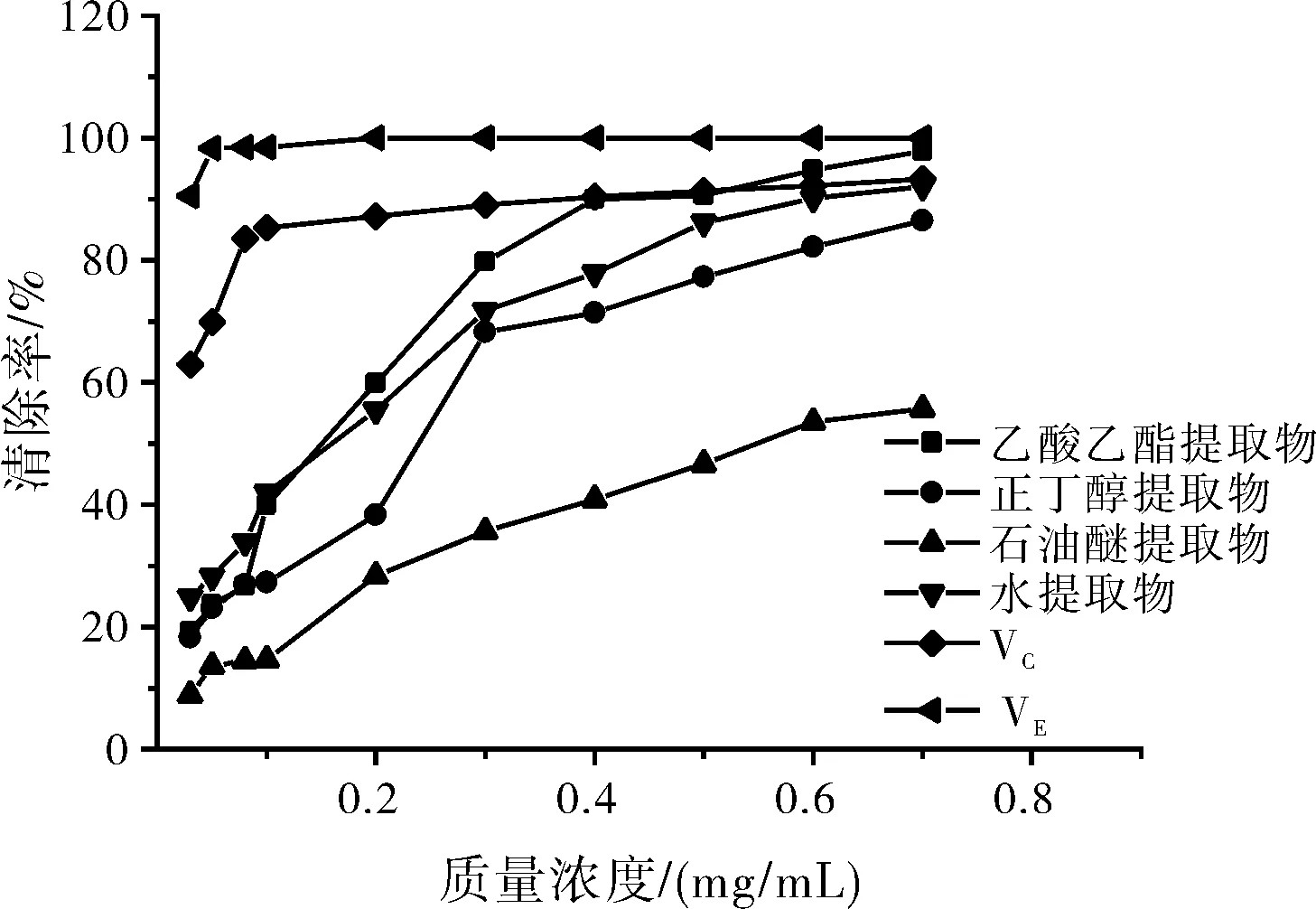
图3 提取物对ABTS+·的清除作用
2.4提取物对·OH的清除作用
羟基自由基是生物细胞内反应活性最强的氧族自由基。实验采用水杨酸竞争捕捉自由基的方式进行测定。由图4可知,当提取物浓度为1.00 mg/mL时,薰衣草叶不同溶剂提取物对·OH的清除作用的大小顺序为:VC>乙酸乙酯提取物>正丁醇提取物>石油醚提取物>水提取物。乙酸乙酯提取物对羟自由基清除能力最强,相当于等浓度VC清除作用的76.76%。水提取物的清除率相当于VC的55.68%。

图4 提取物对·OH的清除作用

图5 提取物对·的清除作用
2.6提取物的还原能力
还原能力是表征物质在氧化还原反应中给出电子自身发生氧化的能力。实验中,采用三价铁离子还原法观察物质的还原能力,吸光值越大,说明样品溶液的还原能力越强。由图6可知,在实验质量浓度范围内,不同溶剂提取物都均表现出一定的还原能力,但各部分均弱于等浓度VC溶液。当浓度为1.00 mg/mL时,薰衣草叶子不同溶剂提取物还原能力的大小顺序为: VC>乙酸乙酯提取物>正丁醇提取物>水提取物>石油醚提取物。此时乙酸乙酯提取物的还原能力相当于VC还原能力的28.13%,正丁醇提取物与之接近,石油醚提取物所表现的还原能力最弱,相当于VC还原能力的10.80%。

图6 提取物的还原能力
3 结 论

[1]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准维吾尔药分册[M].乌鲁木齐:新疆科技卫生出版社,1998:112.
[2]李紫薇,刘伟,张艺,等.薰衣草总黄酮的微波提取及其抗氧化性研究[J].食品工业科技,2013,34(05):255-258.
[3]Field T,Field T,Cullen C,et al.Lavender bath oil reduces stress and crying and enhances sleep in very young infants [J].Early Hum Dev,2008,84(6):399-401.
[4]黄梅桂,李春阳.新疆不同品种薰衣草精油特征香气成分及感官属性分析[J].现代食品科技, 2014,30(12):255-262.
[5]戴好富,梅文莉.天然产物现代分离技术[M].北京:中国农业大学出版社,2006:60.
[6]许宁宁,白云娥,薛强强,等.北桑寄生化学成分系统预实验[J].中国药物与临床,2012,12(06):762-763.
[7]邢蕊.短瓣金莲花药效学及质量标准研究[D].哈尔滨:黑龙江中医药大学,2012.
[8]丘琴,甄汉深,谢梦英,等.桑椹化学成分系统预试验与光谱鉴别的研究[J].广西中医,2009,32(03):52-54.
[9]侯小涛,邓家刚,戴航,等.银合欢种子化学成分预实验[J].时珍国医国,2009,20(1):62-63.
[10]Erel O.A novel automated direct measurement method for total antioxidant capacit y using a new generation,more stable ABTS radical cation[J].Clin Biochem,2004,37(4):277-285.
[11]张玲,李向辉,杨玲.药桑不同萃取部位总黄酮与抗氧化活性相关性[J].光谱实验室,2013,3(01):2645-2648.
Chemical Composition and Antioxidant Activity of Lavender Leaves*
LIZi-wei,ZHANGYi,OUYANGYan,LIShuang-shuang,LIUChong
(Key Laboratory at Universities of Education Department of Xinjiang Uygur Autonomous Region, Yili Normal University, Xinjiang Yining 835000, China)

lavender leaves; chemical composition; antioxidant activity
新疆维吾尔自治区教育厅普通高等学校“天然产物化学与应用重点实验室”重点开放课题(No.2013YSHXZD02)。
李紫薇(1970-),女,副教授,主要从事天然产物的应用研究和环境分析。
O652
A
1001-9677(2016)010-0064-04

