马铃薯品种‘陇薯11号’再生体系的构建
陈晓艳,孟亚雄,贾小霞,张 武,刘 石,郭玉美,齐恩芳*
(1.甘肃农业大学农学院,甘肃兰州730070;2.甘肃省农业科学院马铃薯研究所,甘肃兰州730070;3.甘肃农业职业技术学院,甘肃兰州730070)
遗传育种
马铃薯品种‘陇薯11号’再生体系的构建
陈晓艳1,孟亚雄1,贾小霞2,张武2,刘石2,郭玉美3,齐恩芳2*
(1.甘肃农业大学农学院,甘肃兰州730070;2.甘肃省农业科学院马铃薯研究所,甘肃兰州730070;3.甘肃农业职业技术学院,甘肃兰州730070)
采用L16(45)正交试验设计,以马铃薯品种‘陇薯11号’为试验材料,分别选用4种植物激素(诱导愈伤的GA3、6-BA、NAA、2,4-D和诱导分化的GA3、NAA、IAA、KT)的4个水平对其茎段的离体再生进行了研究,筛选适合‘陇薯11号’的愈伤和芽分化诱导培养基。结果表明,适合‘陇薯11号’的茎段愈伤诱导培养基为MS+GA3(7.5 mg/L)+6-BA(2.5 mg/L)+2,4-D(0.5 mg/L),诱导率达98.72%,生长状态最好;诱导芽分化的最佳培养基为MS+NAA(0.25 mg/L)+IAA(0.1 mg/L)+KT(3.0 mg/L),不定芽诱导率为95.83%,分化苗健壮。
陇薯11号;外植体;愈伤诱导;芽分化;植物激素;正交试验
马铃薯(Solanum tuberosum L.)是茄科茄属作物,具有分布范围广、适应性强、产量高、营养全面和用途广泛等特点,是中国继水稻、小麦、玉米之后的第四大粮食作物[1]。近年来,因其在生产上的重要性及病虫害的影响,马铃薯的改良已受到广泛的重视,利用基因工程技术对马铃薯进行改良具有广阔的前景。马铃薯组织培养再生系统的建立,是遗传转化技术在马铃薯改良中应用的关键。马铃薯不同品种间诱导再生的条件差异较大,因此,对马铃薯特定基因型进行再生体系的筛选,确定有针对性的最佳培养基具有重要意义及应用价值。目前已有研究人员成功建立了‘大西洋’[2]、‘中薯2号’[3]、‘克新1号’[4]、‘陇薯10号’[5]、‘陇薯5号’[6]、‘陇薯3号’和‘陇薯6号’[7]不同马铃薯品种的再生体系。本试验以马铃薯品种‘陇薯11号’为试验材料,进行最佳再生体系的筛选,旨在为通过生物技术途径进行马铃薯品种改良奠定基础。
1 材料与方法
1.1供试材料
供试材料为马铃薯品种‘陇薯11号’,由甘肃省农业科学院马铃薯研究所提供。
1.2培养基和培养条件
MS为基本培养基,含蔗糖3%,琼脂3.5g/L,pH值为5.8。培养条件:温度(22±1)℃,光照14 h/d,光照强度3000lx。
1.3试验方法
1.3.1正交试验设计
采用L16(45)正交设计[8],共16个处理,每个处理设3个重复,考察不同植物激素对‘陇薯11号’愈伤组织诱导和芽分化的影响,各因素水平见表1与表2。
1.3.2外植体制备
在超净工作台上,取带有4~6个茎节的脱毒马铃薯试管苗,切成带1个腋芽的单节茎段,转接到盛有40 mL经过高压灭菌(121℃,30 min)的固体MS培养基、容积为150 mL的三角瓶中。将三角瓶放于培养室中,在温度(22±1)℃、光照强度3 000 lx、光照时间14 h/d条件下培养,待试管苗长至4~5个茎节时,在相同条件下进行扩繁。

表1 诱导愈伤正交试验因素编码Table 1Code for callus induction in L16(45)orthogonal experiment
表2 诱导芽分化正交试验因素编码Table 2Code for bud differentiation in L16(45)orthogonal experiment
1.3.3愈伤组织诱导与芽分化
以生长健壮的试管苗茎段为外植体材料,在无菌条件下将其切成长度约0.5 cm的茎段(不带腋芽),将切段以平铺的方式均匀接种到不同激素配比的愈伤组织诱导培养基中,每处理接3皿,每皿22个茎段,在温度(22±1)℃、光照强度3 000 lx,光照时间14 h/d条件下培养28 d,统计愈伤组织诱导率,筛选出最佳愈伤诱导培养基。将最佳培养基上诱导出的愈伤组织转接到16个诱导芽分化的培养基上继代培养,每处理接3皿,每皿8个愈伤,进行芽分化诱导,观察其不定芽分化情况并统计芽分化率,确定最佳芽分化培养基。在同样的条件下培养芽长至1~2 cm时,将生长粗壮的小苗切下转入1/2 MS培养基上诱导生根。
愈伤率(%)=愈伤化外植体数/总外植体数×100
分化率(%)=分化芽数/总外植体数×100
1.3.4数据处理
试验数据采用Microsoft Excel 2007软件进行基本数据的统计,用DPS v6.55版数据处理系统进行差异显著性分析,处理平均数的多重比较采用LSD法。
2 结果与分析
2.1愈伤组织诱导
‘陇薯11号’茎段在16个正交设计组合中接种10 d后,部分处理上开始形成愈伤组织。有些两端膨大明显,呈哑铃状,颜色鲜绿色或淡黄色,表面光滑,质地较致密;有些两端膨大不明显,结构疏松,整体形状不良;有些表面形成瘤状突起、质地较疏松;有些则生成长短不一的根(图1)。
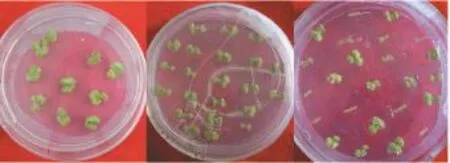
图1 ‘陇薯11号’茎段诱导愈伤组织Figure 1Callus induced from stem segments of'Longshu 11'
表3 ‘陇薯11号’愈伤组织诱导的L16(45)正交试验结果Table 3Results of callus induction in L16(45)orthogonal experiment of'Longshu 11'
不同浓度激素组合对‘陇薯11号’愈伤组织诱导的影响见表3。直观分析结果表明,4种激素诱导愈伤组织形成的能力由强到弱依次为:GA3> 6-BA>2,4-D>NAA,即GA3对愈伤组织的形成影响最大,可显著促进愈伤组织的形成,6-BA和2,4-D的影响次之,NAA的影响最弱。为寻求最佳质量浓度的激素组合,进行了方差分析,结果表明,处理11极显著地高于其他处理,诱导率达98.72%,形成的愈伤呈深绿色、表面光滑、哑铃状、质地致密;其他处理间比较,处理4和6之间无极显著差异,但差异达到显著性水平;而处理6和8,2和3,14、13、7、9和12之间既未达到极显著水平,也无显著差异;7、9、12、15、5和16,15、5、16和1之间无极显著差异,处理7、9、12之间,15、5、16之间以及16和1之间无显著差异,而处理7、9、12显著大于15、5、16,处理15、5显著大于1,处理10极显著高于其他处理,诱导率为84.94%,但处理11的诱导率极显著高于处理10,而且形成的愈伤颜色深,质地更为致密。综合考虑各方面的因素,GA3的浓度取A3, 6-BA的浓度取B3,2,4-D的浓度取D2,NAA的浓度取C1。最后根据正交试验的原则可得出4种植物激素的最佳配比为A3B3C1D2,即MS+GA3(7.5 mg/ L)+6-BA(2.5 mg/L)+2,4-D(0.5 mg/L),诱导率为98.72%。
2.2芽分化
用激素组合A3B3C1D2诱导‘陇薯11号’的茎段,待愈伤组织长出后,转接到16种不同处理的诱导芽分化的培养基上,部分组合可诱导出不定芽(图2)。
对‘陇薯11号’分化率诱导的正交试验结果见表4。直观分析结果表明,4种激素对‘陇薯11号’诱导分化的能力由强到弱依次为:IAA>GA3> NAA>KT,可看出,IAA的存在对不定芽的形成影响最大,GA3的影响次之,NAA和KT的影响最弱。为寻求最佳浓度的激素组合,进行方差分析,结果表明,处理6、8、16之间无极显著差异,其中处理6与8无显著差异,8与16无显著差异,但6与16差异显著;处理8、16、9和14之间,16、9、14和1之间,9、14、1和10之间,10、13和4之间,13、4、15和5之间,4、15、5、2和12之间均无极显著差异,而处理2、12和7之间以及7、11、3之间既无极显著差异也无显著差异。综上说明处理6和8均是促进不定芽形成的最优组合,但考虑到培养基中植物激素添加的种类越少越好的原则,选择处理6为最佳组合,其4种植物激素的最佳配比为C2E2F1G4,即MS+NAA(0.25 mg/L)+IAA(0.1 mg/ L)+KT(3.0 mg/L),诱导率为95.83%。
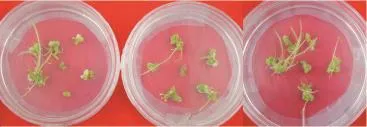
图2 ‘陇薯11号’愈伤诱导芽分化Figure 2Bud induction from callus of'Longshu 11'
2.3生根培养
分化出来的健壮小苗在不含任何激素的1/2 MS培养基中诱导生根,14 d左右即可观察到根的发生,诱导不定芽生根率为100%(图3)。
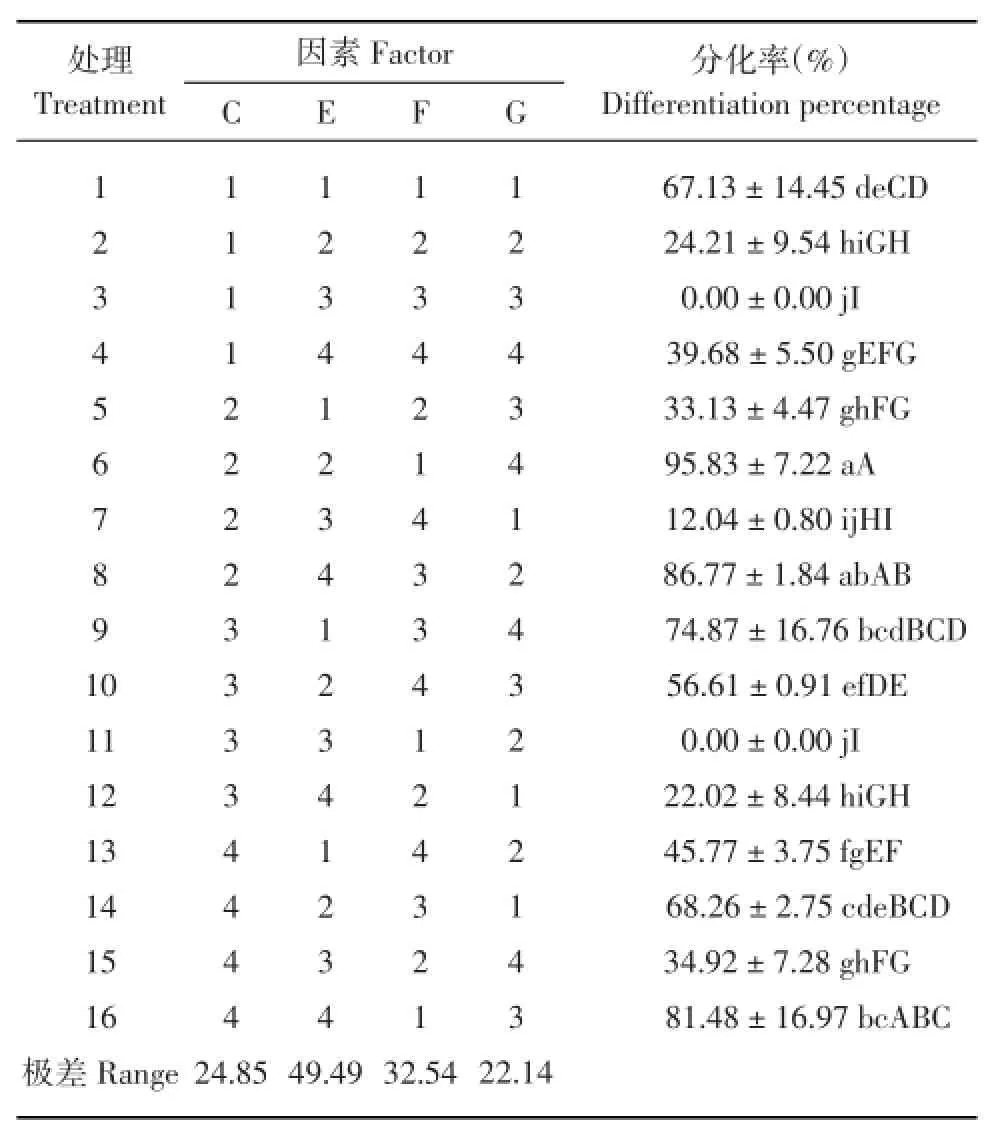
表4 ‘陇薯11号’不定芽诱导的L1(645)正交试验结果Table 4Results of bud differentiation in L16(45) orthogonal experiment of'Longshu 11'

图3 ‘陇薯11号’诱导生根Figure 3Rooting from shoot of'Longshu 11'
3 讨论
通常马铃薯的3种器官均有再生能力,分别为愈伤组织再生途径、不定芽再生途径和体细胞胚胎再生途径。马铃薯再生体系中以愈伤组织再生途径运用最多,采用的外植体主要有叶片、茎段、原生质体等。杨琼芬等[9]以8个马铃薯品种(系)为试验材料,进行了叶片离体再生研究,诱导出了愈伤组织并获得了再生植株。崔海辰等[4]以‘东农303’脱毒试管薯为外植体,接种在添加了ZT和IAA的MS培养基上诱导出了愈伤组织并再生植株。在成功培养出马铃薯再生植株的报道中,基本培养基MS是被普遍应用的。但在培养过程的不同时期,研究者们对激素种类和浓度进行了优化,得到了适合不同马铃薯的最优组合。胡霞[10]用MS+6-BA(2.5 mg/L)+NAA(0.5 mg/L)+GA3(3 mg/L)+2,4-D(0.5 mg/L)培养基从马铃薯品种‘LK99’试管苗茎段上诱导出了胚性愈伤组织,诱导率高达91.58%,生长状态良好。王宪[11]以适应长日照的原始二倍体栽培种‘富利亚’和‘窄刀薯’杂种无性系试管苗为材料,分别以叶片、茎段为外植体,进行愈伤组织诱导,结果表明适合‘富利亚’和‘窄刀薯’杂种叶片愈伤组织的最佳诱导培养基为MS+6-BA(1.0 mg/ L)+IAA(0.1 mg/L)+GA3(2.5 mg/L),适合其茎段愈伤组织的最佳诱导培养基为MS+6-BA(5.0 mg/L)+ IAA(0.1 mg/L)+GA3(5.0 mg/L),同时表明茎段愈伤组织诱导不定芽分化比叶片愈伤组织诱导不定芽分化容易。本试验用‘陇薯11号’茎段作为外植体,筛选出了适合‘陇薯11号’的最佳愈伤诱导培养基组合MS+ GA3(7.5 mg/L)+6-BA(2.5 mg/L)+2,4-D(0.5 mg/ L),将生长状态优良的愈伤组织接种至MS+NAA(0.25 mg/L)+IAA(0.1 mg/L)+KT(3.0 mg/L)培养基上时,分化率最高且分化出的小苗颜色鲜嫩,生长健壮,是适合‘陇薯11号’不定芽诱导的最佳培养基。
本研究应用正交试验设计,确定了马铃薯品种‘陇薯11号’用茎段诱导愈伤组织和芽分化的最佳激素配比,结果表明马铃薯茎段在愈伤诱导和芽分化这2个阶段所需的生长激素种类和质量浓度有很大差异,在互作效应的影响下,最佳激素水平的组合并不是每种单因素最佳水平的组合。这为以后利用马铃薯茎段进行离体快繁提供了理论依据,而且可以作为马铃薯基因转化的载体。
[1]高志民.我国马铃薯主粮化战略启动[N].人民政协报, 2015-01-08(7).
[2]柳蓉.马铃薯的再生及其再生植株遗传稳定性研究[D].长沙:湖南农业大学,2007.
[3]秦敏,郜刚.马铃薯再生体系的建立及其遗传分析[J].中国马铃薯,2005,19(5):18-21.
[4]崔海辰,董磊,陶龙鑫,等.马铃薯再生体系的建立[J].内蒙古农业大学学报:自然科学版,2012,33(4):131-135.
[5]贾小霞,文国宏,齐恩芳,等.马铃薯新品种陇薯10号再生体系的建立[J].甘肃农业科技,2013(11):5-7.
[6]鲍红春,李小雷,王建平,等.马铃薯品种陇薯5号茎段再生体系的建立[J].内蒙古农业科技,2014(2):31-32.
[7]齐恩芳.马铃薯再生体系建立及农杆菌介导AcInv反义基因转化[D].兰州:甘肃农业大学,2006.
[8]张燕.正交试验简介[J].上海农业科技,1977(19):5-8.
[9]杨琼芬,卢丽丽,潘哲超,等.马铃薯叶片愈伤组织再生体系的建立[J].西南农业学报,2012,25(3):1001-1004.
[10]胡霞.全粉加工兼早熟菜用马铃薯品种LK99再生体系的建立[J].甘肃农业科技,2015(1):14-16.
[11]王宪.二倍体马铃薯再生体系建立及耐盐愈伤组织的筛选[D].哈尔滨:东北农业大学,2012.
Construction of Regeneration System for Potato Variety'Longshu 11'
CHEN Xiaoyan1,MENG Yaxiong1,JIA Xiaoxia2,ZHANG Wu2,LIU Shi2,GUO Yumei3,QI Enfang2*
(1.College of Agronomy,Gansu Agricultural University,Lanzhou,Gansu 730070,China;2.Potato Research Institute,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China;3.Gansu Agriculture Technology College,Lanzhou,Gansu 730070,China)
ract:L16(45)orthogonal design was adopted to select the optimal plant hormone combination for regeneration of'Longshu 11'potato stem.Four plant hormones(callus induction with GA3,6-BA,NAA and 2,4-D,and bud differentiation with GA3,NAA,IAA and KT)were applied at four different levels to study their influences on the growth and differentiation of potato stem calli.The results indicated that the optimal medium for callus induction from stem was MS+GA3(7.5 mg/L)+6-BA(2.5 mg/L)+2,4-D(0.5 mg/L),with 98.72%induction percentage and the best growth status;the optimal medium for inducing bud differentiation from stem calli were found to be MS+NAA(0.25 mg/L)+IAA (0.1 mg/L)+KT(3.0 mg/L),with 95.83%induction percentage of adventitious buds and strong seedling.
rds:Longshu 11;explant;callus induction;bud differentiation;plant hormone;orthogonal experiment
S532
B
1672-3635(2016)02-0065-05
2015-07-22
国家自然科学基金(31360353);甘肃省农业生物技术研究与应用开发项目(GNSW-2014-13)。
陈晓艳(1989-),女,硕士研究生,研究方向为抗病毒马铃薯的研究。
(Corresponding author):齐恩芳,副研究员,主要从事马铃薯组培脱毒及品种资源研究,E-mail:qefang@126.com。

