农杆菌侵染条件对柱花草遗传转化效率的影响
陈彩虹,钏秀娟,王荟,贾艳星,陈志坚,刘国道,罗丽娟*
(1.海南大学园艺园林学院,海南 海口 570228;2.中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
农杆菌侵染条件对柱花草遗传转化效率的影响
陈彩虹1,钏秀娟1,王荟1,贾艳星1,陈志坚2,刘国道2,罗丽娟1*
(1.海南大学园艺园林学院,海南 海口 570228;2.中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
在前期建立的柱花草高效组织再生体系基础上,进一步以柱花草热研5号的下胚轴为受体材料,以GUS基因为报告基因,研究了农杆菌介导的柱花草遗传转化的几个影响因素,包括根癌农杆菌菌液浓度、浸染时间和共培养时间等对农杆菌介导的柱花草遗传转化效率的影响。结果表明,以柱花草下胚轴为外植体,在农杆菌菌液浓度(OD600)为0.4~0.6,农杆菌浸染时间为15 min和共培养3 d的条件下,愈伤的转化效率为72%。愈伤组织进一步经过分化、生根和炼苗等过程后,对转化植株进行GUS染色和PCR检测,结果表明外源基因已成功整合到柱花草基因组中。本研究结果对柱花草遗传转化和关键基因功能研究具有重要的参考价值。
根癌农杆菌;遗传转化;GUS染色;柱花草
柱花草(Stylosanthesspp.)是一种重要的豆科牧草,主要分布在热带、亚热带以及温带地区[1]。“热研5号”柱花草是从哥伦比亚国际热带农业中心(CIAT)引进的CIAT184柱花草群体中,通过对早花、耐寒和抗病等性状的单株选育而成,已被种植于我国南方地区,其具有高产、抗炭疽病和耐寒等特点[2]。随着研究技术手段的发展,柱花草在生理生化特性[3]、遗传多样性[4]和植株再生以及遗传转化[5]等方面吸引了广泛的关注和研究。然而,由于存在着可利用资源少、遗传能力弱和易感染炭疽病等限制因素[6],严重制约了柱花草深入研究的开展。为了解决在柱花草中存在的上述问题,最有效和最常用的研究手段就是通过生物技术方法对柱花草进行遗传改良。
根癌农杆菌介导的植物遗传转化是一种最常用的转基因方法,在水稻(Oryzasativa)、玉米(Zeamays)、高粱(Sorghumbicolor)和大豆(Glycinemax)中都有成功的研究报道[7-10]。不同品种柱花草的组织再生以及遗传转化已有文献报道,如S.hamata[11],S.humilis[12-13]和S.guianensis等[5,14]。Manners和Way[13]采用叶盘转化法将载体pGV3850:103neo转化S.humilis,并获得转基因植株。Wang等[15]采用叶盘转化法将口蹄疫病毒外壳蛋白VP1基因转化到柱花草栽培品种“热研二号”中,获得了转基因植株。但是,迄今为止,国内外并未有从农杆菌浸染条件方面对柱花草遗传转化条件进行摸索和优化。并且,由于转化效率低,在转基因柱花草植株中进行基因功能分析只有少量文献被报道[15-16],表明了柱花草是一种难以被根癌农杆菌介导转化的豆科牧草。因此,对农杆菌介导的遗传转化条件进行摸索和优化,在稳定的组织再生体系基础上,建立和优化柱花草遗传转化体系,对柱花草遗传改良和基因功能研究有着重要的意义。
农杆菌介导的遗传转化效率受许多因素的影响,包括植物种类、外植体选择、愈伤组织诱导和分化、农杆菌浸染条件等方面[7-10]。本研究在前期建立的柱花草“热研5号”组织再生体系基础上[17],从农杆菌浸染条件方面对柱花草遗传转化条件进行摸索和优化,利用GUS染色方法分析转化效率,并通过PCR检测来鉴定转基因柱花草植株,为柱花草遗传改良和重要基因功能研究提供重要的技术支持。
1 材料与方法
1.1材料
1.1.1植物与载体菌株柱花草为“热研5号”品种(Stylosanthesguianensiscv. Reyan No. 5),由中国热带农业科学院品种资源研究所牧草中心提供,2014年10月13日种无菌苗;根癌农杆菌为EHA105(Agrobacteriumtumefaciens),载体质粒为pCAMBIA 1301(含GUS报告基因及潮霉素Hyg筛选标记)。
1.1.2试剂材料DNA聚合酶(Premix Taq Version 2.0)和DNA分子量标准(DNA Ladder Marker)均购自大连TaKaRa公司;新型广谱植物基因组DNA快速提取试剂盒购自北京盖宁金诺生物技术有限责任公司;卡那霉素、利福平、潮霉素、乙酰丁香酮均购自北京索莱宝有限公司;PCR引物合成由北京六合华大基因科技股份有限公司合成完成;常规化学药品及组织培养所用试剂均为国产AR级分析纯。
1.2方法
1.2.1无菌苗的培养无菌苗培养参照钏秀娟等[17]方法进行,待子叶完全展开后备用。
1.2.2农杆菌菌液的制备将含质粒pCAMBIA 1301的农杆菌EHA105菌液,划线培养于含有50 mg/L卡那霉素和50 mg/L 利福平的YEB固体培养基上(表1),于28℃培养2 d。挑取单克隆接种于含有50 mg/L卡那霉素和50 mg/L利福平的YEB液体培养基中28℃培养过夜。将20 μL菌液加入到添加相应抗生素的50 mL YEB液体培养基中培养至OD600为0.6。菌液于25℃,4000 r/min离心10 min,去上清,菌体沉淀用50 mL新鲜YEB液体培养基重悬使其最终OD600为0.6[18]。
1.2.3农杆菌介导的遗传转化、抗性愈伤的筛选和植株再生将下胚轴置于农杆菌(菌液OD600为0.6)悬浮液中浸染15 min,并于25℃共培养3 d后,将外植体材料转移至含200 mg/L羧苄青霉素(Carb)的CIM培养基上恢复培养1周,随后转移至含15 mg/L Hyg和200 mg/L Carb的CIM培养基中进行筛选和再生。28 d后将抗性愈伤转移至含15 mg/L Hyg和200 mg/L Carb的芽诱导胚芽培养基(表1,SIM)中,10~30 d后有体胚形成,并将成熟的体胚转入含200 mg/L Carb的状芽(表1,SEM)培养基中,待丛生芽长到2 cm时,从基部切断丛生芽并转移至含200 mg/L Carb的生根培养基(表1,RM)中培养,15 d后可获得抗性再生植株。将生根良好的再生植株经闭瓶炼苗、开瓶炼苗和移栽后,即可定植。
1.2.4转化条件的优化农杆菌菌液浓度摸索:取下胚轴分别置于含不同农杆菌菌液浓度(OD600为0.2,0.4,0.6和0.8)的悬浮液中浸泡15 min,无菌滤纸沥干残留的菌液,然后转移至愈伤诱导培养基(表1,CIM)中,于25℃暗培养3 d后,进行恢复及筛选培养,通过GUS染色结果统计筛选后的阳性转化愈伤数量。每个处理设置3个生物学重复。
农杆菌浸染时间摸索:取下胚轴分别置于OD600为0.6的农杆菌悬浮液中浸泡不同时间(5,10,15和20 min),无菌滤纸沥干残留的菌液,然后转移至愈伤诱导培养基(表1,CIM)中,于25℃暗培养3 d后,进行恢复及筛选培养,通过GUS染色结果统计筛选后的阳性转化愈伤数量。每个处理设置3个生物学重复。
共培养时间筛选:下胚轴于OD600为0.6的农杆菌悬浮液浸染15 min,无菌滤纸沥干残留的菌液,然后转移至愈伤诱导培养基(表1,CIM)中,于25℃共培养1到4 d后,进行恢复及筛选培养,通过GUS染色结果统计筛选后的阳性转化愈伤数量。每个处理设置3个生物学重复。
1.2.5GUS染色分析GUS染色参照Jefferson[19]方法进行。将转化材料浸在GUS染液中,于37℃中反应8~10 h,取出放入75%乙醇中脱色12 h,然后在实体显微镜观察外植体染色情况。
1.2.6PCR鉴定转化植株提取再生柱花草植株叶片的基因组DNA后,通过PCR扩增GUS基因,引物序列分别为F:5′-TCGCGCAAGACTGTAACCAC-3′和 R:5′-CTTTAGGCATTGGTTTCGAAGC-3′。PCR 扩增条件为:94℃预变性5 min,94℃变性30 s,57℃退火30 s,72℃延伸30 s,30个循环,最后72℃延伸10 min,随后将PCR扩增产物进行琼脂糖凝胶电泳检测。
转化效率(%)=GUS染色阳性数/筛选后的愈伤总数×100
1.3数据统计分析
所有数据均用Microsoft office excel 2003进行处理,采用SPSS软件(v13.0)进行数据统计分析。
2 结果与分析
2.1柱花草的遗传转化
以柱花草热研5号下胚轴为外植体,农杆菌介导遗传转化的共培养时期、恢复培养时期、愈伤筛选、诱芽、壮芽、生根以及移栽等过程如图1所示。
2.2不同农杆菌浸染条件对愈伤组织转化效率的影响
在农杆菌介导的遗传转化中,农杆菌菌液浓度、浸染时间和共培养时间均对转化效率有显著的影响。从图2A可以看出,随着农杆菌菌液浓度升高,愈伤组织的转化效率有增加的趋势,当OD600为0.4到0.6时,转化效率最高,约达60%;但是,随着菌液浓度增加,转化效率有降低的趋势,当OD600为0.8时,转化效率为52%,且愈伤组织分化率降低,并逐渐褐化。所以,OD600为0.4~0.6是最适合的农杆菌菌液浸染浓度。
从图2B可以看出,随着农杆菌浸染时间延长,愈伤组织的转化效率有明显增加的趋势,当浸染时间为15 min时,转化效率最高,转化效率为浸染5 min时的2.3倍;但是,随着浸染时间的继续增加,转化效率显著降低,且对愈伤组织造成伤害,浸染时间20 min时的转化效率仅为15 min时的16%,差异显著。所以,最佳的农杆菌浸染时间为15 min。

图2 不同农杆菌浸染条件对转化效率的影响Fig.2 Factors affecting the transformation efficiencies of stylo A:农杆菌菌液浓度;B:浸染时间;C:共培养时间。A: Agrobacterium concentration; B: Infected time; C: Co-culture duration. 不同字母表示差异显著(P<0.05)。Different letters indicate significant difference (P<0.05).
共培养时间显著影响愈伤组织的转化效率。图2C结果表明,随着共培养时间的延长,愈伤组织的转化效率有显著增加的趋势,当共培养时间为3 d时,愈伤组织转化效率最高,为72%,转化效率分别为共培养1和2 d时的2.7和1.3倍;但是,随着共培养时间继续延长,愈伤组织转化效率降低,共培养4 d时的转化效率仅为3 d时的61%,且愈伤组织周围有大量农杆菌形成,影响后期愈伤组织生长。所以,最佳的共培养时间为3 d。
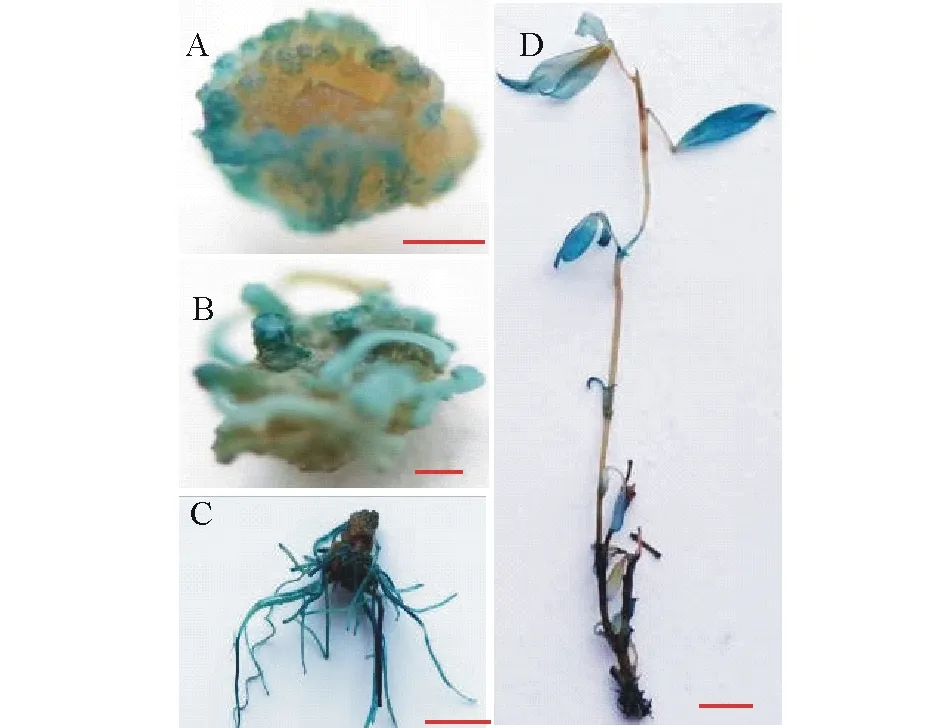
图3 转化材料GUS染色分析Fig.3 GUS staining analysis of transgenic material A:下胚轴外植体愈伤组织,标尺=100 μm;B:抗性芽,标尺=100 μm;C:根染GUS,标尺=1 cm;D:转化植株,标尺=1 cm。A: Callus induced from hypocotyl, Bar=100 μm; B: Resistant shoots induced from callus, Bar=100 μm; C: Root dyeing GUS, Bar=1 cm; D:Putative transgenic plant, Bar=1 cm.

图4 转基因抗性植株PCR检测Fig.4 PCR analysis of putative transgenic plant M:Mark;+:阳性对照(质粒);-:阴性对照(野生型植株);1~3:转基因抗性植株。M: Mark; +: Positive control (plasmid); -: Negative (wild type plant); 1-3: Three putative transgenic plant.
2.3转化材料GUS检测
柱花草下胚轴根据上述优化后的农杆菌转化条件进行处理,并经共培养和恢复培养、抗性愈伤组织诱导培养、抗性芽生长、生根和抗性苗移栽后,获得可能的转基因植株(图1)。对不同阶段的组织进行GUS染色分析,结果表明,处于筛选阶段的愈伤组织经GUS染色后呈现出蓝色,表明GUS基因已成功在愈伤组织中表达(图3A);具有抗性的愈伤组织经过芽诱导后,GUS染色呈现蓝色,表明GUS基因在抗性芽中表达(图3B);抗性芽经生根和炼苗后,转化植株和根的GUS染色呈现蓝色,表明GUS基因已稳定的在柱花草植株中表达(图3C,D)。
2.4转基因植株的PCR检测
本研究进一步对转化后的再生植株在基因组水平上进行PCR检测。我们从12株移栽的抗性植株随机挑选3株并提取其叶片基因组DNA,通过PCR反应扩增GUS基因。结果表明,随机挑选的3株转化植株都能成功的扩增出563 bp的目的片段(图4,1-3泳道),而野生型柱花草(-)则未能扩增出目的条带。结果进一步证明了GUS基因已成功的整合到柱花草基因组中。
3 讨论
根癌农杆菌介导的遗传转化已成为作物遗传转化的主要途径之一,并可对植物性状进行定向的遗传改良[20-21]。在柱花草遗传转化研究中,国外对其组织再生和遗传转化方法进行了相关分析[5,12-13,15],国内就王冬梅等[22]从农杆菌浸染条件之农杆菌菌液浓度方面进行研究的相关报道。由于农杆菌介导的遗传转化效率受植物种类和农杆菌浸染条件等因素影响,因此,本研究主要从农杆菌浸染条件方面对柱花草遗传转化条件进行摸索和优化,结合GUS染色和PCR分析来鉴定转基因柱花草植株。
农杆菌能否有效地附着并浸染外植体是遗传转化成功与否的关键。对农杆菌介导的紫花苜蓿(Medicagosativa)遗传转化条件进行摸索,包括农杆菌菌液浓度,浸染时间和共培养时间等,结果表明最佳的转化条件为农杆菌菌液浓度OD600在0.3~0.5间,浸染时间为10~15 min,共培养时间为3 d,转化效率高达72%[20]。在百脉根(Lotuscorniculatus),研究发现当农杆菌浓度OD600在0.5左右,浸染20 min和共培养3 d的条件下,百脉根遗传转化效率为50%[21]。在本研究中,我们发现当农杆菌菌液OD600为0.4~0.6时,浸染15 min和共培养3 d的条件下,可获得较高的柱花草愈伤组织转化效率(约72%),即为最适的农杆菌转化条件,过低或过高的菌液浓度、浸染时间和共培养时间都对转化效率和愈伤组织生长产生不利影响(图2)。这与上述紫花苜蓿和百脉根转化条件中的最适农杆菌菌液浓度和共培养时间相符,但与百脉根的浸染时间不一致,其可能是由于不同外植体材料受农杆菌浸染的敏感性不同。
柱花草的遗传转化始于1987年,Manners[12]以S.humilis为材料,将农杆菌悬浮液浸泡外植体2~5 min,共培养2 d,植株转化效率约为0.3%。王冬梅等[22]以热研二号为材料,将预培养2 d的外植体,用经10 μmol/L乙酰丁香酮预处理OD值为1.5的农杆菌和稀释5倍番木瓜浸提液一起,采用农杆菌抽真空浸入法转化柱花草,在加1.5 mg/L脯氨酸的共培养基上共培养,芽的转化率可达20%。本研究在前人研究的基础上通过对农杆菌浸染条件进行摸索后,使得柱花草的愈伤转化效率高达72%,建立和优化了柱花草遗传转化体系,获得转基因柱花草。本研究结果对柱花草遗传转化和关键基因功能研究提供了可靠的依据,并为柱花草的遗传改良奠定了基础。
References:
[1]Liu G D, Phaikaew C, Stur W W.Stylosanthesdevelopment and utilization in China and south-east Asia. Journal of Tropical Grasslands, 1997, 31(5): 460-466.
[2]Liu G D, Bai C J, He H X,etal. The selection and utilization ofStylosanthesguianensiscv. Reyan No. 5. Acta Agrestia Sinica, 2001, 9(1): 1-7.
[3]Zhou B Y, Guo Z F. Effect of ABA and its biosynthesis inhibitor on chilling resistance and anti-oxidant enzymes activity. Acta Prataculturae Sinica, 2005, 14(6): 94-99.
[4]Jiang C S. The progress of studies onStylosanthes. Journal of Chinese Journal of Tropical Crops, 2005, 26(4): 104-108.
[5]Quecini V M, Alves A C, Vieiraet M L,etal. Factors influencing electroporation-mediated gene transfer toStylosanthesguianensis(Aubl.) Sw. protoplasts. Journal of Genetics and Molecular Research, 2002, 25(1): 73-80.
[6]Yang M X, Lin G B, Chen C H,etal. Microscopic observation ofStylosanthesinfected byColletotrichumgloeosporioides. Acta Prataculturae Sinica, 2015, 24(5): 175-181.
[7]Qin D J, Chen D X, Hu X,etal. Advances on genetic transformation of rice. Journal of Biology, 2008, 25(5): 5-9.
[8]Sun C b, Guo J, Tao R,etal. Study on genetic transformation system of maize mediated byAgrobacteriumtumefaciens. Journal of Chinese Agricultural Science Bulletin, 2012, 28(36): 71-75.
[9]Zhu L, Lang Z H, Li G Y,etal. Introduction of Btcry1Ahgene into sweet sorghum (SorghumbicolorL. Moench) byAgrobacteriumtumefaciens-mediated transformation. Journal of Scientia Agricultura Sinica, 2011, 44(10): 1989-1996.
[10]Muthukrishnan A, Kondeti S, Thankaraj S M,etal. Application of sonication in combination with vacuum infiltration enhances theAgrobacterium-mediated genetic transformation in indian soybean cultivars. Journal of Applied Microbiology and Biotechnology, 2015, 75: 2266-2287.
[11]Manners J M. Transformation ofStylosanthesspp. usingAgrobacteriumtumefaciens. Journal of Plant Cell Reports, 1987, 6: 204-207.
[12]Manners J M. Transgenic plants of the tropical pasture legumeStylosantheshumilis. Journal of Plant Science, 1988, 55: 61-68.
[13]Manners J M, Way H. Efficient transformation with regeneration of the tropical pasture legumeStylosantheshumilisusingAgrobacteriumrhizogenesand a Ti plasmid-binary vector system. Journal of Plant Cell Reports, 1989, 8: 341-345.
[14]Sarria R, Calderón A, Thro A M,etal.Agrobacterium-mediated transformation ofStylosanthesguianensisand production of transgenic plants. Journal of Plant Science, 1994, 96: 119-127.
[15]Wang D M, Zhu J B, Peng M,etal. Induction of a protective antibody response toFMDVin mice following oral immunization with transgenicStylosanthesspp. as a feed stuff additive. Journal of Transgenic Research, 2008, 17(6): 1163-1170.
[16]Bao G G, Zhuo C L, Guo Z F,etal. Co-expression ofNCEDandALOimproves vitamin C level and tolerance to drought and chilling in transgenic tobacco and stylo plants. Journal of Plant Biotechnology Journal, 2016, 1(14): 1-9.
[17]Chuan X J, Chen C H, Luo L J. Callus induction ofStylosanthesguianensiscv. Reyan No.5. Pratacultural Science, 2015, 32(1): 78-84.
[18]Tippani R, Yarra R, Bulle M,etal. In vitro plantlet regeneration andAgrobacteriumtumefaciensmediated genetic transformation of Indian Kino tree (PterocarpusmarsupiumRoxb.). Journal of Acta Physiologiae Plantarum, 2013, 35: 3437-3446.
[19]Jefferson R A. Assaying chimeric genes in plants: the GUS gene fusion system. Journal of Plant Molecular Biology Reporter, 1987, 5: 387-405.
[20]Liu J L, Zhang Z L, Wu Y M,etal. Establishment of an efficientAgrobacterium-mediated genetic transformation system ofLotuscorniculatus. Acta Prataculturae Sinica, 2006, 15(3): 128-131.
[21]Ma H L, Lu X S, Cao Z Z,etal. Analysis of factors influencing gene transformation inMedicagosativa. Acta Prataculturae Sinica, 2006, 15(5): 94-102.
[22]Wang D M, Tang Y Q, Zhou P. An investigation of approaches to optimize gene transformation system ofStylosanthesguianensisReyanⅡ. Pratacultural Science, 2005, 22(10): 25-30.
[2]刘国道, 白昌军, 何华玄, 等. 热研5号选育研究. 草地学报, 2001, 9(1): 1-7.
[3]周碧艳, 郭振飞. ABA及其合成抑制剂对柱花草抗冷性及抗氧化酶活性的影响. 草业学报, 2005, 14(6): 94-99.
[4]蒋昌顺. 柱花草的研究进展. 热带作物学报, 2005, 26(4): 104-108.
[6]杨茂霞, 林国彪, 陈彩虹, 等. 胶胞炭疽菌侵染柱花草叶片的显微观察. 草业学报, 2015, 24(5): 175-181.
[7]秦代锦, 陈德西, 胡晓, 等. 水稻遗传转化研究进展. 生物学杂志, 2008, 25(5): 5-9.
[8]孙传波, 郭嘉, 陶蕊, 等. 农杆菌介导玉米遗传转化体系的研究. 中国农学通报, 2012, 28(36): 71-75.
[9]朱莉, 郎志宏, 李桂英, 等. 农杆菌介导甜高粱转Btcry1Ah的研究. 中国农业科学, 2011, 44(10): 1989-1996.
[17]钏秀娟, 陈彩虹, 罗丽娟. 热研5号柱花草高频、优质愈伤组织的诱导. 草业科学, 2015, 32(1): 78-84.
[20]刘建利, 张占路, 吴燕民, 等. 百脉根农杆菌快速高效遗传转化体系的建立. 草业学报, 2006, 15(3): 128-131.
[21]马晖玲, 卢欣石, 曹致中, 等. 紫花苜蓿基因转化的影响因素分析. 草业学报, 2006, 15(5): 94-102.
[22]王冬梅, 唐燕琼, 周鹏. 热研二号柱花草转化体系优化的研究. 草业科学, 2005, 22(10): 25-30.
*Factors affecting genetic transformation efficiency for stylo (Stylosanthesguianensis) withAgrobacteriumtumefaciens
CHEN Cai-Hong1, CHUAN Xiu-Juan1, WANG Hui1, JIA Yan-Xing1, CHEN Zhi-Jian2, LIU Guo-Dao2, LUO Li-Juan1*
1.HorticultureandLandscapeofHainanUniversity,Haikou570228,China;2.TropicalCropGeneticResourcesInstitute,ChineseAcademyofTropicalAgriculturalSciences,Danzhou571737,China
The objective of this study was to investigate effects ofAgrobacteriumconcentration, infection time and co-culture duration on the genetic transformation efficiency for stylo (Stylosanthesguianensis) using a high-efficiency regeneration system that had been developed previously. Hypocotyls from stylo seedlings were used as plant material and the β-glucuronidase (GUS) gene was used as the reporter gene. The callus transformation efficiency was evaluated by GUS staining. The callus transformation efficiency reached 72% under the following conditions:Agrobacteriumat a concentration of OD600=0.4-0.6, with 15 mins infection and 3 days of co-cultivation. The exogenous gene had been successfully introduced into the stylo genome as indicated by GUS staining and PCR detection after callus selection, shoot differentiation and rooting. The results indicate that thisA.tumefaciens-mediated transformation system is suitable for genetic improvement and functional gene analysis of stylo.
Agrobacteriumtumefaciens; genetic transformation; GUS staining;Stylosanthes
10.11686/cyxb2015532
http://cyxb.lzu.edu.cn
2015-11-26;改回日期:2016-01-26
国家自然科学基金(31360575), 国家牧草产业技术体系热带牧草育种(CARS-35-03), 海南大学优秀研究生学位论文培育计划(M8K3124001001003002)资助。
陈彩虹(1992-), 女, 海南文昌人, 在读硕士。E-mail:331202062@qq.com
Corresponding author. E-mail:Luoljd@126.com
陈彩虹,钏秀娟,王荟,贾艳星,陈志坚,刘国道,罗丽娟. 农杆菌侵染条件对柱花草遗传转化效率的影响. 草业学报, 2016, 25(6): 102-108.
CHEN Cai-Hong, CHUAN Xiu-Juan, WANG Hui, JIA Yan-Xing, CHEN Zhi-Jian, LIU Guo-Dao, LUO Li-Juan. Factors affecting genetic transformation efficiency for stylo (Stylosanthesguianensis) withAgrobacteriumtumefaciens. Acta Prataculturae Sinica, 2016, 25(6): 102-108.

