次磷酸铝的制备及动力学研究*
周芳,陈玉婷,徐源来,池汝安
(1.武汉工程大学化工与制药学院,湖北武汉430073;2.绿色化工过程教育部重点实验室)
次磷酸铝的制备及动力学研究*
周芳1,2,陈玉婷1,徐源来1,2,池汝安1,2
为了获得一种高效的无卤阻燃剂,采用一水次磷酸钠和十八水硫酸铝合成次磷酸铝。考察了反应温度、原料物质的量比、反应时间对次磷酸铝产率的影响,并通过一级动力学方程和二级动力学方程模拟研究了其反应机理。结果表明,当优化后的反应条件,即反应温度为90℃、反应时间为3 h、次磷酸钠与硫酸铝物质的量比为7.5∶1时,所得次磷酸铝产品产率为96.61%。一水次磷酸钠与十八水硫酸铝合成次磷酸铝属于动力学一级反应,反应动力学常数方程式:k=18exp(-10 547/RT),反应活化能Ea=10 547 J/mol。对所得产品进行IR、XRD和SEM-EDS表征,结果表明产品为目标产物次磷酸铝。
次磷酸铝;次磷酸钠;硫酸铝;动力学
(1.武汉工程大学化工与制药学院,湖北武汉430073;2.绿色化工过程教育部重点实验室)
次磷酸铝作为磷系无卤阻燃剂,多用于工程塑料等高分子材料领域[1]。工程塑料是替代工程材料和金属制造机器零部件的高分子材料,具有优良的综合性能。然而工程塑料及高分子材料均具有易燃,并产生大量有毒气体的缺点。因此,亟需高效、环保的阻燃剂改善工程塑料等高分子材料的阻燃性。相较于传统的卤系阻燃剂在燃烧过程中释放大量毒性、腐蚀性烟气,更为环保的无卤阻燃剂正逐渐进入人们的视野。无卤阻燃剂包括无机阻燃剂、磷系阻燃剂、氮系阻燃剂等。其中,磷系阻燃剂又包括红磷、次膦酸盐、次磷酸盐等[2]。红磷具有高效、低毒的优点,但是也存在易潮、自燃、与聚合物相容性不好等缺点。次膦酸盐具有良好的阻燃性能,但工业生产相对复杂,限制了其发展。因此,与次膦酸盐具有相似结构的次磷酸盐引起了越来越多的关注[3-8]。笔者着眼于次磷酸铝阻燃剂的制备,并通过动力学模拟研究了次磷酸钠与硫酸铝反应生成次磷酸铝的反应机理。
1 实验部分
1.1试剂和仪器
试剂:一水次磷酸钠(AR)、十八水硫酸铝(AR),均购自武汉申试化工科技有限公司。
仪器:Varian 640-IR型傅立叶红外光谱仪、D8-Advance型X射线衍射仪、Vega-3型扫描电子显微镜。
1.2实验原理
将次磷酸钠NaH2PO2·H2O与Al2(SO4)3·18H2O溶于水,发生复分解反应,生成次磷酸铝白色沉淀,反应方程:

1.3实验步骤
采用一水次磷酸钠配置6 mol/L的次磷酸钠溶液,十八水硫酸铝配置0.6 mol/L的硫酸铝溶液备用。用移液管将一定量次磷酸钠溶液加入装有电动搅拌装置、温度计和回流冷凝管的四颈烧瓶中,采用水浴加热,等温度达到实验条件时,加入一定量的硫酸铝溶液,恒温反应一定时间,得到白色沉淀,过滤、干燥、称重,得到白色粉末状次磷酸铝固体,计算产率:

2 结果与讨论
2.1反应条件优化
1)反应时间。在反应温度为90℃、反应物料比(物质的量比,下同)为7∶1的条件下,考察了反应时间(0.5、1、2、3、4、5 h)对次磷酸铝产品产率的影响,结果见图1。从图1可见,随着反应时间的延长,次磷酸铝的产率也在逐渐的增加。在反应前期,产品的产率增加很快。当反应时间为2 h时,产率增加幅度变小。反应时间为3 h时,反应趋于平衡,此时产率达到95.38%。超过3 h后,随着时间不断延长,产品的产率增幅很小,基本保持不变。这是由于随着复分解反应的进行,后期参与反应的反应物总量越来越少,反应基本趋于平衡。反应达到平衡之后,继续延长反应时间不仅对产品产率的影响不大,而且会增大能耗。综上所述,实验确定适宜的反应时间为3 h。
2)反应物料比。在反应时间为3 h、反应温度为90℃的条件下,考察了次磷酸钠与硫酸铝物质的量比(5.5∶1、6∶1、6.5∶1、7∶1、7.5∶1、8∶1)对次磷酸铝产品产率的影响,结果见图2。从图2可见,随着反应物料比的增加,产品的产率也在逐渐增加,并最终达到平衡。在反应的前期,产品的产率增加很快。当反应物料比为7.5∶1时,次磷酸铝的产率最大,为96.61%。当反应物料比为8∶1时,次磷酸铝产率为96.63%,与7.5∶1时的结果相比区别不大。原因是反应前期,次磷酸钠的增加促使反应向着正反应进行,即生成次磷酸钠的方向。根据化学反应平衡原理,随着反应的进行,反应产物的量逐渐增多,正逆反应速率会达到一个相同的值。反应基本保持平衡后产品的产率不再增加,继续增加物料比不仅对产率影响很小,而且还会浪费原材料和增加经济损失。因此,实验确定适宜的反应物料比为7.5∶1。
3)反应温度。在反应时间为3 h、反应物料比为7.5∶1的条件下,考察了反应温度(50、60、70、80、90、100℃)对次磷酸铝产品产率的影响,结果见图3。由图3可见,随着反应温度的升高,次磷酸铝的产率也在逐渐增加,最后基本保持不变。在反应的初期,产品产率增幅较大。当达到90℃时,产品产率也达到最高,为96.61%。之后再提升反应温度,产品产率的增幅则趋缓,基本保持不变。这是因为反应过程中分子的分解和重新结合都需要能量来实现,所以提升温度可以加快反应的进行。但是一定的反应分子量所需要的反应能量存在饱和值,当温度增至能量饱和点时,再提升温度不仅对反应没有多大促进效果,还会浪费热量和损害设备。因此,实验选择适宜的反应温度为90℃。
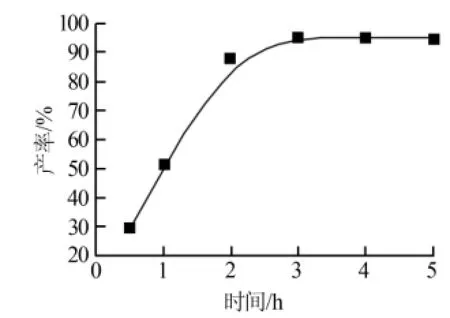
图1 反应时间对次磷酸铝产率的影响
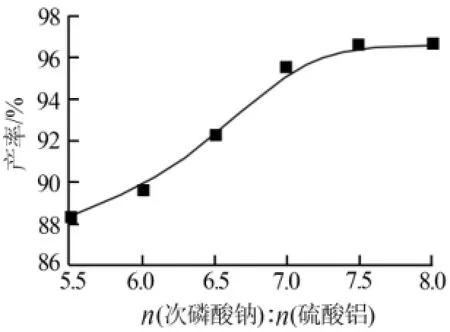
图2 物料比对次磷酸铝产率的影响
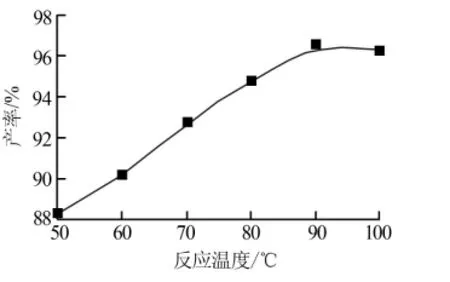
图3 反应温度对次磷酸铝产率的影响
2.2反应动力学研究
为了进一步了解次磷酸钠与硫酸铝反应生成次磷酸铝的反应机理,又进行了化学反应动力学的研究。在2.1节所获得的优化反应条件下,考察了不同反应温度(70、80、90℃)和反应时间对次磷酸铝产率的影响,结果见图4。由图4可见,3条曲线整体呈上升趋势。表明在任意温度下,产品的产率与反应时间呈正比;在反应初始阶段产率增长较快,待反应一段时间后,产率的增长速度逐渐趋缓。这是由于后期反应物的量大量减少,而反应产物则相应增多,根据化学平衡,此时反应趋于平衡。图4中温度曲线按照90、80、70℃的次序自上而下依次排列,说明反应温度越高,产品的产率就越大。而且90℃的曲线上升坡度也是最大的,表明温度越高,产率的增长速率也较大。这充分说明升高反应温度和延长反应时间均可以促进反应的进行。为了确定该反应的动力学的级数,需对该反应做动力学模拟拟合。
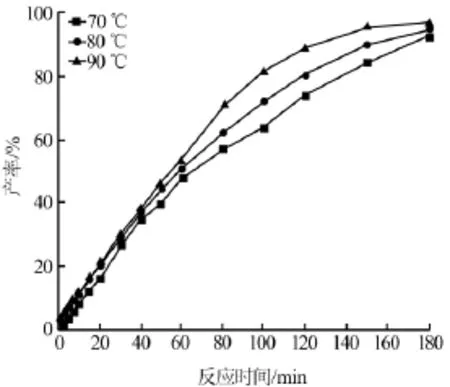
图4 不同反应温度、反应时间与次磷酸铝产率的关系
2.2.1一级反应动力学
1)反应速率常数的测定。假设该反应的反应动力学为一级反应动力学,将实验得到的数据进行处理,对其进行拟合验证。一级动力学方程式:
-dcA/dt=kcA(1)
将式(1)积分后得:
ln cA=-kt+ln cA,0(2)
式(2)中,cA为反应t时刻时,混合液中次磷酸钠的浓度;cA,0为反应初始时,混合液中次磷酸钠的浓度;t为反应时间;k为动力学反应速率常数。
结合实验数据和式(2),考察了时间t与ln cA之间的关系,结果见图5。从图5可见,ln cA与t呈线性关系,且随着时间的延长,ln cA呈直线减少趋势。3条曲线按照70、80、90℃的次序由上至下依次排列,说明随着反应温度的增加,直线的斜率相应变小。根据式(2)可知,直线的斜率就是-k的值,说明k的值随着温度的增加而变大。从图5还可见,ln cA与t的线性拟合程度与理论值仅存在一点差距,只有在90℃的曲线上,反应时间为80~120 min的点对应的ln cA值与曲线有一定的偏离,这可能是实验过程中的操作和仪器等引起的实验误差。根据计算机的拟合结果可知,70、80、90℃的拟合度分别为0.998 22、0.996 40、0.977 29。可以看出温度越小,拟合度越高,整体的拟合度较好。结合图中3条直线的线性关系式计算可知,温度为70、80、90℃时,k分别为0.450 6、0.492 6、0.552 0。
2)反应活化能的测定。由图5得到了不同的反应温度下的反应速率常数,因此要求出反应活化能和指前因子,引用阿伦尼乌斯方程:

结合动力学实验数据,由式(4)可求出反应活化能和指前因子,就能确定该反应的动力学反应速率常数。图6为1/T和ln k之间的关系。
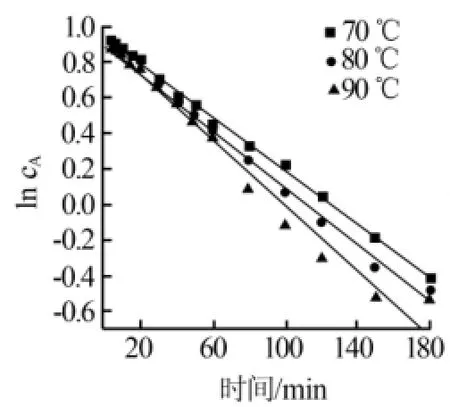
图5 一级动力学模拟
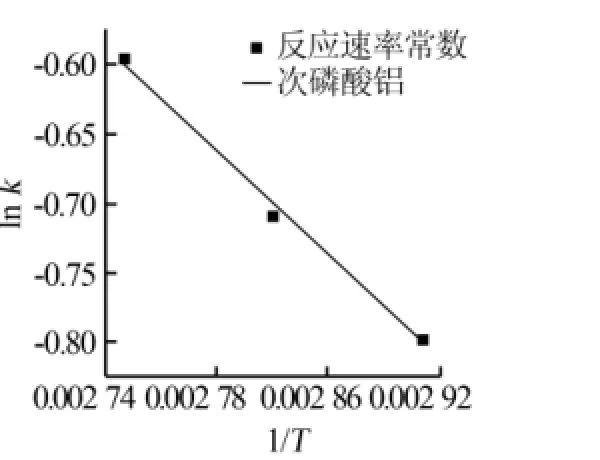
图6 反应温度的倒数与反应数率常数对数的关系
从图6可以看出,反应温度的倒数1/T与反应速率常数的对数ln k呈线性关系。随着1/T不断增大,ln k则不断减小,图6具体的线性关系式由计算机回归得到。ln k对应的3个数据点基本都在直线上,根据计算机处理结果可知曲线的拟合度为0.990 15,说明一级动力学的拟合度较好。由式(4)可知直线的斜率是-Ea/R,直线的截距为ln A。由此可计算得到反应活化能Ea=10 547 J/mol,指前因子A= 18,一级反应动力学的反应速率常数方程式:
k=18exp(-10 547/RT)
2.2.2二级反应动力学
1)反应速率常数的测定。假设该反应的反应动力学方程为二级反应动力学,结合动力学实验数据,进行拟合验证。二级反应动力学方程式:

式(5)中,cB为反应t时刻时,混合液中硫酸铝的浓度。根据实验数据与条件可知cA与cB的关系:
将关系式代入式(5),得到:
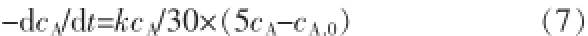
式(7)积分后得:
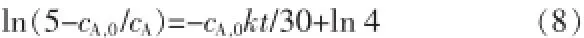
结合实验数据和式(8),以时间t为横坐标,ln(5-cA,0/cA)为纵坐标作图,结果见图7。从图7可见,ln(5-cA,0/cA)与时间t呈线性关系,随着时间增加,ln(5-cA,0/cA)逐渐变小。3条曲线分别按照70、80、90℃自上而下依次排列,说明随着反应温度的提升,直线的斜率越来越小。根据式(8)可知,直线的斜率为-cA,0kt/30的值,与k成反比,说明k随着温度的增加而变大。从图7还可见,ln cA与t的线性拟合程度与理论值有一些差距,尤其是80~120 min时的点对应的ln cA值都与曲线有一定的偏差。根据计算机的拟合结果可知,70、80、90℃的拟合度分别为0.871 39、0.891 81、0.905 26,可见温度越小则拟合度越高。根据式(8)可知,3条直线的斜率是-cA,0kt/30的值。已知cA,0是反应初始时混合液中次磷酸钠的浓度,其值为2.571 4 mol/L。所以结合线性关系式,通过简单的换算得到当温度为70、80、90℃时,k值分别为4.087 8、5.305 8、7.489 8。
2)反应活化能的测定。由图7可知不同的反应温度下的反应速率常数,引用阿伦尼乌斯方程如式(3)、式(4)。结合动力学实验数据,以1/T为横坐标,ln k为纵坐标作图,结果见图8。从图8可见,1/T与ln k之间呈线性关系,且随着1/T不断增大,ln k不断减小。ln k对应的3个数据点基本都在曲线上,且偏差很小,根据计算机处理结果可知曲线的拟合度为0.981 54,相比一级动力学的拟合度0.990 15,二级动力学的拟合度并不理想。由式(4)可知直线斜率是-Ea/R,直线截距为ln A。由此可计算得到反应活化能Ea=31 321 J/mol,指前因子A=235 473,因此二级反应动力学的反应速率常数方程:

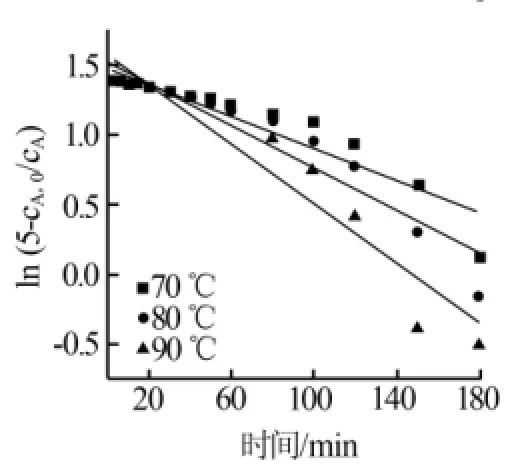
图7 二级动力学不同温度、时间与浓度变式的关系

图8 反应温度的倒数与反应数率常数对数的关系
通过对比一级动力学与二级动力学的计算结果可知,一级动力学模拟的拟合度比二级动力学要高,即采用一水次磷酸钠和十八水硫酸铝合成次磷酸铝反应的反应动力学更符合一级反应动力学方程。
2.3产品分析与检测
2.3.1红外光谱分析
通过傅里叶红外光谱仪对产品次磷酸铝做了表征,结果见图9。次磷酸铝所含基团的特征吸收峰如表1所示。
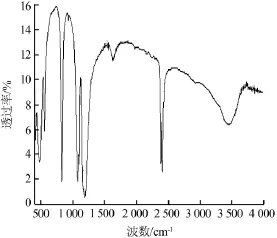
图9 次磷酸铝的红外光谱图
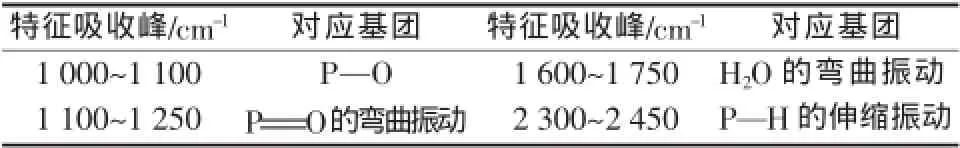
表1 基团对应的特征吸收峰
由图9、表1可见,次磷酸铝产品在1 060 cm-1处可见一个强的吸收峰,对应P—O的吸收峰。1 150 cm-1处可见一个强的吸收峰,为P=O的弯曲振动,即P=O的吸收峰。2 400 cm-1处有一个稍强的吸收峰,是PH2的伸缩振动,即P—H的吸收峰[9-11]。1 600~1 750 cm-1处有一个较弱的吸收峰,为水的弯曲振动吸收峰,说明所制备化合物中含有结晶水[12]。从以上结果分析可知,次磷酸铝产品含有次磷酸铝的所有特征吸收峰,说明得到了目标产物。
2.3.2XRD分析
将所得产品进行X射线衍射表征,结果见图10。

图10 次磷酸铝的XRD谱图
从图10可以看出,所有衍射峰和对应的次磷酸盐标准谱图的特征衍射峰基本一致,说明得到了目标产物。同时XRD谱图中存在少量的较弱的磷酸盐杂峰,这可能是由于整个反应是开放系统,有空气存在导致少量次磷酸的氧化。
2.3.3SEM-EDS分析
通过扫描电子显微镜对次磷酸铝产品进行表征,结果见图11。表2为EDS分析结果。从图11可见,次磷酸铝为不规则柱状结构,柱体团聚后呈现鳞片堆积状,颗粒粒径约为5 μm。从表2可见,EDS共测试3个点,所测试的次磷酸铝合成产品中P、Al和O的质量分数分别为44.91%、13.72%、41.38%,与理论P、Al和O的质量分数相差不超过3%,证明获得的目标产物为次磷酸铝。

图11 次磷酸铝的SEM照片
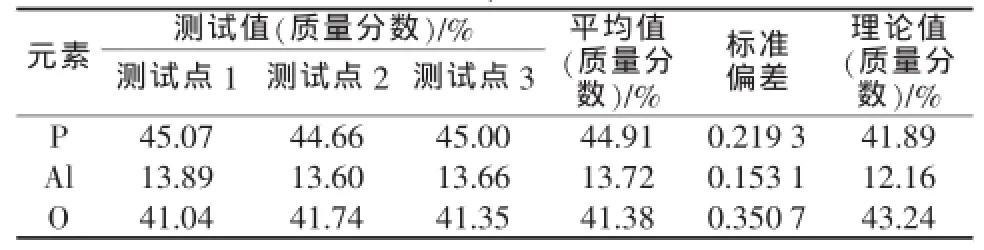
表2 次磷酸铝中磷、铝和氧含量测试结果
3 结论
1)通过NaH2PO2·H2O与Al2(SO4)3·18H2O复分解反应制备次磷酸铝[Al(H2PO2)3],优化了反应条件并研究了其反应动力学机理。优化条件:反应温度为90℃、反应时间为3 h、次磷酸钠与硫酸铝物质的量比为7.5∶1,在此条件下所得次磷酸产品产率为96.61%。2)通过一级动力学方程和二级动力学方程模拟一水次磷酸钠与十八水硫酸铝制备次磷酸铝过程。一级动力学模拟的拟合度比二级动力学要高,一水次磷酸钠和十八水硫酸铝合成次磷酸铝为一级反应,反应动力学常数方程式:k=18exp(-10 547/RT),反应活化能Ea=10 547 J/mol。3)对产品进行IR、 XRD、SEM-EDS表征,红外结果表明产品红外吸收峰都与次磷酸铝的吸收峰相吻合,XRD结果显示产品衍射峰与次磷酸铝标准谱图匹配,SEM结果表明次磷酸铝产品为不规则柱状结构,柱体团聚后呈现鳞片堆积状,EDS结果表明所测试的次磷酸铝产品中P、Al和O的含量与次磷酸理论P、Al和O的含量相差不超过3%(质量分数)。综合以上结果,确定实验制备的产品为目标产物次磷酸铝。
[1]杨旭峰,曹阳,张伟伟,等.次磷酸铝阻燃剂的合成及应用[J].精细化工,2014,31(1):99-102.
[2]钟本和,王辛龙,张志业,等.次磷酸盐和亚磷酸盐介绍[J].无机盐工业,2015,47(9):1-4.
[3]Zhao B,Hu Z,Chen L,et al.A phosphorus-containing inorganic compound as an effective flame retardant for glass-fiber-reinforced polyamide 6[J].Journal of Polymer Science,2011,119(4):2379-2385.
[4]唐刚,王九武,翟彬旭,等.聚苯乙烯/次磷酸铝复合材料的制备及阻燃性能[J].塑料,2015,44(2):5-8.
[5]程宪涛,姜宏伟.次磷酸铝协效MCA阻燃三元乙丙橡胶的研究[J].弹性体,2011,21(3):59-63.
[6]Yuan B,Bao C,Guo Y,et al.Preparation and characterization of flame-retardant aluminum hypophosphite/poly(vinyl alcohol)composite[J].Industrial&Engineering Chemistry Research,2012,51(43):14065-14075.
[7]Li Q,Li B,Zhang S,et al.Investigation on effects of aluminum and magnesium hypophosphites on flame retardancy and thermal degradation of polyamide 6[J].Journal of Applied Polymer Science,2012,125(3):1782-1789.
[8]曹洪玉,周桓.次磷酸钙生产工艺与展望[J].无机盐工业,2016,48(4):13-16.
[9]李启飞.次磷酸盐阻燃剂的合成及阻燃尼龙6研究[D].哈尔滨:东北林业大学,2011.
[10]Noisong P,Danvirutai C,Srithanratana T,et al.Synthesis,characterization and non-isothermal decomposition kinetics of manganese hypophosphitemonohydrate[J].SolidStateSciences,2008,10(11):1598-1604.
[11]Yoshida Y,Inoue K,Kyritsakas N,et al.Syntheses,structures and magnetic properties of zig-zag chains of transition metals with OP-O bridges[J].Inorganica Chimica Acta,2009,362(5):1428-1434.
[12]徐建中,刘欣,屈红强,等.次磷酸盐阻燃剂的合成及其在PBT中的应用[J].塑料科技,2013,41(11)90-95.
联系方式:rac@wit.edu.cn
Preparation and kinetic research of aluminum hypophosphite
Zhou Fang1,2,Chen Yuting1,Xu Yuanlai1,2,Chi Ru′an1,2
(1.School of Chemical Engineering&Pharmacy,Wuhan Institute of Technology,Wuhan 430073,China;2.Key of Laboratory for Green Chemical Process of Ministry of Education)
In order to obtain a kind of efficient halogen-free flame retardant,sodium hypophosphite monohydrate and aluminum sulfate octadecahydrate were applied to prepare aluminum hypophosphite.The influences of reaction temperature,amount-ofsubstance ratio of raw materials,and reaction time on the yield of aluminum hypophosphite were investigated and its reaction mechanism was further researched by the first-order and the second-order kinetic equations.Results showed that when the reaction temperature was 90℃,reaction time was 3 h,and the amount-of-substance ratio of sodium hypophosphite to aluminum sulfate was 7.5∶1,the yield of aluminum hypophosphite was up to 96.61%.The reaction process of sodium hypophosphite and aluminum sulfate to generate aluminum hypophosphite belonged to first-order kinetic reaction.The reaction kinetic constant was k=18exp(-10 547/RT),and the reaction activation energy was 10 547 J/mol.The obtained aluminum hypophosphite products were characterized by IR,XED,and SEM-EDS and the result confirmed the product was aluminum hypophosphite.
aluminum hypophosphite;sodium hypophosphite;aluminum sulfate;kinetics
TQ126.35
A
1006-4990(2016)08-0021-05
国家自然科学基金青年基金(51404171)、湖北省自然科学基金资助项目(2015CFB662)、湖北省中低品位磷矿资源开发利用协同创新中心校内研究基金项目(P201110)。
2016-02-19
周芳(1982—),女,讲师,博士,主要从事磷化工方面的研究,已发表论文5篇。
池汝安

