草鱼(♀)×赤眼鳟(♂)杂交F1与其亲本的肌肉特性比较研究
李 迪,李 伟,肖调义,2*,褚武英,2*,何美凤,周智愚,金生振,邓亚林
(1.湖南农业大学,湖南省特色水产资源利用工程技术研究中心,中国 长沙 410128;2.湖南文理学院,水产高效健康生产湖南省协同创新中心,中国 常德 415000)
草鱼(♀)×赤眼鳟(♂)杂交F1与其亲本的肌肉特性比较研究
李迪1,李伟1,肖调义1,2*,褚武英1,2*,何美凤1,周智愚1,金生振1,邓亚林1
(1.湖南农业大学,湖南省特色水产资源利用工程技术研究中心,中国 长沙410128;2.湖南文理学院,水产高效健康生产湖南省协同创新中心,中国 常德415000)
为探讨草鱼(♀)×赤眼鳟(♂)杂交F1的肉质特点,以同规格的草鱼(♀)×赤眼鳟(♂)杂交F1和其亲本草鱼(母本)、赤眼鳟(父本)为材料,采用质构仪测定分析比较了三者肌肉质构特性,采用冷冻切片法和HE染色法统计分析比较了三者肌纤维数量和密度,采用实时荧光定量PCR的方法分析了与肉质特性关联紧密的钙蛋白酶抑制蛋白(CAST)基因、Ⅰ型胶原蛋白α1基因(COL1A1)和α2基因(COL1A2).在杂交F1和亲本肌肉中的表达量.结果显示:杂交F1与母本草鱼、父本赤眼鳟的肌肉黏附性、胶着性和回复性无显著性差异(P>0.05);杂交F1的肌肉硬度、弹性、内聚性和咀嚼性均显著高于母本草鱼(P<0.05),与父本赤眼鳟无显著差异;杂交F1的肌纤维直径和密度与其母本草鱼无显著差异(P>0.05),与其父本赤眼鳟差异显著(P<0.05);COL1A1和COL1A2两个基因在杂交F1肌肉组织中的表达量显著高于其母本草鱼(P<0.05),而与其父本赤眼鳟无显著差异(P>0.05);CAST基因在杂交F1肌肉组织中的表达量显著高于其母本草鱼(P<0.05),与其父本赤眼鳟无显著差异(P>0.05).
草鱼(♀)×赤眼鳟(♂)杂交F1;肉质;肌纤维;I型胶原蛋白α1;I型胶原蛋白α2;钙蛋白酶抑制蛋白
草鱼是我国养殖产量最大的淡水经济鱼类.由于生产上近亲繁殖的影响,草鱼种质资源衰退较为严重,疾病频发,其品质也呈下降趋势,肉质疏松、口感下降等问题严重影响其经济价值.提高草鱼抗病力和改善草鱼肉质是目前急需解决的问题,远缘杂交育种是实现这一目标的有效方法之一.
赤眼鳟与草鱼同属雅罗鱼亚科,不仅外形上与草鱼相似,还具有抗草鱼出血病毒(GCRV)强的优点,本课题研究团队在2010年完成了草鱼与赤眼鳟的杂交试验,获得了正交F1和反交F1两个杂交子代群体[1].基于日常生活中鱼产品肉质的口感是吸引消费者的重要原因,本实验选取正交F1为试验对象,结合其母本草鱼和父本赤眼鳟的肉质特点,对其进行了肌肉特性分析比较研究,并采用Real Time PCR技术,从mRNA水平研究COL1A1,COL1A2,CAST三个基因在不同群体的表达水平,探索基因表达与肉质性状之间的关系,从分子水平对肌肉品质差异的形成进行初步分析,从而系统评价正交F1.
1 材料与方法
1.1实验材料
选取18月龄杂交F1(体重953.09±23.63 g,体长36.24±0.31 cm)、赤眼鳟(体重235.71±9.81 g,体长20.54±0.35 cm)和草鱼(体重2 215.65±69.65 g,体长47.56±0.45 cm)健康个体各10尾,所有样品均由浏阳乌龙渔场养殖基地提供.
1.2 样品的采集和处理
每种鱼各取10尾,取鱼体侧线上部的背部肌肉,在下面放有冰块的解剖盘内按横纵方向修好组织块(1 cm×1 cm×0.5 cm).采下后放于30%的蔗糖溶液中脱水24 h.采取背中部肌肉样品用于质构实验.另采取部分背肌放入已灭菌的1.5 mL离心管中,迅速放入液氮中带回实验室,置于-80 ℃冰箱保存,用于实时定量PCR分析.
1.3实验方法
1.3.1肌肉质构特性的测定采取鱼背中部肌肉切成厚20 mm×15 mm×15 mm的小块,利用TA.XT.Plus型物性测试仪(英国Stable Micro Systems公司),使用平底柱形探头P/36,模拟人牙齿咀嚼食物,对样品进行两次压缩TPA测试,测试条件如下:测试前速率5 mm/s,测试速率1 mm/s,测试后速率5 mm/s,压缩程度60%,停留间隔时间5 s,负重探头类型:Auto-5g,数据收集率200 pps.样品在室温下进行TPA测试,每尾鱼取4个平行样进行测定.
1.3.2冷冻切片的制备将样品修整好后放入样品托上,均匀抹上OCT,迅速放入冰冻切片机内.待OCT均变为白色后,用刀片休整组织块并切片.其后再进行HE染色.切片制作完成后,在倒置显微镜下观察并拍照(如图1).
1.3.3相关肉质基因表达采用Trizol法提取肌肉RNA,按照Fermentas pure公司提供的cDNA试剂盒产品说明书完成cDNA第一链的合成.使用Primer 5.0软件设计COL1A1,COL1A2以及CAST的定量引物(如表1),送于铂尚公司合成.用于荧光定量表达实验,反应程序如表2.
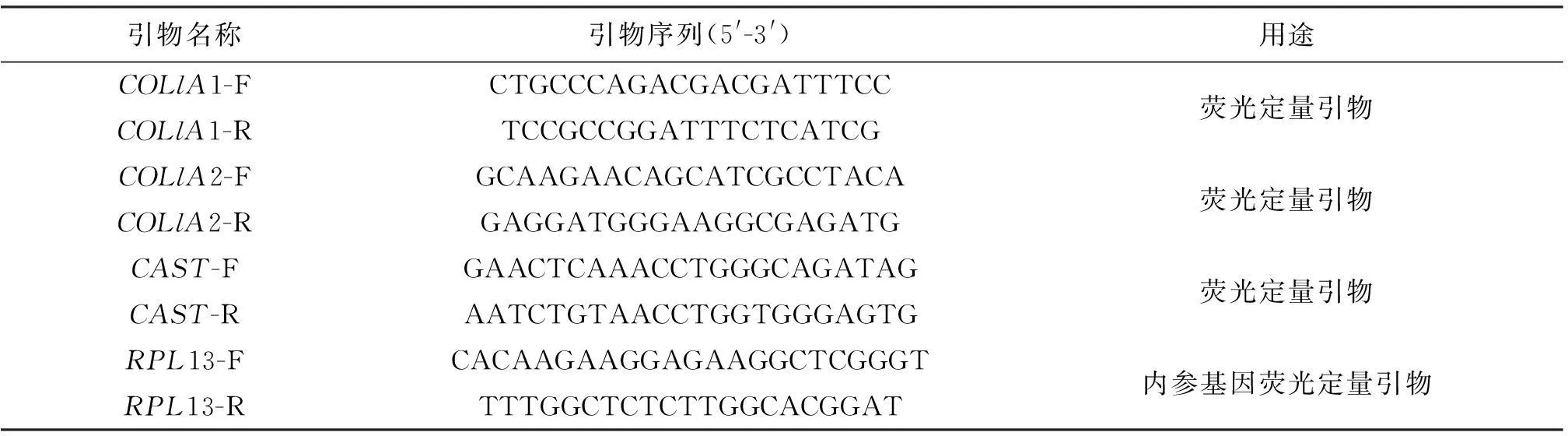
表1 本文所用的引物序列

表2 荧光光定量反应条件
1.4数据统计与分析
用Image-pro plus 6.0进行肌纤维统计,荧光定量数据用EXCEL进行整理,采用SPSS软件对数据进行统计分析,以各组平均值和标准差表示,P<0.05为差异显著,P<0.01为差异极显著.
2 结果
2.1质构特性
通过质构仪对杂交F1及其亲本的测定,得到结果见表3.杂交F1和母本草鱼、父本赤眼鳟的肌肉黏附性、胶着性和回复性无显著性差异(P>0.05);杂交F1肌肉硬度和弹性(分别为4 791.02±427.89 g和0.65±0.05),显著高于母本草鱼的肌肉硬度和弹性(分别为2 348.82±194.69 g和0.42±0.02) (P<0.05).与其父本赤眼鳟肌肉硬度和弹性(分别为4 658.51±564.32 g和0.64±0.03),无显著差异.
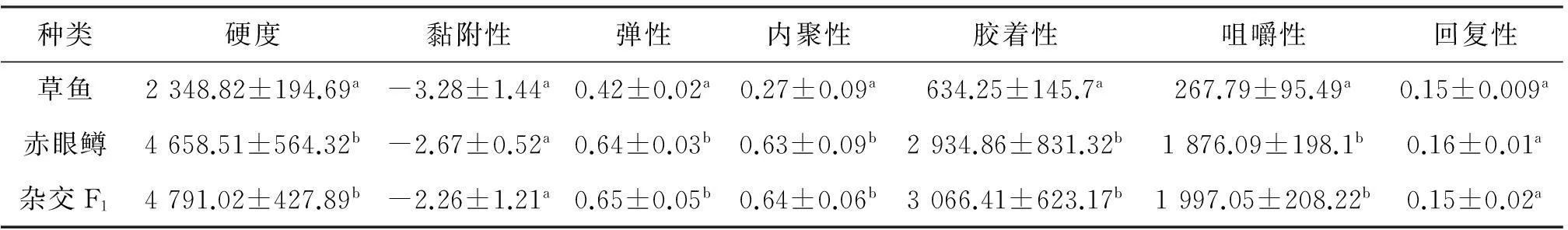
表3 草鱼(♀)×赤眼鳟(♂)F1与其亲本的质构指标
注:同列上标小写字母不同表示二者之间有显著差异(P<0.05).
2.2肌肉组织学分析
在倒置显微镜下观察两种鱼的肌肉切片,可以看出杂交F1和母本草鱼的肌纤维纹理清楚,排列紧密,基本结构相同(图1,彩图见封三).肌纤维直径的测量:参考陈璐等[2]的计算方法,选取一定视野范围内的肌纤维进行统计,图像分析系统计算出每根肌纤维的面积,并默认为“圆”的面积,根据s=πr2(r为半径)自动计算出每根肌纤维的等效直径,统计结果显示,如图2所示,肌纤维直径大小在30~60 μm范围内的杂交F1占61%,母本草鱼占68%,父本赤眼鳟占38%;纤维直径在60~80 μm范围内的杂交F1占28%,母本草鱼占25%,赤眼鳟占41%;80 μm以上的肌纤维直径杂交F1占11%,母本草鱼占7%,父本赤眼鳟占21%. 用SPSS软件进行单因素方差分析,用平均值±标准差来表示,见表4.结果表明,杂交F1的肌纤维直径与其母本草鱼肌纤维直径差异不显著(P>0.05),但显著小于其父本赤眼鳟;杂交F1的肌纤维密度与其母本草鱼的肌纤维密度无显著差异(P>0.05),但显著大于其父本赤眼鳟.
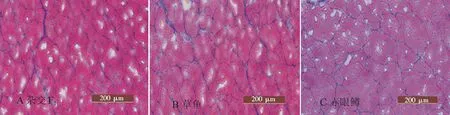
图1 杂交F1及其亲本的肌肉冰冻切片图Fig.1 The muscle frozen section of crossbreed F1 and his parents

图2 肌纤维分布图Fig.2 The distribution graph of muscle fibers

种类肌纤维平均直径/μm肌纤维平均密度/mm2草鱼72.43±9.61a243.89±10.57a赤眼鳟101.74±14.68b164.28±12.85b杂交F180.01±7.86a256.48±17.79a
注:同列上标小写字母不同表示二者之间有显著差异(P<0.05).
2.3相关肉质基因表达分析
以草鱼RPL13作为内参,考察COL1A1,COL1A2,CAST三个基因在F1和草鱼肌肉中的表达,COL1A1和COL1A2两个基因在父本赤眼鳟和杂交F1中的表达量无显著差异(P>0.05),都较母本草鱼高且差异显著(P<0.05).CAST基因在母本草鱼和杂交F1中的表达量无显著差异(P>0.05),都比父本赤眼鳟低且差异显著(P<0.05)(如图3).
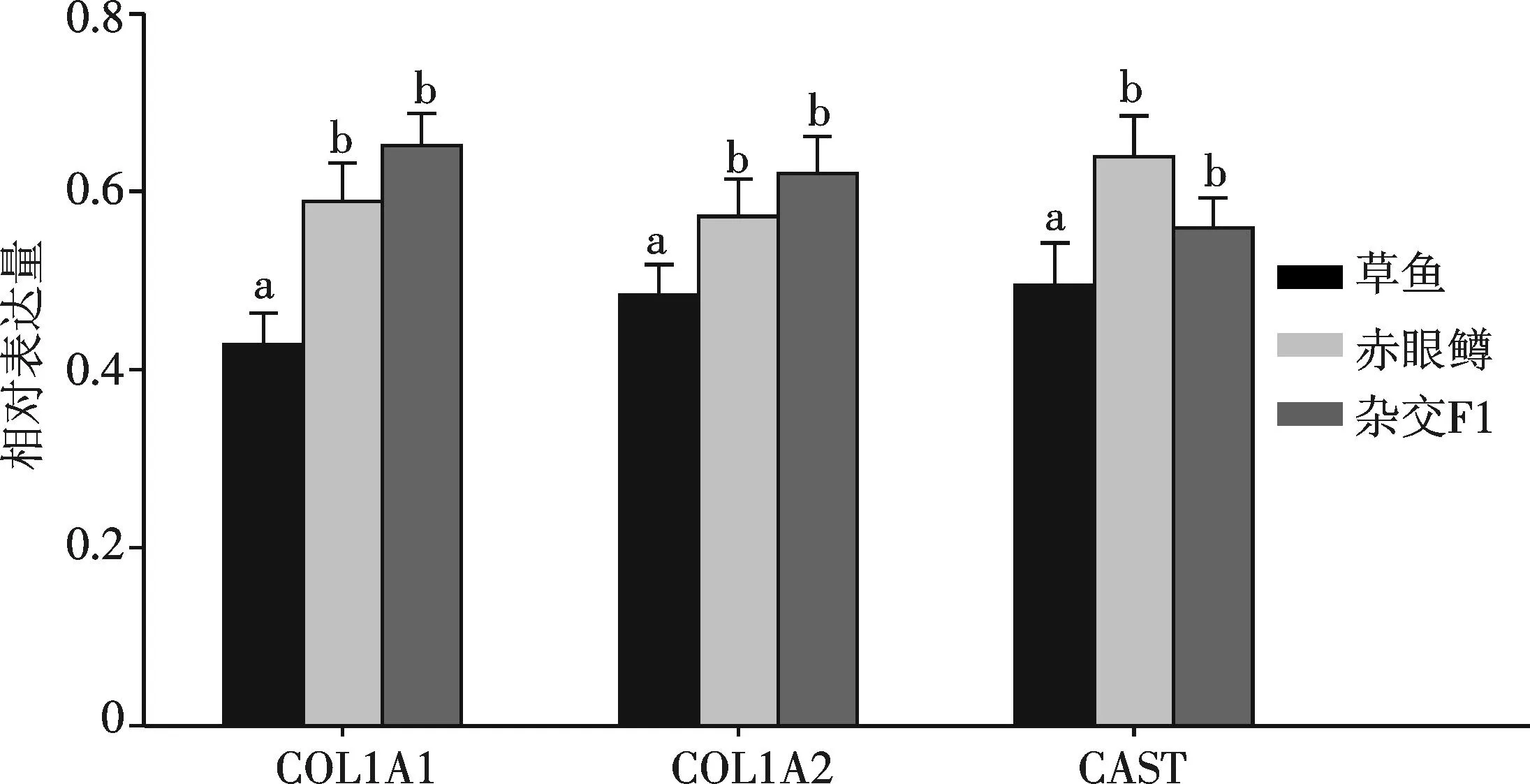
注:字母不同表示差异显著(P<0.05).图3 COL1A1,COL1A2和CAST在杂交F1、草鱼和赤眼鳟肌肉中的表达量Fig.3 The significance tests of COL1A1,COL1A2 and CAST in the muscle of the three fishes
3 讨论
肌纤维是组织学特性中较为重要的物理参数,是鱼类肌肉品质的重要评价指标[3-6].本实验统计分析了杂交F1和母本草鱼、父本赤眼鳟的肌纤维直径和肌纤维密度.结果显示,杂交F1的肌纤维直径显著小于父本赤眼鳟,与母本草鱼的肌纤维直径无显著差异;杂交F1的肌纤维密度显著大于父本赤眼鳟的肌纤维密度,与母本草鱼的肌纤维密度无显著差异.吴信生[7]等对我国7种地方鸡种的组织学研究表明,肌纤维密度与肌肉的嫩度相关比较密切,7个地方鸡种肌纤维密度与嫩度呈负相关,肌纤维直径与嫩度呈正相关,即肌纤维愈细,肌纤维密度愈大,肉质越鲜嫩.刘铮铸[8]等对波尔山羊杂交后代肌肉组织学特性研究发现杂交后代羊与唐山奶山羊在眼肌肌纤维密度方面差异显著,臂三头肌肌纤维密度虽未达到显著差异,但杂交后代明显高于唐山奶山羊,说明杂交后代羊比唐山奶山羊的肉质好.本实验结果显示,与父本赤眼鳟相比,杂交F1的肌纤维直径更小,肌纤维密度更大,这表明杂交F1肉质比亲本赤眼鳟更鲜嫩.
质构特性是决定其品质的重要因素之一,仪器测定是质构特性的重要评价手段,一定程度上减少了人的主观因素带来的评价误差.胡芬[9]等对5种淡水鱼的质构特性进行了相关性分析,得出硬度和弹性是影响鱼肉质构特性的主要因素.本实验中杂交F1肌肉硬度和弹性,显著高于母本草鱼的肌肉硬度和弹性.杂交F1肉质硬度和弹性增强,会使其口感更好.
根据以上实验结果,作者选出了COL1A1,COL1A2和CAST三个与肌肉嫩度和弹性相关基因, 通过实时荧光定量PCR的方法从分子水平上进一步对上述组织学水平指标做出解释.钙蛋白酶系统在细胞内普遍存在,是降解肌原纤维蛋白的主要酶系统,是肌肉蛋白质降解的限速环节,在肌肉的嫩化过程中起着重要作用[10-12].蛋白酶CAST系统在鱼类中的相关研究报道不多,只有斑马鱼[13]、虹鳟[14]和草鱼的部分mRNA被克隆分离.Dutt等[15]研究表明,Calpastatin表达量的减少都会导致肌肉蛋白水解及肉质嫩度的增加,表明钙蛋白酶水解作用才是导致肉质嫩化的主要因素.关磊[16]等研究表明钙蛋白酶抑制蛋白 mRNA 的高表达水平可提高鱼类肌肉生长率和鱼肉硬度、坚韧性,CAST基因在肌肉中的表达可影响其肉质硬度.本实验中CAST基因在杂交F1肌肉上的表达量与父本赤眼鳟无显著差异,但是显著高于其母本草鱼,通过质构实验得出,杂交F1的肉质变硬,弹性变大,可能也是和CAST基因在肌肉中的表达量提高有关.
Hatae[17]等人研究表明,鱼类肌肉的坚韧性与胶原蛋白的含量密切相关.在大西洋鲑[18]研究表明,肌肉中胶原蛋白含量的增加使肌肉具有较高的机械强度,凝聚性增大.李文倩[19]等的实验中表明,胶原蛋白含量与质构参数均呈正相关,胶原蛋白含量增加能够改善肌肉质构,较高的肌肉胶原蛋白含量,其肌肉的结构、强度和品质也相对较好.本实验结果也显示,COL1A1和COL1A2两个基因在杂交F1肌肉上的表达量显著高于在母本草鱼肌肉上的表达量,肌肉硬度和弹性也显著高于母本草鱼.
4 结论
综上所述,杂交F1肌肉弹性大、嫩度高,肉质坚韧,这给人们在选择水产品时提供了一种新的鱼蛋白选择,同时也丰富了鱼类种质资源.
[1]刘巧林.草鱼与赤眼鳟杂交F1遗传特征及对草鱼呼肠孤病毒抗性的研究[D].长沙:湖南农业大学, 2013.
[2]陈璐,金邦荃,刘兴余,等.猪骨骼肌组织学特性与猪肉嫩度关系的研究[J].食品科学, 2009,30(1):10-14.
[3]JOHNSTON I A, ALDERSON R, SANDHAM C,etal. Patterns of muscle growth in early and late maturing populations of Atlantic salmon(SalmosalarL)[J].Aquaculture, 2000,189(3-4):307-333.
[4]KOHN T A, KRITZINGER B, HOFFMAN LC,etal. Characteristics of impala(Aepycerosmelampus) skeletal muscles[J]. Meat Sci, 2005,69(2):277-282.
[5]FIEDLER I, ENDER K, WICKE M,etal. Structural and functional characteristics of muscle fibres in pigs with different malignant hyperthermia susceptibility (MHS) and different meat quality[J]. Meat Sci, 1999,53(1):9-15.
[6]周飘苹,金敏,吴文俊,等.不同养殖模式、投喂不同饵料及不同品系大黄鱼营养成分比较[J].动物营养学报,2014,26(4):969-980.
[7]吴信生,陈国宏,陈宽维,等.中国部分地方鸡种肌肉组织学特点及其肉品质的比较研究[J].江苏农学院学报,1998,19(4):52-58.
[8]刘铮铸,李祥龙,巩元芳,等.波尔山羊杂交后代肌肉组织学特性研究 [J].黑龙江畜牧兽医, 2004(8):8-10.
[9]胡芬,李小定,熊善柏,等.5种淡水鱼肉的质构特性及营养成分的相关性分析[J].食品科学, 2011,32(11):69-73.
[10]HUANG J, NElL E F. Role of calpain in skeletal muscle protein degradation[J].PANS, 1998,95(21):12100-12105.
[11]KOOHMARAIE M, KENT M P, SHACKELFORD S D,etal. Meat tenderness and muscle growth:is there any relationship[J].Meat Sci, 2002,62(3):345-352.
[12]申晓亮,何永梅,贺晓丽,等.钙蛋白酶系统研究进展[J].畜牧与饲料科学, 2012,33(5-6):35-36.
[13]STEPHANIE E L,ASHLEY E E. Characterization and comparative expression of zebrafish calpain system genes during early development[J].Dev Dynam, 2008,237(3):819-829.
[14]MASATAKA S, HONGQI L, VALERY F T,etal. Purification and characterization ofcalpain and calpastatin from rainbow trout, Oncorhynchus mykis[J].Comp Biochem Physiol B Biochem Mol Biol, 2007,146(4):445-455.
[15]DUTT P, SPRIGGS C N, DAVIES P L,etal. Origins ofthe difference in Ca2+requirement for activation of μ-and m-calpain[J].Biochem J, 2002,367(1):263-269.
[16]关磊.脆化草鱼与普通草鱼肌肉特性比较及其CAST基因的克隆与表达[D].上海:上海海洋大学, 2011.
[17]HATAE K, TOBIMATU A, TAKEYAMA M,etal. Contribution of connective tissues on the textural difference of various fish species[J].Nippon Suisan Gakk, 1986,52(11):2001-2007.
[18]GRIGORAKIS K, ALEXIS M N. Effects of fasting on the meat quality and fat deposition of commercial—size farmed gilthead sea bream (SparusaurataL.) fed different dietary regimes[J].Aquacult Nutr, 2005,11(5):341-344.
[19]李文倩.鳜鱼、草鱼肌肉品质评价及比较[D].上海:上海海洋大学,2013.
(编辑WJ)
Comparative Study on Muscle Texture Between the Crossbreed F1Generation from Grass Carp (CtenopharyngodonIdellus) (♀) × Barbel hub (SqualiobarbusCurriculus) (♂) and Their Parents
LI Di1, LI Wei1, XIAO Tiao-yi1,2*, CHU Wu-ying1,2*, HE Mei-feng1,ZHOUZhi-yu1,JINSheng-zhen1,DENGYa-lin1
(1. Hunan Engineering Research Center for Utilization of Characteristics of Aquatic Resources,Hunan Agricultural University, Changsha 410128, China;2. Key Laboratory of Zoology in Hunan Higher Education, Hunan University of Arts and Science, Changde 415000, China)
Objective:To explore the muscle texture of the crossbreed F1. Method: The female parent grass carp (Ctenopharyngodonidellus) (♀) × Barbel chub (Squaliobarbuscurriculus) (♂) F1(crossbreedF1) as well as their parents at the same specification were used for our research. The texture analyzer, the freezing sectioning technology and hematoxylin-eosin staining method were used for muscle characterization and fiber diameter. In addition, the spatio-temporal expression ofCOL1A1,COL1A2,CASTgenes were identified by RT-PCR. Our results show that hybrid F1muscle fiber diameter is less than that of the female parent grass carp. By using the real-time PCR technology, we found thatCOL1A1,COL1A2andCASTgenes expressions in hybrid F1muscle volume were slightly higher than the expression on grass carp muscle. Results: The muscle tenderness, cohesiveness, springiness and chewiness in crossbreed F1is significantly better than those of grass carp (P<0.05). No significant difference was found for barbell chub. The muscle adhesiveness, gumminess and resilience had no significant difference in hybrid F1, grass carp and barbell chub (P>0.05). The muscle fiber diameter and density of crossbreed F1when compared with grass carp had no significant difference (P>0.05). But they were significantly different when compared with barbell chub (P>0.05). The expression ofCOL1A1,COL1A2,CASTgenes in crossbreed F1was significantly higher than that grass carp (P<0.05), but was no significantly different in comparison with barbell chub (P>0.05).
grass carp (♀)×barbel chub (♂) crossbreed F1; muscle texture; muscle fiber; COL1A1;COL1A2;CAST
10.7612/j.issn.1000-2537.2016.03.006
2015-09-10基金项目:现代农业产业技术体系建设专项资金(CARS-46)*通讯作者,E-mail:tyxiao1128@163.com;chuwuying18@163.com
S963.3
A
1000-2537(2016)03-0028-06

