伽玛刀联合培美曲塞/卡铂同步与序贯治疗局部晚期非小细胞肺癌临床观察
许 恒,童皖宁,卓安山,曹玉书,徐世林
·临床医学·
·论著·
伽玛刀联合培美曲塞/卡铂同步与序贯治疗局部晚期非小细胞肺癌临床观察
许恒,童皖宁,卓安山,曹玉书,徐世林
目的观察体部伽玛刀联合培美曲塞/卡铂同步与序贯治疗局部晚期非小细胞肺癌的临床疗效及不良反应。方法125例局部晚期非小细胞肺癌患者,根据患者治疗方法分为3组。同步组30例,给予体部伽玛刀放疗,同步联合培美曲塞/卡铂方案化疗;序贯组31例,先给予培美曲塞/卡铂方案2周期化疗,后序贯体部伽玛刀放疗,再行2周期相同方案化疗;放疗组64例,单纯给予体部伽玛刀放疗。评价各组的临床疗效和不良反应。结果近期有效率同步组为83.33%、序贯组为77.42%、放疗组为73.44%,各组间差异无统计学意义(P>0.05);1、2年生存率及中位生存期:同步组分别为73.33%、43.33%和17.5个月,序贯组分别为64.52%、35.48%和15.4个月,放疗组分别为46.88%、23.44%和10.6个月;同步组优于序贯组,序贯组优于放疗组,提示有生存优势,但差异无统计学意义(P>0.05);同步组与放疗组比较,差异有统计学意义(P<0.05)。各组不良反应均为Ⅰ~Ⅲ级,未出现Ⅳ级,并以骨髓抑制、胃肠道反应为主要表现。放射性食管炎和放射性肺炎发生率方面,3组间比较差异无统计学意义(P>0.05);骨髓抑制和消化系统不良反应发生率方面,同步组、序贯组间比较,差异无统计学意义(P>0.05),2组分别与放疗组比较,差异均有统计学意义(P<0.05)。结论体部伽玛刀联合培美曲塞/卡铂方案同步治疗局部晚期非小细胞肺癌优于单纯伽玛刀放疗,并具有良好的安全性和可耐受性。
局部晚期非小细胞肺癌;体部伽玛刀;培美曲塞;卡铂;同步放化疗;序贯放化疗
80%的肺癌为非小细胞肺癌,由于缺乏有效的早期诊断及治疗手段,初诊为Ⅲ期病变的患者约占30%,其患者的总体疗效及生存期不能令人满意,5年生存率不足15%[1]。ⅢA和ⅢB期的患者手术预后并不理想,此类患者采取放化疗联合治疗的方式是目前国际肿瘤学界的共识,而联合方式又分为同步治疗及序贯治疗两种。本研究探讨关于体部伽玛刀联合培美曲塞/卡铂同步或序贯治疗局部晚期非小细胞肺癌(locally advanced non-small cell lung cancer,LANSCLC)的有效性及安全性,现报告如下。
1 资料与方法
1.1一般资料
选取我院2012年1月至2014年1月间LANSCLC患者125例,根据患者治疗方法分为3组。其中同步组30例,其中男性16例,女性14例;年龄45~68岁,中位年龄62岁;腺癌23例,鳞癌5例,大细胞肺癌2例。序贯组31例,其中男性17例,女性14例;年龄50~69岁,中位年龄59岁;腺癌23例,鳞癌6例,大细胞肺癌2例。放疗组64例,其中男性43例,女性21例;年龄43~68岁,中位年龄60岁;腺癌37例,鳞癌22例,大细胞肺癌5例。各组间一般资料比较差异无统计学意义(P>0.05),具有可比性。入选标准为所有年龄≤70岁的初治患者,经病理组织学或细胞学明确为LANSCLC,经胸部CT确定有可测量的病灶ⅢA、ⅢB期,体力状况(PS)评分≤2分。排除标准:预期生存期<6个月,伴有心、肺、肝、肾脏等脏器重大疾病者,辅助检查血尿常规、生化肝肾功能、心电图明显异常者。本研究所有入组患者均经过知情同意告知并签署治疗同意书,符合医学伦理标准。
1.2治疗方法
1.2.1立体定向体部伽玛刀放疗3组患者均采用放疗,治疗前用真空负压袋固定患者治疗体位,平静呼吸下用层厚3~5 mm螺旋CT对病灶进行薄层扫描,核准N线值及患者体表标记点的X、Y、Z坐标参数,将获得的图象资料和相关数据输入治疗计划系统,进行三维立体重建,以确定各个靶区和靶体积(GTV),在GTV周边外放10~15 mm确定计划靶区(PTV),以PTV的中心靶区部位及范围、并结合病人的身体状况与治疗目的,制定放射治疗计划及调整剂量分布。一般放射剂量处方为: 病灶<3 cm,70%~80%剂量线覆盖100%PTV,8~10 Gy/次,照射5~6次,累计剂量48~50 Gy;3 cm≤病灶≤5 cm,50%剂量线覆盖100%PTV,60%剂量线覆盖90%CTV,70%剂量线覆盖80%以上PTV,50%剂量线处5 Gy/次,5次/周,照射2周,共10次,累计剂量50 Gy;病灶>5cm,根据实际情况相应调整,适当降低分次剂量[2]。
1.2.2培美曲塞/卡铂方案化疗以培美曲塞500 mg/m2+卡铂[血药浓度-时间曲线下面积(area under the curve, AUC)=5];每3周为1周期。首次化疗前7 d肌注维生素B121 000 μg,并每天口服叶酸400 mg。化疗开始前1 d、当天、后1 d口服地塞米松8 mg。同步治疗组,第1周期化疗第1天即给予体部伽玛刀放疗,共4周期;序贯治疗组,先培美曲塞/卡铂方案化疗2个周期,后给予体部伽玛刀放疗,再行2个周期相同方案化疗[2]。
1.3疗效评定标准及观察指标
近期疗效采用实体瘤评价标准(RECIST 1.1版本),以治疗结束4周开始进行评价,分为:完全缓解、部分缓解、稳定、进展,有效率=(完全缓解+部分缓解)/例数×100%,稳定和进展为无效;远期疗效:采用定期随访,包括病史、体格检查、血液常规、生化检查以及胸部CT,了解患者的复发、不良反应,并按照CTC AE(4.0版)标准评价急性毒性反应分级[2],同时记录1、2年生存率及中位生存期。
1.4统计学处理
采用SPSS 13.0进行统计学处理,率的比较采用χ2检验;生存分析用Kaplan-Meier法,对多组生存时间分布进行两两比较,其显著性检验用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1随访情况
存活病例末次随访时间为2016年1月31日,随访时间为5~40个月,中位随访时间20个月,5例失访,随访率96%。
2.2近期疗效
各组间有效率差异无统计学意义(P>0.05),见表1。

表1 治疗后3组患者近期疗效比较(例)
2.3远期疗效
1、2年生存率及中位生存期,同步组分别为73.33%(22/30)、43.33%(13/30)和17.5个月,序贯组分别为64.52%(20/31)、35.48%(11/31)和15.4个月,放疗组分别为46.88%(30/64)、23.44%(15/64)和10.6个月; 同步组与序贯组比较,差异无统计学意义(χ2=0.513,P=0.474);序贯组与放疗组比较,有生存优势,但差异无统计学意义(χ2=2.641,P=0.104); 同步组与放疗组比较,差异有统计学意义(χ2=6.194,P=0.013);中位生存期,同步组较放疗组延长6.9个月。见图1。
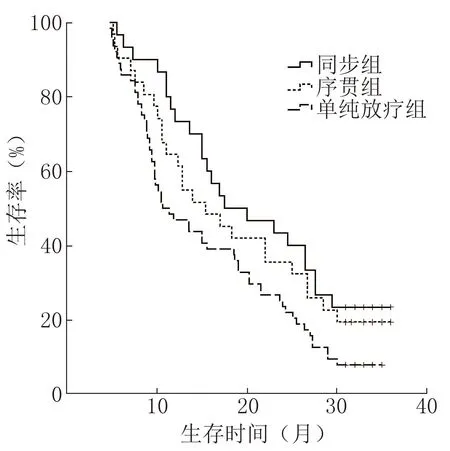
注:+表示失访图1 治疗后3组患者生存率
2.4不良反应
各组不良反应均为Ⅰ~Ⅲ级,未出现Ⅳ级,并以骨髓抑制、胃肠道反应为主要表现。其中发生Ⅲ级白细胞下降同步组4例(13.33%)、序贯组2例(6.45%)。骨髓抑制和胃肠反应发生率方面,同步组、序贯组分别与放疗组比较,差异均有统计学意义(P<0.05),见表2。
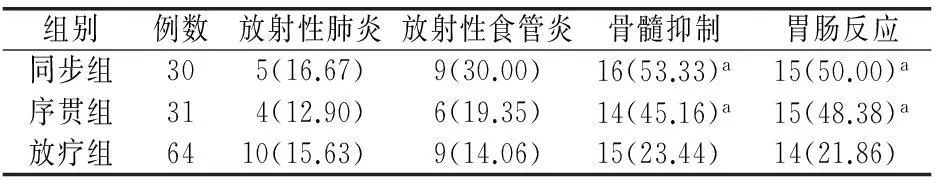
表2 3组患者主要不良反应比较[例(%)]
注:与放疗组比较aP<0.05
3 讨论
LANSCLC患者发现时多已丧失手术指征,由于其体内恶性肿瘤组织并未被手术切除,其负荷过重,所以往往导致单纯化疗或者放疗的疗效不够理想。近年来国内外的多中心随机研究和荟萃分析显示联合放化疗对于局部晚期非小细胞肺癌的疗效优于传统的化疗、放疗等单一治疗[3]。
联合放化疗可分为序贯法和同步法[4],而同步法可以进一步加强两种治疗方式间的协同作用,彼此增加对肿瘤细胞的敏感性,同时兼顾控制远处转移的隐匿病灶;并且避免了肿瘤细胞在放疗后的加速增殖。Curran等[5]2003年报道610例患者,同步组、序贯组中位生存期分别为17.0个月和14.6个月(P=0.04),Zatloukal等[6]2004年报道102例患者,同步组、序贯组中位生存期分别为16.6个月和12.9个月(P=0.02),Belani等[7]2005报道276例患者,同步组、序贯组中位生存期分别为16.3个月和13.0个月,虽差异无统计学意义,但亦提示同步放化疗优于序贯放化疗。2009年美国国立综合癌症网络(National Comprehensive Cancer Network ,NCCN)指南中针对LANSCLC更是推荐采用同步放化疗作为标准治疗,其推荐同步放化疗的标准化疗方案有VP16/顺铂、长春花碱/顺铂、紫杉醇/卡铂方案。当然同步放化疗同时也无可避免地增加了正常组织的毒性[8]。因此,随着新一代抗肿瘤药物的临床应用,传统放疗技术同步更加低毒的培美曲塞/卡铂方案成为新的研究热点。
培美曲塞是一种新型多靶点抗叶酸代谢类的抗肿瘤药物,它主要通过阻断嘌呤和嘧啶合成所需要的酶使细胞分裂停止于S期,从而抑制肿瘤细胞的生长,因其良好的治疗效果及较低的不良反应已被广泛应用于非小细胞肺癌尤其是肺腺癌的一线治疗之中。Bischof等[9]发现培美曲塞可能通过干扰放射性损伤修复,实现放射增敏作用。国外两项培美曲塞+卡铂联合放疗治疗非小细胞肺癌的Ⅱ期临床研究[10-11]显示:总有效率分别为32%、24%,一年生存率达到44%、56%。 Chen等[12]还发现培美曲塞与抗过敏药物及放射治疗联合使用,能够进一步提高临床疗效,降低不良反应。Seiwert等[13]报道了30例患者放疗同步培美曲塞/卡铂的Ⅰ期临床研究,同样提示了低不良反应的特点,Ⅲ~Ⅵ级白细胞减少发生率为20%。而近年国内宋轶鹏等[14]报道34例LANSCLC采用放疗联合培美曲塞和顺铂同步治疗,总有效率为79%,1年总生存率为65%,4级粒细胞减少仅2%,3级急性放射性食管炎、急性放射性肺炎分别为7%、5%,其余不良反应均为2级以下;蔡勇等[15]报道23例老年非鳞型肺癌局部晚期患者接受培美曲塞化疗联合放疗,局控率为73%,1年生存率为67%,不良反应以II级以下反应为主,未出现III级以上反应。以上临床研究结果表明培美曲塞+铂类作为同步放化疗的备选化疗方案为临床医师提供更多选择的可能。
本研究采用了体部伽玛刀放疗技术联合培美曲塞/卡铂治疗方法,同样获得了较为理想的临床效果,其结果显示:近期疗效方面,同步组、序贯组及单纯放疗组相仿,分别达到83.33%、77.42%、73.44%,各组间差异无统计学意义;而远期疗效方面,同步组>序贯组>单纯放疗组, 但同步组与序贯组比较差异无统计学意义,序贯组与单纯放疗组间具有良好生存优势,但亦差异无统计学意义,这可能与本研究样本数量较少有关;而同步组与单纯放疗组比较,差异有统计学意义(P<0.05),从而进一步证明了体部伽玛刀同步培美曲塞/卡铂方案治疗LANSCLC具有显著的生存优势。不良反应方面, 主要为白细胞下降、胃肠道反应、放射性食管炎、放射性肺炎,但多为Ⅰ~Ⅲ级,并未出现因严重不良反应而终止治疗的情况。其中同步组白细胞下降53.33%,Ⅲ级白细胞下降仅为13.33%,与近年间国外内相关报道相近[12-14],但因未出现Ⅵ级反应,似乎更具低毒优势,但因研究方法、样本数量等限制,尚需进一步研究证实;至于组间情况比较,同步组、序贯组在骨髓抑制和消化系统不良反应发生率方面均与单纯放疗组比较差异均有统计学意义(P<0.05),提示联合治疗确实增加了不良反应的发生,尽管程度较低,但在给患者进行治疗的过程中应该引起临床医师的足够重视,临床医师需严格掌握治疗适应指征;此外,放射性食管炎发生率方面,同步组为30%,稍高于序贯组(19.35%)及单纯放疗组(14.06%),但各组差异无统计学意义。以上不良反应经对症处理,均可得到一定程度改善和缓解,基本属于可控范围。
综上所述, 体部伽玛刀联合培美曲塞/卡铂方案同步治疗局部晚期非小细胞肺癌优于单纯伽玛刀放疗;而序贯治疗的生存优势还有待进一步大样本研究;放化疗的联合方式具有良好的安全性和可耐受性。
[1]Morgensztern D, Ng SH, Gao F, et al. Trends in stage distribution for patients with non-small cell lung cancer: a National Cancer Database survey[J]. J Thorac Oncol, 2010, 5(1):29-33. DOI:10.1097/JTO.0b013e3181c5920c.
[2]童皖宁,张军,卓安山,等. 伽玛刀联合培美曲塞/卡铂同步治疗局部晚期非小细胞肺癌的临床观察[J].肿瘤防治研究,2012,39(1):81-84. DOI:10.3971/j.issn.1000-8578.2012.01.021.
[3]朱广迎,申戈.局部晚期非小细胞肺癌同步放化疗规范[J].癌症进展杂志,2009,7(4):370 -378.
[4]胡劲. 局部晚期非小细胞肺癌的放化综合治疗[J]. 国际肿瘤学杂志, 2009, 36(11):856-858. DOI:10.3760/cma.j.jssn.1673-422X.2009.11.019.
[5]Curran WJ, Scott CB, Langer CJ, et al.Long-term benefit is observed in a phase Ⅲ comparison of sequential vs concurrent chemo-radiation in patients with unresected stage Ⅲ NSCLC:RTOG 9410[J].Proc Am Soc Clin Oncol,2003,22:821.
[6]Zatloukal P, Petruzelka L, Zemanova M, et al. Concurrent versus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced non-small cell lung cancer: a randomized study[J]. Lung Cancer, 2004, 46(1):87-98. DOI:10.1016/j.lungcan.2004.03.004.
[7]Belani CP, Choy H, Bonomi P, et al. Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced non-small-cell lung cancer: a randomized phase II locally advanced multi-modality protocol[J]. J Clin Oncol, 2005, 23(25):5883-5891. DOI:10.1200/JCO.2005.55.405.
[8]Aupérin A, Le Péchoux C, Pignon JP, et al. Concomitant radio-chemotherapy based on platin compounds in patients with locally advanced non-small cell lung cancer (NSCLC): a meta-analysis of individual data from 1764 patients[J]. Ann Oncol, 2006, 17(3):473-483. DOI:10.1093/annonc/mdj117.
[9]Bischof M, Weber KJ, Blatter J, et al. Interaction of pemetrexed disodium (ALIMTA, multitargeted antifolate) and irradiation in vitro[J]. Int J Radiat Oncol Biol Phys, 2002, 52(5):1381-1388.
[10] ScagIiotti GV,Kortsik C,Dark GG,et al.Pemetrexed combined With oxaliplatin or carboplatin as first-line treatment in advanced non-small cell lung cancer:a multicenter,randomized,phaseⅡtrial[J].Clin Cancer Res,2005,11(2Pt1):690-696.
[11] Zinner RG, Fossella FV, Gladish GW, et al. Phase II study of pemetrexed in combination with carboplatin in the first-line treatment of advanced nonsmall cell lung cancer[J]. Cancer, 2005, 104(11):2449-2456. DOI:10.1002/cncr.21480.
[12] Chen M, Shao W, He J, et al. Role of pemetrexed and platinums combination in patients with non- small cell lung cancer[J]. Current Drug Targets, 2010, 11(1):29-36. DOI:10.2174/138945010790031027.
[13] Seiwert TY, Connell PP, Mauer AM, et al. A phase i study of pemetrexed, carboplatin, and concurrent radiotherapy in patients with locally advanced or metastatic non-small cell lung or esophageal cancer[J]. Clin Cancer Res, 2007, 13(2):515-522. DOI:10.1158/1078-0432.ccr-06-1058.
[14] 宋轶鹏,郭颖,胡立宽,等. 调强放疗联合培美曲塞和顺铂同期化疗局部晚期非小细胞肺癌的临床研究[J]. 中华放射肿瘤学杂志, 2011, 20(1):14-17. DOI:10.3760/cma.j.issn.1004-4221.2011.01.006.
[15] 蔡勇,王季颖. 适形放疗联合培美曲塞同步治疗局部晚期老年非鳞型肺癌的临床研究[J]. 中国肿瘤临床, 2011, 38(19):1227-1229. DOI:10.3969/j.issn.1000-8179.2011.19.013.
(本文编辑:莫琳芳)
Clinical effects of gamma knife combined with pemetrexed plus carboplatin in concurrent or sequential chemoradiotherapy of locally advanced non-small cell lung cancer
XuHeng,TongWanning,ZhuoAnshan,CaoYushu,XuShilin
(No.411HospitalofCPLA,Shanghai200081,China)
ObjectiveTo observe the clinical effects and adverse reactions of gamma knife combined with pemetrexed plus carboplatin in concurrent or sequential chemoradiotherapy of locally advanced non-small cell lung cancer(LANSCLC).Methods A total of 125 cases of LANSCLC were randomly divided into 3 groups, in accordance with different therapeutic methods. The concurrent group (or group A, 30 cases) received body gamma knife combined with pemetrexed plus carboplatin. The sequential group (or group B, 31 cases) was given 2 weeks of chemotherapy with pemetrexed and carboplatin, then sequential body gamma knife radiotherapy and finally underwent two cycles of chemotherapy with the same regimen. The radiotherapy group (or group C, 64 cases) was given just body gamma knife radiotherapy. Clinical therapeutic effects and adverse reactions were evaluated.ResultsThe short-term effects for group A, group B and group C were respectively 83.33%, 77.42% and 73.44%, and no statistical significance could be seen when comparisons were made between them(P<0.05). The 1-2-year survival rate and the median survival time for group A were respectively 73.33%, 43.33% and 17.5 months, those for group B were respectively 64.52%, 35.48% and 15.4 months, and those for group C were respectively 46.88%, 23.44% and 10.6 months. Analyses indicated that group A was superior to group B, and group B was superior to group C, with the former having a better survival rate, and no statistical significance could be noticed when comparisons were made between them(P>0.05). However, there was statistical significance when comparisons were made between group A and group C (P<0.05). With regard to toxic reactions, all the adverse reactions were from gradeⅠ-Ⅲ, with bone marrow suppression and gastrointestinal reactions as the main manifestations. Grade Ⅳ adverse reaction never occurred. There was no statistical significance in the incidence rates of radiation-induced esophagiti and pneumonitis, when comparisons were made between the 3 groups(P>0.05). With regard to the incidence rates of bone marrow suppression and adverse reactions of the digest system, there was no statistical significance, when comparisons were made between group A and group B(P>0.05). However, statistical significance could be noted, when comparisons were made between group A/B and group C(P>0.05).ConclusionBody gamma knife combined with pemetrexed and carboplatin in concurrent chemoradiotherapy was more superior to body gamma knife alone, furthermore it displayed better safety and higher tolerance.
Locally advanced non-small cell lung cancer; Body gamma knife; Pemetrexed; Carboplatin; Concurrent chemoradiotherapy; Sequential chemoradiotherapy
单位]200081上海,解放军第四一一医院
R563.9
A
10.3969/j.issn.1009-0754.2016.04.007
2016-03-14)

