匹多莫德辅助治疗小儿变应性鼻炎伴变应性哮喘的临床疗效
徐军,李志飞,吕一枝
(宁波大学医学院附属医院 小儿内科,浙江 宁波 315020)
匹多莫德辅助治疗小儿变应性鼻炎伴变应性哮喘的临床疗效
徐军Δ,李志飞,吕一枝
(宁波大学医学院附属医院 小儿内科,浙江 宁波 315020)
目的观察匹多莫德辅助舌下免疫疗法治疗小儿变应性鼻炎伴哮喘的疗效,为今后临床更有效治疗该疾病提供参考和借鉴。方法前瞻性选取宁波大学医学院附属医院小儿内科2013年1月~2015年1月期间确诊的60例小儿变应性鼻炎伴哮喘患儿,随机数字表法为对照组和治疗组,每组30例。对照组采用常规治疗+舌下免疫治疗,治疗组采用常规治疗+舌下免疫治疗+匹多莫德,观察2组患儿病情改善、免疫功能、炎症因子水平、肺功能改善情况以及不良反应发生情况。结果2组患儿治疗后鼻炎和哮喘病情均明显减轻,且治疗组改善情况较对照组更为显著(P<0.05),均未发生严重不良反应;治疗组患儿免疫功能(IgM、IgG、IgA、CD3+、CD4+、CD4+/CD8+),炎症因子水平包括C-反应蛋白(C-reactive protein,CRP)、酶联免疫吸附法检测白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α),肺功能包括一秒钟用力呼气容积(forced expiratory volume in one second,FEV1)、最大呼气峰流速(peak expiratory flow rate,PEF)、用力呼气25%流速(25% of peak expiratory flow rate,PEF25)、用力呼气50%流速(PEF50)、用力呼气75%流速(PEF75)改善情况明显优于对照组(P<0.05)。结论匹多莫德联合舌下免疫治疗小儿变应性鼻炎伴哮喘可明显提高患儿免疫功能,减轻炎症反应,促进肺功能改善,达到改善临床症状的治疗期望,且无严重不良反应。
匹多莫德;小儿;变应性鼻炎;变应性哮喘;舌下免疫治疗;疗效
变应性鼻炎(allergic rhinitis,AR)和哮喘均为变态反应性疾病,在流行病学和病理免疫机制等方面均存在交叉,甚至认为是由变应原诱发的同种疾病[1],临床将其称为全呼吸道炎症高反应综合征。变应性鼻炎发病率呈逐年上升趋势,约20%~40%AR患者合并支气管哮喘,58%~93%哮喘患者伴AR[2],严重影响患儿身心健康和生长发育,已经成为全球高度关注的健康问题之一。
目前,临床上主要治疗方案为对症治疗,但疗效个体差异性大,且易复发[3]。2010年美国变应性鼻炎诊疗指南(American guidelines for the diagnosis and treatment of allergic rhinitis,ARIA)指南提出变应性鼻炎合并哮喘建议采用舌下或皮下免疫治疗控制哮喘症状[4]。但因小儿患者免疫系统尚未完全成熟,故在治疗过程中要重视免疫功能的调节,匹多莫德是一种新型的人工合成高纯度二肽,具有口服生物活性的广谱免疫促进剂,具有抗毒性、抗感染性、抗氧化性、抗刺激性等特征,不仅能促进非特异性免疫反应,还能促进特异性免疫反应,进而发挥强效的抗菌和抗病毒作用[5-6]。本研究对比分析免疫疗效和免疫疗法联合免疫调节剂治疗小儿变应性鼻炎伴哮喘的疗效,取得显著效果,现报道如下。
1 资料与方法
1.1 一般资料 前瞻性选取宁波大学医学院附属医院小儿内科2013年1月~2015年1月期间60例确诊为变应性鼻炎伴哮喘患儿为研究对象,采用随机数字表法将其分为对照组和治疗组,每组30例。对照组中男18例、女12例,年龄5~14岁,平均年龄(8.65±1.28)岁;变应性鼻炎病程6月~5年,平均病程(2.58±1.05)年;变应性鼻炎症状持续时间:间歇性22例、持续性8例,鼻炎严重程度:轻度11例、中度15例、重度4例;哮喘病程3月~4年,平均病程(2.38±0.45)年;哮喘持续时间:间歇性25例、持续性5例,哮喘严重程度:轻度13例、中度16例、重度1例。治疗组中男17例、女13例,年龄5~15岁,平均年龄(8.75±1.68)岁;变应性鼻炎病程6月~6年,平均病程(2.78±1.26)年;变应性鼻炎症状持续时间:间歇性23例、持续性7例,鼻炎严重程度:轻度12例、中度14例、重度4例;哮喘病程3月~5年,平均病程(2.48±0.55)年;哮喘持续时间:间歇性26例、持续性4例,哮喘严重程度:轻度13例、中度15例、重度2例。2组患儿在性别、年龄、病程、病情严重程度等一般资料差异无统计学意义。本次研究经本院医学伦理委员会审批,患儿家属签署知情同意书。
纳入标准:①年龄5~15岁,不限性别;②均符合《儿童变应性鼻炎诊断和治疗指南》中小儿变应性鼻炎诊断标准[7]和《儿童支气管哮喘的诊断及治疗》中支气管哮喘诊断标准[8];③过敏原皮肤试验阳性;④可准确表达自身不适症状者;⑤依从性良好,遵医嘱用药者;⑥临床资料齐全,无影响疗效准确性评价因素。
排除标准:①不符合纳入标准者;②合并其他呼吸系统疾病者;③严重先天性疾病者;④合并严重心、肝、肾功能不全者;⑤近期(2 w内)服用抗组胺等对皮肤反应有抑制作用药物;⑥入组前4 w内服用糖皮质激素和免疫调节剂,间断或持续吸入激素>6月者;⑦急性发作期重度及危重度哮喘患儿或者哮喘危重状态患儿;⑧中重度持续性哮喘者;⑨智力发育迟缓者;⑩精神障碍者。
1.2 方法
1.2.1 治疗方法:对照组患儿入院后均给予全球哮喘防治倡议(Global Initiative for Asthma,GINA)和美国变应性鼻炎诊疗指南(American guidelines for the diagnosis and treatment of allergic rhinitis,ARIA)中常规对症治疗,同时舌下含服粉尘螨滴剂(浙江我武生物科技有限公司,国药准字S20060012)进行对因治疗,含1~3 min后吞咽,1次/天,固定时间用药,1~3 w服用递增剂量,第1周使用1号、第2周使用2号、第3周使用3号,每周1~7 d按说明书依次含服1、2、3、4、6、8、10滴;第4周起使用4号,1次/天,3滴/次,第6周起或遵医嘱特殊需要使用5号,1次/天,2滴/次。维持治疗1年,治疗期间若患儿哮喘急性发作或者其他急性疾病则及时调整尘螨滴剂剂量,同时积极给予对症治疗。治疗组在对照组用药基础上加用匹多莫德口服液(DOPPEL FARMACEUTICI S.r.l.,批准文号:H20090934),0.4 g/次,早晚各1次,服药1 w后调整为早餐前1次,4 w为1疗程,连续治疗3个疗程。
1.2.2 观察指标:治疗3疗程后观察2组患儿病情缓解、免疫功能改善、炎症因子水平改变以及肺功能改善情况。
1.2.3 评价方法及标准
① 病情严重程度评分标准:鼻炎症状(流涕、打喷嚏、鼻噻、咽痒、鼻痒、眼痒等)评分标准[7]:无症状计0分;症状轻微但不影响日常活动和睡眠计1分;症状明显且影响日常活动计2分,症状严重且影响日常活动和睡眠计3分;各项症状评分之和为鼻炎症状总评分,1~6分判定为轻度、7~12分判定为中度、13~18分判定为重度。哮喘严重程度从急性发作严重程度[8](0~4分)、夜间症状(1~4分)、日常活动影响(0~4分)、活动受限程度(0~4分)、β2-受体激动剂(1~3分)应用五方面评估,总评分2~8分为轻度、9~14分为中度、15~19分为重度。
② 免疫功能指标和炎症因子指标检测:使用CENIOS M200型酶标仪(TECAN公司生产)采用酶联免疫吸附实验(ELISA)法检测患儿治疗前后IgM、IgA、IgG水平,试剂均购于深圳市科润达生物工程有限公司。采用流式细胞仪检测CD3+、CD4+、CD8+水平,计算CD4+/CD8+。采用免疫比浊法测定炎症因子C-反应蛋白(C-reactive protein,CRP)、酶联免疫吸附法检测白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)水平。
③ 肺功能检测:采用Master Screen Paed组合式肺功能仪(德国JAEGER公司)检测治疗前后肺功能,分辨率>0.1 mL,流速敏感度>0.5 mL/s,死腔容量2 mL,连续检测3次,取一秒钟用力呼气容积(forced expiratory volume in one second,FEV1)、最大呼气峰流速(peak expiratory flow rate,PEF)、用力呼气25%流速(25% of peak expiratory flow rate,PEF25)、用力呼气50%流速(PEF50)、用力呼气75%流速(PEF75)等指标最佳为最终检测结果。

2 结果
2.1 病情改善情况 2组患儿经3疗程(12 w)治疗后鼻炎和哮喘病情均明显减轻,且治疗组改善情况较对照组更为显著(P<0.05),均未发生严重不良反应。见表1。

表1 2组患儿治疗前后病情变化情况对比分析Tab.1 Comparison of disease changes pre-and post-treatment between two groups (±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05与对照组治疗后比较,compared with control group post-treatment
2.2 免疫功能改善情况 2组患儿治疗后免疫功能指标IgM、IgG、IgA、CD3+、CD4+、CD4+/CD8+水平均较治疗前明显升高(P<0.05),CD8+水平较治疗明显降低(P<0.05),治疗组患儿各项指标改善情况较对照组更为显著(P<0.05)。见表2。

表2 2组患者治疗前后免疫功能指标水平变化比较Tab.2 Comparison of immune function index pre-and post-treatment between two groups (±s)
*P<0.05和同组治疗前比较,compared with the same group pre-treatment;#P<0.05和对照组比较,compared with control group
2.3 炎症因子水平变化 2组患儿治疗后炎症因子(CRP、IL-8、TNF-α)水平较治疗前均明显降低(P<0.05),治疗组患儿下降程度较对照组更为显著(P<0.05)。见表3。

表3 治疗前后各项炎症因子水平变化情况比较Tab.3 Comparison of immune function index pre-and post-treatment in two group(±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05与对照组治疗后比较,compared with control group post-treatment
2.4 肺功能改善情况 2组患儿治疗后肺功能指标(FEV1、PEF、PEF25、PEF50、PEF75)较治疗前均明显升高(P<0.05),治疗组各项指标升高程度明显优于对照组(P<0.05)。见表4。
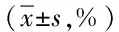
表4 治疗前后肺功能水平变化情况Tab.4 Comparison of pulmonary function pre-and post-treatment between two groups(±s,%)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05与对照组治疗后比较,compared with control group post-treatment
3 讨论
变应性鼻炎是机体接触吸入性过敏原后由IgE介导、Th2细胞驱动的鼻粘膜炎症反应性疾病,主要表现为流涕、喷嚏、鼻痒、鼻塞等症状,发病率呈明显增高趋势,负担日益加重,已经成为全球性健康问题[9]。目前,变应性鼻炎主要防治原则为“防控结合,四位一体”[10],随着药物治疗(抗组胺药、鼻用糖皮质激素、抗白三烯药、鼻用减充血剂、鼻用抗胆碱能药、色酮类药物、中药等)、特异性免疫疗法(皮下免疫治疗、舌下免疫治疗)[11-12]、外科治疗(下鼻甲手术、神经切断术)等众多治疗方案在临床中的广泛应用,可良好控制患者各项临床症状,有效改善其生存质量[13],但尚无彻底治愈该疾病的方案[14]。因此仍是众多学者和专家致力研究的重点和热点领域。
支气管哮喘简称为哮喘,是由炎性细胞、气道结构细胞、细胞组分参与的气道慢性炎症性疾病[15]。目前,普遍认为变应性鼻炎和哮喘存在相似的免疫病理机制、病理改变高度一致[16-17],变应性鼻炎可影响哮喘的发生,多项临床研究证实变应性鼻炎多发生在哮喘之前,故有学者认为变应性鼻炎是支气管哮喘的高危因素[18-19]。临床实践发现哮喘和变应性鼻炎常合并存在,两种疾病显著相关,尤其是儿童患者[20]。
变应性鼻炎和哮喘均属于呼吸道粘膜疾病,具有相同的变态反应过程,对药物治疗反应高度一致[21]。变应性鼻炎伴哮喘患儿,鼻炎发作可导致哮喘的急性发作,而对鼻炎的治疗亦可明显改善患者的哮喘症状[22-23],故临床上强调变应性鼻炎和哮喘协同治疗[24]。
免疫疗法是WHO推荐使用的唯一对因治疗手段,疗效得到充分肯定,大量临床研究均证实应变原特异性免疫治疗对于变应性鼻炎、变应性哮喘等变态反应性疾病疗效确切[25]。免疫疗法通过直接影响患儿的免疫系统,从体液和细胞免疫角度调节免疫平衡,抑制Th2免疫反应和刺激Th1免疫反应,进而达到控制变应性症状的治疗目的[26],目前临床免疫疗法主要包括皮下免疫治疗(SCIT)、舌下免疫治疗(SLIT)、口服免疫治疗、鼻内免疫治疗以及气管免疫治疗,最常用的为SCIT和SLIT,本研究选择舌下含服粉尘螨滴剂进行特异性免疫治疗,结果提示鼻炎和哮喘病情均明显减轻,再次证实皮下免疫治疗可明显改善患者临床症状,疗效确切。
小儿正处于生长发育关键阶段,免疫系统尚未发育成熟,呼吸道IgG、IgA等具有保护作用的免疫因子表达水平相对较低,免疫功能低下,极易受病原菌感染,破坏T淋巴细胞亚群的平衡,导致机体免疫功能紊乱,故在治疗过程中要特别注意对患儿免疫功能的调节[27]。匹多莫德是一种新型的免疫促进剂,可增强机体非特异性和特异性免疫反应,通过刺激白介素-2和γ-干扰素增强细胞免疫反应;激活天然杀伤细胞;增加吞噬细胞的吞噬功能并提高其趋化性;增加循环CD4+数量,恢复CD4+/CD8+比例;促进有丝分裂原引起的淋巴细胞增殖;活化补体,增强C3的调理作用[28]。匹多莫德在呼吸系统疾病、细菌感染性疾病、病毒感染性疾病等方面具有确切的疗效,且安全性高,用药方便,耐受性好,发挥极其重要的作用。本研究在常规治疗和皮下免疫治疗基础上给予匹多莫德调节免疫功能,结果显示治疗组改善情况较对照组更为显著(P<0.05),再次证实变应性鼻炎伴哮喘患儿治疗过程中免疫功能调节治疗的重要性,同时笔者监测患儿免疫功能发现治疗组患儿CD3+、CD4+、CD8+、CD4+/CD8+等免疫功能指标改善情况明显优于对照组(P<0.05),证实匹多莫德可抑制Th2细胞功能,促进中性粒细胞、淋巴细胞增殖,增强中性粒细胞和巨噬细胞的吞噬活性,提高CD4+水平,降低CD8+水平,进而提高机体免疫功能,和Fogli等[29]和Hu等[30]报道高度一致。Oliveira等[31]报道哮喘患儿气道重塑和高反应性与炎症因子浸润密切相关,致炎介质和抗炎介质失衡导致患儿发生炎症反应,主要表现为CRP、TNF-α、IL-8水平异常增高。匹多莫德可抑制嗜酸性粒细胞激活,显著抑制炎症反应功效,故本研究选择CRP、TNF-α、IL-8作为炎症反应监测指标,结果显示治疗组患儿CRP、TNF-α、IL-8水平较对照组改善情况更为显著,此结果和Nambiar等[32]报道吻合。笔者推测变应性鼻炎伴哮喘患儿免疫功能增强、气道和全身炎症反应程度减轻,可促进患儿肺功能改善,故本次笔者亦监测患儿肺功能改变情况,结果显示治疗后肺功能指标(FEV1、PEF、PEF25、PEF50、PEF75)较治疗前均明显下降(P<0.05),且治疗组各项指标下降程度明显优于对照组(P<0.05),但目前国内外尚无相关报道,尚有待进一步大样本、多中心临床试验证实。
综上所述,匹多莫德联合皮下免疫治疗小儿变应性鼻炎伴哮喘可明显提高患儿免疫功能,减轻炎症反应,促进肺功能改善,达到改善临床症状的治疗期望,且无严重不良反应。
[1] 章险峰.舌下含服粉尘螨嘀剂治疗儿童支气管哮喘伴变应性鼻炎的疗效观察[J].现代中西医结合杂志,2013,22(36):4026.
[2] 武沛佩,徐爱晖.变应性鼻炎与支气管哮喘相关性研究进展[J].中华临床医师杂志(电子版),2013,7(23):10993-10996.
[3] 倪建锋,颜厚新,罗德军,等.穴位注射联合药物治疗变应性鼻炎的疗效观察[J].临床合理用药,2015,8(10):45-46.
[4] 程雷,张罗.变应性鼻炎及其对哮喘的影响(ARIA)2010年修订版解读[J].中华耳鼻咽喉头颈外科杂志,2011,46:437-440.
[5] 张翼.匹多莫德片的处方工艺与质量研究[D].重庆:西南大学,2014年.
[6] 李慧,王永军,孙进.匹多莫德及其制剂的研究进展[J].中国药剂学杂志,2012,10(4)68-73.
[7] 中华耳鼻喉头颈外科杂志编辑委员会鼻科组,中华耳鼻咽喉头颈外科学分会鼻科学组、小儿学组,中华儿科杂志编辑委员会,等.儿童变应性鼻炎诊断和治疗指南[J].中华耳鼻咽喉头颈外科杂志,2011,46(1):7-8.
[8] 陈育智,赵京.儿童支气管哮喘诊断及治疗[M].北京人民卫生出版社,2010,18-24.
[9] 陈菲菲,陈漫杰,胡海文.变应性鼻炎患者吸入性过敏原IgE的检测[J].实验与检验医学,2015,33(4):461-463.
[10] Bousquet J, Khaltaev N,Cruz AA,et al.Allergic Rhinitis and its Impact on Asthma(ARIA)2008 update(in collaboration with the World Health Organization,GA2LEN and AllerGen)[J].Allergy, 2008, 63,Suppl 86:8-160.
[11] Wheatley LM,Togias A.Clinical practice.Allergic Rhinitis[J].N Engl J Med,2015,375(5):456-463.
[12] Canonica GW, Cox L,Pawankar R,et al.Sublingual immunotherapy: World Allergy Organization position paper 2013 update[J].World Allergy Organ J,2014,7(1):6.
[13] 苏慧,王士玮,康雪敏,等.小儿过敏性鼻炎治疗进展[J].临床合理用药,2014,7(7):176-177.
[14] 龚霄阳,程雷.变应性鼻炎的诊治现状与进展[J].中国中西医结合耳鼻咽喉科杂志,2015,23(3):161-165.
[15] 黄洋,杨磊,龙珍.儿童哮喘发病的相关因素分析[J].中国妇幼保健,2015,30(4):554-556.
[16] 张进,陈凯鹏,芦爱萍.儿童支气管哮喘与变应性鼻炎的相关性[J].医学综述,2013,19(1):87-89.
[17] Accordini S,Corsico AG,Galcciano L,et al.The impact of asthma, chronic bronchitis and allergic rhinitis on all-cause hospitalizations and limitations in daily activities;a population-based observational study[J].BMC Pulm Med,2015,15(1):8.
[18] Kersten ET, Van Leeuwen JC,Brand PL,et al.Effect of an intranasal corticosteroid on exercise induced bronchoconstriction in asthmatic children[J].Pediatr Pulmonol,2012,47:27-35.
[19] Becker EC,Wolke G,Heinrich J.Bronchial responsiveness,spiromety and mortality in a cohort of adults[J].J Asthma,2013,50(4):427-432.
[20] 付卓,郑跃杰.儿童支气管哮喘与过敏性鼻炎相关性研究进展[J].武警后勤学院学报(医学版),2015,24(4):326-330.
[21] 辛运超,张玉妥,林彦涛,等.儿童变应性鼻炎的诊疗进展[J].临床耳鼻咽喉头颈外科杂志,2015,29(5):400-403.
[22] Scheinmann P,Pham Thi N,Karila C,et al.Allergic march in children,from rhinitis to asthma: management, indication of immounotherapy[J].Arch Pediatr,2012,19:330-334.
[23] Higuchi O, Adachi Y, Itazawa T, et al.Rhinitis has an association with asthma in school children[J].Am J Rhinol Allergy,2013,1:e22-25.
[24] 方秀玲.联合诊治模式下变应性鼻炎合并哮喘儿童的疗效观察及满意度调查[D].福建:福建医科大学,2014年.
[25] 何金根,潘家华,张雪,等.屋尘螨免疫治疗儿童变应性鼻炎-哮喘综合征的临床疗效观察[J].安徽医学,2014,18(4):732-734.
[26] 欧阳晖.特异性免疫治疗小儿支气管哮喘合并变应性鼻炎的远期疗效分析[J].临床和实验医学杂志,2014,13(7):568-570.
[27] 刘勤,朱斌,吴梦晖.匹多莫德治疗对哮喘患儿肺功能、免疫功能和细胞因子的影响[J].海南医学院学报,2015,21(10):1387-1389.
[28] 李留栓.匹多莫德治疗对支气管哮喘患儿免疫功能的影响分析[J].中国实用医药,2015年,10(17):151-152.
[29] Fogli M, Caccuri F, Iaria ML, et al.The immumomodulatory molecule pidotimod induces the expression of the NOD-like receptor NLRP12 and attenuates TLR-induced inflammation[J].J Biol Regul Homeost Agents,2014,28(4):753-766.
[30] Hu S, Fu X, Fu A,et al.The regulatory peptide pidotimod facilitates M2 macrophage polarization and its function[J].Amino Acids,2014,46(5):1177-1185.
[31] Oliveira TT, Campos KM,Cerqueira-lima AT, et al.Potential therapeutic effect of Allium cepa L.and quercetin in a murine model of Blomia tropicalis induced asthma[J].Daru,2015,23(1):18.
[32] Nambiar J,Clarke AW, Shim D,et al.Potent neutralizing antiCD1d antibody reduces lung cytokine release in primate asthma model[J].MAbs,2015,7(3):638-650.
(编校:薛雪)
Clinicalefficacyofpidotimodadjuvanttherapyinchildrenallergicrhinitisandallergicasthma
XU JunΔ, LI Zhi-fei, LV Yi-zhi
(Department of Pediatric Internal Medicine, The Affiliated Hospital of Ningbo University Medical College, Ningbo 315020, China)
ObjectiveTo observe the therapeutic effect of pidotimod in the treatment of allergic rhinitis and asthma in children, and provide reference for the clinical treatment of the disease in the future.Methods60 cases of children with allergic rhinitis and asthma diagnosed in our hospital from January 2013 to January 2015, 60 cases of children with asthma were selected and divided into two groups by the method of random digital table, 30 cases in each group, the control group
routine therapy+sublingual immunotherapy , the treatment group were treated with routine therapy+sublingual immunotherapy+pidotimod, disease improvement, immune function, inflammatory factors, lung function and adverse reactions between the two groups of children were compared.ResultsThe rhinitis and asthma severity in two groups after treatment in children were significantly relieved, and the treatment group improved more significantly than control group (P<0.05), there was no serious adverse reactions in both groups.The improvement of immune function (IgG, IgA, IgM, CD4+, CD3+, CD4+/CD8+) and levels of inflammatory factors (CRP, IL-8, TNF-α)and lung function (FEV1, PEF, PEF25, PEF50,PEF75) in the treatment group was significantly better than those of the control group (P<0.05).ConclusionPidotimod combined with sublingual immunotherapy in children with allergic rhinitis and asthma can significantly improve the immune function, reduce inflammatory reaction, promote lung function and clinical symptoms, with no serious adverse reactions.
pidotimod; children; allergic rhinitis; allergic asthma; sublingual immunotherapy; efficacy
10.3969/j.issn.1005-1678.2016.10.025
徐军,通信作者,男,本科,主治医师,研究方向:新生儿,E-mail:1876774@qq.com。
R765.21;R256.12;R392.8
A

