创伤性失血性休克对机体抗氧化水平影响的实验研究*
李大鹏,吕春雷,王永清,王凤娇,张 霞,翟真真,郑文哲
基础医学
创伤性失血性休克对机体抗氧化水平影响的实验研究*
李大鹏,吕春雷*,王永清,王凤娇,张霞,翟真真,郑文哲
目的探讨创伤性失血性休克(traumatic hemorrhagic shock,THS)对机体过氧化水平的影响。方法选择普通级新西兰兔11只,通过急性失血方式建立收缩压下降曲线,形成THS动物模型,在不同的休克时段测定收缩压基础值(T1),当收缩压降至基础值2/3(T2)、基础值1/2(T3)、基础值1/3(T4)时采集血样,采用酶联免疫吸附分析检测各位置血清过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(T-AOC)水平,并予以统计分析。结果CAT:A组高于B组、B组高于C组、C组高于D组,T1-T2、T2-T3、T3-T4各组间无显著性差异(P>0.05),其余组间存在显著性差异(P<0.05);GSH-Px:A组高于B组、B组高于C组、C组高于D组,T1、T2间无显著性差异(P>0.05),其余组间存在显著性差异(P<0.05);T-AOC:各时间水平间无显著性差异(P>0.05)。结论选择收缩压下降曲线建立THS模型,THS发生过程对机体抗氧化酶CAT、GSH-Px具有显著性影响,可致CAT、GSH-Px活性显著下降,但对T-AOC无显著性影响,失血量与CAT、GSH-Px指标间存在显著相关性。
创伤性失血性休克;抗氧化水平;抗氧化酶;过氧化氢酶;谷胱甘肽过氧化物酶;总抗氧化能力
[Abstract]ObjectiveTo study the influence of traumatic hemorrhagic shock(THS)on peroxidation levels of organism.MethodsThe THS model with gradient decerease in the systolic blood pressure was eatablished in 11 New Zealand rabbits(ordinary grade).The arterial blood at the different phases of shock,i.e.when the decreased systolic pressures were 2/3(T2),1/2(T3),1/3(T4)of the basis systolic blood pressure,was sampled,then hydrogen peroxide enzyme(CAT),glutathione peroxidase(GSH-Px),total antioxidant capacity(T-AOC)levels in the plasmaweredeterminedbythedoubleantibodySandwichmethodofenzyme-labeledimmunosorbentassay(ELISH),and be statistically analysed.ResultsCAT:Group A was higher than group B,group B higher than group C,group C higher than group D;there was no significant difference between T1-T2,T2-T3,T3-T4among all groups(P>0.05).But there were significant differences among the other groups(P<0.05).GSH-Px:Group A was higher than group B,group B higher than group C,group C higher than group D;there was no significant difference between T1-T2among all group(P>0.05).But there were significant differences among other groups(P<0.05).T-AOC:There was no significant difference between all time-level(P>0.05).ConclusionIn selecting the systolic blood pressure decline curve toestablishTHSmodel,THSprocesshasasignificant effect onthe antioxidant enzyme CAT and GSH-Px of organism,can lead to significantly decreased of CAT and GSH-Px activity,but has no significant effect on the T-AOC;there are significantly correlation between blood loss and CAT,GSH-Px index.
[Keywords]Traumatichemorrhagicshock;Antioxidantlevels;Antioxidantenzyme;Hydrogenperoxide enzyme;Glutathione peroxidase;Total antioxidant capacity
创伤性失血性休克(traumatic hemorrhagic shock,THS)是院前急救中常见的急危重症,微循环障碍是失血性休克所有监测指标中的核心评判标准[1]。笔者通过快速失血形成收缩压下降曲线方式建立THS模型,以抗氧化酶系统中过氧化氢酶(hydrogen peroxide enzyme,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及总抗氧化能力(total antioxidant capacity,T-AOC)为监测指标,探讨THS发生过程中不同失血量对机体抗氧化水平的影响,现报告如下。
1 材料与方法
1.1实验对象随机选择新西兰兔(n=11),普通级,体重质量2~3 kg,雌雄不限,购于山东省济南实验动物中心[实验动物生产许可证:SCXK(鲁)2015-0001],普通环境[SYXK(军)2012-0044]中冲洗式饲养兔笼(苏州冯氏实验动物设备公司)内饲养,自由进食及饮水。
1.2主要仪器与试剂ZH-HX-2型无创尾动脉血压测量分析系统(安徽正华生物仪器设备有限公司)用于血流动力学指标监测,小动物人工呼吸机(上海奥尔科特生物科技公司)用于辅助呼吸等。
测定CAT、GSH-Px、T-AOC指标主要仪器包括722型光栅分光光度计(上海第三分析仪器厂,CAT测定为波长405 nm、0.5 cm光径比色杯,GSH-Px测定波长412 nm、1 cm光径比色杯,T-AOC检测波长520 nm、1 cm光径比色杯)、5415R台式冷冻小型离心机、5810R台式冷冻高速离心机(德国Eppendorf公司)等。CAT、GSH-Px、T-AOC测定试剂盒均购自南京建成生物工程研究所。
实验主要耗材:0.3%戊巴比妥钠溶液(自配),肝素钠注射液(上海上药第一生化药业有限公司,批号1507104),0.9%氯化钠注射液(山东齐都药业有限公司,批号2015092407),一次性使用塑料血袋(四川南格尔生物科技有限公司,批号150304)等。
1.3实验方法
1.3.1动物实验新西兰兔适应性饲养4 d以上进行实验,实验前24 h禁食、2~3 h禁水。
实验操作前,实验兔均先称重并记录,并采集血标本2ml以上待检(常规方法迅速分离血清,-80℃保存)。选择0.3%戊巴比妥钠麻醉,剂量为30 mg/kg体重,缓慢耳缘静脉注射。根据实验情况,麻醉过程可逐步追加1/5量,实验中出现呼吸暂停者给予辅助呼吸至自主呼吸恢复。
麻醉稳定后,将实验兔仰卧固定在解剖台上,8%硫化钠脱毛暴露手术区皮肤后常规消毒,手术方式仔细分离出兔右侧颈总动脉,完毕后插入肝素化动静脉插管并用缝合线固定好,肝素化抗凝(500 U/ kg),插管通过压力转换器与无创尾动脉血压测量分析系统相连,监测血压、心率等血流动力学指标变化。无菌操作下,按以上方式分离出右侧股动脉进行PE套管插管并用缝合线固定好以建立放血通路,并与一次性使用塑料血袋(或带刻度定量收集管)相连,用于放血及血液标本留取。
1.3.2实验模型制备实验操作前,记录实验兔收缩压基础值(T1)等指标。选择右侧股动脉建立的放血通路进行放血,使用一次性使用塑料血袋收集,兔收缩压随放血量增加而逐步下降,形成收缩压下降曲线。当收缩压降至基础值2/3(T2)、1/2(T3)、1/3(T4)3个位置时,通过带刻度定量收集管分别留取血标本2 ml以上,按常规方法迅速分离血清,-80℃保存待检。
1.4指标测定CAT活性测定采用可见光法,严格按试剂盒操作说明书要求进行标准品处理和实验操作,405 nm波长测各孔吸光度A,检测范围为0.2~24.8 U/ml。
GSH-Px活性测定采用DTND显色法,严格按试剂盒操作说明书要求进行标准品处理和实验操作,412 nm波长测各孔吸光度A,检测范围为20~330 U/ml。
T-AOC测定采用铁还原-菲啉显色法,严格按试剂盒操作说明书要求进行标准品处理和实验操作,520 nm波长测各孔吸光度A,检测范围为0.2~55.2 U/ml。
1.5统计学分析计量资料以均数±标准差(x±s)形式表示,使用SPSS 13.0统计学软件进行分析处理。重复测量资料使用方差分析,P<0.05为差异有统计学意义。
2 结果
11只实验兔在T1~T4共4个位置采集血样,检测取得血清CAT、GSH-Px、T-AOC指标数据,分别按A、B、C、D进行分组,A~D各组指标分别进行统计学分析。
(1)CAT、GSH-Px、T-AOC检测结果见表1,其中CAT检测A组高于B组、B组高于C组、C组高于D组,GSH-Px检测A组高于B组、B组高于C组、C组高于D组,T-AOC检测A组低于B组、B组高于C组、C组低于D组。

表1 各组CAT、GSH-Px、T-AOC检测结果
(2)统计学分析比较中,重复测量因素为时间因素,有T1、T2、T3、T4共4个水平。
CAT:检测数据进行球型检验,结果P=0.053>0.05,不拒绝球形假设,应用单变量检验方法无须ε校正,结果见表2;对重复效应进行方差分析(F检验),结果见表3,表明各时间水平间存在显著性差异(P<0.001)。采用LSD法对各时间水平间进行多重比较,结果见表4,其中T1-T2、T2-T3、T3-T4各组检验结果P>0.05,其余各组间均P<0.05,表明T1-T2、T2-T3、T3-T4各组间无显著性差异,其他组间存在显著性差异。
GSH-Px:检测数据进行球型检验,结果P= 0.257>0.05,不拒绝球形假设,应用单变量检验方法无须ε校正,结果见表2;对重复效应进行方差分析(F检验),结果见表3,表明各时间水平间存在显著性差异(P<0.001)。采用LSD法进行各时间水平间多重比较,结果见表5,T1-T2间检验结果P>0.05,其余各组间均P<0.05,表明T1、T2间无显著性差异,其余组间存在显著性差异。
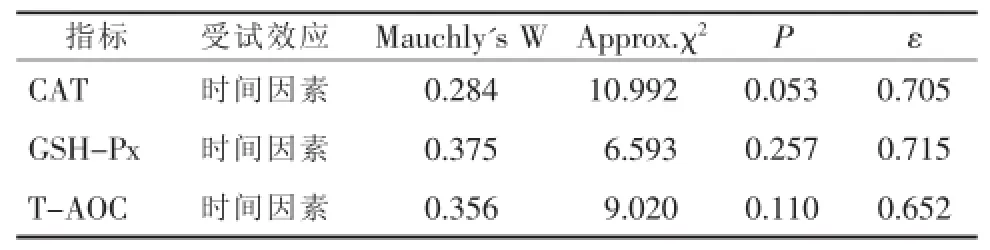
表2 球型检验结果
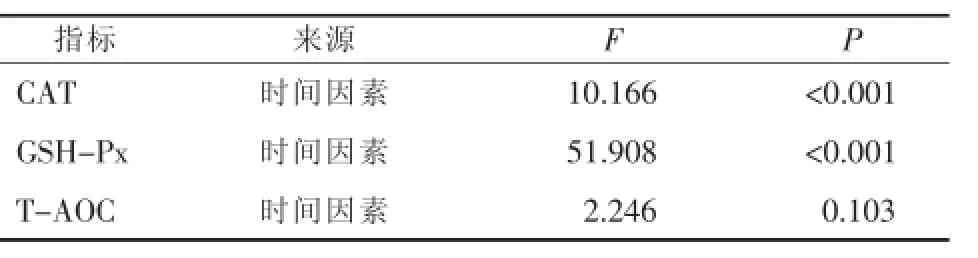
表3 方差分析结果
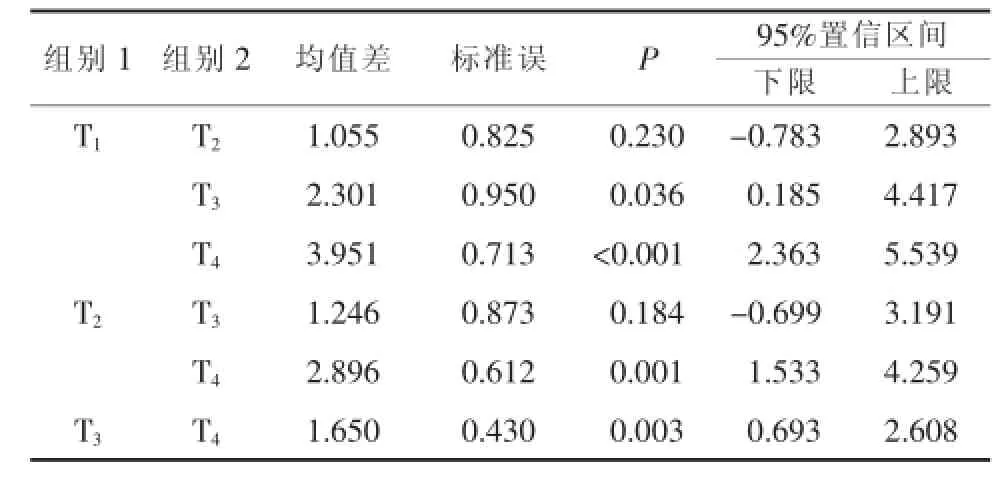
表4 CAT不同时间水平下LSD多重比较结果
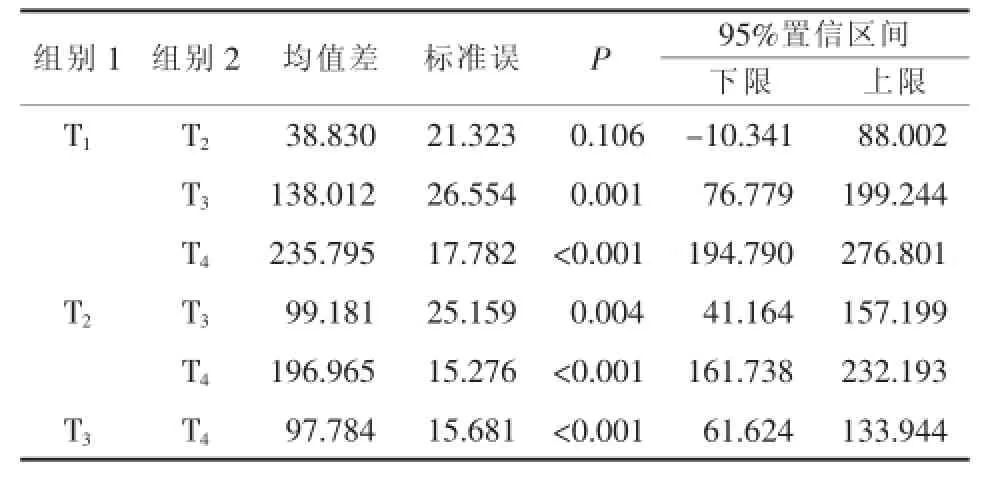
表5 GSH-Px不同时间水平下LSD多重比较结果
T-AOC:检测数据进行球型检验,结果P= 0.110>0.05,不拒绝球形假设,应用单变量检验方法无须ε校正,结果见表2;对重复效应进行方差分析,结果见表3,表明各时间水平间无显著性差异(P=0.103>0.05)。
3 讨论
失血性低血容量休克主要病理生理改变是有效循环血容量急剧减少及微循环障碍,可导致组织低灌注、再灌注损伤等[2]。氧化应激是机体最常见的应激反应之一,系指在损伤因素作用下,机体组织或细胞内氧自由基生成增多和(或)清除能力降低,导致氧自由基在体内或细胞内蓄积,出现脂质过氧化及造成细胞或组织氧化损伤[3,4]。
抗氧化酶是机体抗氧化系统的主要组成。CAT可有效清除自由基、减轻及阻断脂质过氧化反应、还原体内不断生成的过氧化氢、产生保护细胞膜结构和功能完整等作用,可间接反映抗氧化酶的活性及机体清除自由基的能力;GSH-Px作为清除自由基的抗氧化制剂,可还原体内不断生成的脂质过氧化物和过氧化氢,减少活性氧自由基及脂质过氧化物产生,清除自由基和衍生物,增强机体抗氧化能力,防止脂质过氧化物对机体组织造成损害,产生保护细胞膜结构和功能完整的作用。T-AOC是衡量抗氧化系统功能状况的综合性指标,其含量能反映机体抗氧化系统针对外来刺激的代偿能力及自由基代谢的状况[5-11]。
机体抗氧化酶系统及抗氧化水平易受到多种因素影响[11,12]。笔者建立的THS模型,存在研究THS发生过程对机体抗氧化水平的影响。检测数据表明:随THS发生过程中失血量逐步增加,抗氧化酶CAT、GSH-Px活性均不断下降。CAT组间比较,T1-T2、T2-T3、T3-T4各组间均无显著性差异(P>0.05),其余组间存在显著性差异(P<0.05);GSH-Px组间比较,T1、T2间无显著性差异(P>0.05),其余组间存在显著性差异(P<0.05);T-AOC组间比较,各时间水平间无显著性差异(P>0.05)。表明失血量大量增加对CAT、GSH-Px指标具有显著性影响,可致抗氧化酶CAT、GSH-Px活性显著下降,但对反映抗氧化系统功能状况综合性指标T-AOC则无显著性影响。THS发生过程中失血量与CAT、GSH-Px指标活性具有显著相关性。
实验表明,随着THS发生过程中有效循环血容量急剧减少及微循环障碍,可导致组织低灌注、再灌注损伤,使机体组织或细胞内氧自由基生成增多,过量自由基水平可致抗氧化酶CAT、GSH-Px消耗增加,显著降低血清中CAT、GSH-Px活性水平,使机体清除自由基能力及抗氧化能力下降,脂质过氧化反应上调,促进脂质过氧化并导致机体生物膜损伤。
总之,笔者通过快速失血方式建立THS模型,以CAT、GSH-Px及T-AOC为监测指标,探讨及评价THS发生过程中不同失血量对机体抗氧化水平的影响,数据表明THS发生过程中不同失血量对CAT、GSH-Px指标具有显著性影响,可显著降低血清CAT、GSH-Px活性水平,使机体清除自由基能力及抗氧化能力下降,脂质过氧化反应上调,但对TAOC水平则无显著性影响,为院前THS救治及相关研究提供了数据支持。
今后仍有待于进一步增加实验研究数量,结合开展相关生理病理等机理机制研究,并在THS复苏救治等工作中不断加以推广。
[1]李维礁,陈媛,朱玮亚,等.家兔急性失血性休克及分组治疗的血压、微循环同步观测[J].昆明医学院学报,2011,32(5):20-23.
[2]吴健锋,管向东,陈娟,等.早期乳酸清除率评估与失血性低血容量休克预后的研究[J].中华普通外科学文献:电子版,2010,4(4):332-335.
[3]王轩,张展,董惠斌,等.双份A对雄性大鼠抗氧化能力影响的初步研究[J].现代生物医学进展,2011,11(8):1420-1423.
[4]徐其岭,闫莉.富氢生理盐水对大鼠重度颅脑损伤后氧化应激保护作用的研究[J].重庆医学,2014,43(8):943-948.
[5]刘灵芝.丹红注射液对自然衰老大鼠心脏、大脑组织SOD、MDA及GSH-Px的影响[J].中国实用神经疾病杂志,2012,15(17):73-74.
[6]张歆薇,刘海强,徐胜龙,等.次生作用对大鼠血浆SOD、MDA、NO水平的影响[J].现代生物医学进展,2012,12(18):3416-3419.
[7]杨明聪,范小平,王春.低频超声对大鼠颊囊黏膜溃疡组织SOD、MDA含量的影响[J].重庆医学,2012,41(26):2711-2713.
[8]秦小惠,古再丽努尔·艾麦提,邵伟,等.移植BMSCs对乳腺炎大鼠血清中自由基和抗氧化酶水平变化影响的研究[J].现代生物医学进展,2013,13(30):5817-5820,5884.
[9]周峰.烟酰胺对甲基苯丙胺注射后小鼠脑组织中脂质过氧化的影响[J].江苏医药,2014,40(1):13-15.
[10]温啸,贺大方,倪雪勤,等.干酪乳杆菌与银杏叶提取物对肥胖小鼠血脂及抗氧化功能的影响[J].西北农林科技大学学报:自然科学版,2014,42(1):1-12,17.
[11]马宝慧,高永胜,潘桂兰,等.木樨草素对高脂血症模型大鼠血浆一氧化氮水平与抗氧化能力的影响[J].中国老年学杂志,2014,34(8):2176-2178.
[12]宋姌,刘涛.人参皂甙Rg1对慢性疲劳综合征大鼠抗氧化酶系统活性的影响研究[J].陕西中医,2014,35(1):101-103.
[13]于洪领,王增杰.甲醛对小鼠血液中抗氧化酶及微量元素影响[J].辽宁中医药大学学报,2010,12(12):202-203.[2016-01-19收稿,2016-02-16修回]
[本文编辑:韩仲琪]
Experimental study on the influences of traumatic hemorrhagic shock on antioxidant levels of organism
LI Da-peng①,LV Chun-lei,WANG Yong-qing,et al.①Central Medical Laboratory,the 88th Hospital of Chinese PLA,Taian,Shandong 271000,China
R641:R441.9
A
10.14172/j.issn1671-4008.2016.07.018
军队“十二五”后勤科研计划项目(CWS11J297)
271000山东泰安,解放军88医院中心实验室(李大鹏,王凤娇,张霞,翟真真),医务处(吕春雷,王永清,郑文哲)
吕春雷,Email:15653808901@163.com

