外源NO对铜胁迫下小白菜SBPase基因表达特性及其光合速率的影响
叶丽萍, 钟凤林, 林义章, 林琳琳
(福建农林大学园艺学院, 福州 350002)
外源NO对铜胁迫下小白菜SBPase基因表达特性及其光合速率的影响
叶丽萍, 钟凤林, 林义章*, 林琳琳
(福建农林大学园艺学院, 福州 350002)
【目的】本研究通过克隆小白菜光合暗反应中限制核酮糖-1, 5-二磷酸(RuBP)再生的关键酶景天庚酮糖-1,7-二磷酸酶(sedoheptulose-1, 7-bisphosphatase,SBPase)基因,分析铜胁迫及添加外源一氧化氮(NO)供体硝普钠(SNP)缓解铜胁迫时该基因的表达情况,并将其与对应处理下小白菜净光合速率(Pn)的变化情况结合在一起进行分析,以期为全面了解外源NO缓解铜胁迫植物光合作用机理提供理论依据。【方法】以小白菜品种“上海青”34片真叶大的幼苗为材料,采用RT-PCR技术克隆小白菜SBPase基因,铜处理浓度为200 μmol/L,外源NO供体SNP浓度为300 μmol/L,同时设置相关的4个对照组排除其他可能因素的干扰,在添加处理液后的0、 4、 8、 12 d上午九点测定各处理小白菜相同节位叶片的净光合速率,并利用实时荧光定量PCR技术检测在对应的处理时间及对应节位小白菜叶片中SBPase基因的表达情况。试验环境条件为光照强度200 μmol/(m2·s),光周期12 h,温度25℃/18℃。【结果】 1)克隆得到小白菜SBPase基因(Genbank登录号:AHY18974.1),开放阅读框为1182 bp,编码393个氨基酸,蛋白质分子量为42.34kD,理论等电点为5.85。2)序列分析表明其含有氧化还原活性位点,包含一个具有59个氨基酸残基的叶绿体转移肽序列。小白菜SBPase基因推导的氨基酸序列与其他物种中已分离的SBPase编码的氨基酸序列具有很高的同源性。3)实时荧光定量PCR分析表明,SBPase基因在铜胁迫下的小白菜叶片中表达量下降,且随着胁迫时间的延长下降程度加剧;而在铜胁迫的基础上添加外源NO可以在一定程度上缓解铜胁迫引起的小白菜叶中SBPase基因表达量的下降。4)铜胁迫下小白菜叶片Pn显著下降,且随着胁迫时间的延长,Pn下降加剧,施加外源NO后Pn的下降得到一定程度的缓解,各处理下Pn的变化与SBPase基因表达量变化趋势一致。【结论】铜胁迫及在铜胁迫的基础上添加外源NO后小白菜叶片中SBPase基因表达量的变化,可能是影响对应条件下小白菜叶片的净光合速率变化的原因之一。
小白菜; 铜胁迫; 一氧化氮; 景天庚酮糖-1, 7-二磷酸酶; 实时荧光定量PCR
光合作用是植物生长发育的基础,它的强弱对于植物的生长、 产量及抗逆性有着重要的影响。光合暗反应又称为卡尔文循环,是高等植物碳固定的基本途径,其反应过程由RuBP为起点至RuBP再生结束。景天庚酮糖-1,7-二磷酸酶(sedoheptulose-1, 7-bisphosphatase)是限制光合作用卡尔文循环中RuBP再生速率的关键酶,也是植物光合作用途径的主要限速酶之一[1]。CO2受体RuBP由景天庚酮糖-7-磷酸转变而来,景天庚酮糖-7-磷酸由SBPase酶不可逆地催化景天庚酮糖-1,7-二磷酸去磷酸化生成[2]。前人研究表明[3-5],将SBPase基因反向导入烟草中,发现SBPase活性的微小下降即可导致反义转基因植株碳同化速率的显著下降,植株生长受到抑制。Lawson等[6]研究表明,当SBPase活性或SBPase基因表达量下降时,植物的光合能力,生长速度以及生物量的积累均下降。可见SBPase酶对光合作用强弱起着重要的调控作用。
铜是植物生长发育所必需的微量元素,但是过量的铜却会对植物产生毒害作用[7]。近年来随着农业生产上含铜杀菌剂的频繁使用、 铜矿的过度开采及工业生产中含铜污染物的大量排放,使得土壤中的铜含量越来越高,影响着蔬菜的品质和产量[8-11]。植物受到铜胁迫后叶绿体结构发生明显变化,光合速率明显下降[12]。外源NO是一种生物活性气体分子[13],研究表明其在保护植物抵抗重金属毒害等非生物胁迫引起的植物光合作用的下降方面有着重要的作用[14-16]。
目前,关于外源NO缓解铜胁迫下植物光合作用的相关研究主要集中在植物形态及生理生化指标变化方面,研究表明[14, 17-18]施加适宜浓度的外源NO可以显著提高番茄、 玉米、 黄瓜、 油菜在铜、 镉胁迫下的净光合速率,但关于外源NO对铜胁迫下植物光合碳同化过程重要酶对应基因的表达是否产生影响,及其变化情况与光合作用变化的对应关系研究较少。小白菜(BrassicachinensisL.)为十字花科芸薹属蔬菜,营养丰富、 味道鲜美,适应性强,四季均有,栽培周期短,广泛栽培,备受人们喜爱。本研究以小白菜为试验材料,克隆小白菜的SBPase基因序列,并研究外源NO对铜胁迫下小白菜SBPase基因表达量的变化与小白菜光合速率的对应关系的影响,为全面了解外源NO缓解铜胁迫植物光合作用机理提供一定的理论依据。
1 材料与方法
1.1试验材料
试验在福建农林大学园艺学院温室内进行。供试小白菜品种为“上海青”,采用穴盘育苗,待幼苗长到34片真叶时,选取生长一致、 健壮的幼苗将其移至装有12 L通用叶菜类水培营养液的塑料盆中,每盆18株,缓苗5 d后移入处理液中。NO供体SNP购自Sigma公司。处理条件为光照强度200 μmol/(m2·s)、 光周期12 h、 温度25℃/18℃。
1.2试验设计
试验共设6个处理: 1)对照,完全营养液(CK); 2)200 μmol/L CuSO4·7H20(Cu); 3)200 μmol/L CuSO4·7H20+300 μmol/L SNP(Cu+S); 4)200 μmol/L CuSO4·7H20+ 300 μmol/L NaNO2+300 μmol/L NaNO3(Cu+N); 5)200 μmol/L CuSO4·7H20 +300 μmol/L K3[Fe(CN)6](Cu+F); 6)200 μmol/L CuSO4·7H20 + 300 μmol/L SNP+25 μmol/L Nitro-L-arginine(NO抑制剂)(Cu+S+L)。每个处理设3次重复,每4 d更换一次营养液(每次取样后更换营养液),在处理后的0、 4、 8、 12 d上午九点测定各处理植株第3片完全展开的功能叶的净光合速率,并取相同节位的功能叶用液氮速冻后保存于-80℃的冰箱中备用。
1.3测定项目与方法
1)小白菜叶片净光合速率测定采用美国生产的CI-340便携式光合测定仪,于上午九点测定植株第3片完全展开的功能叶的净光合速率(Pn)。
2)小白菜叶片总RNA提取与cDNA合成采用Trizol法提取小白菜叶片总RNA(Trizol购于Invitrogen公司),并对所获得的总RNA进行电泳检测和OD值的测定。利用RevertAit First Strand cDNA Synthesis Kit试剂盒(Thermo公司),将所提取的质量较高的RNA反转录成cDNA,作为模板。
3)SBPase基因的克隆 RT-PCR引物序列为,SBPaseF: 5′-ATGGAGACCAGCATCGCGTGCT-3′;SBPaseR: 5′-AGTTTCTAAGCGGTAACTCC-3′。
RT-PCR反应体系为:反应体系为1 μL cDNA、 1 μLSBPaseF、 1 μLSBPaseR、 2.5 μL 10×Ex-taqbuffer、 0.2 μL Ex-Taq(5U/μL)、 0.5 μL dNTP(10 mmol/L)、 加ddH2O至体积25 μL。RT-PCR反应步骤: 94℃ 5 min; 94℃ 45 s,52℃ 40 s,72℃ 75 s,共35个循环; 72℃ 10 min。
4)SBPase基因的生物信息学分析利用相关软件分析小白菜SBPase编码的氨基酸序列,即用Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行同源序列搜索;用ProtParam (http://web.expasy.org/protparam/)预测基本的理化性质;用ProScal (http://web.expasy.org/protscale/) 默认算法(Hphob./Kyte&Doolittle)预测该蛋白的疏水性;用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/) 预测信号肽;应用DNAMAN进行序列比对;用MEGA5.2构建系统进化树。
5)SBPase基因的特异性表达分析分别提取处理0、 4、 8、 12 d的小白菜叶片总RNA,控制用于逆转录的RNA起始浓度相同,用SuperscriptTMШ First-Strand cDNA Synthesis System for RT-PCR试剂盒合成cDNA。利用小白菜actin为内参基因(引物为actin-qF5′-GTCCTGTTCCAGCCTTCGTTC-3′,actin-qR5′-CAAG TCCTTCCTGATATCCACGTC-3′)。根据已得到的小白菜SBPase基因的ORF序列设计qRT-PCR特异性引物(SBPase-qF:5′-AGGTGGGTTTAGT GTGGCATTTG -3′,SBPase-qR:5′-CTTGATCTCC TCCCGTGACTCC -3′)。用SYBR Premix ExTaq试剂盒进行qRT-PCR检测该基因在不同处理、 相同处理不同处理时长的表达情况。
qRT-PCR反应体系为: 1 μL cDNA、 0.4 μL上游引物、 0.4 μL下游引物、 10 μL SYBR® Premix Ex TaqTM(Tli RNaseH Plus)、 加ddH2O2至体积20 μL。Real-time PCR反应步骤采用两步法,95℃ 10 min, 95℃ 15 s, 58℃ 30 s(回到第二步共40个循环)。
2 结果与分析
2.1外源NO对铜胁迫下小白菜叶片净光合速率的影响

2.2SBPase基因的克隆及序列分析
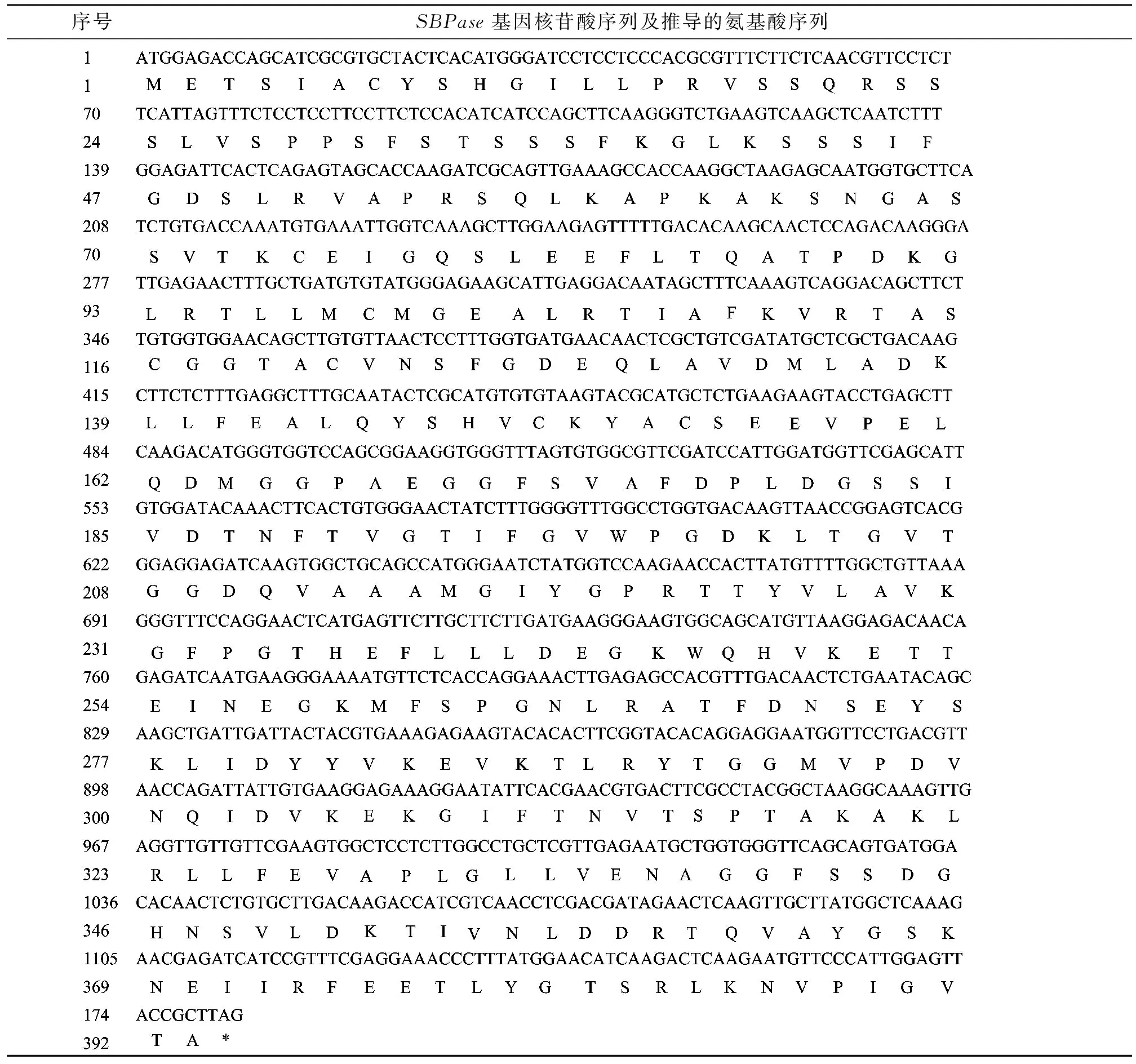
利用RT-PCR技术获得SBPase基因开放阅读框的cDNA序列(图2),长为1182bp(GenBank 登录号:AHY18974.1),推测其编码393个氨基酸,含有起始密码子ATG和终止密码子TAG(表1)。
2.3生物信息学分析
用ProtParam软件预测结果显示,小白菜SBPase基因编码的蛋白质分子量为42.34 kD,理论等电点为5.85,所带的正电荷总数(Arg+Lys)为39,负电荷总数(Asp+Glu)为43为碱性蛋白。理论推导半衰期是30 h,不稳定指数为34.19,为稳定蛋白。

图1 外源NO对铜胁迫下小白菜叶片净光合速率的影响Fig.1 Effects of exogenous nitric oxide on the net photosynthetic rate in leaves of Brassica chinensis L. under the copper stress[注(Note): 柱上不同字母表示处理间差异达5%显著水平Different letters above the bars mean significant difference at the 5%level.]
序号SBPase基因核苷酸序列及推导的氨基酸序列
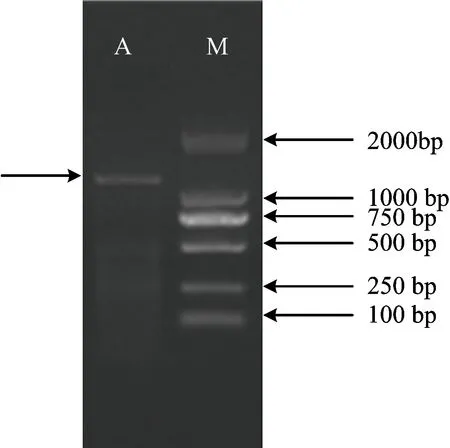
图2 SBPase基因ORF区段扩增结果Fig.2 Amplification product of SBPase[注(Note): M—DL2000; A—SBPase]
利用Expasy对蛋白质亲水性、 疏水性进行分析,结果显示,疏水性氨基酸占42.44%,亲水性氨基酸占57.56,该蛋白为亲水性蛋白。由图3可以看出,在图中所有的SBPase氨基酸序列中,有5个Cys是保守的,其中的2和3形成CGGTAC结构,这一结构被认为是很多酶的氧化还原活性位点,参与光的调节反应[19-20]。由图3还可以发现,不同植物的SBPase氨基酸序列的N-末端同源性较低,但它们都具有叶绿体蛋白转移肽的共同特征,即含有较多的丝氨酸,较少的天冬氨酸、 谷氨酸。利用ChloroP 1.1 Prediction Server分析发现,由小白菜SBPase基因推导的氨基酸序列含有一个包含59个氨基酸残基的叶绿体转移肽序列,这与前人的研究结果一致[2, 21]。

图3 小白菜SBPase基因推测的氨基酸序列与其他植物中该序列的同源性比对Fig.3 Alignment of amino acid sequence of Brassica chinensis L. SBPase with other species[注(Note): NP 001267658.1—黄瓜Cucumis sativus; XP 006355654.1—马铃薯Solanum tuberosum; NP 191139.1—拟南芥Arabidopsis thaliana; XP 002263049.1—葡萄Vitis vinifera; AHY18974.1—小白菜 Brassica chinensis L.]
将小白菜SBPase编码的蛋白与GenBank中登录的12个物种的SBPase蛋白进行聚类分析,构建SBPase进化树。结果如图4所示,小白菜SBPase推测的氨基酸序列与同为十字花科的拟南芥SBPase的亲缘关系最近,同源性为95.67%。同玉米的SBPase的亲缘关系最远,同源性为73.75%。
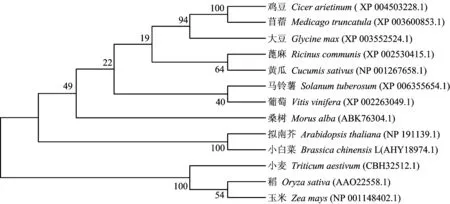
图4 小白菜SBPase氨基酸序列与其他物种SBPase氨基酸序列的系统进化树分析 Fig.4 Phylogenetic tree of amino acid sequences of Brassica chinensis L. SBPase with other species
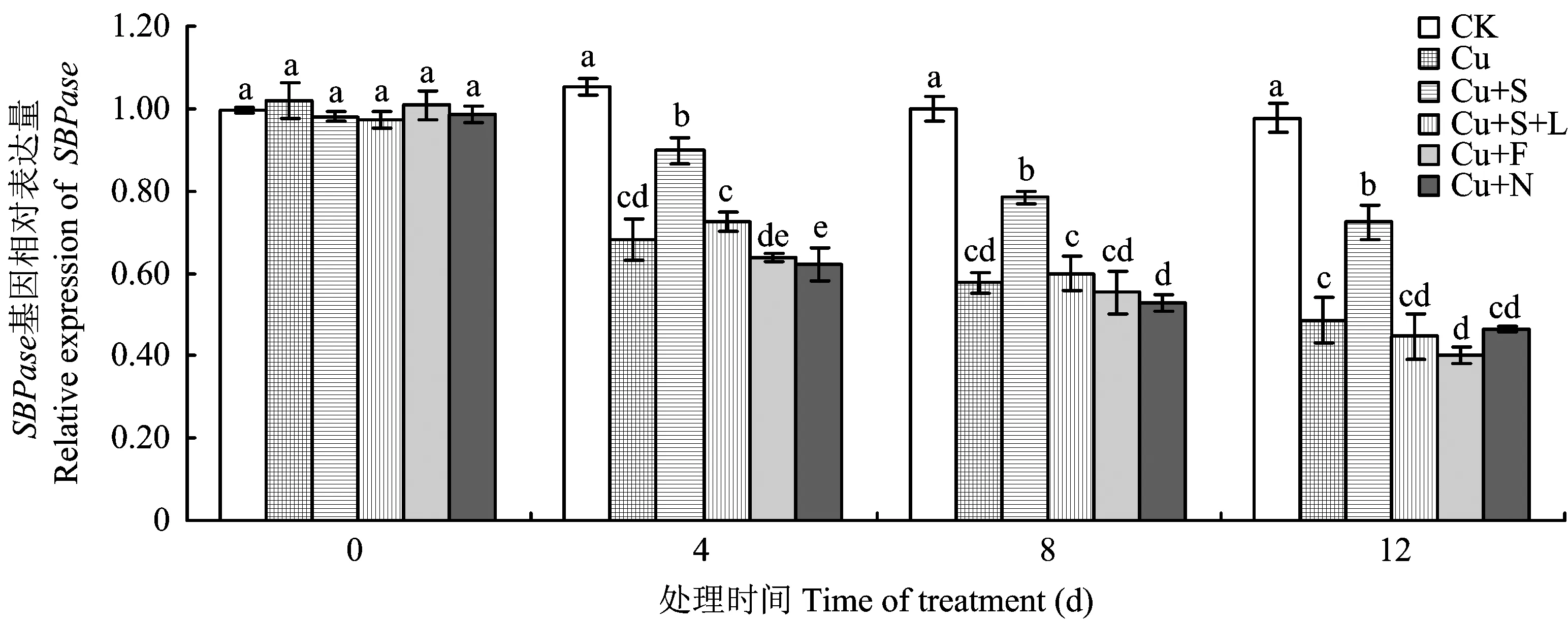
图5 外源NO对铜胁迫下小白菜叶片中SBPase基因表达的影响Fig. 5 Effects of exogenous nitric oxide on the expression of SBPase in leaves of Brassica chinensis L. under the copper stress[注(Note): 柱上不同字母表示差异达5%显著水平Different letters above the bars mean significant difference at the 5%level.]
2.4外源NO对铜胁迫下小白菜叶片中SBPase基因表达特性的影响
由图5可以看出,200 μmol/L的铜处理小白菜,胁迫4 d时小白菜叶片中SBPase基因的表达量显著下降,且随着处理时间的延长小白菜叶片中SBPase基因的表达量下降程度加剧,而在铜胁迫的基础上同时外施300 μmol/L的SNP处理(Cu+S),能提高铜胁迫下小白菜叶片SBPase基因的表达量,但其表达量仍低于对照处理。在添加NO抑制剂处理后(Cu+S+L),SNP的缓解效果被消除。在铜处理液中加入300 μmol/L NaNO2/NaNO3(Cu+N)或300 μmol/L K3[Fe(CN)6](Cu+F),与只添加铜胁迫处理的差异不显著。说明外源NO可以在一定程度上缓解铜胁迫引起的小白菜叶片中SBPase基因表达量的下降。
3 讨论
前人研究表明,在烟草、 番茄、 水稻中SBPase基因表达量下降及酶活下降时,其净光合能力、 生长速度及生物量的积累都会明显下降[3-6],表明SBPase基因表达量及酶活的变化会对植物光合作用的变化产生相应的影响。Wang等[15]研究表明低温胁迫下,番茄叶片的SBPase基因表达量及SBPase酶活性降低,且番茄叶片的Pn出现同样的变化趋势,表明部分非生物胁迫引起的植物叶片中的SBPase基因表达量下降,是植物在对应胁迫下光合速率下降的原因之一。本研究结果表明,铜胁迫4 d就会引起小白菜叶片中的SBPase基因表达量出现显著的下降,且随着胁迫时间的延长,SBPase表达量下降加剧;在铜胁迫4 d时小白菜叶片的Pn也降低,且随着胁迫时间的延长Pn下降加剧,即小白菜受到铜胁迫时SBPase表达量与Pn的值均呈下降趋势。在铜胁迫的基础上施加适宜浓度的SNP处理后小白菜叶片的SBPase的表达量增加,且小白菜叶片中Pn也出现同样的升高趋势。崔金霞[22]研究也表明适宜浓度的SNP处理,可以提高黄瓜叶片中多个参与卡尔文循环过程的酶对应基因的表达水平。本研究结果表明小白菜叶片中SBPase表达量的变化可能是引起小白菜在铜胁迫及铜胁迫的基础上添加外源NO时小白菜叶片净光合速率出现相应的降低或升高的原因之一。
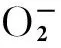
[1]Anja S, Marco B, Rudiger H. Overexpression of the potential herbicide target sedoheptrlose from spinacia oleracea in transgentic tobacco[J]. Molecular Breeding, 2002, 99(1): 53-61.
[2]冀宪领, 盖英萍, 马建平, 等. 桑树景天庚酮糖-1, 7-二磷酸酶基因的克隆、 原核表达与植物表达载体的构建[J]. 林业科学, 2008, 44(3): 62-69.
Ji X L, Gai Y P, Ma J P,etal. Cloning and prokaryotic expression of the sedoheptulose-1, 7-bisphosphatase cDNA from mulberry and construction of plant expression vector[J]. Scientia Silvae Sinicea, 2008, 44(3): 62-69.
[3]Raines, C A, Harrison E P, Olcer H,etal. Investigating the role of thethiolregu-lated enzyme sedoheptulose-1, 7-bisphosphatase in the control of photosynthesis[J]. Plant Physiology, 2000, 110(2): 303-308.
[4]Olcer H, Lloyd J C, Raines C A,etal. Photosynthetic capacity is differentially affected by reductions in sedoheptulose-1, 7-bisphosphatase activity during leaf development in transgentic tobacco plants[J]. Plant Physiology, 2001, 125(2): 982-989.
[5]Raines C A. The calvin cycle revisited[J]. Photosynthesis Research, 2003, 75(1): 1-10.
[6]Lawson T, Bryant B, Lefebver S. Decreased SBPase activity alters growth and development in transgenic tobacco plants[J]. Plant Cell and Environment, 2006, 29(1): 48-58.
[7]王松华, 杨志敏, 徐朗莱. 植物铜毒害及其抗逆性机制研究进展[J]. 生态环境, 2003, 12(3): 336-341.
Wang S H, Yang Z M, Xu L L. Research progress of plant copper toxicity and mechanism of resistance[J]. Ecology and Environment, 2003, 12(3): 336-341.
[8]林义章, 徐磊, 林碧英. Cu胁迫对小白菜保护酶系统及其他相关抗性指标的影响[J].福建农林大学学报, 2007, 36(4): 369-372.
Lin Y Z, Xu L, Lin B Y. Effects of copper stress onBrassicachinensisL. resistant enzyme system and other resistant indexes[J]. Journal of Fujian Agriculture and Forestry University, 2007, 36(4): 369-372.
[9]徐磊, 林义章. 铜胁迫对小白菜品质相关指标的影响[J]. 中国农学通报, 2009, 25(14): 161-163.
Xu L, Lin Y Z. The change ofBrassicachinensisL. quality indicators under the copper stress[J]. Chinese Agricultural Science Bulletin, 2009, 25(14): 161-163.
[10]林义章, 张淑媛, 朱海生. 铜胁迫对小白菜叶肉细胞超微结构的影响[J]. 中国生态农业学报, 2008, 16(4): 948-951.
Lin Y Z, Zhang S Y, Zhu H S. Effect of copper stress on ultra-structure of mesophyll cells in Chinese cabbage[J]. Chinese Journal of Eco-Agriculture, 2008, 16(4): 948-951.
[11]林义章, 徐磊. 铜污染对高等植物的生理毒害作用研究[J]. 中国生态农业学报, 2007, 15(1): 201-204.
Lin Y Z, Xu L. Physiological toxicity of copper pollution to higher plant[J]. Chinese Journal of Eco-Agriculture, 2007, 15(1): 201-204 .
[12]Ouzounidou G. Root growth and pigment composition in relationship to element uptake in Silene compact Plants treated with copper[J]. Plant Nutrition, 1994, 17(6): 933-943.
[13]史庆华, 赖齐贤, 朱祝军, 等. 一氧化氮在植物中的生理功能[J]. 细胞生物学杂志, 2005, 27(1): 39-42.
Shi Q H, Lai Q X, Zhu Z J,etal. The physiological function of nitric oxide in plant[J]. Chinese Journal of Cell Biology, 2005, 27(1): 39-42.
[14]余肇端. 外源NO缓解黄瓜、 油菜幼苗镉胁迫的生理效应[D]. 泰安: 山东农业大学硕士论文, 2010.
Yu Z D. Physiological alleviating effects of exogenous nitric oxide on the cucumber and Chinese cabbage seedlings under cadmium stress[D]. Tai’an: MS Thesis of Shandong Agricultural University, 2010.
[15]Wang M L, Bi H G, Liu P P,etal. Molecular cloning and expression analysis of the gene encoding sedoheptulose-1, 7-bisphosphatase fromcucumisstativus[J]. Scientia Horticulturae, 2011, 129(3): 414-420.
[16]樊洪泓, 李延春, 李正鹏, 等. 强光胁迫下外源NO对霍山石斛叶绿素荧光和抗氧化系统的影响[J].园艺学报, 2008, 35(8): 1215-1220.
Fan H H, Li Y C, Li Z P,etal. Effects of exogenous nitric oxide on the chlorophyⅡ fluorescence and antioxidant system of dendrobium huoshanense under high light stress[J]. Acta Horticulterae Sinica, 2008, 35(8): 1215-1220.
[17]张义凯, 崔秀敏, 杨守祥, 等. 外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响[J]. 应用生态学报, 2010, 21(6): 1432-1438.
Zhang Y K, Cui X M, Yang S X,etal. Effects of exogenous nitric oxide on active oxygen metabolism and photosymthetic characteristics of tomato seedling under cadmium stress[J]. Chinese Journal of Applied Ecology, 2010, 21(6):1432-1438.
[18]钟韬韬. 外源NO对铜胁迫玉米幼苗生理生化特性的影响[D]. 南昌: 南昌大学硕士论文, 2012.
Zhong T T. Physiological and biochemical effects of exogenous nitric oxide on seedlings of maize (ZeamaysL.) under copper stress[D]. Nanchang: MS Thesis of Nanchang University, 2012.[19]Fox B S, Walsh C T. Mercuric reductase: homology to glutathione reductase and lipoamide dehydrogenase.Iodoacetamide alkylation and sequence of the active site peptide[J]. Biochemistry, 1983, 22(17): 4082-4088.
[20]Dunford R P, Catley M A, Raines C A,etal. Expression of wheat sedoheptulose-1, 7-bisphosphatase inE.coliand affinity purification of functional protein[J]. Protein Expression and Purification, 1998, 14(1): 139-145.
[21]Nishizawa A N, Buchanan B B. Enzyme regulation in C4 photosynthesis. Purification and properties of thioredoxin-linked fructose bisphosphatase and sedoheptulose bisphosphatase from corn leaves[J]. Journal Biological Chemistry, 1981, 256(12): 6119-6126.
[22]崔金霞. 一氧化氮和MAPK在油菜素内酯诱导黄瓜抗氧化防御中的作用[D]. 杭州: 浙江大学博士论文, 2010.
Cui J X. The role of nitric oxide and MAPK in brassinosteroids-induced antioxidant defense inCucumissativus[D]. Hangzhou: PhD Dissertation of Zhejiang University, 2010.
[23]王丽娜, 杨凤娟, 王秀峰, 等. 外源NO对铜胁迫下番茄幼苗生长及其抗氧化酶编码基因mRNA转录水平的影响[J]. 园艺学报, 2010, 37(1): 47-52.
Wang L N, Yang F J, Wang X F,etal. Effects of exogenous nitric oxide on growth and transcriptional expression of antioxidant enzyme mRNA in tomato seedings under copper stress[J]. Acta Horticulturae Sinica, 2010, 37(1): 47-52.
[24]陈蕤, 崔盛, 唐江川, 等. NO对百草枯胁迫下玉米胚根氧化损伤的效应[J]. 云南农业大学学报, 2006, 21(4): 479-485.
Chen R, Cui S, Tang J C,etal. Effects of treatment of nitric oxide (NO) on active oxygen species damages in maize radical under MV stress[J]. Journal of Yunnan Agricultural University, 2006, 21(4): 479-485.
Effects of exogenous nitric oxide onSBPasegene expression characteristics and photosynthetic rate ofBrassicachinensisL. under copper stress
YE Li-ping, ZHONG Feng-lin, LIN Yi-zhang*, LIN Lin-lin
(CollegeofHorticulture,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
【Objectives】 In order to provide a theoretical basis for comprehensive understanding mechanism of adding exogenous nitric oxide(NO) to alleviate the decline of net photosynthetic rate(Pn), the gene of sedoheptulose-1, 7-bisphosphatase (SBPase) which is one of the key enzymes to restrict RuBP regeneration in calvin cycle was cloned, and the different expression of theSBPasegene inBrassicachinensisL. leaves under copper stress and adding theSNPwas analyzed combined with the net photosynthetic rate changes. 【Methods】 TheSBPasegene ofBrassicachinensisL. was cloned by RT-PCR, and seedlings ofBrassicachinensisL. (named Shanghai green) with three to four real leaves were used as materials. Copper concentration was 200 μmol/L, and the SNP concentration was 300 μmol/L. At the same time, four related groups were set to exclude the disruptive factors. The Pn and the expression ofSBPasegene ofBrassicachinensisL. leaves at the same position and moment after the treatment of 0, 4, 8 and 12 days were determined. The environmental conditions of the experiment were light intensity, 200 μmol/(m2·s); photoperiod, 12 h; and temperature, 25℃/18℃.【Results】1) The sequence of the open reading frame ofSBPase gene is 1182bp, encoding 393 amino acids. The molecular weight of the predicted protein is 42.34kD and the theoretical isoelectric point is 5.85. 2) The sequence analysis show that it contains a redox active site and a 59-amino acid chloroplast transfer peptide. The amino acid sequence has high homology with other SBPase separated from other species. 3) The qRT-PCR analysis show that theSBPasegene expression inBrassicachinensisL.leaves is declined under copper stress, and with time extending the degree of decline is aggravated. Besides, the expression ofSBPasegene is increased after the addition of NO. 4) The application of exogenous NO increases the Pn ofBrassicachinensisL. leaves under the copper stress, and the variation tendency of Pn and the expression ofSBPasegene are in a good agreement. 【Conclusions】The expression ofSBPasegene inBrassicachinensisL. leaves is changed under the copper stress and the addition of NO, which may be one of the causes of the change of Pn inBrassicachinensisL. under the copper stress and the addition of NO.
BrassicachinensisL.; copper stress; NO; sedoheptulose-1,7-bisphosphatase; real-time PCR
2014-12-08接受日期: 2015-05-28网络出版日期: 2015-09-29基金项目: 福建省大宗蔬菜产业体系(2012K83139294); 福建省自然科学基金(2012j01082); 福建农林大学校重点建设项目(6112c0409)资助。
叶丽萍(1989—), 女, 福建浦城人, 硕士研究生, 主要从事蔬菜遗传育种方面的研究。 E-mail: yeliping1202@163.com
E-mail: lyz2003007@163.com
S634.3.601; Q945.78
A
1008-505X(2016)03-0736-08

