蛋白质层析系统在实验教学中的应用
赵玉红, 李 欣, 崔建林, 赵立青, 李小菊, 李登文, 张金红, 周 浩
(1. 南开大学 生物实验教学中心, 天津 300071; 2. 南开大学 医学院, 天津 300071)
蛋白质层析系统在实验教学中的应用
赵玉红1, 李欣1, 崔建林2, 赵立青1, 李小菊1, 李登文1, 张金红1, 周浩1
(1. 南开大学 生物实验教学中心, 天津300071; 2. 南开大学 医学院, 天津300071)
设计“KTAprimeplus蛋白质层析系统纯化绿色荧光蛋白(GFP)”的综合实验,以GFP蛋白为研究对象,在大肠杆菌中大量表达重组GFP蛋白,经镍柱亲和层析、离子交换层析以及凝胶过滤层析3种常用层析技术逐步纯化,各步纯化样品经SDS-PAGE鉴定分析,最终获得高纯度的GFP蛋白。通过该实验使学生深入、全面、系统地掌握生命科学研究中最新的蛋白质分离纯化技术,提高学生的科研水平和综合能力。
蛋白质层析系统; 蛋白质分离纯化; 镍柱亲和层析; 离子交换层析; 凝胶过滤层析
随着生命科学进入后基因组时代,蛋白质成为新的研究热点[1-2],研究蛋白质对了解生命规律、指导工业生产、医药实践有着重大的理论与实践意义[3]。蛋白质的分离纯化是蛋白质研究的基础,获得高纯度且具有生物活性的蛋白质是研究其结构、功能与应用的前提。利用层析技术分离纯化蛋白质所用条件温和,不影响蛋白质原有的结构和生物活性,因而成为目前分离纯化蛋白质的主要技术手段[4-5]。蛋白质层析系统为层析技术及其过程提供了稳定、准确、可靠的自动化平台,能够快速实现蛋白质的高效分离与纯化,推进了以蛋白质研究为代表的一系列重大科学研究的进展,在科研以及生产实践中有着广泛的应用[6-9]。生命科学类学生掌握利用蛋白质层析系统及各种先进的层析技术分离纯化蛋白质非常必要。
绿色荧光蛋白(greenfluorescentprotein,GFP)是一种在美国西北海岸所盛产的水母中所发现的一种蛋白质。在其包含238个氨基酸的序列中,第65—第67个氨基酸(丝氨酸—酪氨酸—甘氨酸)残基可自发地形成一种荧光发色团[10-11],广泛应用于蛋白质表达纯化、蛋白质相互作用、蛋白质细胞内定位示踪和模式生物转基因等生物学研究中[12]。设计“KTAprimeplus蛋白质层析系统纯化绿色荧光蛋白(GFP)”的实验,以GFP蛋白为研究对象,在大肠杆菌中大量表达重组GFP蛋白,采用镍柱亲和层析、离子交换层析以及凝胶过滤层析3种常用层析技术逐步纯化,并利用SDS-PAGE凝胶电泳进行蛋白纯度鉴定。
1 实验仪器
2 实验材料与试剂
实验材料:重组表达质粒(pET.M-GFP),大肠杆菌感受态细胞BL21(DE3)。
试剂:氨苄青霉素,IPTG,Tris,EDTA,NaCl,NiSO4,乙醇,MilliQ水,PMSF,SDS,过硫酸铵,TEMED,考马斯亮兰R250,甲醇,乙酸,蛋白质LoadingBuffer,低分子量蛋白Maker等。
预装层析柱:镍亲和层析柱(HisTrapTMHP),分子筛层析柱(HiPrepTM16/60SephacrylTMS-200HR),离子交换柱(HiTrapTMDEAEFF,HiTrapTMCMFF)。
3 实验方法
3.1表达GFP重组蛋白
将重组表达质粒(pET.M-GFP)转化大肠杆菌感受态细胞BL21(DE3),转化后在100μg/mL氨苄青霉素的LB平板上,37 ℃过夜孵育;挑取转化的单克隆菌落于5mL含有100μg/mLAmp的液体LB培养基中培养,220r/min,37 ℃,直至浑浊;再将5mL的LB培养液转移到1L含有100μg/mLAmpLB培养基中继续培养,220r/min,37 ℃,至OD值达到0.6;冰水混合物中降温30min,每升菌液加300μL、1mol/L的IPTG,终浓度为300μmol/L,220r/min,16 ℃,诱导16~20h;5 000r/min,离心15min。
3.2GFP蛋白纯化
3.2.1菌体超声破碎
用30mLNi柱结合缓冲液A(5mmol/L咪唑,500mmol/LNaCl,50mmol/LTris-HClpH7.9)重悬菌体沉淀,转移至50mL离心管,添加蛋白酶抑制剂PMSF(1mmol/L);将菌悬液冰上预冷,超声破碎。程序:功率180W,超声5s,间歇6s,循环重复26次,直至菌液不黏稠;破碎完成后,12 000r/min,4 ℃,离心40min。
3.2.2Ni亲和层析
用Ni亲和层析柱对裂解液上清进行初步纯化;用结合缓冲液A平衡预装HisTrapTMHP柱至基线平稳,上样,用结合缓冲液A冲洗Ni柱直至UV值不再变化;将洗脱缓冲液B(1.0mol/L咪唑,500mmol/LNaCl,50mmol/LTris-HCl,pH7.9)和结合缓冲液A形成咪唑梯度(设定程序:200mL,B:0~100%)洗脱目的蛋白;5mL每管收集蛋白洗脱液,SDS-PAGE电泳检测,收集目的蛋白溶液,用Amicon浓缩筒浓缩。
3.2.3凝胶过滤层析
将浓缩后的蛋白样品进一步经凝胶过滤柱纯化。HiPrepTM16/60SephacrylTMS-200HR柱(柱体积120mL)用BufferA(BufferA:50mmol/LTris-HCl、pH7.5,50mmol/LNaCl,1mmol/LEDTA,1mmol/LDTT)平衡1个柱体积;将浓缩后的蛋白样品上样,以2mL每管收集洗脱液,SDS-PAGE电泳检测,收集目的蛋白。
3.2.4离子交换层析
将收集的蛋白样品再进一步经离子柱纯化。(1)BufferA(50mmol/LTris-HCl、pH7.5,50mmol/LNaCl,1mmol/LEDTA,1mmol/LDTT)平衡预装HiTrapTMDEAEFF阴离子交换柱至基线平衡,将凝胶过滤层析纯化后的蛋白样品上样,用BufferA冲洗直到UV值降到不再变化。BufferB(50mmol/LTris-HCl、pH7.5,1mol/LNaCl,1mmol/LEDTA,1mmol/LDTT)洗脱目的蛋白;2mL每管收集蛋白洗脱液,SDS-PAGE电泳检测,收集目的蛋白溶液。(2)预装HiTrapTMCMFF阳离子交换柱操作方法同(1)。
3.2.5SDS-PAGE凝胶电泳
配制5%的浓缩胶和12%的分离胶[13]。取10μL样品与等体积2×蛋白loading混匀后,煮沸5min,冷却上样;稳压80V,待样品从浓缩胶进入分离胶后,将电压调至160V,待指示染料迁移至下沿约1cm处停止电泳。电泳结束后,加入0.25%考马斯亮蓝染液(考马斯亮蓝R250 2.5g,无水乙醇250mL,冰乙酸80mL,水 670mL),微波炉高火煮2min;染色完毕,用水漂洗凝胶,微波炉水煮15min,2~3次,直至凝胶蓝色背景退去、蛋白条带清晰为止[14-15]。
3.2.6GFP蛋白保存
将纯化好的蛋白溶液用Amicon浓缩筒浓缩到一定浓度,然后用nanodrop2000紫外分光光度计测定浓度,分装之后保存到-80 ℃冰箱备用。
4 结果与分析
4.1Ni亲和层析图谱及SDS-PAGE检测
重组表达的GFP蛋白在N端带有6个组氨酸标签,组氨酸与金属镍具有很强的亲和作用,因此本实验首先采用镍亲和层析对蛋白样品进行初步纯化。根据监测图(见图1),发现紫外吸收从第3管开始有升高迹象,在第7、第8管达到峰值,到第10管恢复到基线,于是对洗脱下来的3—10号管中的蛋白样品进行SDS-PAGE电泳检测(见图2)。实验结果表明,镍柱亲和纯化效果良好,GFP蛋白样品中还存在少许杂蛋白,需进一步纯化处理;通过与分子量Marker进行比较发现,GFP蛋白分子量约为27kDa,与理论值相符;其中第6—第8号管中GFP蛋白比较富集且纯度较高,收集这3管蛋白,用Amicon浓缩筒浓缩至5mL,准备进一步纯化处理。
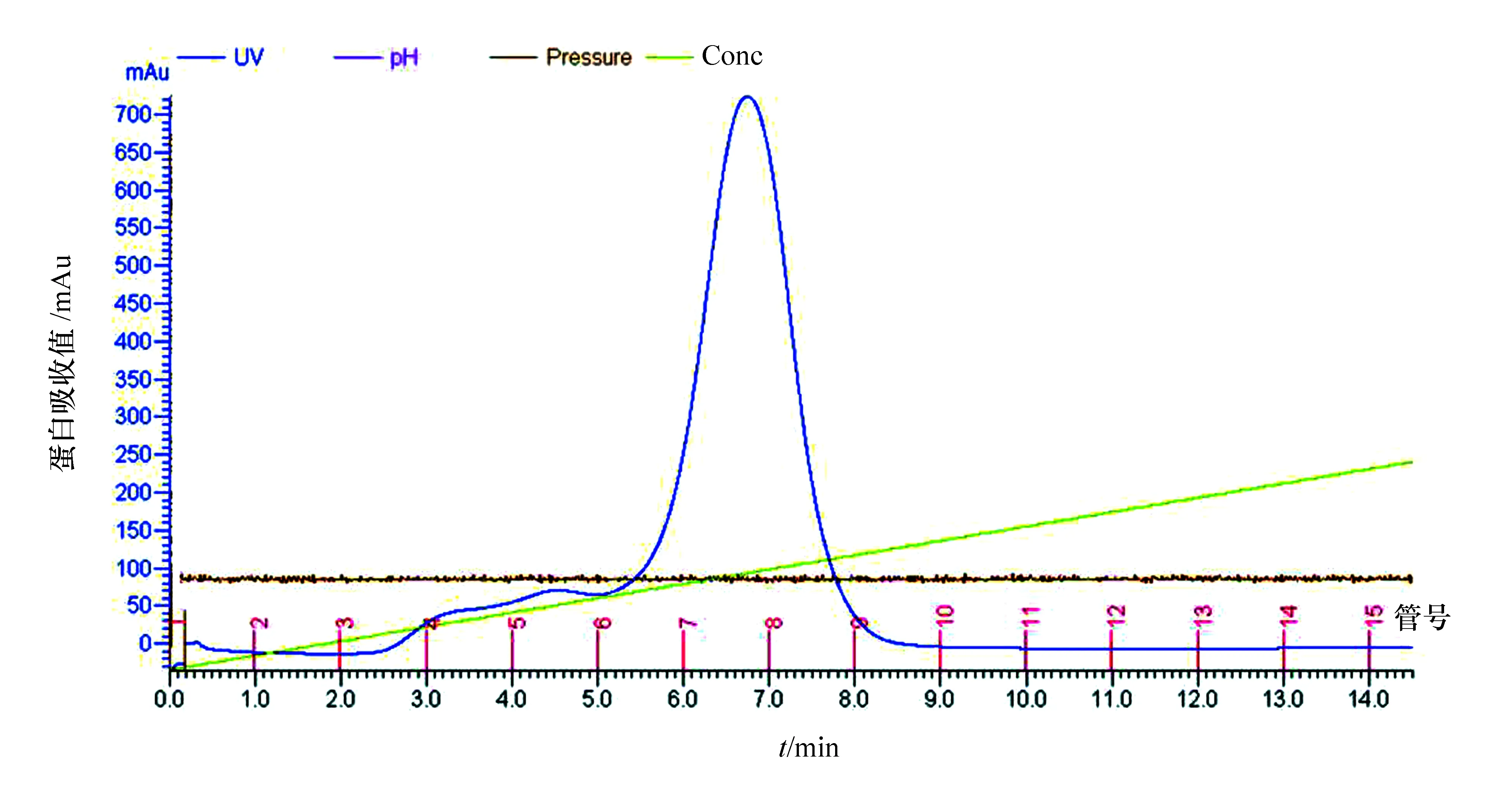
图1 Ni亲和层析监测图
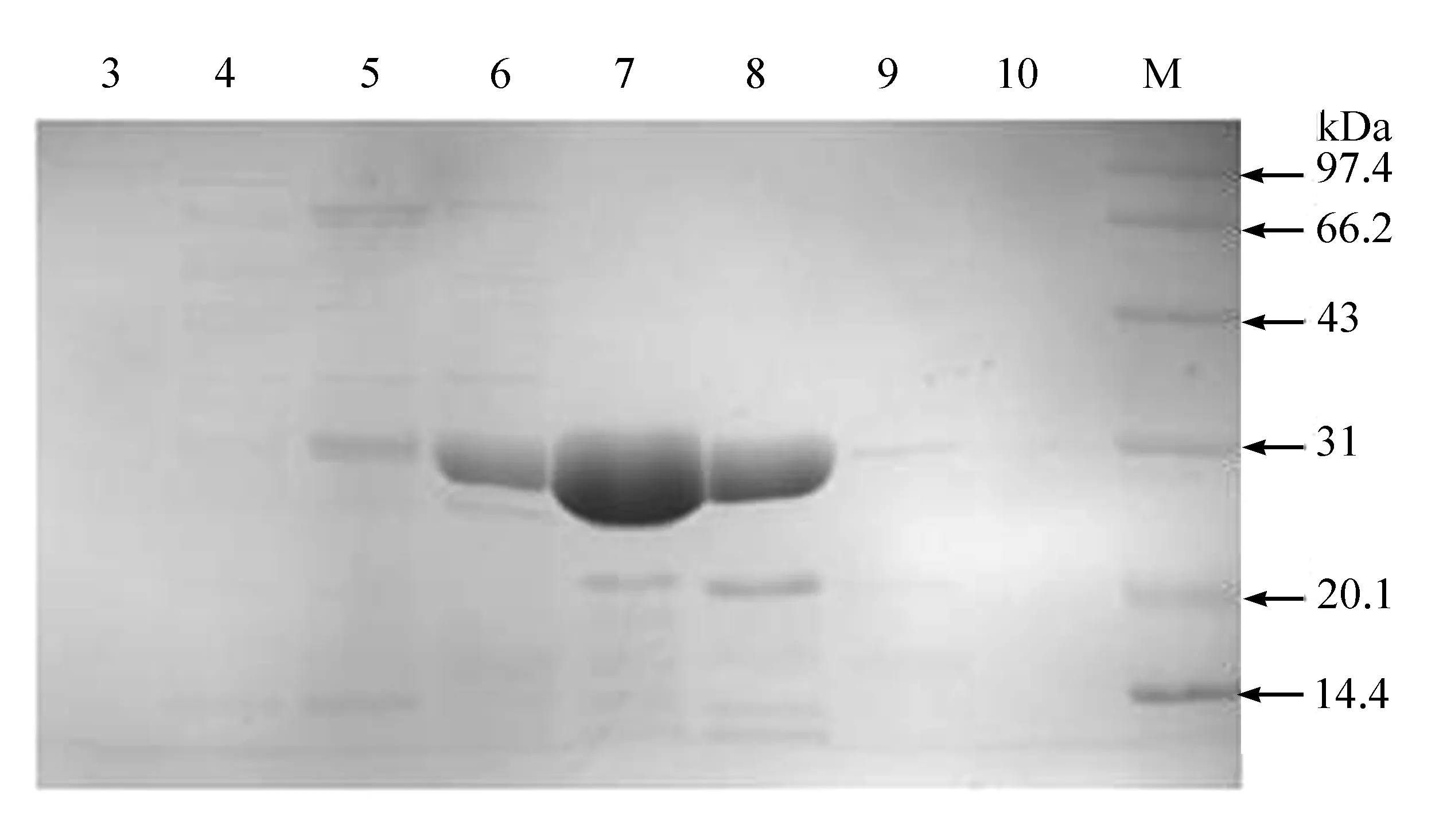
图2 Ni亲和层析纯化得到的GFP蛋白SDS-PAGE电泳结果
4.2凝胶过滤层析图谱及SDS-PAGE检测
将浓缩后的GFP蛋白进一步进行凝胶过滤层析纯化,从监测图(图3)可以看出,出现两个紫外吸收峰,从出峰位置以及峰面积可以大概判断后面的主峰应该是GFP蛋白,前面的小峰可能是分子量大的杂蛋白,也可能是GFP蛋白的聚集体。另外,GFP蛋白的峰形相对比较对称,表明蛋白构象相对较好。图中的红色线代表的是电导,间接表明了缓冲液的成分,GFP蛋白峰与后面的盐峰分得非常开,表明GFP蛋白已经彻底通过凝胶过滤层析置换到预先平衡的低盐缓冲液中,从而除去样品中存在的大量咪唑和高浓度的NaCl,以利于下一步的离子交换层析。取30—38号管进行SDS-PAGE电泳检测,结果见图4,结果显示蛋白纯度进一步提高。

图3 HiPrepTM 16/60 SephacrylTM S-200 HR凝胶过滤监测图
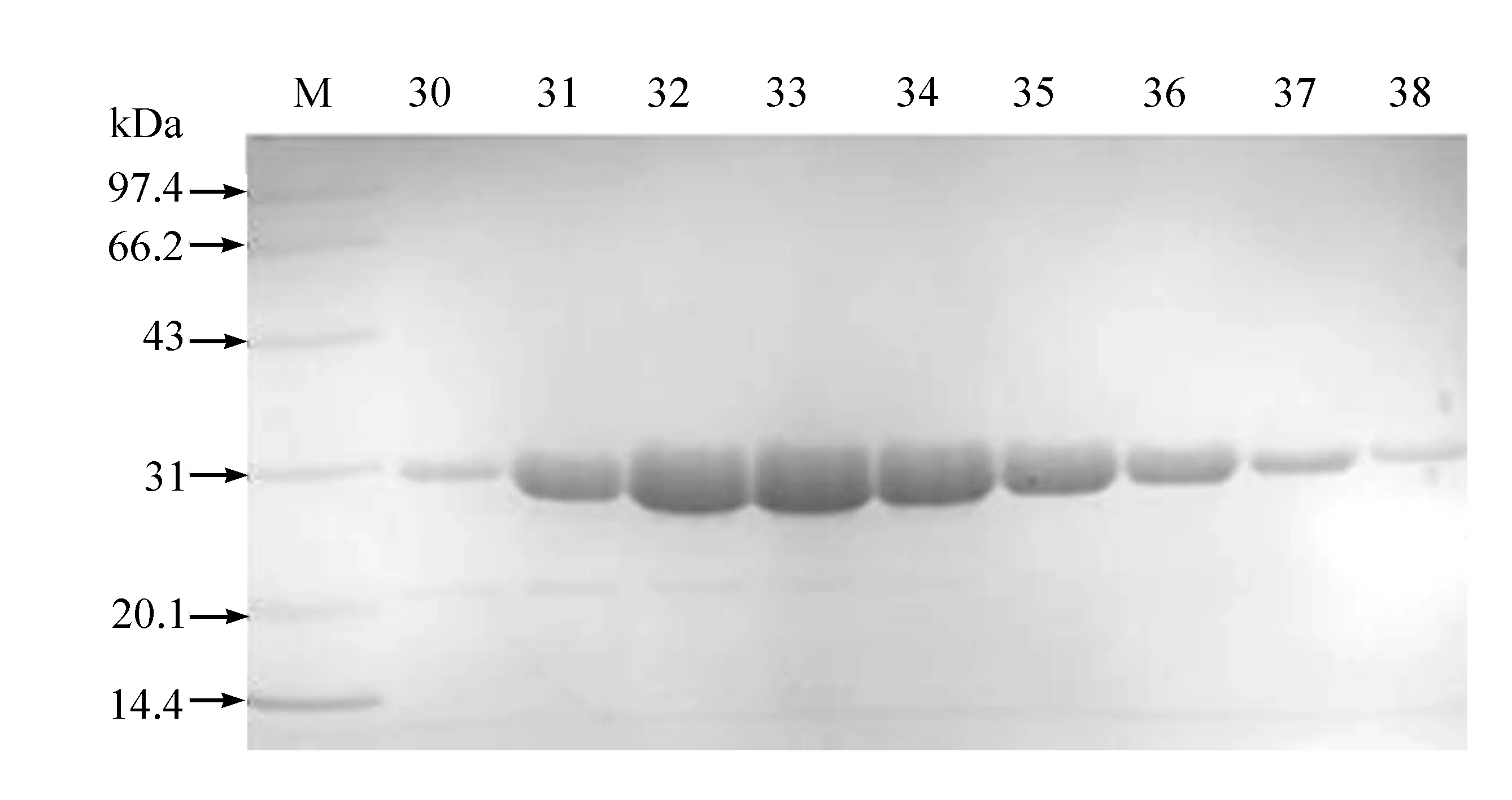
图4 凝胶过滤层析纯化得到的GFP蛋白SDS-PAGE电泳结果
4.3离子交换层析图谱及SDS-PAGE检测
将凝胶过滤后的GFP蛋白分成两份,再进一步用
离子交换层析进行其带电性的分析。首先尝试CM阳离子交换柱,发现GFP蛋白全部流出来,而没有结合到柱子上,因为蛋白质本身能发出荧光,用肉眼很容易观察到。GFP蛋白在pH7.5、50mmol/LNaCl的条件下没有与CM阳离子交换柱结合,表明在此条件下GFP蛋白所带电荷为负,因此采用DEAE阴离子交换柱。由图5可看出,通过颜色明显观察到GFP蛋白结合到DEAE柱,设定程序,利用离子强度梯度把结合的GFP蛋白洗脱下来,图5中的红色线是电导线,表明在洗脱过程中离子强度是逐渐升高的。根据监测图(图5),对8—16号管中蛋白样品进行SDS-PAGE检测并收集,结果见图6。结果表明,收集的蛋白样品纯度很高,达到了分离纯化GFP蛋白的目的。
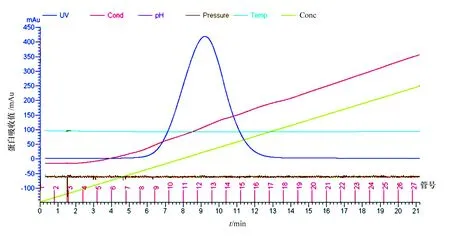
图5 HiTrapTM DEAE FF阴离子交换监测图
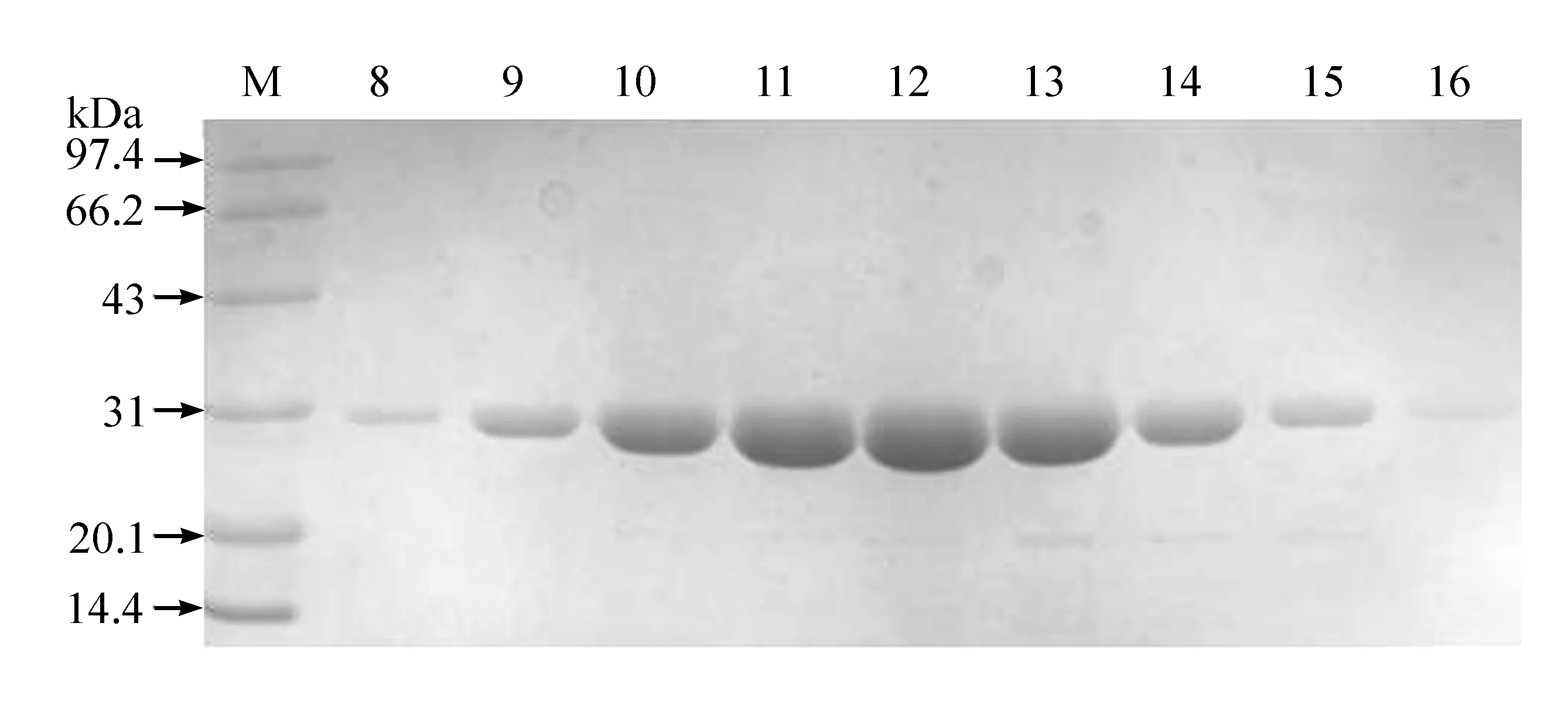
图6 离子交换层析纯化得到的GFP蛋白SDS-PAGE电泳结果
4.4蛋白浓缩与浓度检测
将经DEAE柱收集的蛋白样品浓缩至1mL,用nanodrop2000进行浓度测定,结果吸光度A280为5.0左右,表明1L大肠杆菌最后得到了约5mg的高纯度的重组GFP蛋白。
4.5注意事项
(1) 层析系统中所用buffer及样品等均需要脱气、过0.45μm滤膜处理,系统中不能有气泡。
(2) 实验结束后用20%乙醇冲洗管道,直至所有管道充满20%乙醇。
(3) 实验中确保层析柱承受压力不要超过其能耐受的最大压力。
(4) 镍柱使用后,可以用Stripingbuffer(50mmol/LTris-HCl、pH7.9,200mmol/LEDTA,500mmol/LNaCl)结合Chargebuffer(50mmol/LNiSO4),对镍柱进行恢复和再生。
5 结论
(1) 本实验综合运用科研工作中常用的亲和层析、凝胶过滤层析和离子交换层析对目的蛋白进行逐级纯化。GFP蛋白带有His标签,首先采用亲和层析,去除大部分杂蛋白,再根据GFP蛋白的分子大小
和带电荷性质,进一步经凝胶过滤层析和离子交换层析纯化,最终获得大量高纯度的GFP蛋白。
(2) 凝胶过滤层析是蛋白纯化技术中常用的层析技术,实验中使学生明确凝胶过滤层析操作不仅具有纯化意义,还有将蛋白样品置换至所需溶液以及分析蛋白构象的作用。
(3)GFP带负电荷,可以结合阴离子柱,在分离纯化过程中应该使用阴离子交换柱。但在离子交换层析实验中,为模拟科研实践,将GFP视为未知蛋白,采用阴阳两种离子交换层析柱进行探究性实验,培养学生的科研能力和综合素质。
(4) 实验对象GFP蛋白使得整个实验过程中样品及流动相的流路形象、直观,有助于学生对所学知识及相关实验技能的理解和掌握。
(5)SDS-PAGE凝胶电泳技术是生物学实验中常用的一项重要技术,通过该实验,可使学生充分掌握该项技术并学会综合运用。
通过精心设计,使学生深入、全面、系统地掌握生命科学研究中最新的蛋白质分离纯化技术并学会灵活运用,进而掌握一般生物大分子的分离纯化技术,提高学生的科研水平和综合能力。
References)
[1] 牛瑞,秦胜利.蛋白质分离纯化技术研究进展[J].化工科技市场,2010,33(4):16-17.
[2] 巩红飞,柳军玺,邸多隆.蛋白质组学研究中的分离分析技术及其研究进展[J].氨基酸和生物资源,2014,36(20):12-17.
[3] 王子佳,李红梅,弓爱君,等.蛋白质分离纯化方法研究进展[J].化学与生物工程,2009,26(8):8-10.
[4] 史伟,禹婷.蛋白质的层析分离[J].内蒙古农业科技,2011(1):110-112.
[5] 陈金波.蛋白质层析系统的使用与维护[J].生命科学仪器,2013(11):44-46.
[6] 金昊.MCUR1蛋白的表达纯化以及晶体初筛[J].南开大学学报:自然科学版,2015,48(2):42-45.
[7] 张莉丽,张兰威,杜明,等. 凝胶层析和离子交换层析结合法纯化高盐发酵液中谷氨酰胺转胺酶[J].分析化学研究报告,2012,40(8):1225-1230.
[8] 胡涛,安艳,吕群丹,等. 拟南芥SPX1 蛋白原核表达及纯化分析[J].生物技术通报,2015,31(8):88-93.
[9] 黄健,黄美容,骆诗露,等. 肺炎链球菌SPD1587 蛋白的表达纯化及晶体生长研究[J].生物技术通报,2015,31(7):226-230.
[10]ChalfieM,TuY,EuskirchenG,etal.GreenfluorescentProteinasamakerforgeneexpression[J].Science,1994,263:802-805.
[11]PrasherD,McCannRO,CormierMJ.CloningandexpressionofthecDNACodingforaequorin,abioluminescentcalcium-activatedprotein[J].BiochemBiophysResCommun,1985,126:1259-1268.
[12] 王青松,胡小倩. 绿色荧光蛋白的原核表达和纯化及鉴定的实验设计与实践[J].实验技术与管理,2014,31(5):38-41.
[13] 萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯T.分子克隆实验指南[M].金冬雁,译.2版.北京:科学出版社,1996.
[14] 郝福英,周先碗.生物化学与分子生物学实验[M].北京:高等教育出版社,2009.
[15] 于自然,黄熙泰,李翠风.生物化学习题及实验技术[M].北京:化学工业出版社,2003.
Applicationofproteinchromatographysysteminexperimentalteaching
ZhaoYuhong1,LiXin1,CuiJianlin2,ZhaoLiqing1,LiXiaoju1,LiDengwen1,ZhangJinhong1,ZhouHao1
(1.BiologicalExperimentalCenter,NankaiUniversity,Tianjin300071,China;2.CollegeofMedicine,NankaiUniversity,Tianjin300071,China)
Thecomprehensiveexperimentof“AKTAprimeplusproteinchromatographysystempurifyinggreenfluorescentprotein(GFP) ”,wasdesigned.Thehigh-purityGFPproteinwillbepurifiedfromEscherichia colibynickelaffinitychromatography,ionexchangechromatographyandgelfiltrationchromatographycombinedwithSDS-PAGEanalysis.Students’scientificresearchlevelandcomprehensiveabilitywillbeimprovedthroughdeeply,comprehensivelyandsystematicallymasteringthelatestproteinseparationandpurificationtechnology.
proteinchromatographysystem;proteinseparationandpurification;nickelaffinitychromatography;ionexchangechromatography;gelfiltrationchromatography
DOI:10.16791/j.cnki.sjg.2016.05.015
2015- 11- 04修改日期:2015- 12- 24
国家基础学科人才培养基金项目“南开大学生物学人才培养基地”(J1103503);国家基础学科人才培养基金“条件建设项目”(J1310003);南开大学2014年教学改革项目
赵玉红(1981—),女,山东青岛,硕士,实验师,从事生物化学和分子生物学实验教学工作
E-mail:zyh@mail.nankai.edu.cn
周浩(1981—),男,湖北荆门,博士,副教授,从事蛋白质结构与 功能研究以及基于蛋白质结构的工程应用.
E-mail:haozhou@nankai.edu.cn
G642.0;Q503
A
1002-4956(2016)5- 0048- 04

