超滤膜分离牡蛎多糖工艺研究
郑亚旭,石 璇,李欣遥,佟长青,李 伟
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
超滤膜分离牡蛎多糖工艺研究
郑亚旭,石 璇,李欣遥,佟长青*,李 伟*
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
[目的]获得制备牡蛎多糖的最佳分离工艺。[方法]利用超滤膜对牡蛎多糖进行分离,采用单因素及正交试验考察牡蛎多糖通过不同截留分子量超滤膜的分子量分布并优化超滤膜分离工艺。[结果] 试验表明,选择截留分子量10 kD的超滤膜分离牡蛎多糖,膜通量较好,截留液中牡蛎多糖的分子量为1.2×103kD,透过液中的分子量为4.4 kD。正交试验表明,影响膜通量的主要因素是料液温度,其次是膜分离操作压力,pH影响较弱。综合考虑生产成本及膜的使用寿命等多方因素,超滤膜分离最佳工艺为料液温度30 ℃、压力0.04 MPa、pH 7.0。[结论]研究可为工业化生产牡蛎多糖提供参考依据。
超滤膜;牡蛎多糖;最佳工艺;分子量分布
牡蛎是我国重要的养殖贝类,我国从南到北的沿海各地皆可产牡蛎。牡蛎具有较高的营养价值和保健功能。研究表明,牡蛎多糖是牡蛎的重要活性成分之一。牡蛎多糖具有保肝、增强免疫力以及抗流感病毒等生物活性[1-3]。对牡蛎多糖分离纯化研究是利用牡蛎多糖的重要步骤。多糖是结构复杂的生物大分子,使用膜分离技术对其进行分离可以达到高效分离的目的。从牡蛎中获得的多糖提取液往往还含有多种物质,如核酸、蛋白质、寡肽、氨基酸以及无机盐。因此,要获得纯度较高的牡蛎多糖产品,就需要利用简单、高效的方法将这些物质除去。超滤膜分离技术广泛应用于多糖的分离制备中,如汪维云等研究了利用超滤膜分离灰树花多糖的工艺[4];叶红等报道了马尾藻多糖的膜分离纯化[5];张曜武等研究了红松松塔多糖的膜分离工艺[6];杨宁等研究了仙人掌多糖的超滤膜分离提取工艺[7]。但对于牡蛎多糖的超滤膜分离提取工艺的研究还鲜见报道。
笔者利用超滤膜分离技术,对牡蛎多糖进行提取分离,探索牡蛎多糖膜分离工艺并进行优化,以期为牡蛎多糖工业化生产提供基础数据。
1 材料与方法
1.1材料牡蛎,购于大连兴工街农贸市场;Dextran T-10、Dextran T-40、Dextran T-70及Dextran T-500,购于美国Sigma公司;TSK-gel G4000PWXL柱,购于日本TOSOH公司。聚砜中空纤维膜(PS-10和PS-50)以及超滤膜装置,大连先路科技发展有限公司;UV-754紫外分光光度计,上海光谱仪器有限公司。
1.2方法
1.2.1牡蛎多糖提取液的制备。牡蛎多糖提取液按照修改的Shi等的方法进行制备[1]。将冻干的牡蛎(125 g)进行粉碎,按1∶40 g/mL(W/V)加入水,在90~100 ℃进行提取,在6 000 r/min离心15 min,所得上清液为牡蛎多糖提取液,将其pH调为7。
1.2.2多糖含量测定。利用苯酚-硫酸法测定牡蛎多糖提取液中的糖含量[8]。
1.2.3分子量测定。使用双蒸水配制5 mg/mL的Dextran T-10、Dextran T-40、Dextran T-70及Dextran T-500的标准葡聚糖溶液,以孔径0.45 μm水膜过滤后,使用TSK-gel G4000 PWXL色谱柱,通过P230型高效液相色谱仪,以双蒸水为洗脱液,流速0.6 mL/min,进行洗脱。以苯酚-硫酸法检测各个组份的糖含量,绘制葡聚糖分子量标准曲线。
以双蒸水配制浓度为30 mg/mL样品溶液,以孔径0.45 μm水膜过滤后,使用TSK-gel G4000 PWXL色谱柱,通过P230型高效液相色谱仪,以双蒸水为洗脱液,流速0.6 mL/min,进行洗脱。以苯酚-硫酸法检测各个组份的糖含量。
1.2.4膜的选择。将浓度1 g/L的牡蛎多糖提取液在0.10 MPa压力下和25 ℃条件下分别用截留分子量50 kD(PS-50)和10 kD(PS-10)进行超滤,测定膜通量。
1.2.5超滤膜分离工艺研究。分别在20、25、30、35以及40 ℃时,在0.10 MPa压力下进行牡蛎多糖提取液膜分离,测定浓缩液和透过液的多糖含量,计算截留率。
分别在0.01、0.04、0.07、0.10、0.13 MPa压力条件下,在25 ℃进行牡蛎多糖提取液膜分离,测定浓缩液和透过液的多糖含量,计算截留率。
分别在pH为5.0、5.5、6.0、6.5及7.0时,在0.10 MPa压力下和25 ℃条件下进行浓度1 g/L的牡蛎多糖提取液的膜分离,测定浓缩液和透过液的多糖含量,计算截留率。
1.2.6正交试验设计。 考察牡蛎多糖提取液温度、操作压力、pH 3个因素对膜通量和截留率的影响,每个因素取3个水平,因素水平设计见表1。按照3因素3水平进行正交试验,获得最佳膜通量工艺。
表1牡蛎多糖提取液超滤膜分离正交试验因素水平
Table 1Factors and levels in orthogonal array design for extraction of polysaccharides fromCrassostreagigasby ultrafiltration membrane separation
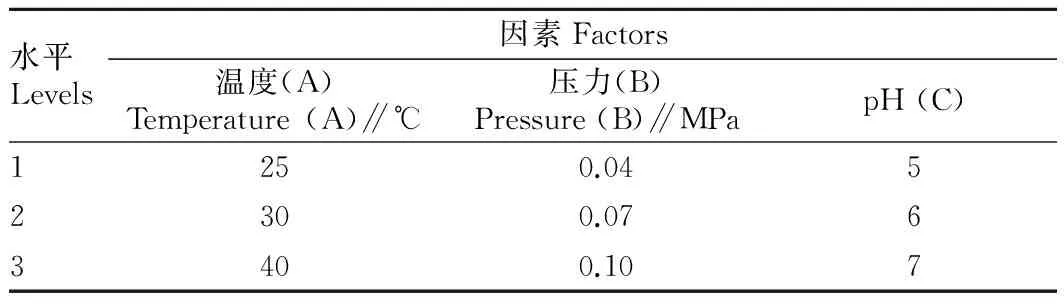
水平Levels因素Factors温度(A)Temperature(A)∥℃压力(B)Pressure(B)∥MPapH(C)1250.0452300.0763400.107
2 结果与分析
2.1超滤膜分离特性将浓度1 g/L的牡蛎多糖提取液在
0.10 MPa压力下和25 ℃条件下分别用截留分子量50和10 kD进行超滤,其通量变化见图1,截留情况见表2。不同截留分子量的膜,其超滤通量也不同,采用10 kD的膜可获得较好的截留效果。
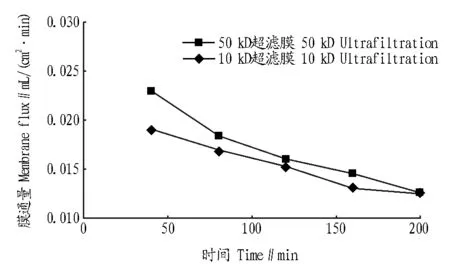
图1 超滤时间对膜通量的影响Fig.1 Effect of ultrafiltration time on membrane flux
牡蛎多糖通过截留分子量10 kD的超滤膜,截留液中牡蛎多糖的分子量为1.2×103kD(图2A),透过液中的分子量为4.4 kD(图2B)。牡蛎多糖通过截留分子量50 kD的超滤膜,截留液中牡蛎多糖的分子量为2.1×103kD(图2C),透过液中的分子量为3.1 kD(图2D)。多糖溶液的分子状态对外界的影响很敏感[9]。因此,使用截留分子量不同的超滤膜,超滤膜截留的牡蛎多糖分子量不同。

表2 不同超滤膜对牡蛎多糖的截留率

注:A.通过截留分子量10 kD超滤膜时,截留液中牡蛎多糖的分子量;B.通过截留分子量10 kD超滤膜时,透过液中牡蛎多糖的分子量;C.通过截留分子量50 kD超滤膜时,截留液中牡蛎多糖的分子量;D.通过截留分子量50 kD超滤膜时,透过液中牡蛎多糖的分子量。Notes:A.molecular weight of CGPS in cut-off liquor when passing through ultrafiltration membranes with molecular weight cut off 10 kD;B.molecular weight of CGPS in permeate liquor when passing through ultrafiltration membranes with molecular weight cut off 10 kD;C.molecular weight of CGPS in cut-off liquor when passing through ultrafiltration membranes with molecular weight cut off 50 kD;D.molecular weight of CGPS in permeate liquor when passing through ultrafiltration membranes with molecular weight cut off 10 kD.图2 通过截留分子量10、50 kD的超滤膜时截留液与透过液中牡蛎多糖分子量Fig.2 Molecular weight of CGPS in cut-off liquor and permeate liquor using ultrafiltration membranes with molecular weight cut off 10 kD and 50 kD
2.2温度的影响料液操作压力0.10 MPa,温度升高,料液流通量增大,因为在一定范围内,黏度随着温度上升而下降,溶解度变大;截留率却随着温度升高而降低,可能是因为膜截留性能和溶液的理化性质随着温度的升高而变化,温度对10 kD膜的超滤通量和截留率的影响见表3。综合考虑膜性能及截留率等多种因素来选择温度,因此,选择25 ℃作为超滤时温度较适宜。
表3温度对超滤膜截留率的影响
Table 3Effect of temperature on rejection ratio of ultrafiltration membrane

温度Temperature∥℃膜通量Membraneflux∥mL/(cm2·min)截留率Rejectionratio∥%200.0111±0.001186.1±0.3250.0193±0.002985.4±0.5300.0300±0.001083.2±0.4350.0317±0.001281.2±0.3400.0336±0.000380.3±0.3
2.3压力的影响料温25 ℃的料液、浓度为1.0 g/L条件下,不同压力对超滤的影响如表4所示,随压力增大,料液通过量增大,但截留率随着压力上升反而下降。
表4压力对超滤膜截留率的影响
Table 4Effect of pressure on rejection ratio of ultrafiltration membrane

压力PressureMPa膜通量Membraneflux∥mL/(cm2·min)截留率Rejectionratio∥%0.010.0160±0.000391.3±0.80.040.0177±0.001689.0±0.20.070.0203±0.000887.0±0.80.100.0235±0.000483.6±0.20.130.0241±0.000776.8±1.6
2.4pH的影响1.0 g/L的粗多糖液用冰乙酸调节pH。在25 ℃、0.10 MPa压力下超滤特征见表5。在pH 7.0(料液为中性)条件下膜通量最大,浓缩倍数高,可能与不同pH时,多糖的溶解度不同有关。

表5 pH对超滤过程的影响
2.5正交试验结果由表6所知,RA>RB>RC,各因素对超滤膜通量的影响顺序大小依次为:提取液温度、操作压力、pH,最佳组合为A3B1C2,即超滤膜最佳工艺条件为料液温度为40 ℃,压力为0.04 MPa,pH 6.0。
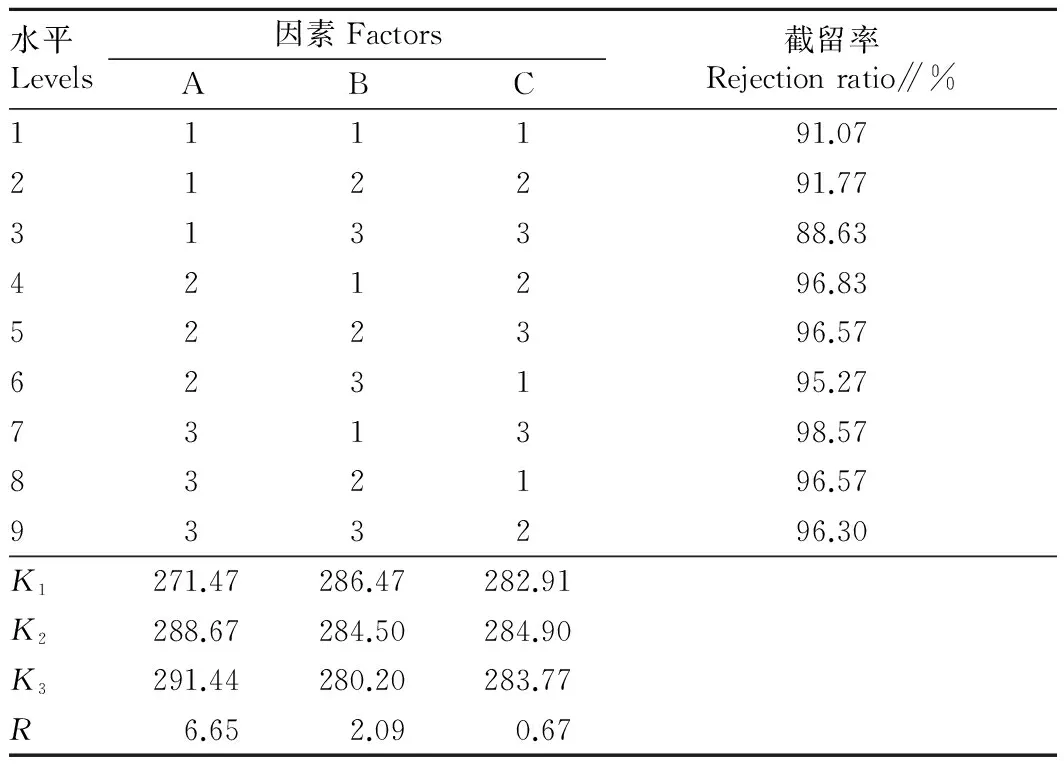
表6 牡蛎多糖提取液超滤膜分离正交试验结果
3 结论与讨论
超滤膜分离方式已被广泛应用于各种物质的分离,它具有不损害分离物质的活性、分离效率高、能耗低、设备简单、可连续生产、无污染等优点。但膜分离技术也存在一定的问题,如膜的污染与使用寿命。该试验利用膜分离工艺进行牡蛎多糖提取液浓缩分离,为下一步牡蛎多糖产品的生产提供了高效、节能的工艺条件。
选择截留分子量10 kD的中空纤维聚砜膜分离牡蛎多糖,膜通量较好。正交试验结果表明,影响膜通量的主要因素为料液温度,其次是膜分离操作压力,pH影响较小,最佳组合为A3B1C2,即超滤膜分离时采用料液温度为40 ℃,压力为0.04 MPa,pH 6.0。综合考虑生产成本及膜的使用寿命等多方因素,采用超滤膜分离时料液pH 7.0、料温30 ℃、压力为0.04 MPa为膜分离优化最佳工艺条件。该研究结果可以为工业化生产牡蛎多糖提供重要的数据依据。
[1] SHI X,MA H,TONG C,et al.Hepatoprotective effect of a polysaccharide fromCrassostreagigason acute and chronic models of liver injury[J].International journal of biological macromolecules,2015,78:142-148.
[2] 王俊,姚滢,张建鹏,等.牡蛎多糖的制备和生物学活性研究[J].医学研究生学报,2006,19(3):217-220.
[3] 李志.牡蛎多糖的分离纯化及生物学活性研究[D].福州:福建农林大学,2009.
[4] 汪维云,施燕,时宏斌,等.超滤膜分离灰树花多糖的工艺条件优化[J].食品与发酵工业,2010,36(4):190-193.
[5] 叶红,周春宏,曾晓雄,等.马尾藻多糖的膜分离纯化[J].湖北农业科学,2011,50(2):375-377.
[6] 张曜武,冯雪.膜分离制备红松松塔多糖的研究[J].中国林副特产,2013,10(5):18-21.
[7] 杨宁,赵谋明,崔春,等.仙人掌多糖的超滤膜分离提取及其影响因素[J].华南理工大学学报(自然科学版),2007,35(4):42-45.
[8] DUBOIS M,GILLES K A,HAMILTON I K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical chemistry,1956,28(3):350-356.
[9] 李国有.基于原子力显微镜的多糖分子聚集行为、单分子形貌的可视化和多糖/量子点多层膜的制备[D].广州:暨南大学,2006.
Optimization Process for Separation of Polysaccharides fromCrassostreagigasUsing Ultrafiltration Membrane
ZHENG Ya-xu, SHI Xuan, LI Xin-yao, TONG Chang-qing*, LI Wei*
(College of Food Science and Engineering, Dalian Ocean University, Dalian, Qingdao 116023)
[Objective] To optimize the methods of separating polysaccharides fromCrassostreagigas(CGPS). [Methods] Ultrafiltration membrane was used, single factor and orthogonal experiment were carried, and the molecular weight distribution and process of CGPS were studied. [Results] Results indicated that the flux of ultrafiltration membrane with molecular weight cut off of 10 kD was was better. The CGPS cut off by the membrane hasmolecular weight with 1.2×103kD, and the permeate liquor has molecular weight of 4.4 kD. The orthogonal tests showed the main influencing factors are temperature of solution and operating pressure, while pH had less influence. In overall consideration of the life of membrane and production costs, the optimum technology of ultrafiltration are temperature 30 ℃, operating pressure 0.04 MPa and pH 7.0. [Conclusion] This study is expected to provide certain reference for extracting
Ultrafiltration membrane;Crassostreagigaspolysaccharides (CGPS); Optimum technology; Molecular weight distribution
海洋局公益性行业科研专项项目(201405017-03)。
郑亚旭(1992- ),女,吉林桦甸人,硕士研究生,研究方向:水产品加工与贮藏工程。*共同通讯作者:佟长青,副教授,博士,从事活性物质研究;李伟,教授,博士,从事食品科学研究。
2016-05-25
S 985.3+5
A
0517-6611(2016)19-104-03

