小鼠γδ T细胞亚群在不同组织器官的分布特性及在感染后的变化①
胡 渊 李 燕 关 妘 张 彩
(山东大学药学院免疫药物学研究所,济南250012)
小鼠γδ T细胞亚群在不同组织器官的分布特性及在感染后的变化①
胡渊李燕关妘张彩
(山东大学药学院免疫药物学研究所,济南250012)
①本文受国家重点基础研究发展计划(973)项目(2013CB944901)和国家自然科学基金项目(81273220, 81472646, 91442114)资助。
目的:关注不同γδ T细胞亚群在各组织器官的分布特点及在鼠伤寒沙门氏菌肠道感染中的变化,为探讨γδ T细胞组织学分布的生理学意义和在感染性疾病中的作用提供依据和新的思路。方法:采用流式细胞术与PCR技术检测胸腺、脾脏、淋巴结、肝脏、皮肤以及小肠上皮内淋巴细胞中γδ T细胞及其不同亚群的比例;通过PMA与离子霉素体外刺激,流式细胞术检测不同组织γδ T细胞分泌细胞因子IFN-γ与IL-17a的差异;通过灌胃建立鼠伤寒沙门氏菌肠道感染模型,流式细胞术检测肝脏与小肠上皮内淋巴细胞中不同γδ T细胞亚群比例的变化。结果:γδ T细胞富含于小肠上皮内、皮肤与肝脏中,而在胸腺、脾脏与淋巴结中比例较低。不同亚群在各组织器官中的分布存在较大差异,皮肤主要存在Vγ5+γδ T细胞亚群,小肠中主要存在Vγ1+、Vγ4+与Vγ7+γδ T细胞亚群。肝脏γδ T细胞主要分泌IL-17a,而小肠上皮内γδ T细胞主要分泌IFN-γ。在鼠伤寒沙门氏菌肠道感染时,小肠上皮内γδ T细胞的比例明显升高,其中Vγ1+γδ T细胞比例升高更为显著;肝脏总γδ T细胞比例无显著变化,但Vγ1+γδ T细胞比例降低,Vγ4+γδ T细胞比例明显升高。结论:γδ T细胞富含于小肠、皮肤与肝脏中,且其不同亚群具有组织分布特异性。不同组织的γδ T细胞产生细胞因子的能力存在较大差异。鼠伤寒沙门氏菌感染时,小肠与肝脏γδ T细胞亚群的分布变化也存在较大差异。
γδ T细胞;组织分布;鼠伤寒沙门氏菌
T细胞在胸腺发育的早期发生TCR基因重排,形成具有巨大多样性特征的TCR库。根据T淋巴细胞表达TCR的不同,可以将T淋巴细胞分成两类,即表达αβ TCR的T细胞(αβ T细胞)和表达γδ TCR的T细胞(γδ T细胞)。γδ T细胞是固有免疫细胞的重要组成之一,在免疫防御、免疫监视及某些疾病(例如人类获得性免疫缺陷综合征、肿瘤和自身免疫性疾病等)的进程中扮演重要角色。多项研究表明,γδ T细胞在肠黏膜屏障抵抗病原菌的过程中发挥重要作用,在感染数小时内,即可快速、准确地迁移至受感染部位,杀伤受感染的上皮细胞,抑制病原菌的侵袭[1,2]。
γδ T细胞是一群异质性的细胞群体,根据其TCR γ或δ链使用的不同,将其分为多个亚群。从发现γδ T细胞至今,有多个命名系统被应用。这里我们采用Heilig与Tonegawa命名法则[3]对小鼠γδ T细胞进行分类。与αβ T细胞类似,γδ T细胞的发育过程中需要进行TCR基因重排,编码TCRγ链的基因座上含有V、J、C基因片段。早期研究发现小鼠TCRγ基因包含7个V基因片段,但由于与V3基因片段进行重排的J3与C3基因片段是假基因[4],故不存在Vγ3Jγ3Cγ3链。因此,根据γ链使用的不同,可将小鼠γδ T细胞分为6个亚群,分别为Vγ1+、Vγ2+、Vγ4+、Vγ5+、Vγ6+和Vγ7+γδ T亚群。简单来说,Vγ1+γδ T细胞主要发挥抑炎作用[5,6],而Vγ4+γδ T细胞主要发挥促炎作用[5],Vγ5+γδ T细胞主要分布于皮肤,对于皮肤创伤的修复起重要作用[7];Vγ7+γδ T细胞主要分布于小肠,对于肠道稳态的维持、免疫监视与病原菌的清除发挥关键作用[2]。目前,针对γδ T细胞发育与功能的研究相对较多,但是对于不同γδ T细胞亚群的组织分布特性未见详细系统的研究报道。因此本研究主要关注不同γδ T细胞亚群在各组织器官的分布特点及在鼠伤寒沙门氏菌肠道感染后的变化,以期为γδ T细胞的组织分布及在感染等相关疾病中的作用提供依据和新的思路。
1 材料与方法
1.1实验材料、试剂
1.1.1菌株鼠伤寒沙门氏菌,购自ATCC,编号14028。
1.1.2实验动物C57BL/6J小鼠,雄性,6~8周龄,购于北京华阜康生物科技股份有限公司。
1.1.3试剂FITC标记的γδ TCR抗体、Vγ1抗体、Vγ4抗体和Vγ5抗体,PerCP-Cy5.5标记的CD3e抗体,APC标记的γδ TCR抗体,均购自Biolegend公司。内标用固定穿膜试剂盒购自美国BD公司。离子霉素和佛波酯(Pbolmyristate acetate,PMA)购自Sigma公司。布雷菲德菌素A(Brefeldin A,BFA)购自碧云天公司。Trizol试剂和M-MLV反转录酶购自Invitrogene公司。Taq DNA聚合酶购自全式金公司。胶原酶Ⅱ购自Gibco公司。Percoll液购自GE Healthcare公司。分离小肠上皮内淋巴细胞所需的消化液配方为1 000 ml三蒸水中加入8 g NaCl、0.4 g KCl、0.152 g Na2HPO4·12H2O、0.06 g KH2PO4、0.175 g NaHCO3、1 g葡萄糖、1 mmol/L EDTA及1 mmol/L DTT。
1.1.4仪器流式细胞仪FACS Calibar,美国BD公司;普通PCR仪,Bio-Rad公司;离心机Centrifuge 5810R,Eppendorf公司;凝胶成像仪,Alphalmager公司。
1.2实验方法
1.2.1肝脏单个核细胞的分离摘眼球放血后颈椎脱臼处死小鼠,剪下肝脏,用PBS清洗干净后剪碎肝组织,经200目金属筛网研磨过滤后,700 r/min离心1 min,收集上层液体,弃沉淀。再1 200 r/min离心5 min,收集细胞沉淀。经40% Percoll液2 500 r/min密度梯度离心25 min后,留沉淀,弃上层液体。细胞沉淀中加入红细胞裂解液裂解红细胞,再经PBS洗涤后,即得肝脏单个核细胞。
1.2.2小肠上皮内淋巴细胞的分离处死小鼠,取出小肠,除去黏连的结缔组织,冲洗肠腔并将小肠外翻。将小肠剪成约1 cm的小段,放入10 ml消化液中,37 ℃,180 r/min振荡40~45 min。振荡完毕后,用尼龙柱和纱布进行过滤,收集滤液,1 200 r/min离心5 min,收集细胞沉淀。用3 ml 40% Percoll液悬起细胞沉淀,将其叠加到2 ml 70% Percoll液上,1 800 r/min梯度密度离心20 min后,吸取白色云雾状中间层细胞,再经PBS洗涤后,即得小肠上皮内淋巴细胞。
1.2.3皮肤淋巴细胞的分离剪取腹部及背部皮肤组织,剪去鼠毛及脂肪组织。将皮肤剪成小块,放入5 ml 含2 mg/ml胶原酶Ⅰ的PBS中,37℃,110 r/min振荡2 h。经200目金属筛网过滤后,再1 200 r/min离心5 min,收集细胞沉淀。用4 ml 40% Percoll液悬起细胞沉淀,将其叠加到4 ml 70% Percoll液上,2 200 r/min梯度密度离心25 min后,吸取白色云雾状中间层细胞,再经PBS洗涤后,即得皮肤淋巴细胞。
1.2.4脾脏、胸腺与淋巴结单个核细胞的分离摘眼球放血后颈椎脱臼处死小鼠,剪下脾脏、胸腺与腹股沟淋巴结,用PBS清洗干净后剪碎,分别经200目金属筛网研磨过滤后,1 200 r/min离心5 min,收集细胞沉淀,即得胸腺和淋巴结单个核细胞。脾脏细胞再经红细胞裂解液裂解,PBS洗涤后,即得脾脏单个核细胞。
1.2.5流式细胞术检测细胞表面标志将提取的细胞加入大鼠血清进行封闭,4℃,30 min。分别加入相应稀释的荧光抗体,4℃避光染色30 min。加入PBS离心洗涤,除去未结合的抗体,加入适量PBS悬起细胞沉淀,上机检测。
1.2.6胞内细胞因子的检测将细胞沉淀重悬于含10%新生牛血清的RPMI1640完全培养基中,接种于12孔板内,加入终浓度为30 ng/ml PMA与1 μg/ml离子霉素,37℃ 5%CO2孵育1 h后加入终浓度为10 ng/ml 的BFA,继续孵育3 h。收集细胞,经PBS洗涤后,加入大鼠血清封闭,加入外标抗体染色,避光,室温染色1 h。胞内固定穿膜按BD公司试剂盒说明书的步骤执行,加入内标抗体,经洗涤后,悬起细胞,上机检测。
1.2.7半定量RT-PCR检测不同Vγ链的表达Trizol法提取细胞总RNA,按M-MLV试剂说明书的步骤进行逆转录。按下列条件进行PCR扩增:94℃ 30s,55℃ 1 min,72℃ 1 min,38个循环后,72℃ 10 min,扩增结束后,进行琼脂糖凝胶电泳检测。由于TCRγ链转录时会发生TCR基因重排,通常6个V基因与J或D基因的重排组合是Vγ1Jγ4Cγ4、Vγ2Jγ2Cγ2、Vγ4Jγ1Cγ1、Vγ5Jγ1Cγ1、Vγ6Jγ1Cγ1、Vγ7Jγ1Cγ1[8]。PCR检测不同TCRγ链的引物组合策略见表1,引物序列见表2。
1.2.8鼠伤寒感染模型的建立采用灌胃方式建立鼠伤寒肠道感染模型[9]。鼠伤寒沙门氏菌的灌胃剂量是1×105CFU/只,空白对照组给予相同体积的LB培养基(0.2 ml)。
1.3统计学处理实验结果用GraphPad Prism 5软件进行统计,采用方差分析检验各组均数间差异的显著性,组间比较选用t检验,以P<0.05表示差异具有显著性。
2 结果
2.1不同组织器官γδ T细胞的比例检测我们首先用流式细胞术分别检测了成年小鼠胸腺、脾脏、淋巴结、肝脏、皮肤及小肠上皮内淋巴细胞中γδ T细胞的比例。如图1所示,胸腺、脾脏、淋巴结、肝脏、皮肤及小肠上皮内淋巴细胞中γδ T细胞的比例分别是0.18%±0.06%、0.67%±0.15%、0.63%±0.08%、1.81%±0.33%、9.36%±6.01%和34.10%±12.94%。肝脏、皮肤与小肠中γδ T细胞的比例明显高于其他免疫器官,差异有显著性。

表1 引物组合策略Tab.1 Primer combination strategy
2.2不同γδ T细胞亚群的组织分布我们利用流式细胞术与PCR技术分别检测了胸腺、脾脏、肝脏、皮肤与小肠中γδ T细胞亚群的分布。由于只能买到商品化抗Vγ1、Vγ4与Vγ5的单抗,所以我们通过流式细胞术检测了这三个亚群在不同器官的分布。同时结合PCR技术,检测了各器官中Vγ1、Vγ2、Vγ4、Vγ5、Vγ6与Vγ7的表达。流式细胞术检测结果显示,分布于小肠的γδ T细胞主要以Vγ1和Vγ4亚群为主,皮肤组织的γδ T细胞以Vγ5亚群为主(图2A)。PCR的结果显示,小肠IEL中γδ T细胞除Vγ1和Vγ4表达较高(与流式细胞术检测结果一致)外,Vγ7表达水平很高(与文献报道一致),胸腺与脾脏只表达Vγ1、Vγ2和Vγ4,而肝脏Vγ1~Vγ7均有表达(图2B)。PCR结果基本与流式细胞术检测的结果一致,并可补充流式细胞术不能检测的亚群情况。
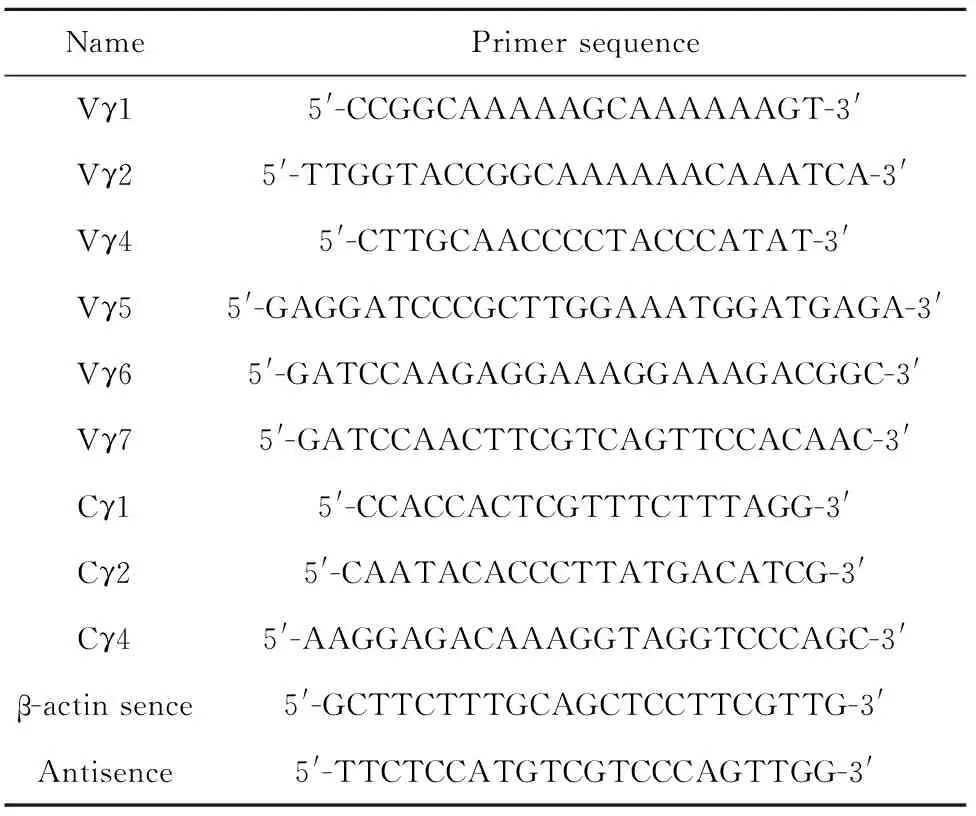
表2 引物序列Tab.2 Primer sequence
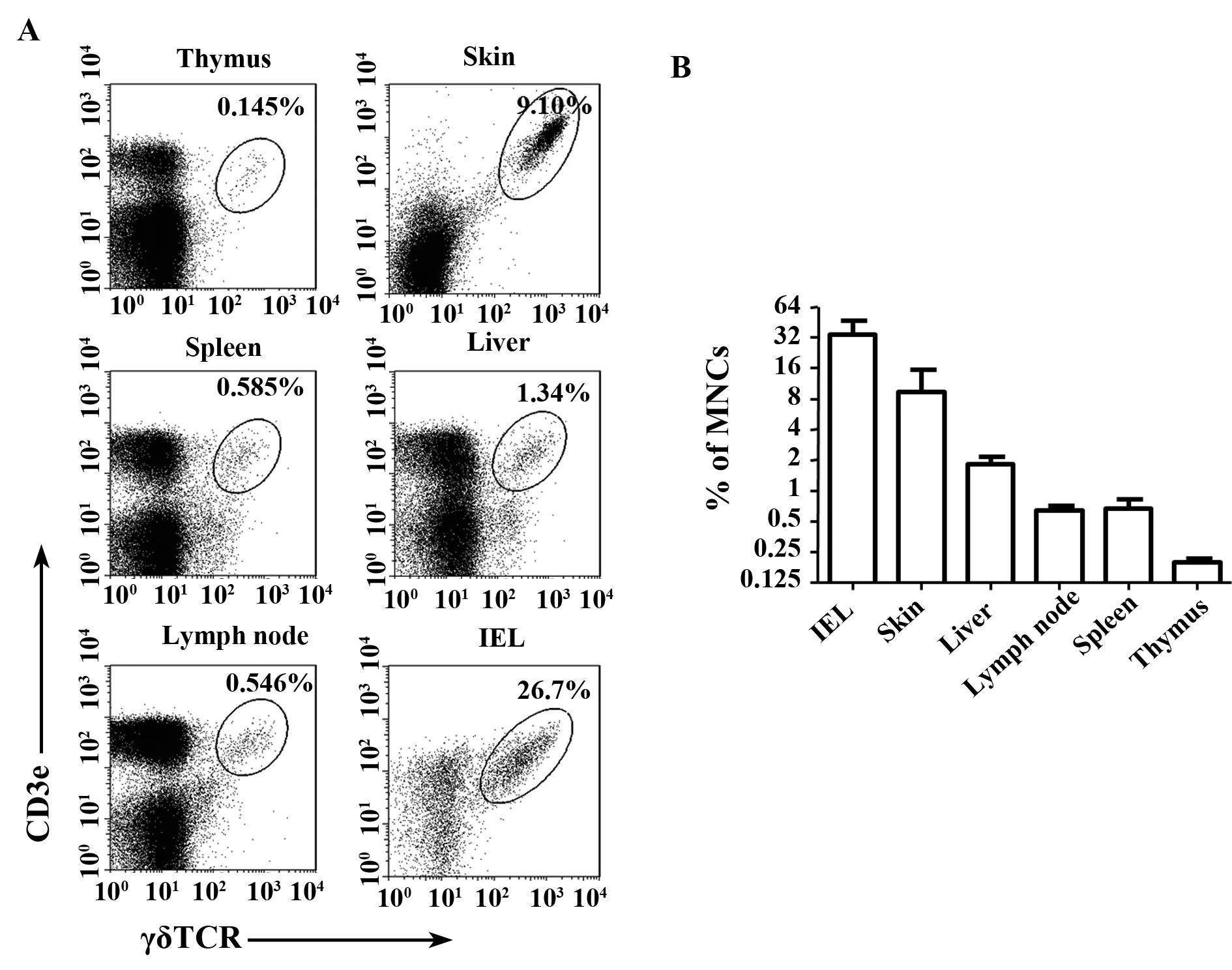
图1 流式细胞术检测各脏器中γδ T细胞的比例Fig.1 Flow cytometry detects proportion of γδ T cells in various tissues
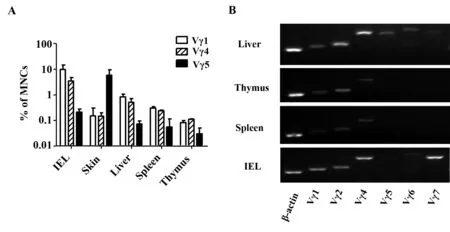
图2 流式细胞术及PCR技术检测γδ T细胞亚群的组织分布Fig.2 Flow cytometry and PCR technique analyzes distributions of different γδ T cell subsetsNote: A.FACS analyzes the proportion of Vγ1+,Vγ4+ and Vγ5+ γδ T cells in various tissues;B.PCR technique detects expression of Vγ1-Vγ7 mRNA in various tissues.

图3 流式细胞术检测不同部位γδ T细胞分泌的细胞因子Fig.3 Flow cytometry analyzes cytokine secretions of γδ T cells in various tissuesNote: A.FACS analyzes cytokine secretion of liver γδ T cells;B.FACS analyzes cytokine secretions of γδ T cells in various tissues.
2.3不同部位γδ T细胞分泌细胞因子的差异小鼠γδ T细胞按分泌细胞因子IFN-γ与IL-17能力的不同可以分为4个亚群:IFN-γ+γδ T细胞(又称γδ T1细胞)、IL-17+γδ T细胞(又称γδ T17细胞)、双阴的γδ T细胞与双阳的γδ T细胞。通过PMA与离子霉素的体外刺激,流式细胞术检测胞内细胞因子的分泌(图3),我们发现肝脏γδ T细胞分泌细胞因子的能力最强,且以分泌IL-17a为主(图3B)。脾脏γδ T细胞分泌IFN-γ与IL-17a的能力相当(图3B),胸腺γδ T细胞以分泌IL-17a为主(图3B),而IEL中γδ T细胞以分泌IFN-γ为主,几乎检测不到IL-17a的分泌(图3B)。
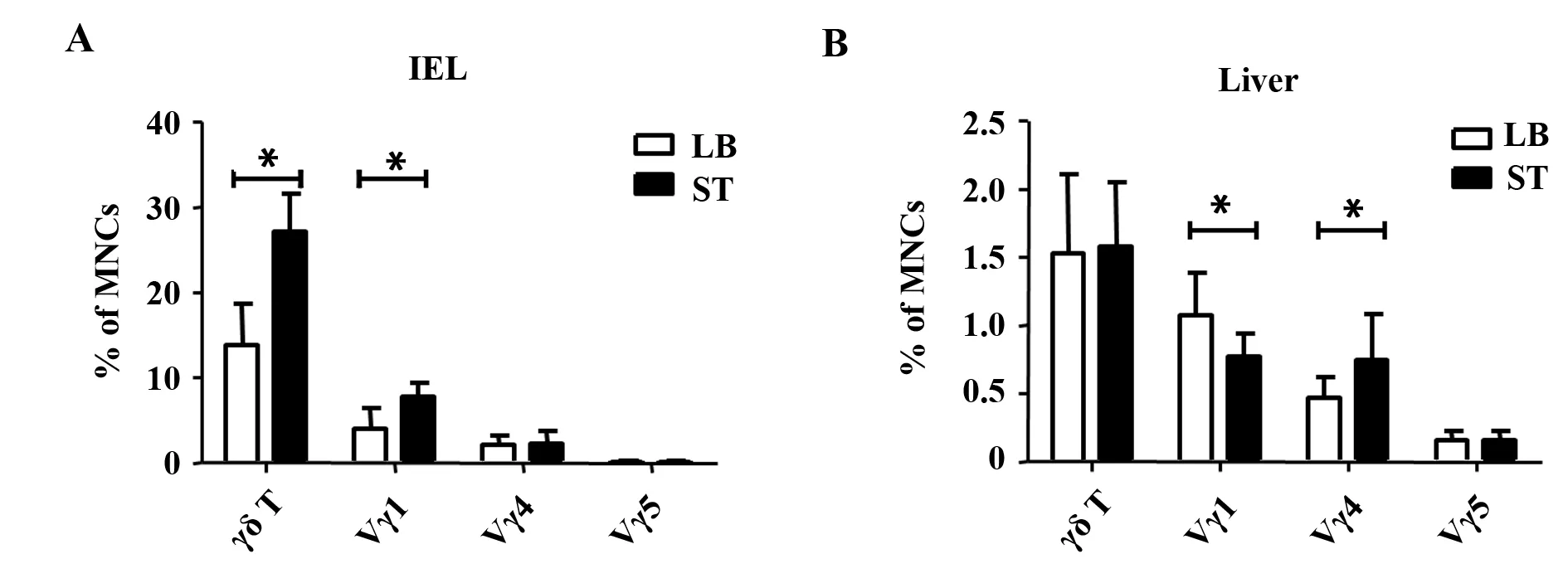
图4 流式细胞术检测伤寒感染后小肠与肝脏中γδ T细胞亚群的分布变化Fig.4 FACS analyzes distribution changes of various γδ T cell subsets in liver and small intestine after Salmonella typhimurium infectedNote: A.3 days after Salmonella typhimurium infected,FACS analyzes the proportion of Vγ1+,Vγ4+ and Vγ5+ γδ T cells in IEL;B.5 days after Salmonella typhimurium infected,FACS analyzes the proportion of Vγ1+,Vγ4+ and Vγ5+ γδ T cells in liver.
2.4伤寒感染后不同组织γδ T细胞亚群分布变化已有研究表明,γδ T细胞在免疫防御、免疫监视与某些疾病(例如病原菌感染[2]、肿瘤[10]与乙肝[11,12]等)的进程中扮演重要角色。为了探讨γδ T细胞在病理状态下不同亚群分布的变化,我们选用了鼠伤寒沙门氏菌肠道感染模型进行研究。流式细胞术检测结果显示,伤寒感染第3天时,感染组小肠IEL中γδ T细胞比例明显高于未感染对照组(P<0.05,图4A)。其中Vγ1+γδ T细胞亚群比例明显高于对照组(P<0.05,图4A),Vγ4+与Vγ5+γδ T细胞亚群比例未见明显变化(P>0.05,图4A)。伤寒感染第5天时,肝脏γδ T细胞比例未见明显差异(P>0.05,图4B),但Vγ1+γδ T细胞比例明显下降(P<0.05,图4B),Vγ4+γδ T细胞比例显著升高(P<0.05,图4B)。
3 讨论
胸腺是T细胞分化、发育的主要场所。αβ T与γδ T细胞来源于共同的前体细胞——淋巴样前体细胞。由于其表面不表达CD4与CD8分子,又将这群细胞称为DN细胞。根据其表面CD44和CD25分子的表达,将DN细胞分为4个阶段:DN1(CD44+CD25-)、DN2(CD44+CD25+)、DN3(CD44-CD25+)和DN4(CD44-CD25-)。DN细胞在DN3阶段经历一系列有序的TCR基因重排与表达,决定其分化方向。如果DN细胞进行Tcrb基因座重排,其会向αβ T细胞发育,而进行Tcrg、Tcrd基因座重排,其会向γδ T细胞发育。在胚胎时期,γδ T细胞就开始在胎胸腺内进行发育,并逐渐发育成熟,迁出胸腺至外周。
本研究发现,γδ T细胞富含于小肠、皮肤与肝脏中,在淋巴结、脾脏或胸腺中含量较低。小肠、皮肤与肝脏的一个共同特点是易于接触外界抗原或病原菌,以天然免疫占优势。我们发现,不同γδ T细胞亚群在这些器官中的分布具有差异性。小肠主要以Vγ1+、Vγ4+与Vγ7+γδ T细胞亚群为主,皮肤主要以Vγ5+γδ T细胞亚群为主,而肝脏中所有6个亚群均能检测到。在成年小鼠胸腺中检测不到Vγ5+、Vγ6+与Vγ7+γδ T亚群的存在,提示这三个亚群在成年小鼠个体中可能不是在胸腺内发育成熟的。已有研究表明,γδ T细胞存在胸腺外发育的现象,Vγ7+γδ T亚群可能是在小肠中发育而来的[13],而肝脏亦可能是胸腺外发育的器官之一[14]。那么是否存在这样的一个可能:在成年个体内,肝脏作为γδ T细胞胸腺外发育分化的场所,源源不断地维持着部分γδ T细胞亚群的更新。但是,由于肝脏独特的结构特点,有利于免疫细胞的驻留,所以不能排除肝脏中存在的γδ T细胞亚群是从其他器官迁移而来并在肝脏驻留的可能性。
γδ T细胞除了杀伤功能外,另一个重要的功能是分泌多种细胞因子,如IFN-γ、IL-17与TNF-α等[15]。通过胞内细胞因子的检测,我们发现,肝脏γδ T细胞分泌细胞因子的能力最强,且以分泌IL-17a为主;而小肠γδ T细胞分泌细胞因子的能力较弱,主要分泌IFN-γ。肝脏为具有免疫耐受特点的器官,其虽然能够通过肠系膜静脉接受肠道来源的大量外来抗原与微生物产物,却不引起严重的炎症应答。肝脏与小肠γδ T细胞接触相似的抗原刺激,产生细胞因子的能力却截然不同,这可能与γδ T细胞在其中发挥的功能不同相关。研究表明,小肠上皮内γδ T细胞在抵抗肠道外来病原体感染过程中发挥关键的保护作用,并参与保护肠黏膜的完整性、维持肠道微环境的稳态[9,16]。而肝脏γδT细胞是产生IL-17最为丰富的细胞,在HBV慢性持续性感染和肝癌模型均发现肝脏γδT细胞通过分泌IL-17诱导局部产生CXCL5,招募MDSC至炎症或肿瘤部位,通过诱导CD8+T细胞耗竭,参与维持HBV诱导的或肿瘤微环境的免疫耐受[10,11]。结合文献与我们的结果,我们推测,肠道γδ T细胞主要通过杀伤功能和分泌IFN-γ发挥重要的免疫监视作用,而肝脏γδ T细胞主要通过分泌IL-17a等细胞因子在维持肝脏局部免疫耐受中发挥关键作用。不同γδ T细胞亚群具有组织分布特异性,其在不同的组织部位及在不同的疾病模型中亦可能发挥不同的功能。通常认为,Vγ1+γδ T细胞具有抑炎作用,清除该亚群可增强小鼠对李斯特菌的清除能力[17]。研究发现,该亚群主要通过杀伤活化的巨噬细胞来控制炎症进程[18]。然而,Vγ4+γδ T细胞却对巨噬细胞具有活化作用,可促进巨噬细胞分泌TNF-α、IL-6与IL-10等细胞因子的能力[19]。在病毒介导的心肌炎模型中,也发现该亚群具有促进炎症的作用[20]。本研究发现,在伤寒感染时,肠道与肝脏γδ T细胞亚群的分布发生明显不同的变化,在感染第3天,小肠上皮内总的γδ T细胞的比例明显升高,尤其是Vγ1+γδ T细胞比例升高,而Vγ4+与Vγ5+γδ T细胞无变化,显示此时小肠γδ T细胞处于抑制炎症的状态。在感染第5天时,肝脏总的γδ T细胞比例虽无明显变化,但Vγ1+γδ T细胞比例下降,Vγ4+γδ T细胞比例升高,呈现了一种促进炎症的状态。小肠与肝脏中γδ T细胞变化的差异是否与不同组织γδ T细胞特性、伤寒感染的程度或免疫应答的进程相关还有待下一步的研究。
[1]Ismail AS,Severson KM,Vaishnava S,etal.Gamma delta intraepithelial lymphocytes are essential mediators of host-microbial homeostasis at the intestinal mucosal surface[J].Proc Natl Acad Sci USA,2011,108(21):8743-8748.
[2]Edelblum KL,Singh G,Odenwald MA,etal.Gamma delta intraepithelial lymphocyte migration limits transepithelial pathogen invasion and systemic disease in mice[J].Gastroenterology,2015,148(7):1417-1426.
[3]Heilig JS,Tonegawa S.Diversity of murine gamma genes and expression in fetal and adult T lymphocytes[J].Nature,1986,322(6082):836-840.
[4]Carding SR,Egan PJ.Gammadelta T cells:functional plasticity and heterogeneity[J].Nat Rev Immunol,2002,2(5):336-345.
[5]Andrew EM,Newton DJ,Dalton JE,etal.Delineation of the function of a major gamma delta T cell subset during infection[J].J Immunol,2005,175(3):1741-1750.
[6]徐银姬,苗姝,佟金平,等.V gamma 1+T淋巴细胞对气道变应性炎症和气道高反应性的调节[J].中国免疫学杂志,2009,25(7):617-621.
[7]Macleod AS,Havran WL.Functions of skin-resident gammadelta T cells[J].Cell Mol Life Sci,2011,68(14):2399-2408.
[8]Chien YH,Meyer C,Bonneville M.Gammadelta T cells:first line of defense and beyond[J].Annu Rev Immunol,2014,32:121-155.
[9]Li Z,Zhang C,Zhou Z,etal.Small intestinal intraepithelial lymphocytes expressing CD8 and T cell receptor gammadelta are involved in bacterial clearance during Salmonella enterica serovar Typhimurium infection[J].Infect Immun,2012,80(2):565-574.
[10]Ma S,Cheng Q,Cai Y,etal.IL-17a produced by gammadelta T cells promotes tumor growth in hepatocellular carcinoma[J].Cancer Res,2014,74(7):1969-1982.
[11]Kong X,Sun R,Chen Y,etal.GammadeltaT cells drive myeloid-derived suppressor cell-mediated CD8+T cell exhaustion in hepatitis B virus-induced immunotolerance[J].J Immunol,2014,193(4):1645-1653.
[12]常琳,王磊,彭辉,等.T细胞在急性乙型肝炎病毒感染小鼠模型中的变化分析[J].中国免疫学杂志,2014,30(1):18-29 .
[13]Hayday A,Gibbons D.Brokering the peace:the origin of intestinal T cells[J].Mucosal Immunol,2008,1(3):172-174.
[14]Ohteki T,Abo T,Seki S,etal.Predominant appearance of gamma/delta T lymphocytes in the liver of mice after birth[J].Eur J Immunol,1991,21(7):1733-1740.
[15]Shibata K,Yamada H,Nakamura R,etal.Identification of CD25+gamma delta T cells as fetal thymus-derived naturally occurring IL-17 producers[J].J Immunol,2008,181(9):5940-5947.
[16]Dalton JE,Cruickshank SM,Egan CE,etal.Intraepithelial gammadelta+lymphocytes maintain the integrity of intestinal epithelial tight junctions in response to infection[J].Gastroenterology,2006,131(3):818-829.
[17]O′Brien RL,Yin X,Huber SA,etal.Depletion of a gamma delta T cell subset can increase host resistance to a bacterial infection[J].J Immunol,2000,165(11):6472-6479.
[18]Dalton JE,Pearson J,Scott P,etal.The interaction of gamma delta T cells with activated macrophages is a property of the V gamma 1 subset[J].J Immunol,2003,171(12):6488-6494.
[19]Tramonti D,Andrew EM,Rhodes K,etal.Evidence for the opposing roles of different gamma delta T cell subsets in macrophage homeostasis[J].Eur J Immunol,2006,36(7):1729-1738.
[20]Huber SA,Graveline D,Newell MK,etal.V gamma 1+T cells suppress and V gamma 4+T cells promote susceptibility to coxsackievirus B3-induced myocarditis in mice[J].J Immunol,2000,165(8):4174-4181.
[收稿2015-10-29修回2016-01-05]
(编辑倪鹏)
Distinct distributions of mouse γδ T cells in various tissues and changes after infection
HU Yuan,LI Yan,GUAN Yun,ZHANG Cai.Institute of Immunopharmacology and Immunotherapy,School of Pharmaceutical Sciences,Shandong University,Ji′nan 250012,China
Objective:The study focuses on the distinct distributions of γδ T cells in various tissues and the changesafterSalmonellatyphimuriuminfection,and attempts to explore the physiological significance of γδ T cell distribution and the role of γδ T cells in infectious diseases.Methods: Flow cytometry and PCR technique were used to detect the proportion of different γδ T cell subsets among thymus,spleen,lymph nodes,liver,skin,and intestinal intraepithelial lymphocytes.Flow cytometry was applied to detect the secretion of IFN-γ and IL-17a.The changes of various γδ T cell subsets in liver and intestinal intraepithelial lymphocytes were analyze afterSalmonellatyphimuriuminfection.Results: γδ T cells were rich in the intestinal epithelium,skin and liver,but poor in the thymus,spleen and lymph nodes.The distribution of different subsets was quite dissimilar.Vγ5+γδ T cells chiefly existed in skin,and Vγ1+,Vγ4+,Vγ7+γδ T cells largely existed in small intestine.γδ T cells in liver mainly secreted IL-17a;however,γδ T cells in intestinal intraepithelial secreted IFN-γ.After infection by Salmonella typhimurium,the proportion of γδ T cells in intestinal intraepithelial increased significantly,particularly Vγ1+γδ T cells.In Liver,there was no significant change of total γδ T cell ratio,but the ratio of Vγ1+γδ T cells reduced,Vγ4+γδ T cells raised.Conclusion: γδ T cells are rich in the intestinal epithelium,skin and liver.The distribution of different subgroups has specificity.There are large differences in the ability of cytokine secretion among various subgroups of γδ T cells.The distribution of γδ T cell subgroups in small intestine and liver changes duringSalmonellatyphimuriuminfection.
γδ T cells;Tissue distribution;Salmonellatyphimurium
10.3969/j.issn.1000-484X.2016.08.005
R392.12文献标志码A
1000-484X(2016)08-1107-06
胡渊(1990年-),男,在读硕士,主要从事肝脏免疫学研究,E-mail:huyuan_tx@163.com。
及指导教师:张彩(1965年-),女,教授,博士生导师,主要从事天然免疫和肝脏免疫学研究,E-mail:caizhangsd@sdu.edu.cn。

