羊肚菌胞内多糖的提取及单糖组成分析*
矫丽曼
(辽宁省杨树研究所,辽宁 盖州115200)
羊肚菌胞内多糖的提取及单糖组成分析*
矫丽曼
(辽宁省杨树研究所,辽宁盖州115200)
以人工培养的羊肚菌菌丝为材料,通过单因素和正交试验的方法,筛选羊肚菌胞内多糖(MIP)的最佳提取方法,并用硅胶G薄层层析和高效液相色谱法对MIP纯品的单糖组分进行分析。结果表明,羊肚菌多糖最佳的提取工艺为加水倍数25倍、提取温度90℃、浸提时间2h、用95%乙醇沉淀多糖,其多糖得率为7.694%。其MIP由D-甘露糖和D-半乳糖两种单糖组成,摩尔比为1︰1.059。
羊肚菌;胞内多糖;提取工艺;薄层层析;高相液相色谱
进入21世纪后,中国林下经济迅速发展,林下经济产业能够大幅度提高林地的利用效率以及森林产业的综合效益,利用林地的资源优势,促进林下经济产业的深入发展,使其集约化、产业化、规模化发展,最终实现农民收入的增加,成为中国林业发展新的经济增长点。当前中国林下经济发展的基本模式主要包括森林景观利用、林下产品采集加工、林下养殖和林下种植等4种模式。其中林下种植,就是利用林下资源,适当地发展药类、菌类、牧草等种植类产品[1]。
中国真菌的半野生栽培技术已取得了成功,适合这种半野生栽培的菌种也很多。羊肚菌(MorchellaconicaFr)就是其中一种。羊肚菌(Morchella)是一种珍贵的食(药)用菌,具有补肾、补脑、提神的功能。多糖是其主要的功能成分,是一种有效的生物系统调节剂,具有较高的药用价值,可明显改善腰腿疼痛、手麻木、盘骨不舒等症状[2]。羊肚菌人工栽培最早成功的是1982年Ower等发明的羊肚菌(M.esculenta)人工栽培方法[3]。中国从20世纪80年代至今也有羊肚菌(M. spp.)栽培成功的报道[4~5],关明进行了林下羊肚菌栽培技术探索,实验采用改良的土豆培养基制作母种,选择以杨树(Populus)或桦树(Betula)为主的针阔叶林作为播种场地,种植羊肚菌获得成功[6]。刘红民对杨树林下羊肚菌菌种的制备及林下栽培方法进行了研究[7]。本文以人工培养的羊肚菌菌丝为材料,对羊肚菌胞内多糖的提取方法及其单糖组成进行了研究,以期为进一步研究杨树林下栽培的菌种及其多糖药用价值的开发利用提供参考。
1 材料与方法
1.1材料和试剂
1.1.1材料
羊肚菌购自中国科学院微生物研究所菌种保存中心。
1.1.2试剂
苯酚、硫酸、无水乙醇、硅胶G、甲醇、冰乙酸、氯仿、乙腈、苯胺、二苯胺、磷酸、鼠李糖、木糖、葡萄糖、半乳糖醛酸、甘露糖、果糖、半乳糖、蔗糖。
1.2仪器设备
DHG-9240(A)型鼓风干燥箱;LGJ-10型冷冻干燥仪;AL104型电子天平;HZQC型恒温浴振荡器;UV2501PC紫外分光光度计;高效液相色谱仪Waters 600(美国Water公司);Ultrahydrogel 2000和Ultrahydrogel 500色谱柱串联(美国沃特世公司);SPD-10A示差折光检测器(日本岛津公司);LC-10AT流动泵;层析柱(2.0cm×40cm)。
1.3方法
1.3.1多糖含量测定
采用苯酚-硫酸法测定多糖的含量[8]。
1.3.2羊肚菌胞内多糖(MIP)的基本提取方法[9]
取长满羊肚菌菌丝的发酵培养基,用纱布滤出菌丝,蒸馏水清洗3次,40℃干燥12h,粉碎后充分研磨,得到羊肚菌菌丝干粉。5g的羊肚菌菌丝干粉,加入20倍体积的水,在80℃条件下浸提2h,提取液4 000rpm离心15min,上清液经纱布过滤,滤液减压浓缩至原体积的1/3,浓缩液加入3倍体积的95%乙醇,沉淀12h。然后4 000rpm离心15min,沉淀在40℃下减压干燥即为羊肚菌胞内粗多糖。
1.3.3各提取因素对多糖得率的影响[10~11]
在基本提取方法的基础上,只改变一个条件,其他条件不变,每组试验3次重复,分别研究加水倍数(分别为5倍、10倍、15倍、20倍、25倍、30倍)、提取温度(分别为40℃、50℃、60℃、70℃、80℃、90℃)、浸提时间(分别为1h、2h、3h、4h、5h)、提取次数(分别为1次、2次、3次、4次、5次)、乙醇浓度(分别为70%、75%、80%、85%、90%、95%、100%)对羊肚菌胞内多糖得率的影响。
1.3.4正交试验法确定MIP的最佳热水提取法[12~13]
在单因素试验的基础上,根据各个因素对多糖得率影响的显著性程度以及各个因素的有效影响范围,选择显著的因素及其有效的水平,设计正交试验,来确定最佳的热水提取法。
1.3.5 不同提取方法对多糖得率的影响[14~15]
将最佳提取法中的热水分别替换0.1mol/L、0.2mol/L、0.3mol/L、0.4mol/L、0.5mol/L的盐酸溶液、氢氧化钠溶液和氯化钠溶液,每组试验3次重复。同热水提取法相比,研究稀酸、稀碱、稀盐提取法对多糖得率的影响。
1.3.6MIP的单糖组成分析
(1)单糖的水解[16~17]脱蛋白后的多糖溶液经DEAE-52纤维素柱层析和SephadexG-100凝胶柱层析进行分离纯化;用紫外光谱、醋酸纤维素薄膜电泳和SephadexG-200葡聚糖凝胶柱层析方法进行纯度鉴定,得到均一组分MIP纯品,用2mol/L的硫酸110℃水解,即为多糖的水解液。
(2)薄层层析法[18~20]取活化过的硅胶G薄板一块,依次点鼠里糖、木糖、葡萄糖、半乳糖醛酸、甘露糖、果糖、半乳糖溶液和多糖水解液,用冰乙酸︰氯仿︰水=35︰30︰5做展层剂。根据色斑颜色及Rf值即可初步鉴定出MIP水解液中含有的单糖样品。
(3)高效液相色谱法[21~23]将多糖的水解液用高效液相色谱分析,并与标准单糖对照,确定单糖的组成种类,计算各单糖的摩尔比。
2 结果与分析
2.1各提取因素对多糖得率的影响
2.1.1加水倍数对多糖得率的影响
加水倍数对多糖得率的影响见图1。
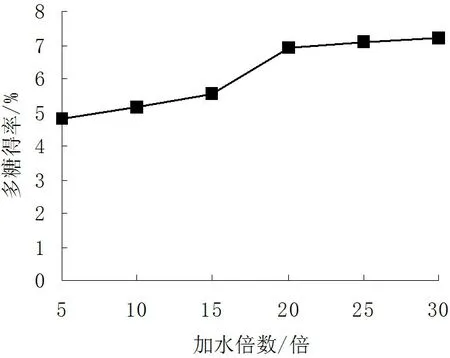
图1 加水倍数对多糖得率的影响
由图1可见,随着加水倍数的增加,多糖得率也随着逐渐增大。达到20倍后多糖得率增幅不大,而且随着加水倍数的增加,会增加后续提取液的浓缩工作量,因此,提取过程的加水倍数应选择20倍。
2.1.2提取温度对多糖得率的影响
由图2可见,随着提取温度的提高,多糖得率也逐渐增大;而且当温度达到80℃时,增幅较大,随后增幅明显减弱。因此提取温度应选择80℃。
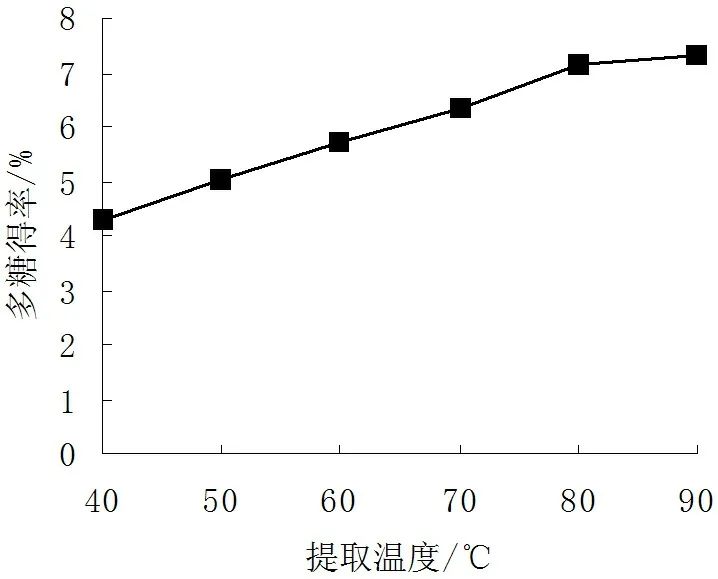
图2 提取温度对多糖得率的影响
2.1.3浸提时间对多糖得率的影响
由图3可见,随着提取时间的延长,多糖得率逐渐增大;当提取时间达到2h,多糖得率的增幅较大,随后其增幅变小。因此,提取时间应选择2h。
2.1.4提取次数对多糖得率的影响
由表1可见,随着提取次数的增加,多糖得率有逐渐增大的趋势,但增幅很小,从多糖得率上来看,提取5次与提取1次相比,多糖总得率只增加了0.324%,因此,可以确定提取次数对多糖得率的影响作用不明显,可以作为次要因素考虑。
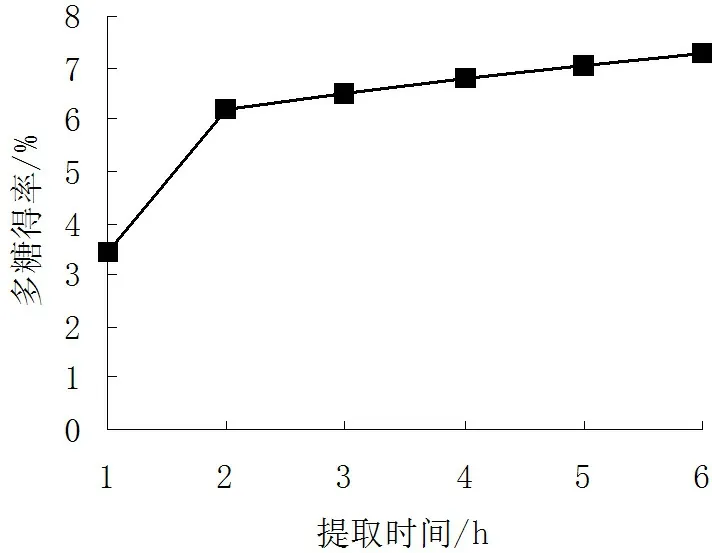
图3 浸提时间对多糖得率的影响

提取次数/次12345多糖得率/%6.8346.9987.0377.0827.158
2.1.5乙醇浓度对多糖沉淀效果的影响
由图4可见,随着乙醇浓度的增加,多糖得率逐渐增大,而且增大的幅度相同,因此提取过程的乙醇浓度应选择100%乙醇,即无水乙醇。
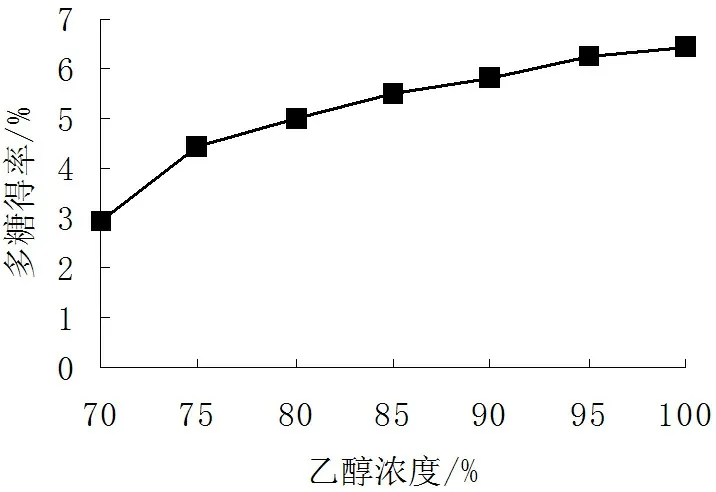
图4 乙醇浓度对多糖得率的影响
2.1.6正交试验结果
根据单因素试验的结果,确定加水倍数、浸提温度、提取时间、乙醇浓度为影响多糖得率的主要因素,而且确定各个因素的水平,其中加水倍数(A)分别为:20倍、25倍、30倍;浸提温度(B)分别为:70℃、80℃、90℃;提取时间(C)分别为:2h、3h、4h;乙醇浓度(D)分别为:90%、95%、100%。因此,正交试验采用L9(34)的方法(表2)进行试验,来确定最佳方法。
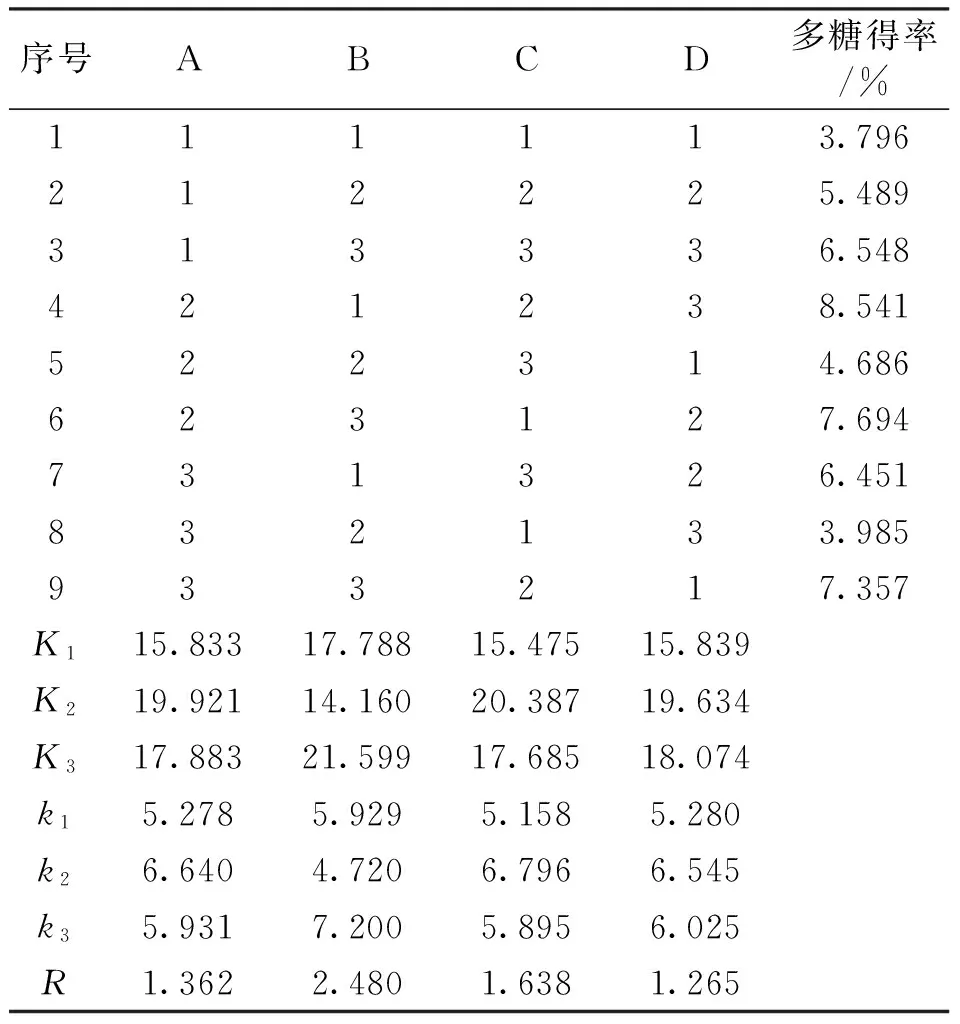
表2 正交试验及结果分析
注:A为加水倍数(倍),B为浸提温度(℃),C为提取时间(h),D为乙醇浓度(%),Ki表示任意列上水平号为i时所对应的试验结果之和,k表示平均值,R表示极差。
从表2的正交试验R值可以看出,A、B、C、D 4个因素对多糖得率的影响程度依次为:B>C>A>D。正交试验确定最佳多糖提取工艺为A2B3C2D2,即加水倍数为25倍、90℃、提取3h、用95%乙醇沉淀多糖。照正交试验确定的最佳组合A2B3C2D2,进行多糖提取试验,并设3次重复,此时粗多糖的平均得率为7.547%,与表2中的第6次试验A2B3C1D2的结果相比,A2B3C2D2组合的多糖得率略小于A2B3C1D2的多糖得率,因此,羊肚菌胞内多糖最佳提取工艺为:A2B3C1D2。即加水倍数为25倍、浸提温度为90℃、提取时间为2h、用95%乙醇沉淀多糖,多糖的得率为7.694%。
2.2不同提取溶剂对多糖得率的影响
从图5可以看出,采用稀HCl溶液提取羊肚菌胞内多糖时,随着HCl溶液浓度的增加,多糖的得率有明显的下降趋势;采用稀NaOH溶液提取时,随着NaOH溶液浓度的增加,多糖得率也有下降的趋势;采用NaCl溶液提取时,随着NaCl溶液浓度的增加,多糖的得率有较小的下降趋势。
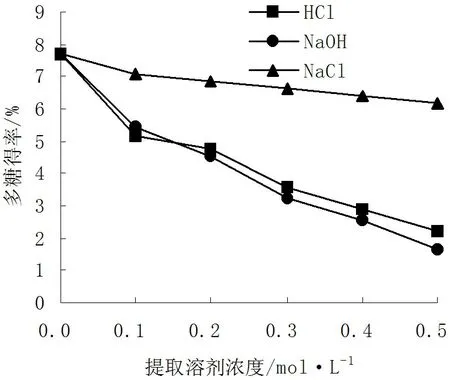
图5 不同浓度的溶剂对多糖得率的影响
最佳热水提取法多糖的得率为7.694%,酸、碱、盐溶液提取羊肚菌胞内多糖时,多糖的得率没有提高,反而下降,从7.694%分别降到2.194%、1.657%、6.189%。因此,选用热水提取法提取较为适宜。
2.3MIP的单糖组分分析结果
2.3.1硅胶G薄层层析分析结果
如图6所示,各种单糖显示出不同的颜色。多糖水解样品的斑点颜色与几种标准单糖样品都很相似,Rf值也和几种标准单糖样品相近,初步确认该多糖含有几种单糖成分,必须通过高效液相色谱来确定它的单糖组成。

注:1为L-鼠李糖,2为D-木糖,3为D-葡萄糖,4为半乳糖醛酸,5为D-甘露糖,6为D-果糖,7为D-半乳糖,8为多糖水解样品。

图8 MIP水解液的HPLC色谱图
2.3.2高效液相色谱法分析结果
从图7和图8可以看出,与标准单糖的保留时间对比,MIP纯品完全水解液里含有二种单糖:D-甘露糖和D-半乳糖,摩尔比为1︰1.059。可见MIP主要由D-甘露糖和D-半乳糖组成。
3 结论与讨论
3.1各单因素对多糖得率的影响
采用L9(34)的正交试验设计,得到羊肚菌胞内多糖的最佳热水提取工艺,即加水倍数为25倍、浸提温度为90℃、提取时间为2h、95%乙醇沉
淀多糖,该提取工艺的多糖得率为7.694%。在羊肚菌胞内多糖提取率的各个因素中,影响程度依次为:浸提温度>提取时间>加水倍数>乙醇浓度。究其原因,可能在多糖释放过程中,细胞壁是一个薄薄的屏障,温度越高,提取时间越长,细胞壁越容易破损,多糖越容易释放;同样,在一定温度下,提取时间越长,细胞壁破损程度越大,多糖越容易释放;利用了反萃取的技术,以乙醇作为萃取液,乙醇浓度越大,越易吸收细胞内的水分,使其多糖越容易沉淀。因条件和时间限制,未对其他的提取法做比较分析,例如采用超声破碎,液氮研磨,酶解等方法破坏细胞壁,然后释放出多糖,尚待在今后实验中作深入研究。
3.2不同提取溶剂对多糖得率的影响
采用正交试验确定了最佳的提取方法为热水提取法。
3.3MIP单糖组成分析
经过高效液相色谱分析得出,MIP主要由D-甘露糖和D-半乳糖组成,摩尔比为1︰1.059,两者均属于吡喃糖。
本文主要对羊肚菌菌丝中的胞内多糖提取和单糖组成进行了研究,未对分离纯化、分子结构及其生物活性进行分析。今后应着重于羊肚菌多糖的分子结构、理化性质及其生物活性,尤其是在抗肿瘤机理等方面研究。
[1]张云翔.林下经济产业现状与发展重点[J].南方农业,2014,8(12):84-89.
[2]Elmastas M,Isildak O,Turkekul I,etal.Determination of auto oxidant and antioxidant compounds in wild edible mushrooms[J].Food Composition and Analysis,2007(20):337-345.
[3]Ower R,Mills C G I,Malachowski J A.Cultivation ofMorchella:United States USA,4594809[P].1986-07-17.
[4]朱斗锡.羊肚菌的栽培方法.中华人民共和国国家知识产权局,00112812.4[P].2001-10-03.
[5]张飞翔.羊肚菌人工栽培技术[J].农村实用科技,2006(8):17.
[6]关明.林下羊肚菌人工栽培技术[J].中国林副特产,2012,8(4):42-43.
[7]刘红民.杨树林下羊肚菌人工栽培技术[J].防护林科技,2014(11):110-111.
[8]吕淑霞.基础生物化学实验指导[M].北京:中国农业出版社,2003:15-16.
[9]高丽君,王汉忠,崔建华,等.白首乌可溶性多糖提取工艺研究[J].食品科学,2004,25(10):178-180.
[10]杨娜,王鸿飞,郝艳佳,等.裂褶菌多糖提取工艺及抗氧化活性研究[J].中国食品学报,2014,14(8):98-104.
[11]高娃,于德水,刘佳宁,等.桦褐孔菌子实体多糖提取研究[J].生物技术,2012,22(2):72-75.
[12]王茂胜,连宾,梁宗琦,等.鸡油菌多糖的提取及组成分析[J].重庆大学学报(自然科学版),2005,28(7):122-125.
[13]连宾,郁建平.树舌、茯苓多糖的提取分离及组成研究[J].重庆大学学报(自然科学版),2004,27(1):120-122.
[14]连宾,郁建平.红托竹荪多糖的提取、分离及组成研究[J].食品科学,2004,25(3):43-45.
[15]黄才欢,李炎,王秀芬.茯苓多糖的提取及其结构表征[J].广州食品工业科技,2001,17(3):13-15.
[16]高宏伟,李兆兰,刘志礼,等.双胞蘑菇胞外多糖及胞内多糖的分离纯化和化学结构分析[J].南京中医药大学学报,1999,15(4):224-225.
[17]段玉峰,韩果萍.马齿苋多糖组分的分离纯化及抗氧化活性研究[J].食品科学,2005,26(3):225-228.
[18]陈恩成,彭超英,张兴如,等.红毛菜多糖的分离、纯化及纯度鉴定[J].广州食品工业科技,2004,20(2):30-32.
[19]Mizuno T.A Studies on the host-mediated antitumor-polysaccharides,antitumor-activity and some proper-ties of water-soluble polysaccharides from himemat-sutake,the fruiting body of termitomyces albuminosus[J].Agriculture and Biological Chemistry,2003,54(11):2889-2896.
[20]傅明辉,林总华.沙棘果水溶性多糖的分离纯化、组分分析及抗氧化学性的研究[J].食品科学,2002,23(3):73-75.
[21]Yang YJ,Wan JMF,Mi Ketal..The quantification of(1,3)-β-glucan in edible and medicinal mushroom polysaccharides by using limulus G test[J].Mycosystema,2003,22(2):296-302.
[22]葛青,张安强,孙培龙.桑黄子实体多糖的分离纯化及单糖组成研究[J].食品科学,2008,29(9):291-294.
[23]刘葳,于源华,毛亚杰,等.黄绿蜜环菌多糖的分离纯化与组成结构分析[J].长春理工大学学报,2007,30(2):102-105.
Extraction and Monosaccharide Composition of Intracellular Polysaccharide of Morchella conica Fr.
JIAO Li-man
(Liaoning Provincial Institute of Poplar,Gaizhou Liaoning 115200,P.R.China)
The mycelium of the plantedMorchellaconicaFr as materials,the best extraction method of intracellular polysaccharide by single factor analysis and orthogonal experiment were studied.The composition sugars of MIP was also analyzed with Silica gel G thin-layer chromatography and HPLC.The results show that the optimal extraction technology is :the water multiple with 25,the extractive temperature with 90℃,the extractive time with 2 hours,the alcohol concentration with 95%.At this condition,the yield is 7.694% ,and the MIP is constituted by D-mannose and D-galactose,the mol proportion is 1︰1.059.
MorchellaconicaFr.;intracellular polysaccharide;extractive technology;thin-layer chromatography;HPLC
2015-08-27
辽宁省科技攻关及成果产业化项目(2014207011)。
矫丽曼(1981-),女,工程师,硕士研究生,主要从事杨树转基因育种和杨树林下食用菌栽培等方面研究工作。E-mail:jiaoliman1025@163.com
Q 946.3
A
1672-8246(2016)04-0130-06
doi:10.16473/j.cnki.xblykx1972.2016.04.022

