响应面法优化蛹虫草子实体多糖的提取工艺研究*
黄 琰,朱赛君,杜羽亭,王伊帆,赵柯正兴,孙诗清
(嘉兴学院南湖学院,浙江 嘉兴 314000)
响应面法优化蛹虫草子实体多糖的提取工艺研究*
黄琰,朱赛君,杜羽亭,王伊帆,赵柯正兴,孙诗清
(嘉兴学院南湖学院,浙江嘉兴314000)
对蛹虫草子实体多糖热水浸提工艺进行研究。以人工培养的蛹虫草子实体为原料,采用苯酚-硫酸法测定提取液中多糖的提取率为指标,考察提取温度、提取时间、料液比对多糖提取率的影响,分别进行单因素试验和响应面试验优化。结果显示,在单因素试验筛选的水平区间,响应面优化的最佳提取工艺为:在78 ℃下,按照33 mL/g料液比,提取两次,每次提取1.2 h,其多糖的提取率可达到6.11%,与模型的预测值接近。该工艺简单可靠,为虫草多糖的进一步产业化提供一定指导作用。
蛹虫草;多糖;热水浸提法;响应面试验
蛹虫草(Cordycepsmilitaris)又称北冬虫夏草[1]是属于虫草属的一种名贵中药材。在我国,虫草菌的种类很多,但作为药食两用的只有两种,一种叫做冬虫夏草菌,一种叫做北冬虫夏草菌。其中,大多质量标准以核苷类物质作为其质量控制指标之一[2-3],但其是不是主要的功能成分仍没有定论[4]。蛹虫草子实体多糖作为新兴的活性物质群,已经在抗氧化[5-6]、抗肿瘤[7-8]、降压[9]等方面表现出良好的生物活性。因此,本研究采用实验室培养的蛹虫草子实体作为原料,进行多糖物质群的提取工艺优化,为虫草产品的进一步开发提供理论指导。
1 实 验
1.1材料、试剂与仪器
蛹虫草子实体粉末:蛹虫草子实体来自嘉兴学院生化学院生物试验室培养,经75 ℃烘干后粉碎,再过100目筛,备用。标准葡萄糖溶液:精密称取干燥的葡萄糖0.50 g稀释定容置100 mL容量瓶中,充分摇匀,取出1 mL溶液于50 mL容量瓶中定容,制得100 μg/mL葡萄糖标准溶液,备用。乙醇,苯酚等均为分析纯并购自阿拉丁。
AL204电子天平,梅特勒-托利多仪器有限公司;DK-S24型恒温水浴锅,上海精密实验设备有限公司;UV1801紫外可见分光光度计,北京瑞利分析仪器有限公司。
1.2试验方法
1.2.1单因素试验
分别考察提取温度、提取时间、提取次数和料液比对虫草多糖的提取率的影响,其对应条件为:精确称取干燥的1.0 g蛹虫草子实体粉末,按30:1(体积:质量)的料液比,使用蒸馏水分别放在40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃的恒温水浴中提取2次,每次提取1 h,将两次的提取液过滤后合并,定容至100 mL容量瓶中;在提取时间的考察中,其他条件同上,在80 ℃的恒温水浴中分别提取0.5 h、1 h、1.5 h、2.0 h、2.5 h、3.0 h;在提取次数的考察中,其他条件同上,分别提取1次、2次、3次、4次、5次、6次;料液比的考察中,其他条件同上,分别按10 mL/g、20 mL/g、30 mL/g、40 mL/g、50 mL/g、60 mL/g的料液比进行多糖的提取。按照1.2.3的测定方法进行不同提取条件下的多糖提取率计算,以提取条件对应多糖提取率作图,分析其对多糖提取率的影响。
1.2.2响应面试验设计
在上述单因素试验中,选取提取温度、提取时间和料液比这三个对多糖提取率影响较大的因素,利用 Design Expert 软件,根据 Box-Behnken 试验设计,代表符号分别为X1、X2、X3,并以-1、0、1分别代表这三个自变量的各个水平(见表1),通过最小二乘法来拟合出二次多项式方程,方程如下:
其中,Y是响应值(多糖提取率);Xi、Xj(i≠j)代表自变量;A0、Ai、Aii、Aij为系数。

表1 因素-水平设计表Table 1 Factors-Level Design
1.2.3标准曲线的绘制与多糖提取率的计算
本试验采用硫酸-苯酚法测量多糖[10]的含量。以葡萄糖作为标准品,以葡萄糖浓度(μg/mL)为X轴,以吸光度A为Y轴,绘制标准曲线,结果葡萄糖浓度在0~70 μg/mL时得回归方程:y=0.0076x-0.0135,其中R2=0.985。
多糖的提取率按以下公式计算:

式中:C——样液中多糖浓度,μg/mL
m——蛹虫草子实体粉末质量,g
V1——定容体积,mL
V2——样液稀释倍数
2 结果与讨论
2.1单因素试验结果


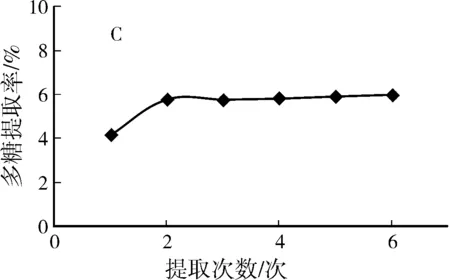

图1 单因素对多糖提取率的影响
由图1A可见,在40~80 ℃之间,多糖的提取率随温度的升高而有明显的增大,在80 ℃时达到最高点,为5.77%,超过80 ℃之后随着温度的进一步升高,多糖提取率反而有所降低,故选择提取温度80 ℃为好。由图1B可知,随着提取时间的延长,多糖提取率也随之增加,在提取时间为1 h时达到最高,为6.19%,而后趋于平行,甚至有些降低,故选择提取时间1 h为好。从图1C可知,虫草多糖提取率随提取次数的增加而增加,在前两次提取操作中,其增加幅度较大,而随后,当提取次数继续增加时,多糖提取率不再有大幅度的变化,而是趋于平行,故选择提取2次为宜。由图1D的结果显示,当料液比在10~30 mL/g时,可以十分明显的看出虫草多糖的提取率随着溶剂体积的增加而增加,在料液比为30 mL/g时提取率达到最高,为6.09%,而当蒸馏水体积继续增加时,多糖提取率基本趋于平行,因此在料液比为30 mL/g时,虫草多糖基本达到了最大溶出量。
2.2响应面试验结果
2.2.1模型的建立与显著性检验

表2 Box-Behnken实验设计及测定结果Table 2 Box-Behnken experimental design and measurement results
通过2.1的结果分析,固定提取次数为两次,选择提取时间1 h、提取温度80 ℃、料液比30 mL/g为中心点,进行Box-Behnken试验设计,结果见表2。利用Design-Expert 8.0.6软件对表2的试验数据进行二次多元回归拟合,得到回归方程如下:

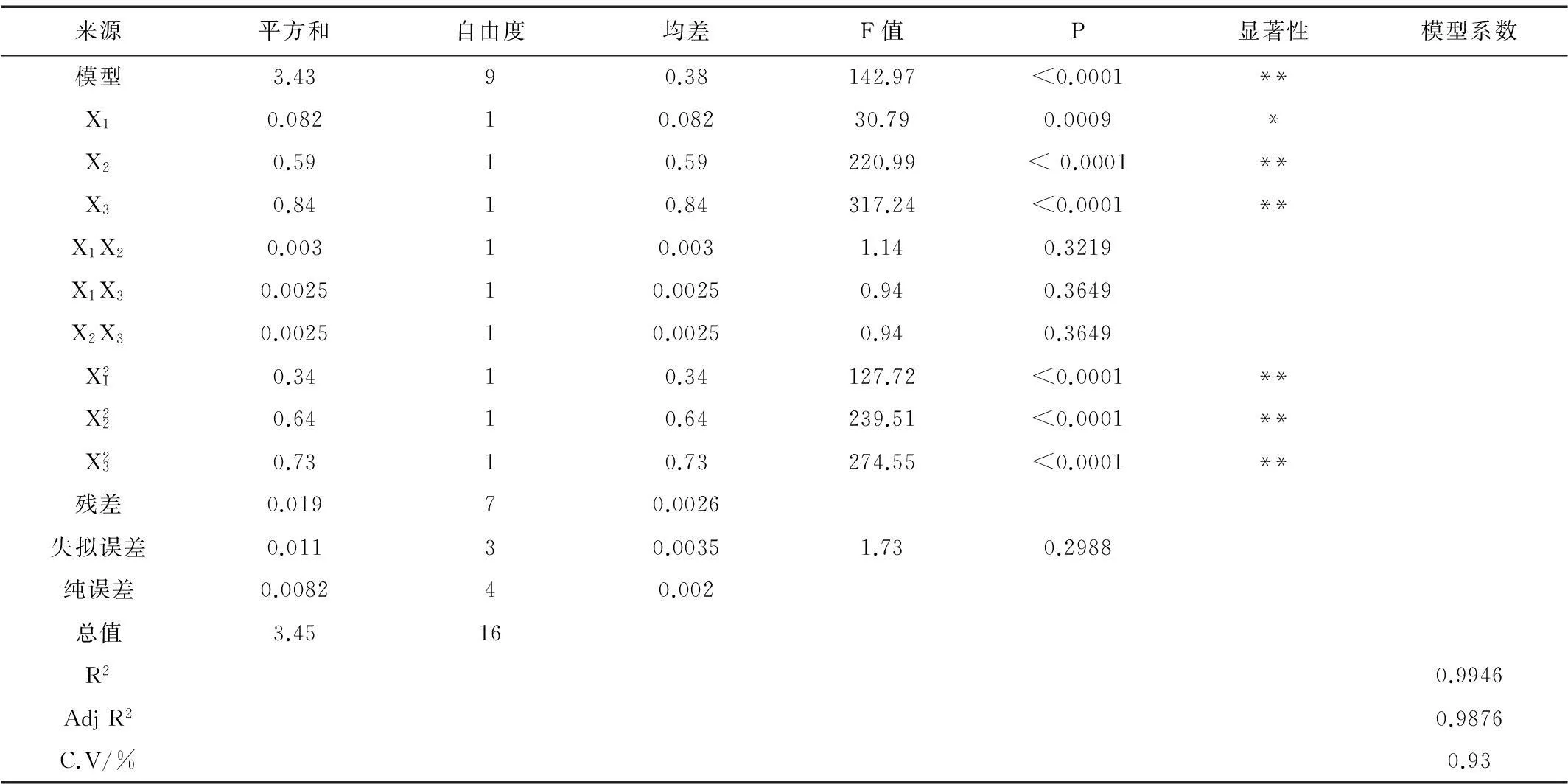
表3 回归模型方差分析及模型系数Table 3 Variance analysis and model coefficient
注:“*”表示显著(P<0.05); “**”表示极显著(P<0.001)。
2.2.2模型的验证优化
利用Design-Expert 8.0.6软件对回归方程进行分析,得到热水浸提法提取蛹虫草多糖的最优提取工艺为:提取温度为77.87 ℃、料液比为33.65 mL/g、提取时间为1.2 h,其预测多糖提取率为6.17%。根据实际情况,选择提取的工艺条件为:提取温度80 ℃、料液比33 mL/g、提取时间1.2 h。在该条件下进行3次平行试验取平均,实际测得的蛹虫草多糖提取率为6.11%,与方程预测值的误差为0.972%,在误差允许范围内(5%),说明该方程能很好的反映各因素对蛹虫草多糖提取率的影响情况。
3 结 论
(1)在单因素的实验结果中,发现提取次数在两次以后基本稳定,没有大幅度变化,同时第一次与第二次的变化也没有其他三个因素明显,因此在响应面实验中固定提取次数为两次,选择提取时间、提取温度和料液比为考察因素;在其他的三个单因素实验结果中,显示提取时间和提取温度对提取率并不是越大越好,当达到一定的数值(如时间1 h,温度80 ℃)时,多糖的提取率最高,然而对于料液比是达到一定数值后,基本趋于平稳,考虑后期的浓缩和纯化成本,选择30 mL/g为响应面试验的中心点。
(2)在单因素实验结果的基础上,通过响应面试验对蛹虫草多糖的提取工艺进行了进一步优化,对试验结果进行方程模拟和预测,探讨了提取温度、料液比和提取时间这三个因素中两两因素之间的交互作用对蛹虫草多糖提取率的影响,得出用热水浸提法提取蛹虫草多糖的最佳工艺条件为:蛹虫草子实体粉末过100目药筛,按照33 mL/g的料液比,在80 ℃下提取2次,每次1.2 h,蛹虫草多糖提取率达到6.11%,与响应面模型的预测值基本一致,说明此优化模型可靠,有实用价值。
[1]邵力平.真菌分类学[M].北京:中国林业出版社,1984:109.
[2]国家药典委员会.中华人民共和国药典[M].一部.北京:化学工业出版社,2005:75-76.
[3]刘玉军,徐芳,陈波,等.毛细管区带电泳法测定冬虫夏草及人工北冬虫夏草子实体中核苷及碱基成分的含量[J].药物分析杂志,2010,30(1):24-29.
[4]Li S P, Yang F Q, Tsim K W K. Quality control of Cordyceps sinensis, a valued traditional Chinese medicine[J].Journal of pharmaceutical and biomedical analysis,2006,41(5):1571-1584.
[5]Wang M, Meng X Y, Yang R L, et al. Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J]. Carbohydrate polymers, 2012, 89(2): 461-466.
[6]Wu F, Yan H, Ma X, et al. Comparison of the structural characterization and biological activity of acidic polysaccharides from Cordyceps militaris cultured with different media[J]. World Journal of Microbiology and Biotechnology, 2012, 28:2029-2038.
[7]ZHANG Guo-qing, HUANG Yue-dong, BIAN Yong,et al. Hypoglycemic activity of the fungi Cordyceps militaris,Cordyceps sinensis, Tricholoma mongolicum and Omphalia lapidescens in streptozotocin-induced diabetic rats[J].Applied Microbiology and Biotechnology, 2006, 72(6): 1152-1156.
[8]YANG Jin-yu, ZHANG Wei-yun, SHI Pei-hua, et al. Effects of exopolysaccharide fraction (EPSF) from a cultivated Cordyceps sinensis fungus on c-Myc, c-Fos, and VEGF expression in B16 melanoma-bearing mice [J]. Pathology Research and Practice,2005,201(11):745-750.
[9]Hu Z, Xia F B, Wu X G, et al. Cordyceps sinensis new efficacy composition [J]. Edible Fungi of China,2004,23(5):37-38.
[10]鲁晓岩.硫酸-苯酚法测定北冬虫夏草多糖含量[J].食品工业科技,2002,23(4):69-70.
Research on Extraction of Polysaccharides from Cordyceps militaris by Response Surface Method*
HUANG Yan, ZHU Sai-jun, DU Yu-ting, WANG Yi-fan, ZHAO Ke-zheng-xing, SUN Shi-qing
(Nanhu College, Jiaxing University, Zhejiang Jiaxing 314000, China)
The extraction process of polysaccharide was studied in the paper by hot water assisted extraction fromCordycepsmilitaris. The content of polysaccharides was determined by phenol-vitriol method. The effects of extraction temperature, extraction time, solid-liquid ratio and the number of extraction were investigated on the basis of single factor test. Through response surface methodology, the optimum extraction conditions of polysaccharide were as follows: solid-liquid ratio of 33 mL/g, extraction time of 1.2 h, extraction temperature of 80 ℃, two time extraction under this process condition, the extraction rate of polysaccharides was 6.11%. The optimized extraction method was simple and guided large-scale extraction of polysaccharides fromCordycepsmilitaris.
Cordycepsmilitaris; polysaccharide; hot water infusion extraction; response surface methodology
2015年嘉兴学院大学生研究训练(SRT)计划项目(NH8517150)。
黄琰(1994-),女,嘉兴学院南湖学院生物工程专业在校本科生。
O62
A
1001-9677(2016)014-0073-04

