水稻数量性状(QTL)定位主要作图群体及统计方法概述
孙佳丽,彭 锐,彭既明
水稻数量性状(QTL)定位主要作图群体及统计方法概述
孙佳丽1,2,彭 锐2,彭既明1,2
(1.中南大学研究生院隆平分院,湖南 长沙 410125;2.湖南杂交水稻研究中心,湖南 长沙 410125)
水稻许多重要的性状是由多基因控制的数量性状,因此数量性状的研究对促进水稻高产、抗病、质优具有重要意义。分子生物技术的迅速发展和 QTL 定位方法的日趋完善,为水稻数量性状的研究提供了基础。综述了QTL定位的原理、定位群体和常用的方法,并对目前水稻数量性状QTL定位存在的问题和发展前景进行了探讨。
水稻;QTL定位;作图群体;分子标记;综述
DOI:10.16498/j.cnki.hnnykx.2016.07.032
水稻大多数重要的性状如产量、生育期、籽粒重等,都表现为数量性状遗传,数量性状受遗传背景和环境因素影响[1]。数量性状(QTL)是在某一群体内的个体间表现为连续变异的性状,受环境影响较大。因此,数量性状的遗传研究如控制数量性状的基因数目、染色体上的位置及效应等,很难依据后代性状表型分布来确定。随着DNA分子标记技术的兴起以及遗传图谱的构建,QTL定位成为确定数量性状基因在染色体上位置的一种新方法。它能将分子标记信息综合到遗传评估中,辅助人工选择程序,建立更加真实的表型变异、选择反应和进化过程模型,对当前存在的数量变异进行分子生物学研究。研究表明,将生物技术应用于水稻性状改良,同时应用分子标记辅助育种,为成功改良水稻高产、抗病、广适性等综合性状奠定了基础[2]。
1 水稻QTL定位的原理与作图群体
目前,关于QTL的研究已有很多,大量QTL被定位[3],分布于水稻全部12条染色体上[4]。孟德尔的遗传学是先将各种表型分组,根据各组比例,验证连锁是否存在,并以此估算重组率,从而确定基因连锁关系。QTL定位的本质是根据QTL与分子标记连锁关系,将QTL对应到相应的染色体位置。
目前几种主要的定位群体如回交群体(BC)、F2、重组自交系(RIL)、双单倍体(DH)、单片段代换系(SSSLs)、近等基因系(NILs)、回交导入系(ILs)、回交自交系(BIL)、染色体片段置换系(CSSLs)[5]、残留异质系(RHLs)[6]等各有优缺点[7](详见表1)。例如:BC是暂时性分离群体,仅能使用一次,遗传背景相对复杂,容易造成定位偏差[8];相比较于BC,F2群体包含亲本所有的基因型(如MM、Mm和mm),因此对显性效应以及加性效应的估算较为准确,但F2群体基因并不是纯和基因,连续性的研究在F2群体中较困难;RIL为多次自交形成,重组信息比较大,基因纯合度高,适合估算加性效应,同时RIL受环境干扰较小,定位结果较精确;DH群体是F1诱导单倍体并加倍形成的群体,群体内基因完全纯和,适合于估算加性效应以及QTL与环境互作效应;QIRs比较容易构建,并且可以获得低于1 cM的分子标记,但受遗传背景干扰,不能检测上位性效应;SSSLs和NIL群体也可作永久性群体,构建时间较长,受环境因素和遗传背景影响较小,因而QTL定位结果更加准确稳定。这些年来已有很多学者应用此类群体进行QTL定位,并取得一定进展。
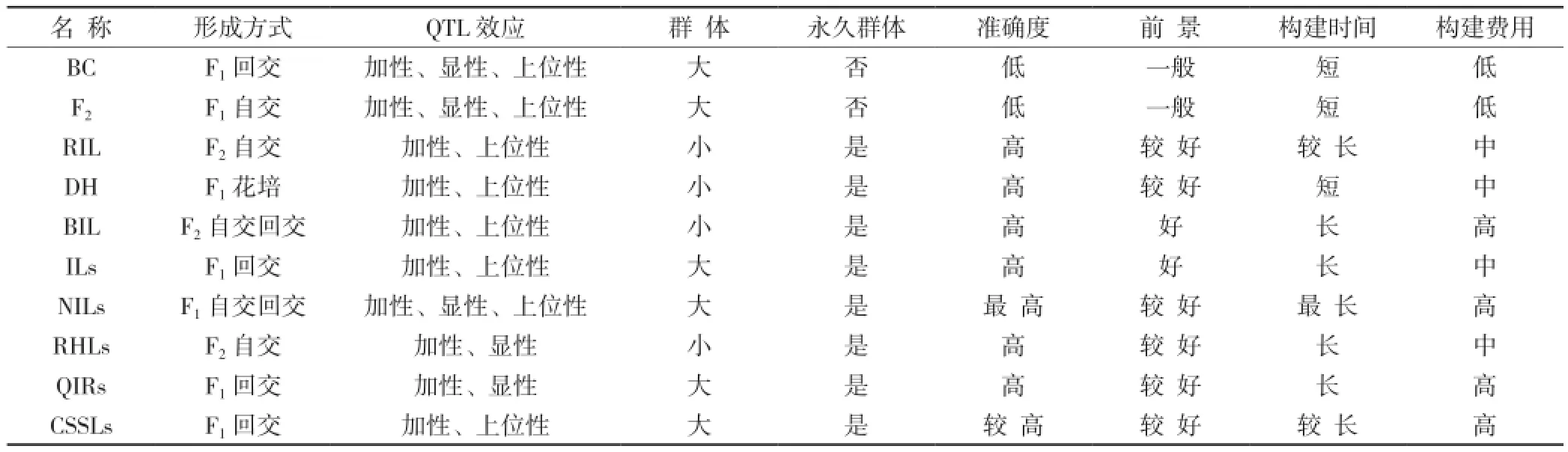
表1 水稻定位群体比较
2 多态性分子标记及其特点
连锁遗传图谱的构建,与多态性分子标记紧密相关。理想的分子标记特点是:多态性好,位点均匀分布在染色体上,共显性,易于检测,成本较低等[9]。近年来常用的DNA分子标记可分为3类:第一类是依据DNA杂交的限制片段长度多态性(RFLP)[10];第二类是依据PCR扩增,包括随机引物扩增的RAPD、AFLP、AP-PCR[11]、ISSR和特异性引物扩增的SSR、STS、SCAR[12]、CAPS[13]、SSCP[14]、TGGE、DGGE;第三类是具有显著优势的单核苷酸多态性SNP[15]。各种分子标记技术的优缺点如表2所示。
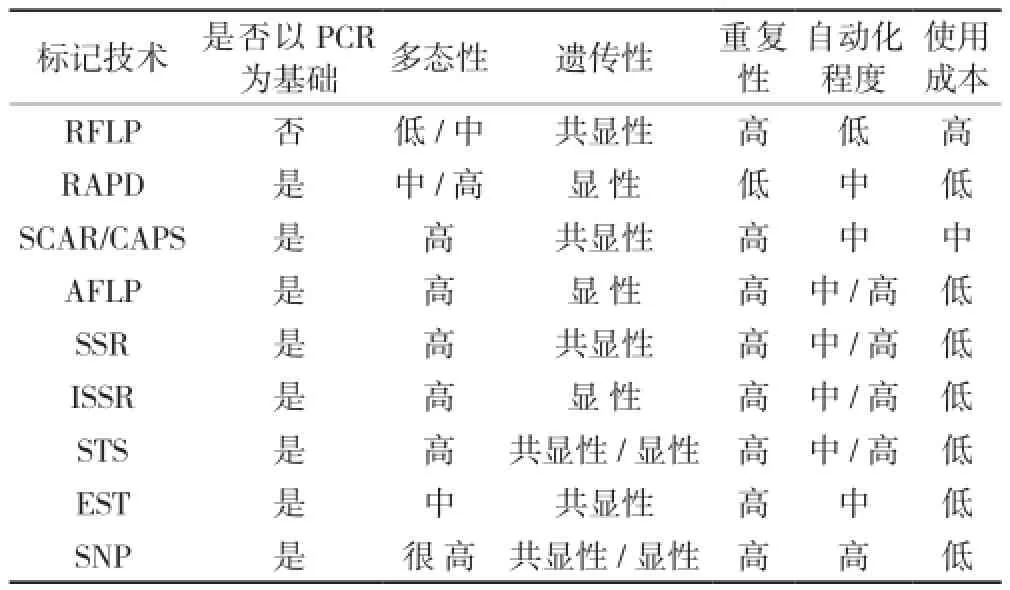
表2 广泛使用的分子标记技术比较
2.1 RFLP
RFLP(Restriction fragment length polymorphism)标记稳定可靠,检测不受发育阶段和环境条件等因素的影响[16]。上位效应不存在于非等位RFLP标记之间,因其来源于DNA自身变异,也不受数量限制[17]。目前,RFLP技术成本较高,自动化程度较低,操作复杂,而且所需DNA样品量大,对于涉及许多个体(200以上)的鉴定研究并不可取。
2.2 RAPD
RAPD(Random amplified polymorphic DNA)技术比RFLP操作简单[18],易于掌握,具有同工酶位点多,比RFLP技术操作简单等特点,不需进行同位素杂交,对实验室要求较低,因此一般实验室即可操作。RAPD分子标记除少数为共显性标记外,大多为显性标记,即信息量有限,标记大多是完全显性遗传,不能区别杂合体和纯合体。RAPD技术在不严格实验条件下假阳性出现概率高、重复性差;同时,对DNA纯度的要求高,已取得的标记只有转化成其他类型,才能完成基因定位。
2.3 AFLP
AFLP(Amplified fragment length polymorphism)的多态性水平相当高,且稳定可靠,但需DNA模板量大,操作步骤复杂[19],成本太高。
2.4 ISSR
ISSR(Inter-simple sequence repeat)具有操作简单、检测多态性能力强、成本低、所需DNA模板量少等优点。目前已成功地运用于居群生物学的研究、品种鉴定、物种的分类系统学比较,并成为构建连锁遗传图谱的工具[20]。但ISSR标记一般是显性遗传的,每对引物扩增条带较多,因而不能应用于杂交水稻种子的纯度鉴定。
2.5 SSR
SSR(Simple sequence repeat)标记具有数量丰富、均匀分布、高多态性、呈共显性、含复等位基因等特点。SSR所含信息量大并且以孟德尔遗传方式进行遗传,因其引物序列决定固定位点,使资料得以在实验室间共享,提高了信息利用率。
SSR在操作时不需要使用同位素,减少了对实验操作人员的危害;SSR实验中DNA的用量很少[21],降低了对DNA提取工作的要求;实验过程中不需经过Southern转移、分子杂交等过程[22],精简了试验操作过程;同时,SSR所用的材料不需经过有性世代,可以选用任意亲本的任何部位作材料[23],在线粒体DNA、叶绿体DNA研究中均可使用。
2.6STS
STS(Sequence-tagged site)特定序列位点是对由特定引物序列界定的标记技术的统称。特异PCR技术最大的特点是信息准确可靠[24],可区别于RAPD、AFLP和利用随机探针产生的RFLP存在某种模糊性(如片段来源的鉴别较难)。
2.7 EST
与来自于基因组DNA开发的传统标记相比,以EST(Expressed sequence tag)为基础的分子标记是一种新型分子标记,具有开发简便、信息量高和通用性好等显著优势[25],在多方面都有重要的利用价值。
3 QTL定位的方法
QTL作图模型及统计分析方法已经广泛应用到分子标记QTL 定位及效应估计中。目前QTL 定位的方法主要有采用 t-检验、方差分析、回归分析等方法的单标记法(SMA),以及基于两个侧连标记区间作图法(IM)、复合区间作图法(CIM)、多重区间作图法(MIM)和混合型线性模型复合区间作图法(MCIM)。
3.1 SMA
单标记分析法是应用方差分析、回归分析法或者似然比检验,比较标记基因型的数量性状差异。若差异显著,表明控制该性状的QTL与标记连锁。其特点是检测个体较多,效率不高,QTL与标记的确切位置和个数无法确定,不能分析QTL的重组率,易导致低估遗传效应等[26]。
3.2 IM
区间作图法是根据两个侧邻标记检测数量性状与连锁区间的显著关系,明确QTL 是否存在该区间的一种方法[27]。IM不能逐一分辨同一染色体上的多个QTL 效应,易出现假阳性,因此 QTL 定位结果的准确性不高,甚至出现错误结果[28]。
3.3 CIM
为了解决IM法存在的问题,Zeng[29]提出复合区间作图法,是将IM与多元线性回归相结合的一种方法。CIM既保留了IM的优点,又充分利用了全部基因组的标记信息,把对多个QTL的检验降低为1个区间,精确性增加[30]。当上位性效应、QTL与环境互作效应不存在时,QTL效应和位置的估计是无偏估计,提高了检测QTL的能力,因而被广泛应用。
3.4 MIM
MIM方法克服了传统作图方法的局限性,也满足了QTL作图的发展。该方法从Cockerham模型[31]出发,根据遗传参数而推导似然估计公式,利用LTR统计量与逐步选择结合,检测QTL主效应以及上位效应。该方法能够利用多个标记区间确定多个QTL,提高了作图效率和精确度[32]。
3.5 MCIM
朱军等[33]于1998年提出了多重区间作图法,该方法把群体各项效应分为固定效应和随机效应。其中,固定效应主要为遗传主效应,而随机效应包括QTL与环境互作效应、环境效应、残差及分子标记效应。估计效应与定位分析相结合,使位置的无偏估算[34]和QTL效应不受环境影响,作图效率和准确度都大幅提高,具有广阔的应用前景。
4 展 望
分子遗传学和生物技术快速发展背景下,复杂水稻数量性状(QTL)研究取得了飞跃进展,QTL定位研究的文献发表量几乎以指数模型增长[35]。QTL定位能够确定控制某一复杂性状的QTL在染色体上的大体位置及其效应,为数量性状特别是经济性状的成功改良提供了可能,具有巨大的应用前景和发展空间。但QTL定位在不同群体、不同环境中的结果有较大差异,QTL数目、染色体区域、同一QTL的贡献率等都会出现差异。因此,设计科学的实验方案,有效地控制实验误差,准确定位到在不同群体和环境中均稳定表达的QTL,这为探索控制水稻性状的复杂分子机制及生理过程,最大限度地发挥作物潜力提供了技术支撑,也为采用基因工程技术培育高产、抗病、质优的水稻品种奠定了基础。
[1] Wang X Q,Pang Y L,Zhang J,et al. Genetic background effects on QTL and QTL × environment interaction for yield and its component traits as revealed by reciprocal introgression lines in rice[J]. The Crop Journal,2014,(6):345-357.
[2] 李阳生,李绍清,朱仁山,等. 生物技术在水稻超高产育种中的应用[J]. 沈阳农业大学学报,2007,38(5):701-706.
[3] 刘 健,牛付安,江建华,等. 多环境下粳稻产量及其相关性状的条件和非条件QTL定位[J].中国水稻科学,2012,26(2):144-154.
[4] Mei D Y,Zhu Y J,Yu Y H,et al. Quantitative trait loci for grain chalkiness and endosperm transparency detected in three recombinant inbred line populations of Indica rice[J]. Journal of Integrative Agriculture,2013,12(1):1-11.
[5] 王智权,刘 喜,江 玲,等. 利用染色体片段置换系(CSSLs)群体检测水稻剑叶形态性状QTL[J]. 南京农业大学学报,2010,33(6):1-6.
[6] 蒋洪蔚,刘春燕,高运来,等. 作物QTL常用作图群体[J]. 生物技术通报,2008,(S1):12-17.
[7] 周丽慧,赵春芳,赵 凌,等. 利用染色体片段置换系群体检测水稻叶片形态QTL[J]. 中国水稻科学,2013,27(1):26-34.
[8] Hu W D,Zhang H,Jiang J H,et al. Genetic analysis and QTL mapping of large flag leaf angle trait in Japonica rice[J]. Rice Science,2012,19(4):277-285.
[9] 田 翠,张 涛,蒋开锋,等. 水稻QTL定位研究进展[J]. 基因组学与应用生物学,2009,28(3):557-562.
[10] Li P,Lu C F,Zhou K D,et al. RFLP mapping of major and minor genes for impoetant agronomic characters in rice[J]. Science in China,1996,39(4):440-448.
[11] 汪 莉,易 平,万翠香,等. 红莲型细胞质雄性不育水稻线粒体DNA的AP-PCR分析[J].武汉植物学研究,2002,20(6):405-408.
[12] Li S J,Xie H W,Qian M J,et al. A set of SCAR markers efficiently differentiating hybrid rice[J]. Rice Science,2012,19(1):14-20.
[13] Wang H M,Chen J,Shi Y F,et al. Development and validation of CAPS markers for marker-assisted selection of rice blast resistance gene Pi25[J]. Acta Agronomica Sinica,2012,38(11):1960-1968.
[14] 魏太云,林含新,吴祖建,等. 应用PCR-RFLP及PCR-SSCP技术研究我国水稻条纹病毒RNA4基因间隔区的变异[J]. 农业生物技术学报,2000,8(l):41-44.
[15] 叶少平. 水稻分子图谱的构建和QTL定位研究[D]. 四川:四川农业大学,2004.
[16] Chen L,Liang C Y,Sun C Q,et al. Comparision between AFLP and RFLP markers in detecing the diversity of rice[J]. Agricultural Sciences in China,2002,1(7):713-719.
[17] Huang W,Wang L,Yi P,et al. RFLP analysis for mitochondrial genome of CMS-Rice[J]. Acta Genetica Sinica,2006,33(4):330-338.
[18] Long W H,Xu M H,Zhang S H. A preliminary study on the relationship between the Indica-Japonica RAPD differentiation of parents and heterosis in dian type hybrid rice[J]. Agricultural Sciences in China,2002,(12):1303-1309.
[19] 蔡 健,兰 伟. AFLP标记与水稻杂种产量及产量杂种优势的预测[J]. 中国农学通报,2005,21(4):39-43,121.
[20] 黄光文,欧立军,陈觉梁,等. 水稻ISSR标记遗传距离与杂种优势的相关性研究[J]. 杂交水稻,2010,(S1):326-331.
[21] 张玉山,陈庆全,吴 薇,等. 水稻SSR标记遗传连锁图谱着丝粒的整合及其偏分离分析[J].华中农业大学学报,2008,27(2):167-171.
[22] Cheng J,Zheng C X. Optimization of SSR-PCR reaction system and screening of polymorphic primers for RIL parents[J]. Agricultural Science &Technology,2013,14(11):1566-1568.
[23] 程 江,郑常祥. 水稻SSR-PCR的反应体系优化及RIL亲本间多态性引物筛选[J]. 贵州农业科学,2013,41(4):10-13.
[24] 樊颖伦,陈学伟,王春连,等. 水稻抗白叶枯病基因Xa23的RFLP标记定位及其STS标记的转化[J]. 作物学报,2006,32(6):931-935.
[25] 李小白,崔海瑞,张明龙. EST分子标记开发及在比较基因组学中的应用[J]. 生物多样性,2006,14 (6):541-547.
[26] 辛业芸. 水稻产量性状QTL定位研究进展[J]. 湖南农业大学学报(自然科学版),2007,33(4):396-402.
[27] 毛传澡,程式华. 水稻农艺性状QTL定位精确性及其影响因素的分析[J]. 农业生物技术学报,1999,7(4):386-394.
[28] 王建康. 数量性状基因的完备区间作图方法[J]. 作物学报,2009,35(2):239-245.
[29] Zeng Z B. Theoretical basis of separation of multiple linked gene effects on mapping quantitative traitloci[J]. Proc Natl Acad Sci USA,1993,90:10972-10976.
[30] 林 谦,毛孝强,杨 德,等. QTL作图主要统计方法及主要作图群体[J]. 云南农业大学学报,2004,19(2):121-127.
[31] Cockerham C C. An extension of the concept of partitioning hereditary variance for analysis of covariance amongrelatives when epistasis is present[J]. Genetics,1954,39:859.
[32] Kao C H,Zeng Z B,Teasdale R D. Multiple interval mapping for qutatitve trait loci[J]. Genetics,1999,152:203-1216.
[33] 朱 军. 运用混合线性模型定位复杂数量性状基因的方法[J]. 浙江大学学报(自然科学版),1999,33(3):327-335.
[34] 苏成付,赵团结,盖钧镒. 不同统计遗传模型QTL定位方法应用效果的模拟比较[J]. 作物学报,2010,36(7):1100-1107.
[35] 周元昌,陈启锋,吴为人,等. 作物QTL定位研究进展[J]. 福建农业大学学报,2000,29(2):138-144.
(责任编辑:成 平)
Overview of Rice quantitative traits (QTL) Mapping Main Construction Population and Statistical Methods
SUN Jia-li1,2,PENG Rui2,PENG Ji-ming1,2
(1. Longping Branch of Graduate School,Central South University, Changsha 410125, PRC;2. Hunan Hybrid Rice Research Center, Changsha 410125, PRC)
Most of the important agronomic are quantitative traits in rice, which are controlled by polygenes. Therefore the research of quantitative character to promote the rice yield, disease resistance, good quality is of great significance. The rapid development of molecular biotechnology and the emergence of mapping methods were the basic of the research of many important agronomic traits in rice. The principle, population and main analysis methods were briefly introduced in this paper. The author also summarized the problems and prospects of mapping QTLs for rice yield traits.
rice; QTL mapping; mapping populations; molecular marker
Q341
A
1006-060X(2016)07-0120-04
2016-04-22
公益性行业(农业)科研专项(201403002)
孙佳丽(1990-),女,山东潍坊市人,硕士研究生,研究方向为水稻遗传育种。
彭既明

