外源脱落酸增强甘薯幼苗耐盐性的作用
肖 强, 王 刚, 衣艳君, 史衍玺, 杨洪兵, 刘家尧*
(1青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,山东青岛 266109;2青岛农业大学资源与环境学院,山东青岛 266109)
外源脱落酸增强甘薯幼苗耐盐性的作用
肖 强1, 王 刚1, 衣艳君1, 史衍玺2, 杨洪兵1, 刘家尧1*
(1青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,山东青岛 266109;2青岛农业大学资源与环境学院,山东青岛 266109)
【目的】本文系统研究了不同浓度NaCl胁迫及外源脱落酸(ABA)对NaCl胁迫下甘薯幼苗生根及一些生理生化特性的影响,探讨了外源ABA对盐胁迫下甘薯幼苗的缓解效应,为增强盐碱地甘薯耐盐性、 提高产量提供理论依据。【方法】以甘薯种植品种徐薯25为实验材料,在装有石英砂的具孔塑料盆中放入培养室自然光照/昼夜温度[(26±1)/(17±1)℃]中培养,并进行不同浓度NaCl处理以及对NaCl300mmol/L胁迫甘薯幼苗叶片喷施ABA溶液,连续处理7d后,测定生根数,使用CIRAS-1型便携式光合仪测定光合作用指标、 植物效率分析仪测定叶绿素荧光参数、 采用比色法测定丙二醛、 脯氨酸、 可溶性糖含量和超氧化物歧化酶活性、 用原子吸收分光光度计测定Na+、K+、Ca2+含量,利用SPSS13.0和Excel软件对数据进行处理分析。【结果】低浓度NaCl胁迫(50mmol/L)对甘薯幼苗影响较小; 随着盐度的增加,甘薯生根不断减少,相对电导率、 丙二醛(MDA)、 脯氨酸和可溶性糖含量持续增加,甘薯叶片超氧化物歧化酶(SOD)活性呈先增加后降低趋势; 叶片净光合速率(Pn)、 蒸腾速率(Tr)、 气孔导度(Gs)、 光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)、 捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率(Ψ0)、 用于电子传递的量子产额(ΦE0)逐渐降低,放氧复合体活性(Vk)和用于热耗散的量子比率(ΦD0)不断增加; 叶片中Na+含量增加,K+、Ca2+和K+/Na+水平降低。高浓度(300mmol/L)NaCl胁迫下,甘薯幼苗的正常生理代谢受到显著抑制。适当增加外源ABA浓度,能够显著缓解NaCl胁迫造成的伤害作用,以ABA浓度为70μmol/L的缓解效果最好。【结论】外源ABA可显著促进盐胁迫下甘薯幼苗生根,维持细胞膜的稳定性,降低膜脂过氧化程度,调节植物细胞的渗透和离子动态平衡,使甘薯幼苗叶片维持较高的Fv/Fm、Ψ0、ΦE0和较低的Vk、ΦD0,缓解PSⅡ光抑制的程度,改善植物的光合作用,提高植物的耐盐性。因此,喷施70μmol/LABA是缓解NaCl胁迫效应,提高甘薯幼苗耐盐性的一种有效方法。
甘薯;NaCl胁迫;ABA; 缓解效应
研究表明,ABA在植物逆境中具有十分显著的作用[1]。作为一种植物逆境“应激激素”,当植物受到环境胁迫时,ABA会迅速积累并参与植物的生理调节过程[2],如维持细胞膜的稳定性,调节植物细胞的渗透和离子动态平衡,减少膜脂过氧化,提高抗氧化酶的活性,缓解PSⅡ光抑制的程度,改善植物的光合作用。钟新榕等[3]研究发现,黄瓜幼苗施加外源ABA,能够显著提高盐胁迫下黄瓜幼苗抗氧化酶的活性,降低幼苗叶片质膜透性和MDA积累,有效缓解黄瓜幼苗叶片细胞膜脂过氧化;Jia等[4]用ABA对玉米植株进行数天的处理,发现外源ABA可以提高叶黄素循环和固定同化二氧化碳的能力,从而提高植株对盐胁迫的响应。甘薯(Ipomoea batatasLam.)是我国一种重要的粮食和能源作物。在我国长江以北和沿海许多地区,土壤中盐碱含量往往过高,从而严重限制了甘薯种植。关于盐胁迫对甘薯生长及生理的影响已有一些研究,柯玉琴、 潘廷国等[6-8]研究表明,盐胁迫能破坏甘薯叶片叶绿体结构、 抑制甘薯幼苗生长,使叶片IAA水平、 光合速率下降,ABA、 多胺含量升高; 高叶等[5]发现盐胁迫能使甘薯幼苗Na+含量和Na+/K+明显升高; 过晓明等[11]、 王灵燕等[10]还比较了不同品种甘薯的耐盐性。但是盐胁迫对甘薯幼苗的生理生化影响研究比较零散,外源ABA对甘薯盐胁迫的缓解效应方面研究很少有报道,因此本文系统研究了NaCl胁迫对甘薯幼苗的生根及生理生化特性(离子含量、 膜透性、 抗氧化能力、 渗透调节物质、 光合和荧光动力学参数等)的影响,并通过NaCl胁迫下对甘薯幼苗喷施外源ABA,来探讨外源ABA对盐胁迫下甘薯幼苗的缓解效应,为增强盐碱地甘薯耐盐性从而提高产量提供理论依据。
1 材料与方法
1.1材料培养与处理
1.2生根数的测定
将甘薯幼苗整盆取出,采用水冲洗法去掉根部石英砂,统计生根数目[13]。
1.3光合气体交换参数和叶绿素荧光参数的测定

1.4其他生理指标的测定
选取植株的第4片叶,去除叶脉后剪碎混合均匀,用于测定以下生理生化指标: 细胞膜透性测定参照Lutts等的方法[14]; 丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[15]; 脯氨酸和可溶性糖含量测定分别用酸性茚三酮比色法和蒽酮比色法[16]; 超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)法[17];Na+、K+、Ca2+含量测定用SP-3520AA型原子吸收分光光度计法。
1.5数据处理
利用SPSS13.0和Excel软件对数据进行处理分析。数据为3次重复±标准差。
2 结果与分析
2.1NaCl胁迫对甘薯幼苗生根及生理反应的影响

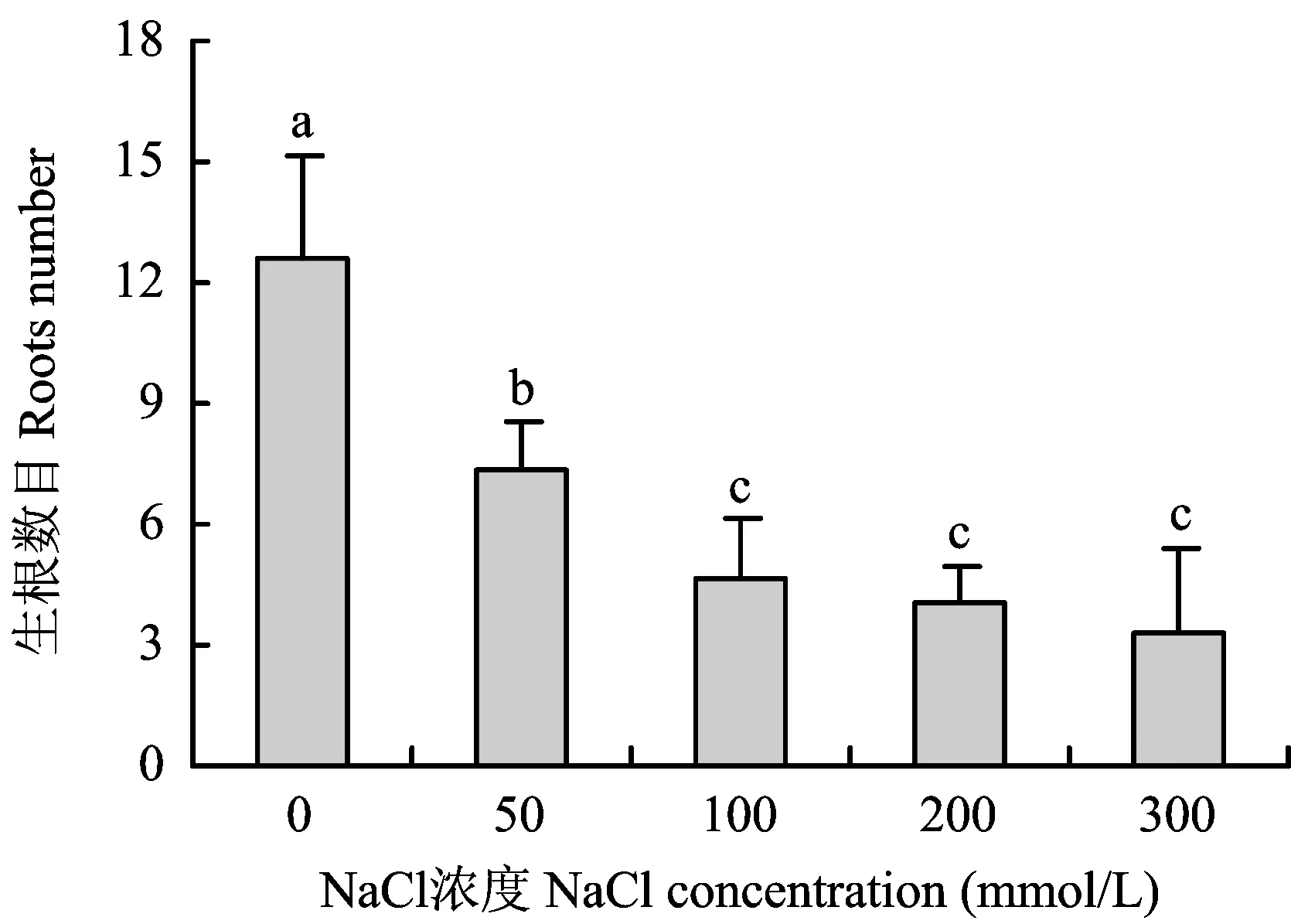
图1 NaCl胁迫对甘薯幼苗生根数目的影响Fig. 1 Effects of NaCl stress on roots number of sweet potato seedlings

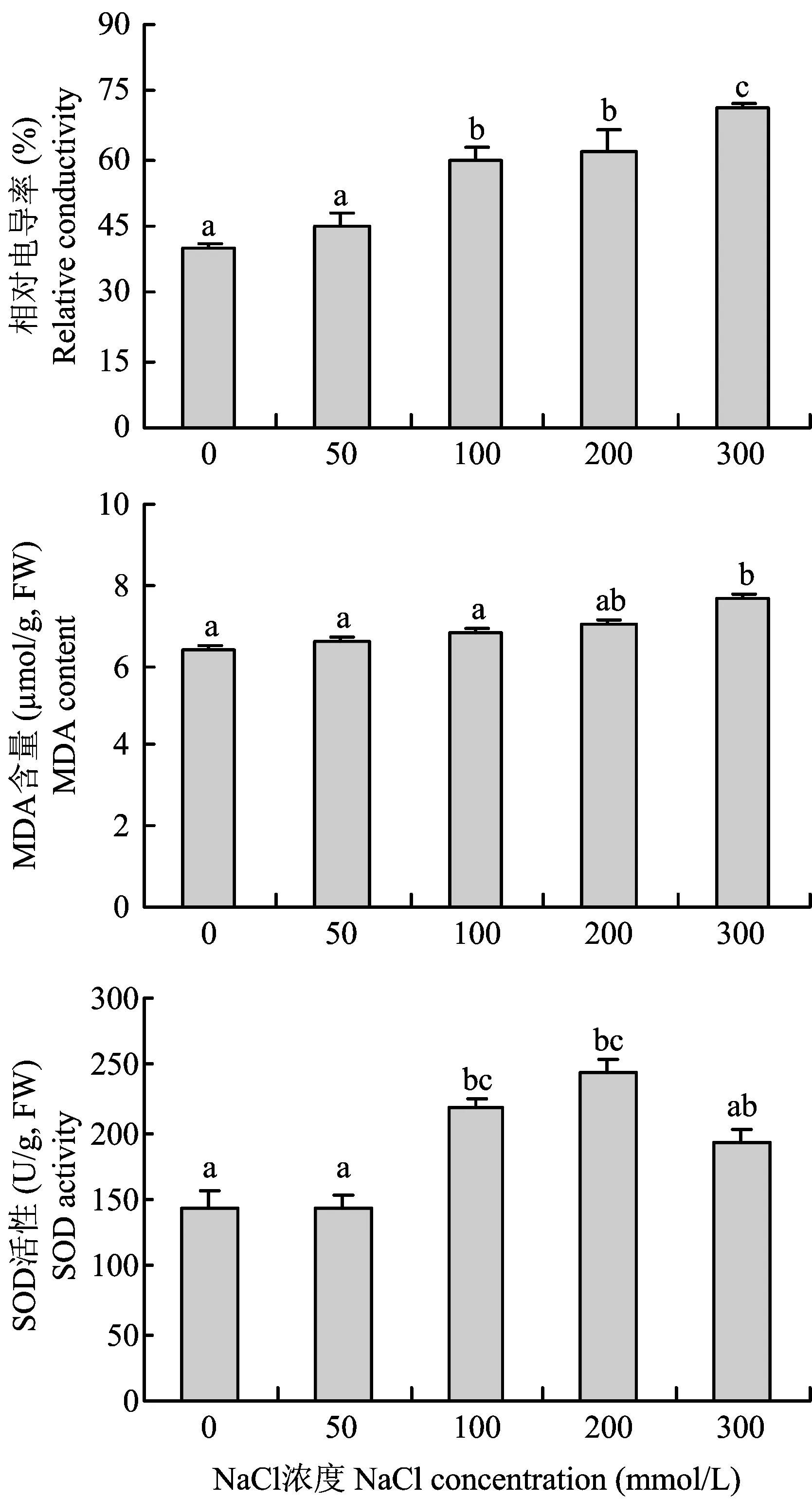
图2 NaCl胁迫对甘薯幼苗叶片相对电导率、 MDA含量和SOD活性的影响Fig.2 Relative conductivity,MDA content and SOD activity in the leaves of sweet potato seedlings exposed to NaCl stress



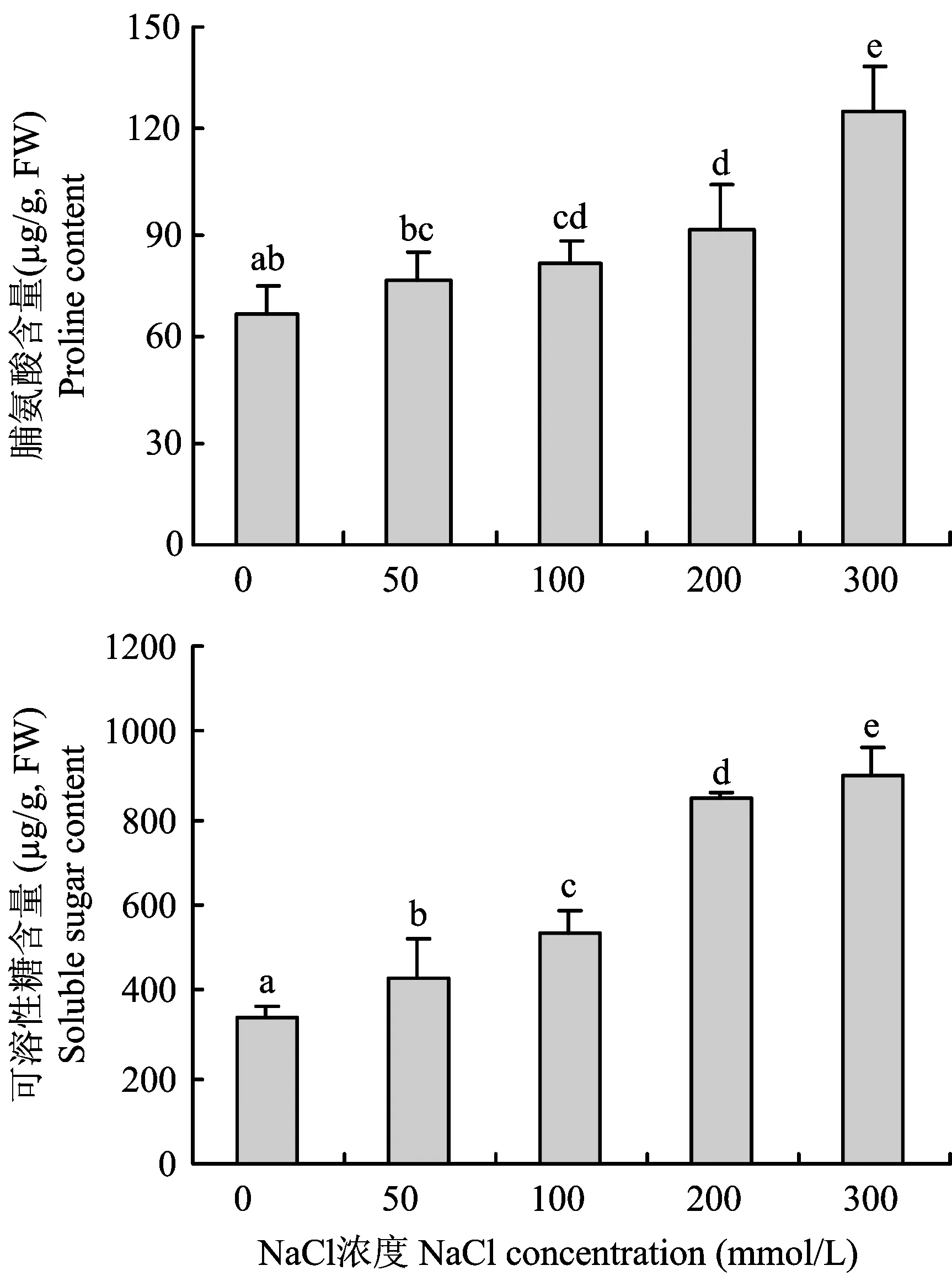
图3 NaCl胁迫对甘薯幼苗叶片脯氨酸和可溶性糖含量的影响Fig.3 Effects of NaCl stress on proline and soluble sugar contents in the leaves of sweet potato seedlings
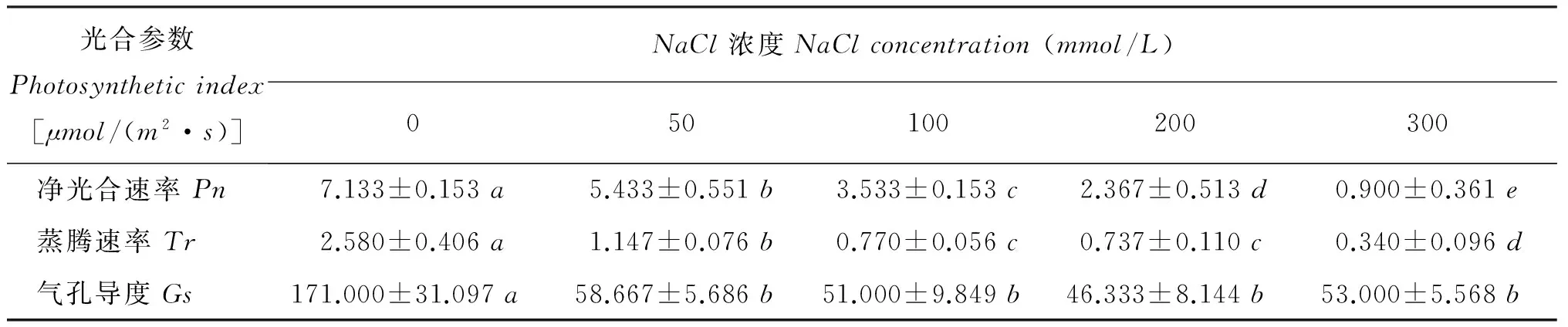
光合参数Photosyntheticindex[μmol/(m2·s)]NaCl浓度NaClconcentration(mmol/L)050100200300净光合速率Pn7.133±0.153a5.433±0.551b3.533±0.153c2.367±0.513d0.900±0.361e蒸腾速率Tr2.580±0.406a1.147±0.076b0.770±0.056c0.737±0.110c0.340±0.096d气孔导度Gs171.000±31.097a58.667±5.686b51.000±9.849b46.333±8.144b53.000±5.568b
注(Note): 同行数值后不同字母表示差异显著(P<0.05)Valuesfollowedbydifferentlowercaseintherowmeansignificantdifference(P<0.05).

表2 NaCl胁迫对甘薯幼苗叶片叶绿素荧光参数的影响Table 2 Effects of NaCl stress on chlorophyll fluorescence in the leaves of sweet potato seedlings
注(Note): 同行数值后不同字母表示差异显著(P<0.05)Valuesfollowedbydifferentlowercaseintherowaresignificantlydifferent(P<0.05)
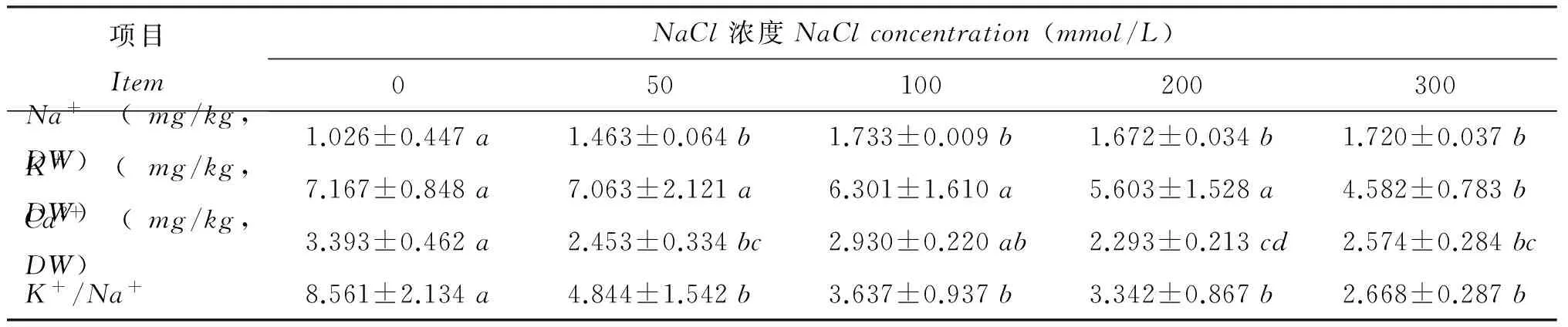
表3 NaCl胁迫对甘薯幼苗叶片Na+、 K+、 Ca2+和K+/Na+的影响Table 3 Effects of NaCl stress on Na+、 K+、 Ca2+ and K+/Na+ in the leaves of sweet potato seedlings
注(Note): 同行数值后不同字母表示差异显著(P<0.05)Valuesfollowedbydifferentlowercaseintherowaresignificantlydifferent(P<0.05).
2.2不同浓度ABA对NaCl胁迫下甘薯幼苗生根及生理特性的影响
2.2.1 不同浓度ABA对NaCl胁迫下甘薯幼苗生根数目的影响如图4所示,在300mmol/LNaCl胁迫时,甘薯幼苗的生根数目与对照(0mmol/LNaCl)比较显著降低,比对照降低了76.4%; 当喷施ABA(浓度为30、 50、 70和100μmol/L)后,幼苗的生根数目明显增加,50μmol/L和70μmol/LABA处理下的生根数目比300mmol/LNaCl处理显著增加,其中70μmol/LABA处理下有最多的生根数目,与对照相比降低幅度最小,只降低了36.4%; 当ABA浓度为100μmol/L处理时,幼苗生根数目的降低幅度比70μmol/LABA处理增大,说明ABA浓度过高不利于提高甘薯幼苗的耐盐性。
2.2.2 不同浓度ABA对NaCl胁迫下甘薯幼苗叶片细胞膜透性和丙二醛(MDA)含量的影响在300mmol/LNaCl胁迫下,甘薯幼苗叶片相对电导率和MDA含量与对照(0mmol/LNaCl)相比显著增加,分别增加了44.8%和119%。喷施ABA(浓度为30、 50、 70和100μmol/L)后,甘薯幼苗叶片的相对电导率和MDA含量显著降低,其中70μmol/LABA处理效果最好,与30、 50和100μmol/LABA处理相比有最低的相对电导率和MDA含量,与对照相比没有显著差异。说明喷施适当浓度ABA可以有效缓解NaCl胁迫下对甘薯幼苗细胞膜的损害,减轻膜脂过氧化程度,但当喷施过多的ABA不利于缓解盐胁迫对质膜的伤害,如100μmol/LABA处理比70μmol/LABA处理有高的相对电导率和MDA含量(图5)。
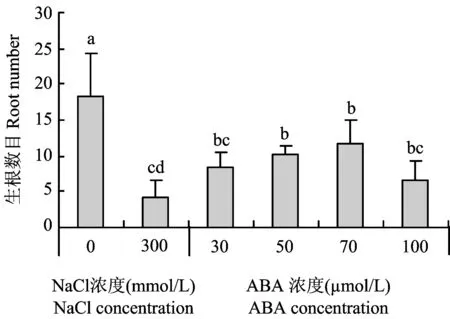
图4 不同ABA浓度对NaCl胁迫下甘薯幼苗生根数目的影响Fig.4 Effects of different concentrations of ABA on root number of sweet potato seedlings under NaCl stress
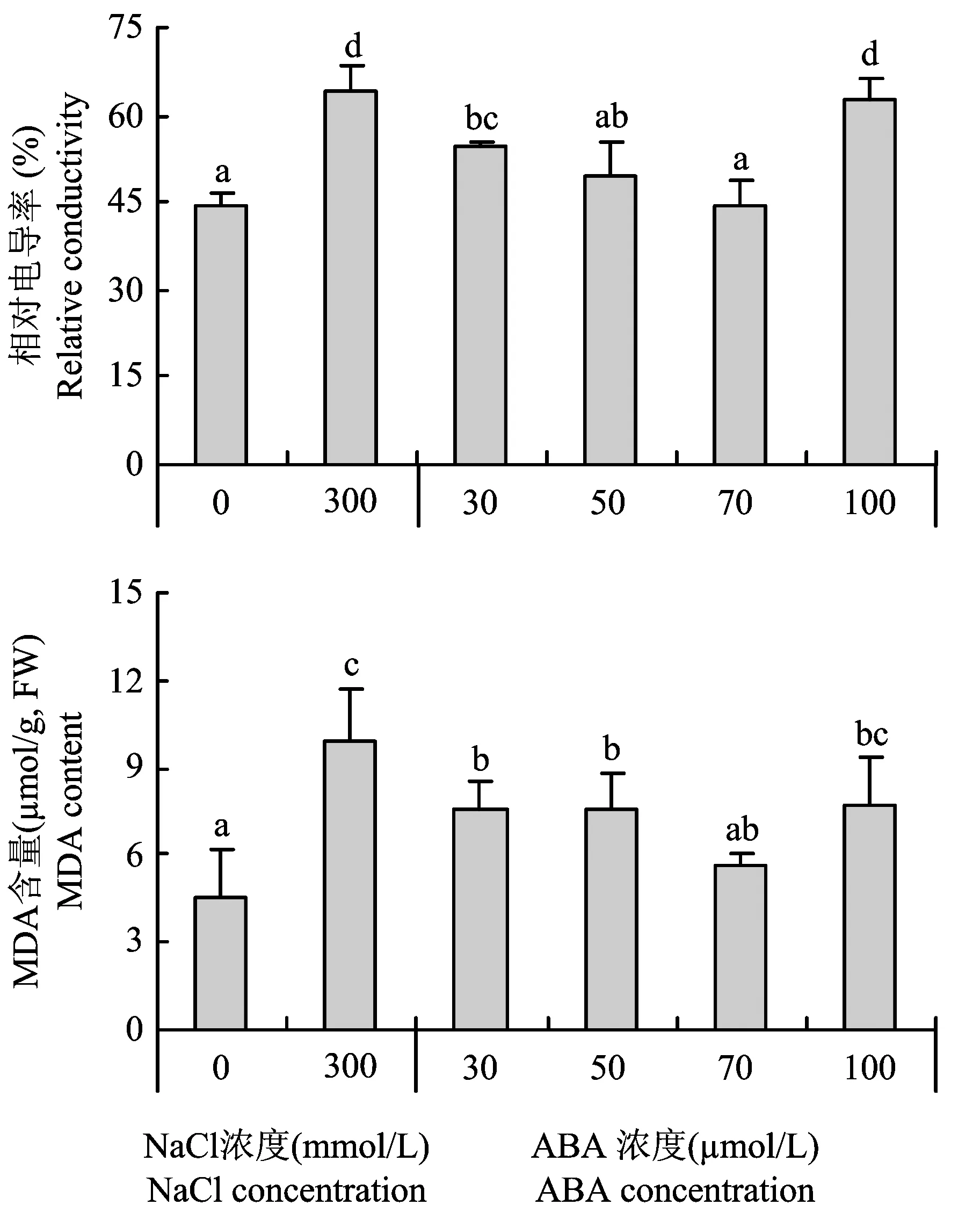
图5 不同ABA浓度对NaCl胁迫下甘薯幼苗叶片相对电导率和MDA含量的影响Fig.5 Effects of different concentration of ABA on membrane relative conductivity and MDA content of leaves of sweet potato seedlings under NaCl stress
2.2.3 不同ABA浓度对NaCl胁迫下甘薯幼苗叶片叶绿素荧光参数的影响由表4可以发现,在300mmol/LNaCl(0μmol/LABA)处理下,甘薯幼苗叶片的Fv/Fm、Vk、Ψ0、ΦE0、ΦD0与CK(对照)相比有显著差异,其中Fv/Fm、Ψ0、ΦE0显著降低,Vk和ΦD0显著增加; 在300mmol/LNaCl胁迫下喷施不同浓度ABA后,甘薯叶片荧光参数得到明显改善,其中喷施70μmol/LABA改善效果最好,Fv/Fm、Vk、Ψ0、ΦE0、ΦD0与0μmol/LABA处理相比缓解效果显著,与CK差异不显著; 喷施100μmol/LABA,甘薯幼苗Fv/Fm、Ψ0、ΦE0比喷施70μmol/LABA时明显降低,Vk和ΦD0有所升高,说明过高浓度的ABA不利于甘薯幼苗叶片PSⅡ活性的改善,降低光合作用。
3 讨论
3.1盐胁迫对甘薯幼苗生根及生理反应的影响
盐胁迫是限制植物生长发育的重要影响因子之一。在盐胁迫下,植株的形态、 相对干鲜质量、 生
表4喷施不同浓度ABA对300mmol/LNaCl胁迫下甘薯幼苗叶片叶绿素荧光参数影响
Table4ChlorophyllfluorescencesintheleavesofsweetpotatoseedlingsunderNaCl300mmol/LstressanddifferentconcentrationsofABA
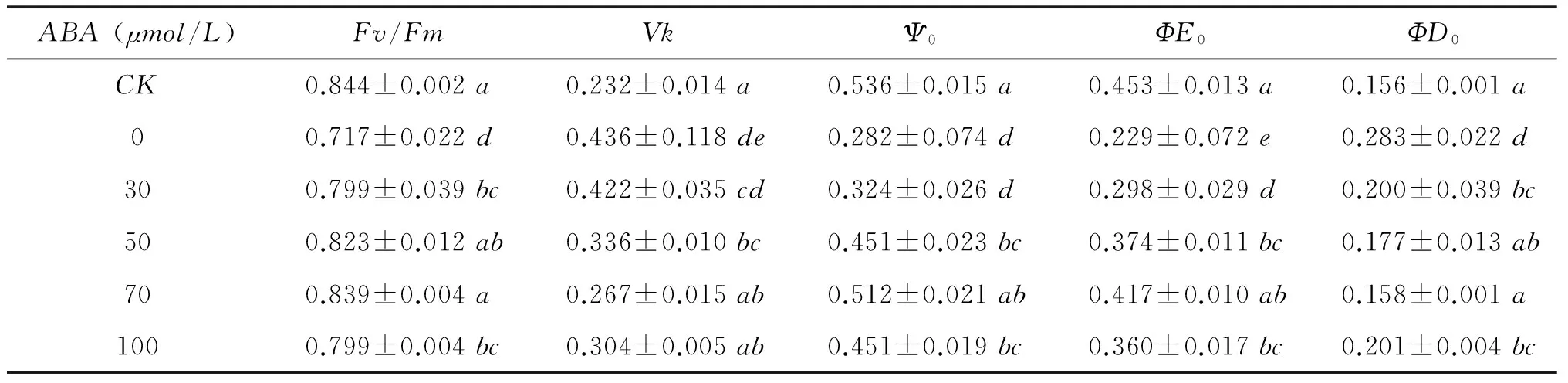
ABA(μmol/L)Fv/FmVkΨ0ΦE0ΦD0CK0.844±0.002a0.232±0.014a0.536±0.015a0.453±0.013a0.156±0.001a00.717±0.022d0.436±0.118de0.282±0.074d0.229±0.072e0.283±0.022d300.799±0.039bc0.422±0.035cd0.324±0.026d0.298±0.029d0.200±0.039bc500.823±0.012ab0.336±0.010bc0.451±0.023bc0.374±0.011bc0.177±0.013ab700.839±0.004a0.267±0.015ab0.512±0.021ab0.417±0.010ab0.158±0.001a1000.799±0.004bc0.304±0.005ab0.451±0.019bc0.360±0.017bc0.201±0.004bc
注(Note): 同列数值后不同字母表示差异显著(P<0.05)Valuesfollowedbydifferentlowercaseinthecolumnaresignificantlydifferent(P<0.05).

盐胁迫能影响离子在细胞内外的分布,对植物产生离子胁迫[21],同时还会对植物造成渗透效应,导致植物水分大量流失,为了维持细胞内水分平衡,许多小分子有机物质会大量积累。Wang等[22]对苜蓿进行盐胁迫发现细胞内有大量脯氨酸积累,Zhao等[23]发现,NaCl处理下大量Na+进入了玉米细胞的细胞质、 液泡、 叶绿体等部位,破坏了细胞的内部结构。本研究可以看出,随着NaCl浓度的增加甘薯幼苗叶片Na+含量逐渐增加,K+、Ca2+及K+/Na+逐渐降低,离子的动态平衡被破坏; 同时随盐胁迫增强徐薯25叶片中脯氨酸和可溶性糖含量逐渐增加,通过脯氨酸和可溶性糖的积累,细胞在一定程度上可以通过渗透调节从胞外吸收水分,减少细胞因为缺水而造成的功能降低。
盐胁迫对植物最关键的破坏就是对光合作用的影响[24]。随着NaCl浓度的增加,甘薯幼苗叶片的净光合速率、 蒸腾速率和气孔导度均显著降低,叶片光系统Ⅱ的活性下降,光系统Ⅱ的最大光化学效率降低,细胞内的放氧复合体遭到破坏,电子传递链的活性也明显下降。结果说明高浓度的盐胁迫还对光合器官造成了不可逆的损伤,使光合作用效率降低。
3.2ABA对盐胁迫下甘薯幼苗的缓解作用
ABA作为一种胁迫激素,在植物抵抗盐胁迫方面起着重要作用。ABA可以调控植物的生长发育及响应各种非生物胁迫[25]。施加外源ABA处理可以增强NaCl胁迫下羊草的膜稳定性,减少膜脂过氧化[26]。钟新榕等[3]对黄瓜幼苗研究发现施加外源ABA可以提高黄瓜幼苗POD活性,降低MDA的含量。本实验表明,对甘薯幼苗喷施70μmol/LABA可以显著提高幼苗的生根数目,显著降低相对电导率和MDA含量,最大限度地减少活性氧对膜脂的破坏,有效保护细胞膜,维持质膜的完整性,减轻膜脂过氧化作用。适当浓度ABA处理可使甘薯幼苗光系统Ⅱ的最大光化学效率和放氧复合体的活性明显得到改善,电子传递链的传递效率降低幅度也大大减缓。说明喷施ABA可以显著改善甘薯幼苗的光合作用,保护光合系统免受盐胁迫的破坏。Saradhi等[27]也证实外源ABA可以维持光合器官的稳定性,加速PSⅡ中心复合物光合状态的恢复过程,促进叶片光能的捕获和转化,提高光合作用,缓解盐胁迫对植株的伤害。
4 结论
盐胁迫对甘薯幼苗的生根、 抗氧化能力、 光合能力、 离子平衡等方面产生不利影响,对甘薯幼苗喷施70μmol/LABA能够显著缓解NaCl胁迫造成的伤害作用,维持细胞膜的稳定性,调节植物细胞的渗透和离子动态平衡,减少膜质过氧化,缓解PSⅡ光抑制的程度,改善植物的光合作用,最终缓解盐胁迫对植物的伤害作用,提高植物的耐盐性。因此,喷施70μmol/LABA是缓解NaCl胁迫效应,提高甘薯幼苗耐盐性的一种有效方法。
[1]HuangGT,MaSL,BaiLP, et al.Signaltransductionduringcold,saltanddroughtstressesinplants[J].MolecularBiologyReports, 2012, 39: 969-987.
[2]WangYL,MaFW,LiMJ, et al.PhysiologicalresponsesofkiwifruitplantstoexogenousABAunderdroughtconditions[J].PlantGrowthRegulation, 2011, 64: 63-74.
[3]钟新榕, 郁继华, 颉建明, 等.NaCl胁迫及外源ABA和GA3对黄瓜幼苗抗氧化酶活性的影响[J]. 甘肃农业大学学报, 2005, 40 (4): 467-470.
ZhongXR,YuJH,XieJM, et al.EffectofNaClstressandextrinsicABA,GA3onantioxidantenzymeactivityofcucumberseedlings[J].JournalofGansuAgriculturalUniversity, 2005, 40(4): 467-470.
[4]JiaHS,LuCM.Effectsofabscisicacidonphotoinhibitioninmaizeplants[J].PlantScience, 2003, 65 (6): 1403-1410.
[5]高叶, 赵术珍, 陈敏, 等.NaCl胁迫对甘薯试管苗生长及离子含量影响[J]. 安徽农业科学, 2008, 36(35): 15333-15335.
GaoY,ZhaoSZ,ChenM, et al.Effectofsodiumchloridestressongrowthofsweetpotatoplantletsinvitroandioncontent[J].JournalofAnhuiAgriculturalScience, 2008, 36(35): 15333-15335.
[6]柯玉琴, 潘廷国.NaCl胁迫对甘薯苗期生长、IAA代谢的影响及其与耐盐性的关系[J]. 应用生态学报, 2002, 13(10): 1303-1306.
KeYQ,PanTG.EffectsofNaClstressonseedlinggrowthandIAAmetabolismofsweetpotatoanditsrelationtosalttolerance[J].ChineseJournalofAppliedEcology, 2002, 13(10): 1303-1306.
[7]柯玉琴, 潘廷国.NaCl胁迫对甘薯叶片叶绿体超微结构及一些酶活性的影响[J]. 植物生理学报, 1999, 25(3): 229-233.
KeYQ,PanTG.EffectsofNaClstressontheultrastructureofchloroplastandtheactivitiesofsomeprotectiveenzymesinleavesofsweetpotato[J].PlantPhysiologyJournal, 1999, 25(3): 229-233.
[8]柯玉琴, 潘廷国.NaCl胁迫对甘薯叶片水分代谢、 光合速率、ABA含量的影响[J]. 植物营养与肥料学报, 2001, 7(3): 337-343.KeYQ,PanTG.EffectsofNaClstressonwatermetabolism,photosyntheticrateandintraneousABAinleavesofsweetpotato[J].PlantNutritionandFertilizerScience, 2001, 7(3): 337-343.[9]刘伟, 魏日凤, 潘延国.NaCl胁迫及外源Ca2+处理下甘薯幼苗叶片多胺水平的变化[J]. 福建农林大学学报, 2005, 34(2): 244-247.
LiuW,WeiRF,PanYG.ChangesofpolyaminelevelinsweetpotatoseedlingleavesunderNaClstressandCa2 +treatment[J].JournalofFujianAgricultureandForestryUniversity, 2005, 34(2): 244-247.
[10]王灵燕, 贾文娟, 鲍敬, 等. 不同甘薯品种苗期耐盐性比较[J]. 山东农业科学, 2012, 44(1): 54-57.
WangLY,JiaWJ,BaoJ, et al.Comparisonofseedlingsalinitytoleranceofdifferentsweetpotatovarieties[J] .ShandongAgriculturalSciences, 2012, 44(1): 54-57.
[11]过晓明, 李强, 王欣, 马代夫. 盐胁迫对甘薯幼苗生理特性的影响[J]. 江苏农业科学, 2011, 39(3): 107-109.
GuoXM,LiQ,WangX,MaDF.Effectsofsaltstressonphysiologicalcharacteristicsofsweetpotatoseedlings[J].JiangsuAgriculturalSciences, 2011, 39(3): 107-109.
[12]薛延丰, 刘兆普. 不同浓度NaCl和Na2CO3处理对菊芋幼苗光合及叶绿素荧光的影响[J]. 植物生态学报, 2008, 32(1): 161-167.
XueYF,LiuZP.EffectsofNaClandNa2CO3stressesonphotosynthesisandparametersofchlorophyllfluorescenceinhelianthustuberosusseedlings[J].JournalofPlantEcology, 2008, 32(1): 161-167.
[13]邵云, 王钰亮, 王小洁, 等. 3种质地土壤上As胁迫对小麦灌浆期旗叶光合特性的影响[J]. 华北农学报, 2012, 27(3): 150-155.
ShaoY,WangYL,WangXJ, et al.Effectsofarsenicstressongrowthandphotosyntheticcharacteristicsofwheatduringfillingstageinthreetexturesofsoil[J].ActaAgriculturaeBoreali-Sinica, 2012, 27(3): 150-155.
[14]LuttsS,KinerJM,BouharmontJ.NaCl-inducedsenescenceinleavesofrice(Oryza sativaL.)cultivarsdifferinginsalinityresistance[J].AnnalsofBotany, 1996, 78: 389-398.
[15]赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯. 1994,30(3): 207-210.
ZhaoSJ,XuCC,ZouQ, et al.Improvementsofmethodformeasurementofmalondialdehvdeinplanttissues[J].PlantPhysiologyCommunication, 1994, 30(3): 207-210.
[16]张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2005.
ZhangZL,QuWJ.Plantphysiologyexperimentinstruction[M].Beijing:HigherEducationPress, 2005.
[17]DasguptaM,SahooMR,KolePC, et al.Evaluationoforange-fleshedsweetpotato(Ipomoea batatasL.)genotypesforsalttolerancethroughshootapexcultureunderinvitroNaClmediatedsalinitystressconditions[J].PlantCellTissueOrganCulture, 2008, 94: 161-170.
[18]杨凤军, 李天来, 宿越, 等.NaCl、 单Na+、Cl-胁迫对不同番茄幼苗光合特性的影响[J]. 华北农学报, 2009, 24(4): 163-168.YangFJ,LiTL,SuY, et al.EffectsofNaClandNa+,Cl-stressonphotosyntheticcharacteristicsofdifferentgenotypesoftomatoseedlings[J].ActaAgriculturaeBoreali-Sinica, 2009, 24(4): 163-168.
[19]ChenQ,ZhangMD,ShenSH.Effectofsaltonmalondialdeh-
ydeandantioxidantenzymesinseedlingrootsofJerusalemartichoke(Helianthus tuberosusL.)[J].ActaPhysiologiaePlantarum, 2011, 33: 273-278.
[20]RahnamaH,EbrahimzadehH.TheeffectofNaClonantioxidantenzymeactivitiesinpotatoseedlings[J].BiologiaPlantarum, 2005, 49 (1): 93-97.
[21]ZhangZH,LiuQ,SongHX, et al.Responsesofcontrastingrice(Oryza sativaL.)genotypestosaltstressasaffectedbynutrientconcentrations[J].AgriculturalSciencesinChina, 2011, 10 (2): 195-206.
[22]WangXS,HanJG.Changesofprolinecontent,activityandactiveisoformsofantioxidativeenzymesintwoalfalfacultivarsundersaltstress[J].AgriculturalSciencesinChina, 2009, 8 (4): 431-440.
[23]ZhaoKF,SongJ,FanH, et al.GrowthresponsetoionicandosmoticstressofNaClinsalt-tolerantandsalt-sensitivemaize[J].JournalofIntegrativePlantBiology, 2010, 52 (5): 468-475.
[24]SaglamaA,SaruhanbN,TerziR, et al.Therelationsbetweenantioxidantenzymesandchlorophyllfluorescenceparametersincommonbeancultivarsdifferinginsensitivitytodroughtstress[J].RussianJournalofPlantPhysiology, 2011, 58 (1): 60-68.
[25]CutlerSR,RodriguezPL,FinkelsteinRR, et al.Abscisicacid:Emergenceofacoresignalingnetwork[J].AnnualReviewofPlantBiology, 2010, 61: 651-679.
[26]李建东, 王萍, 殷丽娟.NaCl胁迫下羊草幼苗的生理反应及外源ABA的缓解效应[J]. 应用生态学报, 1996, 7(2): 155-158.
LiJD,WangP,YinLJ.PhysiologicalresponseofAneurolepidium chinenseseedlingsonNaClstressandmitigationeffectofexternalABAonit[J].ChineseJournalofAppliedEcology, 1996, 7(2): 155-158.[27]SaradhiPP,SuzukiI,KatohA, et al.Protectionagainstthephoto-inducedinactivationofthephotosystemIIcomplexbyabscisicacid[J].PlantCellandEnvironment, 2000, 23: 711-718.
Enhancingthesalttoleranceofsweetpotatoseedlingsthroughexogenousabscisicacid
XIAOQiang1,WANGGang1,YIYan-jun1,SHIYan-xi2,YANGHong-bing1,LIUJia-yao1*
(1 College of Life Sciences, Qingdao Agricultural University/Key Lab of Plant Biotechnology in Universities of Shandong,Qingdao, Shandong 266109, China; 2 College of Resource and Environment, Qingdao Agricultural University,Qingdao, Shandong 266109, China)
【Objectives】Thephysiologicaleffectsofexogenousabscisicacid(ABA)onthetoleranceofsweetpotatoseedlingsvarietyXushu25toNaClstresswereanalyzedtoprovideatheoreticalbasisforenhancingthesalttoleranceandimprovingtheyieldofsweetpotato.【Methods】ThesweetpotatoseedlingsofvarietyXushu25weretreatedwithdifferentconcentrationsofNaCl,andtheleavesofsweetpotatoseedlingsexposedtoNaClwithdifferentconcentrationsinculturemediumswerecontinuouslysprayedbythesolutionscontainingdifferentconcentrationsofABAfor7d.Rootamountsofseedlingsweredetermined,andphotosynthesisindexwasmeasuredusingaportablephotosyntheticapparatus,andchlorophyllfluorescencewasdeterminedbyaplantefficiencyanalyzer.TheconcentrationsofNa+,K+,Ca2+inleavesweredeterminedbyatomicabsorptionspectrophotometer,andthelevelsofMDA,proline,solublesugarandtheactivityofsuperoxidedismutaseinleaveswererespectivelydeterminedbycolorimetricmethod.【Results】ThesweetpotatoseedlingswerelightlyaffectedbyNaClof50mmol/L.Withtheincreaseofsalinity,therootgrowthratewasdecreased,whiletherelativeconductivityandthecontentsofMDA,prolineandsolublesugarswereincreased,andtheactivityofsuperoxidedismutaseshowedanincreasetrend,andthengraduallydecreased.ThePn,Tr,Gs,Fv/Fm,Ψ0andΦE0valuesintheleavesweredecreased,butthoseforVkandΦD0increased.ExceptNa+,thecontentsofK+,Ca2+andtheratioofK+/Na+weredecreased.ThegrowthandmetabolismweresignificantlyaffectedbyhigherconcentrationofNaCl.ApplicationofexogenousABAsignificantlyabatesthepoisonouseffectofNaClonsweetpotatoseedlings,andthebesteffectwasobtainedinABAconcentrationof70μmol/L.【Conclusions】ExogenousABAcouldsignificantlypromotetherootgrowthofsweetpotatoseedlings,reducethedegreeofmembranelipidoxidation,andkeephighervaluesofFv/Fm,Ψ0andΦE0,butlowervaluesofVkandΦD0.Threrfore,leafsprayingwith70μmol/LofABAisrecommendedtoalleviatethetoxicitydamageofsweetpotatoseedlings.
sweetpotato;NaClstress;ABA;abatingeffects
2014-07-04接受日期: 2014-08-28网络出版日期: 2015-05-21
国家甘薯产业技术体系甘薯营养与栽培生理岗位(CARS-11-B-14); 国家自然科学基金项目(31270314); 青岛农业大学人才基金项目(630743); 山东省泰山学者岗位项目资助。
肖强(1988—),男,山东潍坊市人,硕士研究生,主要从事植物逆境生理研究。E-mail:exiaoqiang@126.com
Tel: 0532-86080631,E-mail:qdliujiayao@163.com
S531;S482.8+7
A
1008-505X(2016)01-0201-08

