人乳头瘤病毒分型检测用于妇女子宫颈癌筛查的分析
关 婷 周 龙 谢燕芳 杨 娟 姜 燕 盛 俊
深圳市计划生育服务中心(518000)
·临床研究·
人乳头瘤病毒分型检测用于妇女子宫颈癌筛查的分析
关 婷 周 龙 谢燕芳 杨 娟 姜 燕 盛 俊
深圳市计划生育服务中心(518000)
目的:探讨人乳头瘤病毒(HPV)分型检测在子宫颈癌筛查中的应用价值。方法:对2011年7月~2012年10月在深圳市基层计划生育服务机构接受子宫颈癌筛查的5882例妇女进行HPV分型检测。其中1032例同时接受液基细胞学(LCT)检查,选取可疑宫颈癌患者273例行阴道镜下活检,子宫颈上皮内瘤变Ⅱ级(CINⅡ)及以上级别定为病理检查结果阳性。①分析不同型别HPV检出情况;②以病理诊断为标准,评价HPV分型检测的敏感度和特异度。结果:①接受HPV分型检测的5882例妇女中,HPV感染率为13.0%(765/5882),单一亚型感染率为11.0%(650/5882),多重(≥2种亚型)感染率为2.0%(115/5882),感染率最高的5种HPV亚型依次为HPV16(2.4%,141/5882)、52(2.1%,123/5882)、58(1.7%,98/5882)、66(1.4%,80/5882)、18(1.3%,79/5882)。病检结果阳性者中,最常见的3种HPV亚型依次为HPV16(33.3%,20/60)、HPV52(18.3%,11/60)、HPV58(15.0%,9/60)。②HPV分型检测的敏感度为96.7% (58/60),特异度为11.3% (24/213)。结论:HPV分型检测作为子宫颈癌的初筛手段是可行的,可解决细胞学筛查基层阅片医生不足的问题。
乳头状瘤病毒科;宫颈肿瘤;宫颈上皮内瘤样病变;普查
子宫颈癌的发病率在中国女性恶性肿瘤中排第二位[1]。据WHO估计,每年全世界新发子宫颈癌病例逾47万,中国每年新发病例占全世界28%。人乳头瘤病毒(HPV)感染是子宫颈癌及其癌前病变的主要病因,其中高危型HPV持续感染与子宫颈癌的发病密切相关[2],HPV分型检测在子宫颈癌筛查中具有重要意义[3]。本研究依托深圳市基层计划生育服务机构进行大规模HPV分型检测,并与细胞学及病理学检查结果进行比较,探讨HPV分型检测在子宫颈癌筛查中的应用价值。
1 资料与方法
1.1 资料来源
2011年7月~2012年10月在深圳市各计划生育服务机构自愿接受子宫颈癌筛查的妇女5882例,平均年龄37±7(20~70)岁,均有性生活史,无与子宫颈相关的手术史。所有受检者均接受HPV分型检测,765例感染者中成功召回530例,行液基细胞学(LCT)检查;同时选取502例HPV检测阴性,但有接触性出血者,行LCT检查。最终选取273例行阴道镜下取材做病理检查。
1.2 方法
1.2.1 HPV分型检测 采用华大基因飞行时间质谱检测技术(MALDI-TOF MS)进行16种HPV-DNA亚型分析。①样本采集:用专用宫颈刷伸入颈管内0.5cm,顺时针旋转3~5圈,收集宫颈分泌物中的脱落细胞,置刷头于保存液中送检。②检测试剂与仪器:HPV DNA抽提采用BioQ公司的磁珠全基因组提取试剂盒。MALDI-TOF MS检测技术仪器及试剂均购自美国Agena公司。③检测原理:根据待检测样本终产物的质荷比(m/z)差异实现检测[4]。
1.2.2 液基细胞学检查(LCT) ①样本采集:窥器暴露宫颈,拭去宫颈表面分泌物,用AutoCyte专用宫颈刷收集宫颈及宫颈管的脱落上皮细胞,置毛刷头于保存液中,放置24h后制片;②薄片制作:制片和染色由AutoCyte全自动薄层细胞制片机一次完成,细胞学诊断采用TBS分级系统。意义未明的非典型鳞状上皮细胞(ASCUS)及以上级别定为结果阳性。
1.2.3 病理检查 阴道镜下取活组织病理检查。选取标准:①LCT检测阳性;②LCT检测阴性,但HPV16或18阳性;③LCT检测阴性且HPV阴性,但存在接触性出血。子宫颈上皮内瘤变Ⅱ级(CINⅡ)及以上为病理结果阳性。
1.3 统计学分析
采用SPSS19.0统计学软件进行数据分析。
2 结果
2.1 HPV分型检测结果
接受HPV分型检测的5882例妇女中,HPV总感染率为13.0%(765/5882),单纯(一种亚型)感染率为11.0%(650/5882),多重(≥2种亚型)感染率为2.0%(115/5882),感染率最高的5种亚型依次为HPV16 、52 、58、66、18 。见表1。病理结果阳性者中检出率最高的3种HPV亚型依次为HPV16(33.3%,20/60)、52(18.3%,11/60)、58(15.0%,9/60)。不同病理结果者HPV亚型检出情况见表2。

表1 5882例妇女HPV感染情况
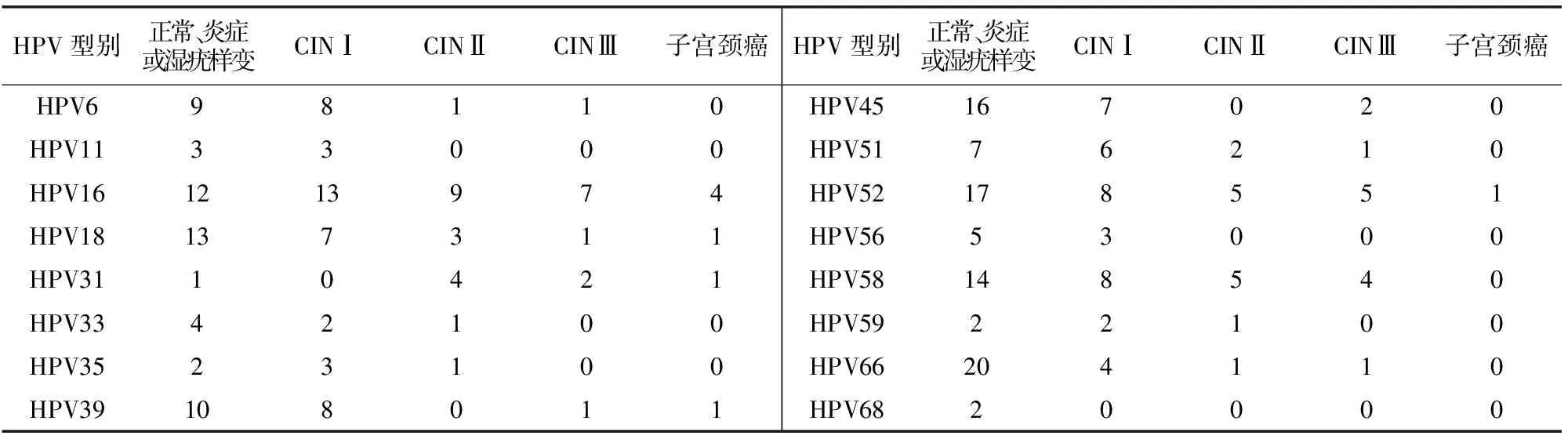
表2 不同病理结果者HPV亚型检出情况 (例)
2.2 HPV及LCT检测结果与病理结果比较
①LCT阳性且HPV阳性共计281例,成功召回201例作病理检查;②LCT阳性但HPV阴性共计19例,成功召回15例作病理检查;③LCT阴性,但HPV16或18亚型阳性共计57例,成功召回46例作病理检查;④LCT阴性且HPV阴性,但存在接触性出血者11例接受病理检查。共计273例接受病理检查,以病理检查结果为金标准,HPV、LCT检测的敏感度分别为为96.7 % (58/60)、88.3%(53/60),特异度分别为为11.3% (24/213)、23.5%(50/213)。见表3

表3 不同病理结果的HPV及LCT检测对比(例)
3 讨论
子宫颈癌是全球第二位常见的女性恶性肿瘤,中国子宫颈癌的发病数和死亡数约占全世界1/3,开展大规模人群宫颈癌筛查是降低子宫颈癌发病率和死亡率的关键[1,5]。遍布中国基层的公益类计划生育技术服务机构,为筛查工作提供了场所、人员等便利条件。但由于普遍缺乏细胞学医生,如果采用传统的宫颈脱落细胞学检查作为初筛方法难以实施,同时细胞学检查结果受制于阅片医生水平,存在主观性大、重复性差、假阴性率高的缺陷。HPV检测具有高通量、实验快速、结果客观、重复性好,对检测人员要求不高,存在成本-效益上的明显优势,极大地改变了子宫颈癌的筛查策略和临床诊疗[6-7]。
2011年欧洲生殖器官感染和肿瘤研究组织(EUROGIN)提出初筛应用HPV分型检测比应用细胞学检查能更多地发现子宫颈上皮内瘤变[3]。2014年,欧洲4国的一项随机对照试验结果发现,在检查的第3.5年和第5.5年随访时,HPV阴性者宫颈癌的累积发生率低于细胞学检查阴性者,HPV筛查预测子宫颈癌的效果相当于在细胞学检查方法的基础上提高60%~70%[8]。国内研究团队也提出HPV分型检测可以作为子宫颈癌筛查的初筛手段[9]。本研究中,HPV检测的敏感度为96.7%,高于LCT的88.3%,说明HPV分型检测作为基层计生机构子宫颈癌筛查的初筛手段是可行的。
HPV感染的型别分布在不同地区和不同种族的人群中具有一定差异性[10-11]。在世界范围内常见的HPV感染型别依次为HPV16、18、45、31、33[12],刘国忠等[13]对天津市444例妇产科门诊患者检测结果显示,HPV感染常见型别依次为HPV16、58、33、18、52。在本研究中,感染率高的前5种HPV亚型依次为HPV16(2.4%)、HPV52(2.1%)、HPV58(1.7%)、HPV66(1.4%)、HPV18(1.3%),在CINII级别的病变中感染HPV亚型排名前3的依次是HPV16(33.3%,20/60)、HPV52(18.3%,11/60)、HPV58(15.0%,9/60),提示不同型别的HPV病毒致病风险不同,说明HPV分型检测的必要性和重要性。
本研究中273例同时接受了HPV、LCT和病理检查。以病理检查为金标准,HPV检测CIN Ⅱ级及以上病变的敏感度(96.7%)高于LCT(88.3%);HPV检测的特异度(11.3%)低于LCT(23.5%)。HPV检测的特异度较低可能是由于在HPV DNA检测阳性患者中部分是一过性感染,且其DNA在凋亡细胞及细胞碎屑等临床无关条件下也可表达[6]。
有研究显示,子宫颈病变程度与高危型HPV感染率呈正相关,通过HPV分型检测识别出高危型HPV能有效提示子宫颈疾病的发展风险[14-16]。在子宫颈癌筛查中结合HPV16、HPV18分型,可以更好地进行风险分层管理[17]。2015年美国妇科肿瘤学会(SGO)和美国阴道镜和宫颈病理学会(ASCCP)发布了高危型HPV检测用于宫颈癌初筛的中期指南,明确指出对HPV16或HPV18感染者应直接进行阴道镜检查[18]。在本筛查中,对LCT阴性但HPV16或18亚型阳性的感染者直接行阴道镜下活检,避免了单一细胞学检查所造成的漏诊、误诊,对高风险人群的分流管理具有重要意义。
综上所述,HPV分型检测筛查宫颈癌敏感度高,可解决基层阅片医生不足的问题,提高了大规模筛查子宫颈癌的可行性。
[1] 郎景和. 精确筛查风险分层HPV与子宫颈癌防治[J]. 中华妇产科杂志, 2014,49(10):746-748.
[2] Ronco G, Giorgi-Rossi P, Carozzi F, et al. Efficacy of human papillomavirus testing for the detection of invasive cervical cancers and cervical intraepithelial neoplasia: a randomised controlled trial[J]. Lancet Oncol, 2010,11(3):249-257.
[3] Li N, Franceschi S, Howell-Jones R, et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication[J]. Int J Cancer, 2011,128(4):927-935.
[4] Söderlund-Strand A, Dillner J, Carlson J. High-throughput genotyping of oncogenic human papilloma viruses with MALDI-TOF mass spectrometry[J]. Clin Chem, 2008,54(1):86-92.
[5] 郎景和. 迎接子宫颈癌预防的全球挑战与机遇[J]. 中华妇产科杂志, 2002,37(3):129-131.
[6] 李广太. HPV检测在子宫颈癌筛查中的意义[J]. 中华妇产科杂志, 2015,(4):241-245.
[7] Wright T, Huang J, Baker E, et al. The budget impact of cervical cancer screening using HPV primary screening[J]. Am J Manag Care, 2016,22(3):95-95,105.
[8] Ronco G, Dillner J, Elfström KM, et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials[J]. Lancet, 2014,383(9916):524-532.
[9] 马莉, 丛笑, 卞美璐, 等. 高危型HPV分型检测作为子宫颈癌及其癌前病变初筛手段的探讨[J]. 中华妇产科杂志, 2015,(4):246-252.
[10] Youssef MA, Abdelsalam L, Harfoush RA, et al. Prevalence of human papilloma virus (HPV) and its genotypes in cervical specimens of Egyptian women by linear array HPV genotyping test[J]. Infect Agent Cancer, 2016,11:6.
[11] Zoa AS, Ndjoyi MA, Mabika MB, et al. Human papillomavirus genotypes distribution among Gabonese women with normal cytology and cervical abnormalities[J]. Infect Agent Cancer, 2016,11:2.
[12] Munoz N, Bosch FX, Castellsagué X, et al. Against which human papillomavirus types shall we vaccinate and screen? The international perspective[J]. Int J Cancer, 2004,111(2):278-285.
[13] 刘国忠, 于黎明, 宋海燕, 等. HPV分型检测在子宫颈病变诊断中的应用[J]. 中华妇产科杂志, 2014,49(6):446-450.
[14] Castle PE, Stoler MH, Wright TC, et al. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study[J]. Lancet Oncol, 2011,12(9):880-890.
[15] Wright TC, Stoler MH, Sharma A, et al. Evaluation of HPV-16 and HPV-18 genotyping for the triage of women with high-risk HPV+ cytology-negative results[J]. Am J Clin Pathol, 2011,136(4):578-586.
[16] Stoler MH, Wright TC, Sharma A, et al. High-risk human papillomavirus testing in women with ASC-US cytology: results from the ATHENA HPV study[J]. Am J Clin Pathol, 2011,135(3):468-475.
[17] Ebisch RM, de Kuyper-de Ridder GM, Bosgraaf RP, et al. The clinical value of HPV genotyping in triage of women with high-risk-HPV-positive self-samples[J]. Int J Cancer, 2016,139(3):619-699.
[18] Huh WK, Ault KA, Chelmow D, et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: interim clinical guidance[J]. Obstet Gynecol, 2015,125(2):330-337.
[责任编辑:张 璐]
Analysis of application of HPV genotyping testing in cervical cancer screening
GUAN Ting,ZHOU Long,XIE Yanfang,YANG Juan,JIANG Yan,SHENG Jun
ShenzhenFamilyPlanningServiceCenter,Guangdong, 518000
Objective: To explore the value of HPV genotyping testing in cervical cancer screening. Method:From July 2011 to October 2012, 5882 women voluntarily accepted HPV genotyping test in grass root level family planning instation of Shenzhen. In which, 1032 women were examined by liquid based cytology (LCT). 273 women who were suspected sickening cervical cancer had
pathological examination. Equal to or above cervical intraepithelial neoplasia(CIN) Ⅱ was as a positive pathologic examination results. Detection of different type HPV was analyzed. And sensitivity and specificity of HPV detection based on pathological diagnosis as gold standard were further evaluated. Result:1.The total infection rate of HPV was 13.0%(765/5882),and rate of infected by single subtype HIV was 11.0%(650/5882), rate of infected by multiple subtypes (two or more subtypes) was 2.0%(115/5882). The highest rate of 5 subtypes HIV infected was HPV16(2.4%,141/5882), HPV52(2.1%,123/5882), HPV58(1.7%,98/5882), HPV66(1.4%,80/5882),and HPV18(1.3%,79/5882). Among the women with positive pathologic results, the most common 3 HPV subtypes were HPV16(33.3%,20/60), HPV52(18.3%,11/60), and HPV58(15.0%,9/60). 2. Pathological examination results were used as gold standard, the sensitivity of genotyping testing was 96.7% (58/60), and the specificity was 11.3% (24/213). Conclusion:It is feasible that HPV genotyping testing as the primary screening method of cervical cancer, and can solve service staff insufficient of cytology screening read at the grass-roots level.
Papillomaviridae;Uterine cervical neoplasms;Cervical intraepithelial eoplasia
广东省人口和计划生育委员会科研项目(20110247)
2016-03-18
2016-05-19
10.3969/j.issn.1004-8189. 2016.08

