碳酸锂在水中的溶解度和超溶解度的测定及热力学分析
宋昌斌,李润超(青海盐湖镁业有限公司,青海 格尔木 86099;北京四中高三(5)班,北京 00088)
研究开发
碳酸锂在水中的溶解度和超溶解度的测定及热力学分析
宋昌斌1,李润超2
(1青海盐湖镁业有限公司,青海 格尔木 816099;2北京四中高三(5)班,北京 100088)
固体溶质在溶剂中的溶解度和超溶解度数值决定了结晶介稳区的宽度,而溶质结晶分离过程又是在介稳区中进行操作,因此固体溶质的溶解度和超溶解度在工业结晶中是很重要的基础数据。本文以碳酸锂为溶质,在标准压力条件和283.15~318.15K温度条件下,用重量分析法测定其在水中的溶解度;用激光动态法测定其在一定温度条件下在水中的超溶解度,从而得到碳酸锂在水溶液中的介稳区;结果显示,碳酸锂在水中的溶解度和超溶解度均随温度的升高而减小,介稳区宽度随温度的升高而变窄;其溶解度数据用Van't Hoff方程和修正的Apelblat方程进行了热力学关联计算,结果表明,两种热力学模型对碳酸锂在水中溶解度的关联效果都很好,其中Van't Hoff方程和修正的Apelblat方程的计算值与实验值的平均相对偏差分别为0.54%和0.20%。通过溶解热力学计算,得到碳酸锂在水中的溶解焓∆Hd、熔解熵 ΔSd和溶液标准吉布斯自由能变∆Gd,结果表明该溶解过程为放热熵减小的非自发过程,并且溶解熵变对溶解过程的影响较大。
碳酸锂;水;溶解度;超溶解度;介稳区;热力学计算
碳酸锂(Li2CO3)是制备各种锂化合物的原料,在玻璃、陶瓷、冶金、能源、医药等行业中应用广泛。高纯度的碳酸锂是电子材料、磁性材料、光学材料和原子能工业的必需品,实际生产中对碳酸锂产品的纯度要求很高[1-2]。世界上锂资源分布广泛,盐湖型锂资源占世界锂资源储量的70%,常用的盐湖提锂技术有沉淀法、溶剂萃取法、离子交换吸附法、煅烧浸取法等,高纯碳酸锂主要是由重结晶法制得[3]。
溶质在溶剂中的溶解度和超溶解度决定了结晶介稳区的宽度,而结晶过程又是在介稳区中进行操作,因此固体溶质的溶解度和超溶解度在工业结晶中是很重要的基础数据。碳酸锂在水中的溶解度和超溶解度对于工业结晶生产有着重要的指导意义[4]。
本文通过实验测定了碳酸锂在一定温度条件下在水中的溶解度和超溶解度数据,得到一定温度和操作条件下碳酸锂在水溶液中的介稳区,并用热力学模型对溶解度进行关联得到热力学参数,从而可以计算预测得到碳酸锂在水中其他温度条件下的溶解度,为结晶工艺优化和工业生产提供指导依据。
1 实验部分
1.1碳酸锂在水中的溶解度测定
1.1.1实验原料
去离子水,实验室自制;碳酸锂,纯度0.99,北京华威锐科化工有限公司。
1.1.2实验仪器
Sartorius CP124S电子分析天平,德国Sartorius公司;THZ-82A水浴恒温振荡器,江苏金坛市科析仪器有限公司;DZ-2BCⅡ真空干燥箱,天津泰斯特仪器有限公司;TW-4A真空泵,合肥拓天真空设备有限公司;温度计,玻璃培养皿。
1.1.3实验步骤
本文测定碳酸锂溶解度的实验用重量分析法,实验装置如图1所示,在含有40mL去离子水的锥形瓶中加入过量的碳酸锂溶质,把上述锥形瓶放入恒温水浴振荡器中,恒温震荡摇晃72h以上,恒温条件下再静置12h以上,然后用5mL的注射器抽取大约5mL的上清液,通过0.25μm的滤膜过滤再注入空的培养皿中,称量得到含一定量饱和上清液的培养皿的质量,含饱和上清液的培养皿放入真空干燥箱中烘干72h以上,直到每隔1h称量得到的培养皿质量不变,可视为碳酸锂溶质完全烘干,称量得到含有碳酸锂溶质的培养皿的质量。所有的实验重复操作3次,取测量结果的平均值作为碳酸锂在水中的溶解度。
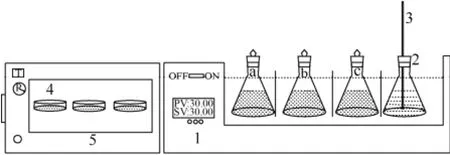
图1 溶解度测定实验装置
1.2碳酸锂在水中的超溶解度测定
1.2.1实验原料
去离子水,实验室自制;碳酸锂,纯度0.99,北京华威锐科化工有限公司。
1.2.2实验仪器
Sartorius CP124S电子分析天平,德国Sartorius公司;玻璃夹套溶解釜(定制),北京北玻科实玻璃仪器公司;99-1型磁力搅拌器,巩义予华仪器有限公司;JDW-3型激光电源,北京大学物理系;MPG-10C型制冷和加热循环槽,上海一恒科学仪器有限公司。
1.2.3实验步骤
采用激光动态法测定了一定温度范围内碳酸锂在水中的超溶解度,实验装置如图2所示。配制一定浓度的碳酸锂溶液加入溶解釜中,在溶液达到平衡时,再将温度降低至低于溶解温度 10℃,保持30min,在300r/min的搅拌速率和0.2℃/min的升温速率条件下进行升温结晶,取红外强度信号突然发生下降时的温度为出晶温度,记录碳酸锂的浓度和结晶温度,重复测定3次取平均值作为碳酸锂在水中的超溶解度。
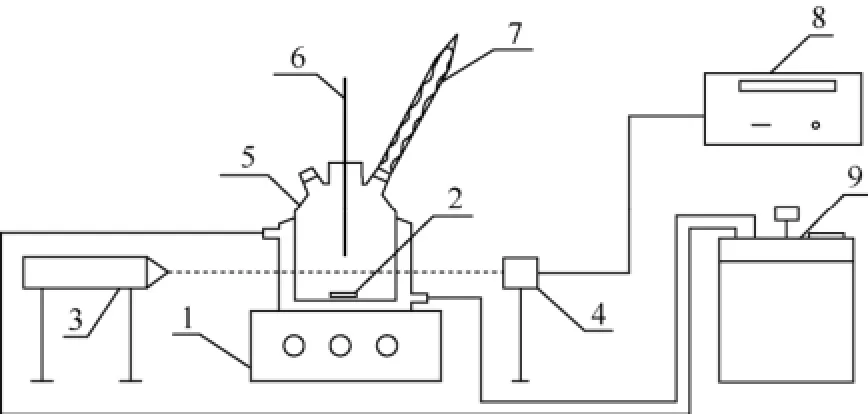
图2 超溶解度测定实验装置
碳酸锂在水中的溶解度用摩尔分数x1表示,如式(1)。
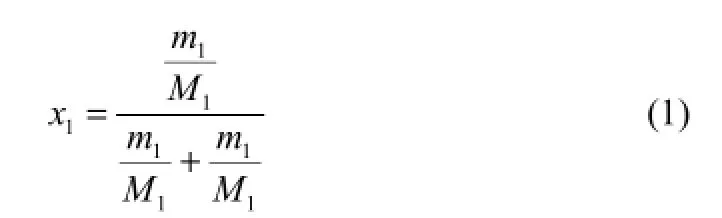
式中,m1和m2分别为碳酸锂、水的质量,g;M1和M2分别为碳酸锂、水的摩尔质量,g/mol。
碳酸锂溶质在水中的摩尔溶解度的模型关联值与实验值的相对偏差用RD表示,计算如式(2)。

式中,x1,i表示某温度下碳酸锂溶解度的实验值;x1,ical表示某温度下碳酸锂溶解度的模型关联值。
碳酸锂固体溶质在水中的模型关联拟合效果用平均相对偏差(RAD)来表示,计算见式(3)。

式中,N为碳酸锂在水中溶解度的实验数据点的数目。
相对过饱和度是指超过饱和度的那部分溶质的量与饱和度的比值,表示溶液结晶过程中过饱和的程度[5]。碳酸锂溶液的过饱和度计算如式(4)。)

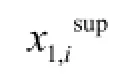
1.3关联模型
1.3.1Van't Hoff方程
Van't Hoff方程是活度系数方程的简化形式,在理想溶液中,溶质摩尔分数的对数值和绝对温度的倒数呈现线性相关的关系[6],方程如式(5)。
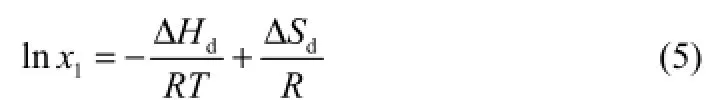
式中,x1是溶质的摩尔分数;T是绝对温度;R是理想气体常数;ΔHd和 ΔSd分别代表溶解焓和溶解熵。
1.3.2修正的Apelblat方程
修正的 Apelblat方程是一个半经验方程[7],由于它的简单性,被广泛用于溶解度的关联过程中,方程如式(6)。
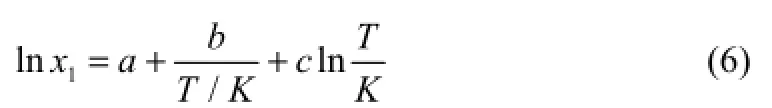
式中,a、b、c为量纲为1的关联参数;T为热力学温度,K。
1.4碳酸锂的溶解热力学数据的计算方法
由Van't Hoff方程可知[8],溶解过程中的焓和熵满足如式(7)、式(8)
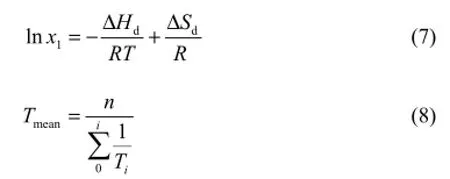
式中,R为通用气体状态常数,8.314J/(mol·K);∆Sd为溶解熵,J/mol;∆Hd为溶解焓,J/(mol·K);Tmean为体系的平均温度,K。
溶液吉布斯自由能变和溶解焓、溶解熵、平均温度的关系如式(9)。

溶解焓和溶解熵为溶解过程中的驱动力,二者所占的比例分别用ξH、ξTS表示[9-11],如式(10)、式(11)。
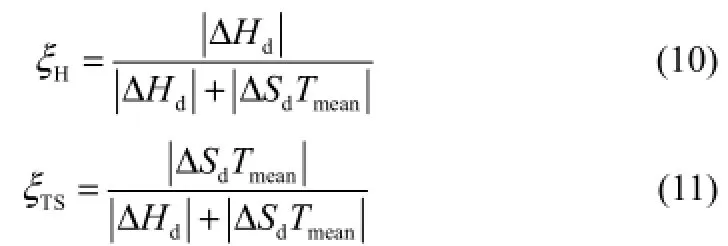
2 结果与讨论
2.1实验装置准确性检验
本实验使用重量分析法测定了碳酸锂在水中的溶解度并且与文献值进行了对比(表1),最大误差<1%,对比结果误差很小,说明实验装置实验方法可靠。
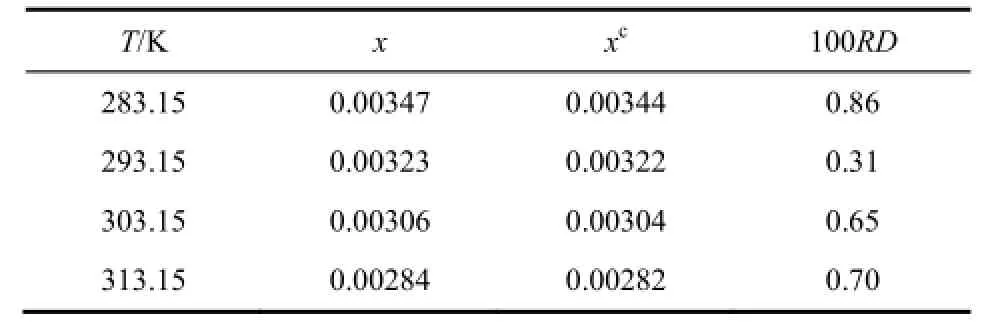
表1 碳酸锂在水中的溶解度数据
2.2碳酸锂在水中溶解度的实验结果分析
碳酸锂在水中的溶解度,用Van't Hoff方程和修正的Apelblat方程关联得到热力学参数,并计算得到溶解度的模型关联拟合值以及实验值和计算值之间的相对偏差,模型关联的偏差如表2所示。从表2可以看出,用Van't Hoff方程关联的相对偏差最大不超过0.73%,其平均相对偏差为0.54%;用修正的Apelblat方程关联的相对偏差最大不超过0.35%,其平均相对偏差为0.20%,相对误差都很小,说明关联效果较好。Van't Hoff方程和修正的Apelblat方程关联的参数列于表3。还可以根据需要用热力学模型参数计算得到其他温度下碳酸锂在水中的溶解度数据,从而为结晶分离提供基础数据。

表2 溶解度的实验值以及Van't Hoff方程和修正的Apelblat方程关联得到的溶解度计算值和实验值的偏差

表3 修正的Apelblat方程和Van't Hoff方程回归得到的参数值
图 3为碳酸锂在水中的溶解度随温度变化的曲线(曲线为修正的三参数模型拟合得到的溶解度曲线),从曲线可以看出,随着温度的升高,碳酸锂在水中的溶解度是减小的,这可能是因为碳酸锂在水中的溶解过程是放热的,根据平衡移动原理,随着温度的升高,平衡向有利于吸热的方向移动,导致碳酸锂在水中的溶解度随着温度的升高而减小。
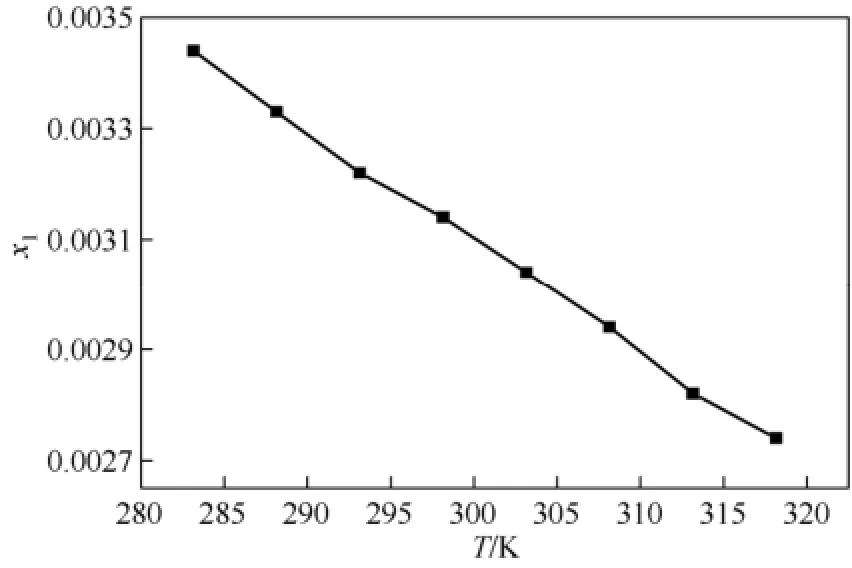
图3 碳酸锂在水中的溶解度曲线
2.3碳酸锂在水中超溶解度的实验结果分析
碳酸锂在水中的溶解度、超溶解度和过饱和度数值如表4所示,碳酸锂在水中的溶解度和超溶解度随温度的变化曲线如图4所示。由图4可以看出,碳酸锂在水中的溶解度和超溶解度均随温度升高而减小,其超溶解度数值恒大于其溶解度数值,并且随着温度的升高,溶解度和超溶解度的差值逐渐变小,碳酸锂在水溶液中的介稳区宽度随温度的升高而变窄。这可能是因为高温条件下溶质的溶解度降低,并且高温条件还可以加速碳酸根离子和锂离子的运动和相互碰撞,促进溶质传递过程,有利于碳酸锂晶体晶核的生成长大[12]。所以结晶生产过程中,如果溶液温度过低,浓度过高,那么其结晶的介稳区很宽,结晶过程需要的时间偏长;如果溶液温度过高,浓度过低,那么其结晶的介稳区会很窄,结晶过程不容易控制,结晶得到的碳酸锂晶体晶型粒度分布等不是很理想,所以应该选择合适的溶液浓度和结晶温度进行结晶分离操作。
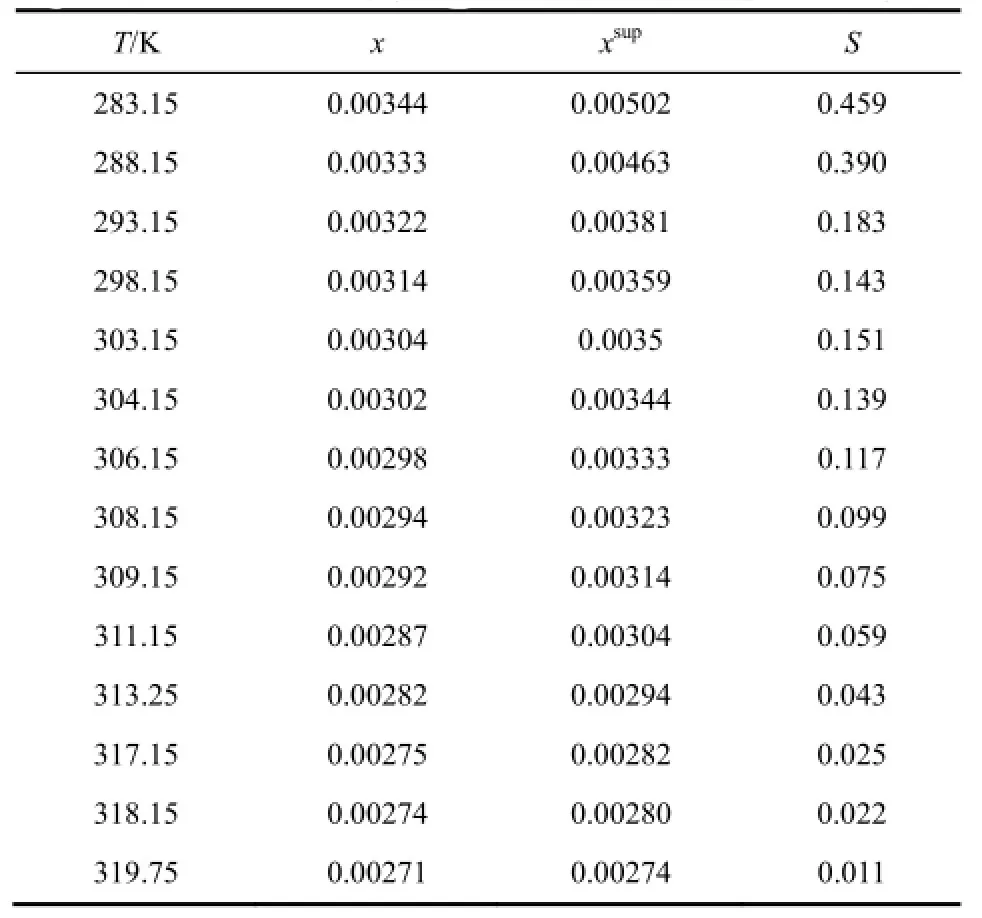
表4 碳酸锂在水中的溶解度、超溶解度和过饱和度数值
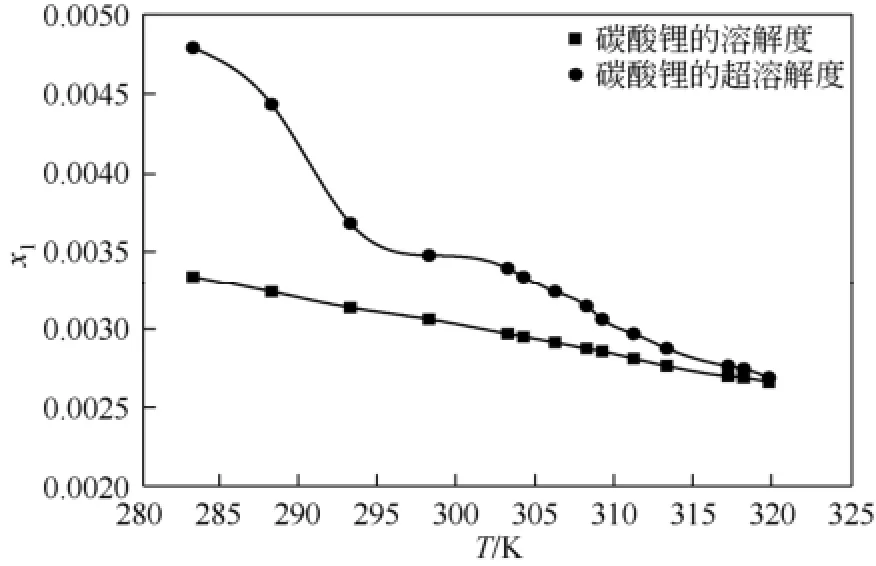
图4 碳酸锂在水中的溶解度和超溶解度曲线
盐湖卤水结晶分离提纯碳酸锂的过程中,选择合适的碳酸锂浓度和溶液体系温度,控制结晶过程中介稳区加入晶种的量、搅拌速率、降温速率等工艺条件,可以得到纯度和收率高、晶型好、粒度分布均匀的碳酸锂晶体产品。
由表4可以看出,其过饱和度数值随温度升高而减小,且数值均大于 0,表明同一温度下,碳酸锂在水中的超溶解度均大于其溶解度,并且随着温度的增加,碳酸锂在水中的超溶解度和溶解度数值差别减小,所以碳酸锂结晶生产过程中,应该合理控制适当的碳酸锂溶液浓度和结晶温度等操作条件。可以选择过饱和度数值为0.15~0.20的碳酸锂溶液浓度和温度条件,进行结晶分离操作。
2.4溶解热力学计算
根据热力学原理,溶液的∆Sd和∆Hd可以认为是不随温度变化的常数,从式(7)可知,lnx1是关于1/T的一条直线,通过线性拟合可以得到直线的斜率和截距,可以进一步求得∆Sd和∆Hd。实验的平均温度采用式(8)计算得到 Tmean=300.213K,再根据式(9)求得溶解过程中的吉布斯自由能的变化值∆Gd。碳酸锂在水中的溶解过程中的焓变∆Hd、熵变∆Sd、吉布斯自由能变∆Gd、焓驱动ξH、熵驱动ξTS这5个热力学参数列于表5中。
从表5可以得出,∆Hd<0,说明溶解过程为放热过程,∆Sd<0为熵减小的过程,∆Gd>0溶解过程为非自发过程。在溶解过程中,计算得到ξTS>ξH,溶解过程为熵驱动过程。

表5 碳酸锂溶解过程中的热力学参数
3 结 论
通过分析283.15~318.15K温度条件下碳酸锂在水中的溶解度,可得到以下结论。
(1)在一定温度范围内,碳酸锂在水中的溶解度随温度升高而减小。
(2)碳酸锂在水中的溶解度用Van't Hoff方程和修正的Apelblat方程进行热力学关联,关联得到的平均相对偏差分别为0.54%和0.20%。表明这两个热力学模型能够很好地关联碳酸锂在水中的溶解度,并且可以用Van't Hoff方程和修正的Apelblat方程来关联预测得到其他温度下碳酸锂在水中的溶解度数值,进而为工业结晶生产碳酸锂提供基础依据。
(3)通过溶解热力学计算,得到∆Hd和∆Sd两个热力学参数,溶解过程中的∆Hd和∆Sd为负值,说明溶解过程为放热熵减小过程,∆Gd为正值,说明溶解过程为非自发的过程。并且ξTS>ξH,说明碳酸锂在水中的溶解过程为熵驱动过程。
通过分析实验温度范围内碳酸锂在水中的超溶解度数值,可得到以下结论。
(1)在实验温度范围内,碳酸锂在水中的超溶解度随温度的升高而减小,其超溶解度数值恒大于其溶解度数值,并且随着温度的升高,溶解度和超溶解度的差值逐渐变小,碳酸锂在水溶液中的介稳区宽度随温度的升高而变窄。
(2)盐湖卤水结晶分离提纯碳酸锂的过程中,选择合适的碳酸锂浓度和溶液体系温度,控制结晶过程中介稳区加入晶种的量、搅拌速率、降温速率等工艺条件,可以得到纯度和收率高、晶型好、粒度均匀的碳酸锂晶体产品。
[1]李燕茹,朱亮,袁建军,等. 粗级碳酸锂提纯工艺过程研究[J]. 无机盐工业,2013,45(8):15-17.
[2]伊文涛,闫春燕,戴志锋,等. 高纯碳酸锂的应用与制备方法评述[J]. 化工矿物与加工,2005(11):5-8.
[3]黄维农,王学魁,孙之南,等. 扎布耶盐湖卤水碳酸锂恒温平衡浓度和结晶规律初步研究[J]. 盐业与化工,2009,38(2):8-16.
[4]LI Bingbo,LI Ruopen,YAN Weidong. Solubilities of phloretin in 12 solvents at different temperatures[J]. Chemical &Engineering Data,2011,56(4):1459-1462.
[5]伊文涛,闫春燕,戴志锋,等. 碳酸锂结晶动力学与机理研究[J].化工矿物与加工,2010(2):4-7.
[6]HUANG C,XIE Z,XU J,et al. Experimental and modeling studies on the solubility of d-pantolactone in four pure solvents and ethanol-water mixtures[J]. J. Chem. Eng. Data,2015,60(3):870-875.
[7]APELBLAT A,MANZUROLA E. Solubilities of o-acetylsalicylic,4-aminosalicylic,3,5-dinitrosalicylic,andp-toluic acid,and magnesium-DL-aspartate in water from T =(278 to 348)K[J]. J. Chem. Thermodyn,1999,31(1):85-91.
[8]HIGUCHI T,CONNORS K A. Phase-solubility techniques[J]. Adv. Anal. Chem. Instrum,1965,4(2):117-212.
[9]SOUSA J M M V, FONSECA I M A. Solubility of hydrofluorocarbons in halobenzene solvents[J]. Journal of Chemical & Engineering Data,2014,59(11):3605-3609.
[10]TIAN Y,LI J,WU B,et al. Determination and modeling of the solubility of 2,4-dimethoxybenzoic acid in six pure and isopropanol+ ethyl acetate mixed organic solvents at temperatures from (288.15 to 323.15) K[J]. Journal of Chemical & Engineering Data,2015,60(4):1098-1105.
[11]SUN X,YIN Q,DING S,et al. Solid-liquid phase equilibrium and ternary phase diagrams of ibuprofen-nicotinamide cocrystals in ethanol and ethanol/water mixtures at (298.15 and 313.15) K[J]. Journal of Chemical & Engineering Data,2015,60(4):1166-1172.
[12]李艳茹,袁建军,朱亮,等. 盐湖卤水碳酸锂提取工艺过程研究[J].无机盐工业,2013,45(7):12-14.
Measurement and thermodynamic analysis of the solubility and supersolubility of lithium carbonate in water
SONG Changbin1,LI Runchao2
(1Qinghai Salt Lake Magnesium Industry Co.,Ltd.,Geermu 816099,Qinghai,China;2Beijing No.4 Middle School,High Senior Three Class 5,Beijing 100088,China)
The solubility and supersolubility determines the width of the metastable state and the crystallization process is operated in the metastable zone. Therefore,the solubility and supersolubility are an important basic data in industrial crystallization process. In this study,lithium carbonate was used as solute and the solubility of lithium carbonate in water was measured at (283.15 to 318.15) K and atmospheric pressure by using a gravimetric method. The supersolubility was measured by using a laser dynamic method. It was obviously showed that the solubility and supersolubility of lithium carbonate in water and the width of the metastable zone decreased with increasing temperature.The solubility data was correlated by Van't Hoff equation and modified Apelblat equation. The results indicated that the solubility of calculated values was in good agreement with the experimental values. The average relative deviation of the Van't Hoff equation and the modified Apelblat equation were 0.54% and 0.20%,respectively. The changes of enthalpy(ΔHd),entropy(ΔSd)and Gibbs free energy (ΔGd)of the dissolving process were obtained by the thermodynamic calculation. The dissolving process was a non-spontaneous process of exothermic and Entropy. The entropy change was the main influencing factor in the dissolution process.
lithium carbonate;water;solubility;supersolubility;metastable zone;thermodynamic calculation
TQ 013.1
A
1000-6613(2016)08-2350-05
10.16085/j.issn.1000-6613.2016.08.07
2016-01-13;修改稿日期:2016-03-10。
及联系人:宋昌斌(1987—),男,工程师。E-mail
15209790330@163.com。

