云南蓝果树凋落物对其天然更新的影响1)
张珊珊 向振勇 康洪梅 杨文忠
(国家林业局云南珍稀濒特森林植物保护和繁育重点实验室(云南省林业科学院),昆明,650201)
云南蓝果树凋落物对其天然更新的影响1)
张珊珊向振勇康洪梅杨文忠
(国家林业局云南珍稀濒特森林植物保护和繁育重点实验室(云南省林业科学院),昆明,650201)
为了探讨云南蓝果树(NyssayunnanensisW.C.Yin)濒危机理,采用野外调查和室内控制相结合的方法,分析云南蓝果树凋落物对其天然更新的影响。结果表明:野外条件下,去除凋落物处理对云南蓝果树种子萌发率和幼苗都有显著的影响。室内受控实验发现,凋落物厚度和凋落物位置对云南蓝果树种子萌发和幼苗的影响差异显著;不同质量分数的凋落物浸提液,显著影响云南蓝果树的种子萌发率及幼苗的生长,抑制程度随浸提液质量分数的增加而增强。云南蓝果树幼苗生长受限与其根部丛枝菌根真菌被浸提液抑制有关。因此,云南蓝果树凋落物对其天然更新具有物理阻碍作用和化感作用,应定期对天然林合理地清理林下凋落物,以促进云南蓝果树的天然更新。
云南蓝果树;凋落物;天然更新;种子萌发;幼苗生长
In order to explore the endangered mechanism ofNyssayunnanensisand make effective protection, we used in-situ experiment in field and manipulated greenhouse experiments to examine the physical and allelopathic effects of litter onN.yunnanensisnatural regeneration. The seed germination and seedling growth ofN.yunnanensiswere significantly inhibited by the litter in the field. Different thickness and different seed-sowing positions of litter had significant physical effects on seed germination and seedling growth. Allelochemicals in the litter also inhibited seed germination and seedling formation, which was evidenced by the fact of different concentrations of the litter extractions. Different concentrations of litter had significant negative allelopathic effects, and the inhibition degree of seed germination rate and seedling growth were aggravated with the increasing of the concentration. The inhibition ofN.yunnanensisseedling growth may be due to the inhibition of AMF symbiosis ion in theN.yunnanensisroot. Therefore, the litter in the forest has physical and chemical impacts on seed germination and seedling growth ofN.yunnanensis, and the conservation strategies should be dedicated to ameliorating the effects of litter and enhancing natural regeneration through regularly cleaning up the natural forest litter.
云南蓝果树(NyssayunnanensisW.C.Yin)为国家Ⅰ级重点保护野生植物,云南特有种和极危种[1]。云南蓝果树天然种群及幼苗数量都极少,已经低于稳定存活界限,濒临灭绝,属于典型的极小种群物种。但迄今为止,对云南蓝果树濒危机制的研究甚少,仅见于系统分类、形态修订及种子萌发特性等方面的研究[2-3]。
森林更新是从具有活力的种子到形成幼苗并完成定居的整个过程[4]。种子的成功萌发和幼苗的顺利成活是森林更新成功的重要环节,这一环节受森林凋落物的影响[5-7]。林内较厚的凋落物会影响森林的天然更新[8-11]。凋落物数量和天然更新幼苗数量呈负相关性[12]。凋落物对幼苗存活和生长的作用是与种子掉落的位置密切相关的,这决定了种子萌发所需要的光照和种子到达土壤界面的能力[13-14]。种子可能萌发的掩埋深度阈值,随着植物种类和种子大小的不同而改变,进而影响树种的天然更新[15-16]。森林凋落物还会通过化感作用影响树木种子的发芽和幼树的生长,也会对树种的天然更新造成影响[17-19]。但是,对于濒危植物云南蓝果树来说,凋落物是否会影响其天然更新过程,这种影响是物理因素还是生物化学因素还是两者的共同作用,并不是很清楚。
因此,为探究云南蓝果树的濒危机制,通过野外原位实验和室内受控实验,研究云南蓝果树凋落物对其种子萌发和幼苗的物理影响及化感效应,揭示其对天然更新的作用,探讨可能影响极小种群植物云南蓝果树天然更新的关键生态因子。
1 材料和方法
1.1实验材料
供试的云南蓝果树种子采于云南省西双版纳州普文镇普文试验林场天然林,也是目前云南蓝果树唯一天然分布的保护小区。云南蓝果树果实属核果,未成熟时为黄绿色,成熟时为紫红色。云南蓝果树种子外果皮和种仁中的抑制物影响云南蓝果树种子萌发[20-21]。因此,果实采回后,去除肉质外果皮,洗净含有坚硬内果皮的种子,用水选法除去浮在水面的瘪粒,自然阴干备用。云南蓝果树凋落物收集于野外分布的云南蓝果树种群周围,并带回实验室烘干。
1.2实验方法
1.2.1野外原位试验
原位试验于2013年8月20日进行。在云南蓝果树天然林内,据云蓝果树野外资源分布调查结果,在研究区域内,找到3株结有果实的云南蓝果树,以目标植株为中心,5~8 m为半径画圆(试验小区与树干保持一定距离,且试验小区落入树冠投影为准),将圆按120°平均分为3份,在每每个区域里按照单因素试验设计随机布置。凋落物处理分为无凋落物和凋落物2个水平,每个处理3个重复。共有3(母株)×2(凋落物)×3(重复)=18盆钵。为了排除其他因子影响,提前1 a在处理中的每个小区内放置5个直径为20 cm的盆钵,盆钵里的土壤为云南蓝果树下原位土壤。直至云南蓝果树种子成熟,对小区设置不同处理。无凋落物处理为去除所有凋落物;种子在凋落物上层处理将种子均匀散落在凋落物上层;种子在凋落物下层将种子均匀放置在凋落物下层。每盆撒播50粒云南蓝果树种子,每个小区共播种50粒/盆×5盆=250粒。试验期间,观测记录不同月份(9月~次年5月)的种子萌发和幼苗存活生长、存活情况,直至数据没有发生显著变化。
1.2.2室内受控试验
(1)凋落物厚度和位置对云南蓝果树种子萌发与幼苗生长的影响试验。本实验为2因子实验,分别为凋落物厚度和种子位置(凋落物之上和凋落物之下)的混合实验。共设计了4个不同的处理,分别为:①种子播种在泥炭基质深0.5 cm处;②种子播种在泥炭基质之上,并覆盖1.5 cm厚的凋落物(0.6 kg·m-2);③种子播种在泥炭基质之上,并覆盖3 cm厚的凋落物(1.1 kg·m-2);④种子播种在1.5 cm厚度的凋落物-泥炭混合基质之上。
种子萌发实验于2014年3月5日开始进行,云南蓝果树种子播种于(9 cm×9 cm×10 cm)的容器中,每个容器播种20粒。实验在人工智能气候箱中进行,光照16 h,黑暗8 h,温度(25±1)℃,湿度(90±0.8)%。供试植物的种子在播种前分别用体积分数为10%的H2O2表面消毒2 min,然后用无菌水冲洗5~6次。观测记录种子萌发和幼苗存活生长情况,直至数据不再发生显著变化。幼苗生长实验期为6个月,实验结束后收获全部植株幼苗,记录地上部分株高和叶片数,分地上部分和地下部分测定生物量。
(2)凋落物浸提液对云南蓝果树种子萌发和幼苗生长的影响试验。试验于2014年5月23日实施。以黄壤和腐殖土1∶2混合作发芽基质,过筛后装入直径为10 cm的塑料花盆中。将烘干的凋落物粉碎,在室温下,按1∶20的料液比用去离子水浸提48 h,作为母液待用。将备用的母液稀释成梯度浓度,加入到盆钵中(500 g细砂/盆),每个处理作6个重复。云南蓝果树种子的播种密度为每培养皿30粒。实验在人工智能气候箱中进行,光照16 h,黑暗8 h,温度(25±1)℃,湿度(60±0.8)%。供试植物的种子在播种前分别用体积分数为10%的H2O2表面消毒2 min,然后用无菌水冲洗5~6次。将表面已消毒的云南蓝果树种子接种至铺有滤纸的培养皿内,每一培养皿加入10 mL的处理液,对照组(CK)加10 mL蒸馏水。定期加蒸馏水,以保证培养皿内湿润。
在次氯酸钠(NaClO)中浸泡细砂(直径0.45~1.00 mm)24 h,用纯水洗净后120 ℃烘8 h,每盆装入1 000 g灭菌后的细砂。云南蓝果树凋落物浸提液的提取操作参照以上实验,陆续加入到盆钵中(料液比为1∶20),每个处理6个重复,共18盆。然后将育苗1个月长势均等的云南蓝果树幼苗移至盆钵中,每盆移苗1株。所有盆钵转移到光照培养箱中,光周期设置为16 h光照与8 h黑暗,培养箱内温度保持在白天(30±1)℃,夜晚(25±1)℃。培养箱中相对湿度为80%。每7 d浇1次Hoagland营养液,维持植物正常生长。幼苗生长实验期为6个月,实验结束后收获全部植株幼苗,记录地上部分株高和叶片数,分地上部分和地下部分测定生物量。
1.3测定项目与方法
萌发率(GR)。种子开始萌发后,每天测定种子的萌发数(以胚根或胚轴突破种皮2 mm为萌发标准),种子萌发以胚根突破种皮为标准。GR=(实验终期正常萌发的种子数/供试种子总数)×100%。
生物量。对云南蓝果树地上部分和地下部分分别取样,洗净后放入烘箱,115 ℃杀青30 min后,65 ℃烘48 h至恒质量,测定生物量。
丛枝菌根真菌(AMF)侵染率的测定。取部分新鲜根部样品固定于FAA溶液中(37%甲醛、冰醋酸、50%乙醇溶液,体积比为9.0∶0.5∶0.5)用于检测AMF侵染率。先将根部的固定液清洗干净,然后浸泡在10%的KOH中,90 ℃水浴加热5 min,然后用1%的盐酸酸化15 min,并用酸性品红染色过夜,将根部剪成2 cm长的根段,在显微镜下(10倍物镜)观察,用十字交叉法计算侵染率。侵染率的计算公式为:侵染率=(侵染根段长度/根段总长度)×100%。
1.4数据处理与分析
采用单因素方差分析方法,分析野外原位实验中,凋落物处理对云南蓝果树种子萌发和幼苗株高的影响;采用双因素方差分析方法,比较凋落物厚度和凋落物位置对云南蓝果树种子萌发、幼苗生长及其存活的影响;采用单因素方差分析方法,分析室内受控实验中,不同质量分数凋落物浸提液对云南蓝果树种子萌发和幼苗的影响。方差分析时,不满足方差齐性检验的数据(发芽速率和存活率等)通过转换以满足方差分析的要求。采用Post-hoc Tukey方法检验变量的显著性,如果数据不满足参数检验的条件,就采用Kruskall-Wallis方法检验(5%为显著水平,1%为极显著水平)。所有的数据都通过SPSS17.0软件进行方差分析。
2 结果与分析
2.1去除凋落物处理对云南蓝果树种子萌发和幼苗生长的影响
由表1~2可知,野外原位试验中,去除凋落物处理对云南蓝果树种子萌发率和幼苗株高都有显著的影响。虽然在处理后的第一个月(9月25日),去除凋落物处理对云南蓝果树的种子萌发和幼苗株高没有显著的影响(P>0.05);但是随着处理时间的增加,在处理后的第二个月(10月15日)和第三个月(12月30日)时,去除凋落物处理显著提高了云南蓝果树种子的萌发率和幼苗的株高(P<0.05)。至2014年1月底,幼苗全部死亡。

表1 凋落物处理对云南蓝果树幼苗株高的影响 cm
注:表中数值为“平均值±标准差”;同列不同小写字母表示差异显著(P<0.05)。
2.2凋落物厚度与位置对云南蓝果树种子萌发和幼苗生长的物理影响
由表3可以看出,凋落物厚度和凋落物位置都对云南蓝果树种子萌发和幼苗的影响差异显著。对照组(CK)种子的萌发率及幼苗的存活率、株高、叶片数量、地上部分生物量和地下部分生物量等5个指标最高;播种在1倍凋落物下方(处理1)的云南蓝果树种子萌发率及幼苗的5个生长指标显著低于对照(P<0.05);随着凋落物厚度的增加,云南蓝果树种子的萌发率和幼苗的5个指标显著降低(P<0.05),即播种在2倍凋落物下方(处理2)的云南蓝果树种子萌发率及幼苗的5个生长指标显著低于对照和1倍凋落物处理(P<0.05),但是与播种在凋落物上方处理(处理3)间的结果没有显著差异(P>0.05)。
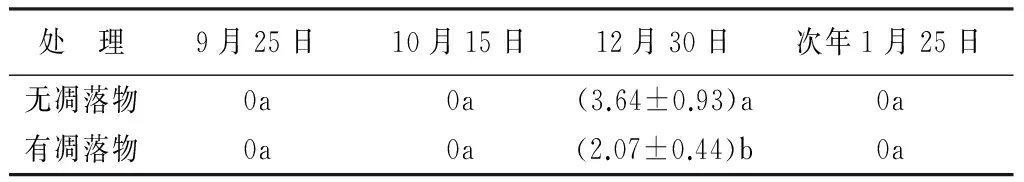
表2 凋落物处理对云南蓝果树种子萌发的影响 %
注:表中数值为“平均值±标准差”;同列不同小写字母表示差异显著(P<0.05)。
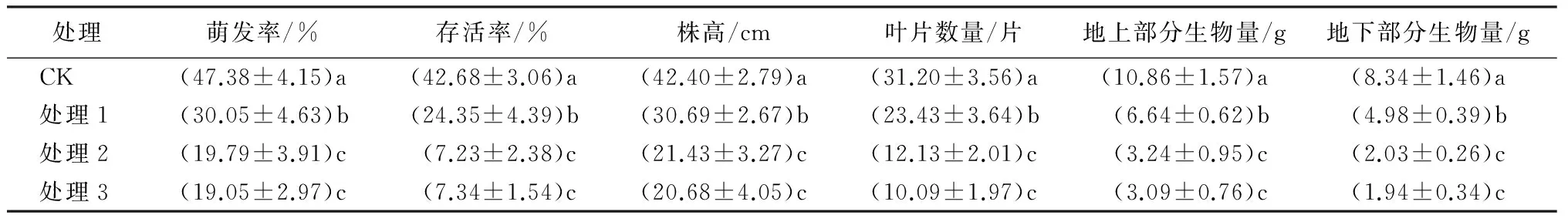
表3 凋落物厚度和播种位置对云南蓝果树种子萌发和幼苗的物理影响
注:表中数值为“平均值±标准差”;同列不同小写字母表示差异显著(P<0.05)。
2.3凋落物浸提液质量分数对云南蓝果树种子萌发和幼苗生长的化感影响
由表4可知,不同质量分数的凋落物浸提液对云南蓝果树种子萌发率及幼苗的株高、叶片数量、地上部分生物量和地下部分生物量的影响相似,与对照的差异显著(P<0.05);当凋落物浸提液质量分数为0.625%时,云南蓝果树幼苗的株高、叶片数量、地上和地下部分生物量,与对照间没有显著差异(P>0.05)。随着凋落物浸提液质量分数的增加(>1.25%),云南蓝果树幼苗的株高、叶片数量、地上和地下部分生物量显著降低(P<0.05)。当凋落物浸提液质量分数为2.5%和5%时,云南蓝果树幼苗的株高、叶片数量、地上和地下部分生物量最低,两处理间差异不显著(P>0.05)。
随着凋落物浸提液质量分数的升高,种子萌发率和幼苗的4个生长指标都显著降低,云南蓝果树种子萌发率及幼苗的4个生长指标都受到其凋落物的显著抑制作用,且抑制程度随着浸提液质量分数的升高而显著增加,这与“云南蓝果树凋落物的物理影响”中凋落物厚度、凋落物浸提液质量分数的增加会增强云南蓝果树种子的萌发率和幼苗的抑制作用的结果是一致的。
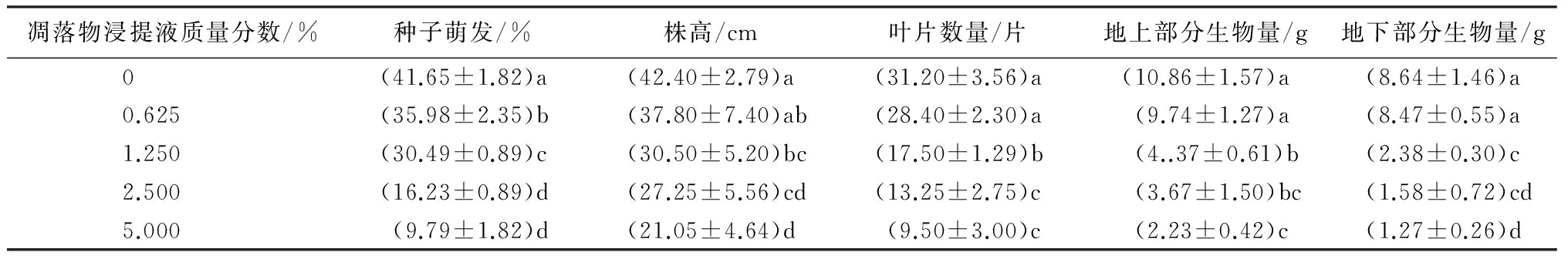
表4 不同质量分数凋落物浸提液对云南蓝果树种子萌发和幼苗的化感影响
注:表中数值为“平均值±标准差”;同列不小写字母表示差异显著(P<0.05)。
2.4云南蓝果树凋落物对其根部AMF侵染率的影响
通过实验观察和计算,凋落物处理显著降低了AMF对云南蓝果树幼苗根的侵染率。当凋落物浸提液质量分数为0.625%时,云南蓝果树幼苗根部的AMF侵染率为45.86%,与对照(47.66%)间没有显著差异(P>0.05)。随着凋落物浸提液质量分数的增加(1.25%),AMF侵染率显著降低(P<0.05)。当凋落物浸提液质量分数为2.5%和5%时,云南蓝果树幼苗根部的AMF侵染率最低,分别为21.62%和20.19%,两处理间差异不显著(P>0.05)。
3 讨论
凋落物抑制森林天然更新过程中的种子萌发和幼苗生长[22-24],成为植物种群动力学研究中的主要瓶颈[11-12]。许多研究证实森林凋落物降低了种子萌发率和幼苗的成活率[25-28]。本研究中,原位试验去除凋落物处理显著影响了云南蓝果树的种子萌发和幼苗的更新补充,表明凋落物是影响其天然更新的原因之一。
凋落物作用的机制如何呢?研究发现,凋落物对种子萌发和幼苗生长的影响是一个有关物理和化学等共同作用的综合且复杂的过程[12,17]。ROTUNDO et al[14]和Navarro-Cano[16]发现凋落物会阻断种子与土壤的接触,增加机械阻碍,阻止或延迟幼苗到达土壤表面的时间,而减少其萌发可能性和幼苗定居机会;另外,凋落物会遮荫,减少光照,影响需光先锋树种的种子萌发和幼苗生长[29]。室内受控实验模拟野外凋落物作用的结果表明,凋落物的不同位置和不同厚度显著影响了云南蓝果树的种子萌发和幼苗生长,证实了过厚的凋落物层是影响云南蓝果树天然更新的物理因素之一。其原因为:一是凋落物层加厚,掉落于枯枝落叶上的种子吸收不到充足的水分而不能萌发,即使萌发也扎根困难;二是凋落物层加厚,导致种子萌发所需的光照降低,导致云南蓝果树在较厚的凋落物层下难以萌发成苗,萌发幼苗又因凋落物的机械阻力难于生长。另外,很多学者已经研究证明,凋落物在降解过程中会通过释放化感物质抑制种子萌发和幼树的生长[17,30-31]。某些树种的凋落物浸提液被证实对自身种子萌发和幼苗生长有自毒作用[32-34]。本研究发现,云南蓝果树凋落物厚度、凋落物浸提液质量分数的增加和种子位置的不同,显著影响云南蓝果树的种子萌发和幼苗生长,证明了云南蓝果树凋落物对其天然更新的物理影响;云南蓝果树凋落物浸提液对其种子萌发和幼苗生长具有显著的抑制作用,且与浸提液的质量分数呈正相关关系,这与“云南蓝果树凋落物的物理影响”中凋落物厚度、凋落物浸提液质量分数的增加会增强云南蓝果树种子的萌发率和幼苗的抑制作用的结果是一致的。加上前期研究证实云南蓝果树的根茎叶都具有抑制自身种子萌发和幼苗生长的自毒作用[21],一定程度上解释了云南蓝果树凋落物对其天然更新影响的化学机制。
化感物质在植物与土壤微生物之间往往起到一种信号传导的作用,凋落物可能通过化感物质抑制丛枝菌根真菌(AMF)的生长。AMF广泛存在于土壤中,它能与绝大部分高等植物营养根系共生形成菌根,促进宿主对土壤中矿质元素N、P、K、Cu、Zn等的吸收以及根系对病原菌的抵抗能力,在植物生长发育中起着重要作用[34]。试验也证明了葱芥(Alliariapetiolate)的水提液能够阻止AMF孢子的萌发,抑制AMF与本地宿主植物番茄(Lycopesieumesculentum)形成共生体[35]。在探讨云南蓝果树凋落物浸提液对其幼苗生长作用机制的实验中发现,云南蓝果树凋落物处理显著降低了AMF对云南蓝果树幼苗根的侵染率,且随着凋落物浸提液质量分数的增加,AMF侵染率显著降低,抑制了AMF共生体的形成。而且,云南蓝果树凋落物浸提液对AMF的影响与云南蓝果树凋落物浸提液对其幼苗的作用趋势是一致的,即当凋落物浸提液质量分数为0.625%时,云南蓝果树幼苗根部的AMF侵染率和幼苗生长指标,都与对照差异不显著;凋落物浸提液质量分数分别为1.25%、2.5%、5%时,云南蓝果树幼苗根部的AMF侵染率和幼苗生长指标显著降低,且与对照差异显著。基于化感作用—丛枝菌根真菌—植物生长之间的反馈关系,被凋落物浸提液影响的AMF共生体的形成也许正是云南蓝果树凋落物浸提液抑制幼苗生长的间接原因,一定程度上揭示了云南蓝果树凋落物浸提液对其幼苗生长的作用机制。
综合分析表明,云南蓝果树凋落物对其云南蓝果树种子萌发和幼苗生长均产生了显著的影响,可被认为是影响其天然更新的关键因子之一。目前对云南蓝果树开展了一系列保护措施,例如就地保护、近地保护、迁地保护和回归引种等。然而,保护地的云南蓝果树近几年开始出现生长缓慢、部分死亡的现象,对云南蓝果树采取进一步的保护措施迫在眉睫。基于本研究云南蓝果树凋落物对其天然更新影响的结果,在对云南蓝果树开展保护措施的过程中,建议定期清理云南蓝果树林中的凋落物,以便消除凋落物对云南蓝果树的影响。
[1]陈伟,史富强,杨文忠,等.云南蓝果树的种群状况及生态习性[J].东北林业大学学报,2011,39(9):17-20.
[2]孙宝玲,张长芹,周凤林,等.极度濒危植物:云南蓝果树的种子形态和不同处理条件对种子萌发的影响[J].云南植物研究,2007,29(3):351-354.
[3]孙宝玲,张长芹.极度濒危植物云南蓝果树的形态修订[J].云南植物研究,2007,29(2):173-175.
[4]韩文娟,曹旭平,张文辉.地被物对油松幼苗早期更新的影响[J].林业科学,2014,50(1):49-54.
[5]汤景明,翟明普.影响天然林树种更新因素的研究进展[J].福建林学院学报,2005,25(4):379-383.
[6]JENSEN K, GUTEKUNST K. Effects of litter on establishment of grassland plant species: the role of seed size and successional status[J]. Basic and Applied Ecology,2003,4(6):579-587.
[7]彭闪江,黄忠良,彭少麟,等.植物天然更新过程中种子和幼苗死亡的影响因素[J].广西植物,2004,24(2):113-121.
[8]彭少麟,邵华.化感作用的研究意义及发展前景[J].应用生态学报,2001,12(5):780-786.
[9]徐振邦,代力民,陈吉泉,等.长白山红松阔叶混交林森林天然更新条件的研究[J].生态学报,2001,21(9):1413-1420.
[10]WATANABE T, FUKUZAWA K, SHIBATA H. Temporal changes in litterfall, litter decomposition and their chemical composition in Sasa dwarf bamboo in natural forest ecosystem of northern Japan[J]. Journal of Forest Research,2013,18(2):129-138.
[11]周艳,陈训,韦小丽,等.凋落物对迷人杜鹃幼苗更新和种子萌发的影响[J].林业科学,2015,51(3):65-74.
[12]羊留冬,杨燕,王根绪,等.森林凋落物对种子萌发和幼苗生长的影响[J].生态学杂志,2010,29(9):1820-1826.
[13]ECKSTEIN R L, DONATH T W. Interactions between litter and water availability affect seedling emergence in four familial pairs of floodplain species[J]. Journal of Ecology,2005,93(4):807-816.
[14]ROTUNDO J L, AGUIAR M R. Litter effects on plant regeneration in arid lands: a complex balance between seed retention, seed longevity and soil-seed contact[J]. Journal of Ecology,2005,93(4):829-838.
[15]GUO Q, RUNDEL P W, GOODALL D W. Horizontal and vertical distribution of desert seed banks: patterns, causes, and implications[J]. Journal of Arid Environments,1998,38(3):465-478.
[16]NAVARRO-CANO J A. Effect of grass litter on seedling recruitment of the critically endangeredCistusheterophyllusin Spain[J]. Flora,2008,203(8):663-668.
[17]BOSY J L, READER R J. Mechanisms underlying the suppression of forb seedling emergence by grass (Poapratensis) litter[J]. Functional Ecology,1995,9(4):635-639.
[18]RANIELLO R, MOLLO E, LORENTI M, et al. Phytotoxic activity of caulerpenyne from the Mediterranean invasive variety ofCaulerparacemosa: a potential allelochemical[J]. Biological Invasions,2007,9(4):361-368.
[19]YIRDAW E, LEINONEN K. Seed germination responses of four afromontane tree species to red/far-red ratio and temperature[J]. Forest Ecology Management,2002,168(1/2/3):53-61.
[20]袁瑞玲,向振勇,杨文忠,等.云南蓝果树种子休眠与萌发特性[J].林业科学研究,2013,26(3): 384-388.
[21]张珊珊,向振勇,康洪梅,等.云南蓝果树对种子萌发及幼苗生长的自毒效应[J].林业科学研究,2014,27(4):502-507.
[22]JANECEK S, JAN LEPJ. Effect of litter, leaf cover and cover of basal internodes of the dominant speciesMoliniacaeruleaon seedling recruitment and established vegetation[J]. Acta Oecologica,2005,28(2):141-147.
[23]LI Q, CAI J, JIANG Z, et al. Allelopathic effects of walnut leaves leachate on seed germination, seedling growth of medicinal plants[J]. Allelopathy Journal,2010,26(2): 235-242.
[24]杨占彪,李圣男,金红喜.六盘山林区华北落叶松天然更新影响因素研究[J].江苏农业科学,2011,39(3):206-209.
[25]SCARIOT W. Seedling mortality by litterfall in amazonian forest fragments[J]. Biotropica,2000,32(4a):662-669.
[26]蒋有绪.川西亚高山冷杉林枯枝落叶层的群落学作用[J].植物生态学与地植物学丛刊,1981,5(2):89-98.
[27]刘尚华,石凤翎,吕世海,等.京西百花山区植物群落凋落物对土壤种子库的影响[J].水土保持通报,2008,28(2):41-47.
[28]PIERSON E A, MACK R N. The population biology ofBromustectorumin forests: Effects of disturbance, grazing and litter on seedling establishment and reproduction[J]. Oecologia,1990,84(4):526-533.
[29]潘开文,何静,吴宁.森林凋落物对林地微生境的影响[J].应用生态学报,2004,15(1):153-58.
[30]FACELLI J M, PICKETT S T A. Plant litter: light interception and effects on an oldfield plant community[J]. Ecology,1991,72(3):1024-1031.
[31]FUJII Y, SHIBUYA T, NAKATANI K, et al. Assessment method for allelopathic effect from leaf litter[J]. Weed Biology and Management,2004,4(1):19-23.
[32]HOVSTAD K A, OHLSON M. Physical and chemical effects of litter on plant establishment in semi-natural grasslands[J]. Plant Ecology,2008,196(2):251-260.
[33]黄闽敏,潘存德,罗侠,等.天山云杉针叶提取物对种子萌发和幼苗生长的影响[J].新疆农业大学学报,2005,28(3):30-34.
[34]职桂叶,陈欣,唐建军.丛枝茵根真菌(AMF)对植物群落调节的研究进展[J].菌物系统,2003,22(4):678-682.
[35]ROBERTS K J, ANDERSON R C. Effect of garlic mustard Alliaria petiolata (Beib. Cavara & Grande) extracts on plants and arbuscular mycorrhizal (AM) fungi[J]. The American Midland Naturalist,2001,146(1):146-152.
Effects ofNyssayunnanensisLitter on Its Nature Regeneration//
Zhang Shangshan, Xiang Zhenyong, Kang Hongmei, Yang Wenzhong
(Key Laboratory of Rare and Endangered Forest Plant of State Forestry Administration, Yunnan Academy of Forestry, Kunming 650201, P. R. China )//Journal of Northeast Forestry University,2016,44(1):6-10.
Nyssayunnanensis; Litter; Natural regeneration; Seed germination; Seedling growth
张珊珊,女,1984年10月生,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室(云南省林业科学院),助理研究员。E-mail: zhang_ss1012@163.com。
杨文忠,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室(云南省林业科学院),副研究员。 E-mail:wzyang2004@126.com。
2015年7月15日。
S718.43
1)国家林业局珍稀濒危物种野外救护与繁育项目(2014YB1004);国家自然科学基金项目(31460119);云南省应用基础研究青年项目(2013FD075)。
责任编辑:王广建。

