超低温冷冻技术在马铃薯脱毒中应用的研究进展
康俊++刘海英

摘 要:马铃薯茎尖超低温冷冻脱毒技术是超低温保存种质资源方法在脱毒领域一个新的应用,为今后解决马铃薯病毒病、生产优质脱毒马铃薯种薯提供一条崭新的高效利用途径。本文详细阐述了超低温冷冻技术在马铃薯脱毒中的发展过程、应用技术原理、常用操作方法,明确指出目前马铃薯茎尖超低温冷冻脱毒技术在国内还处在探索研究阶段,今后还需在冷冻材料选择、冷冻时间等方面进行深入研究,完善马铃薯茎尖超低温冷冻脱毒技术体系。
关键词:马铃薯;茎尖;超低温冷冻;脱毒
中图分类号:S532 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.08.003
Abstract: Potato shoot tip cryotherapy is a new application methods of cryopreservation germplasm to produce high quality virus-free seed potato. This paper described the development of potato shoot tip cryotherapy technology, applied technology principles, commonly used methods of operation, clearly pointed out that the current potato shoot tip cryotherapy in China is still in the research stage to explore the future needs in the freezer in-depth research, material selection, freezing time, perfect potato virus-free shoot tip cryotherapy technology system.
Key words: potato (Solanum tuberosum L.); shoot tip; cryotherapy; detoxification
马铃薯(Solanum tuberosum L.)在生产上利用的是无性繁殖方式,无性繁殖会造成病毒在植物体内逐代积累,多代后表现出发生病毒病,造成大幅度的减产,并且感病薯块在贮运期间会发生腐烂,对生产和销售都造成很大的损失[1]。目前尚无特效药物能治愈马铃薯病毒性病害[2],生产上解决这一问题运用最广泛的方法是采用热处理结合茎尖剥离脱毒技术[3],获得无毒植株后再通过组织培养扩繁获得大量无毒苗,在温室或网室生产出无毒种薯用于生产。然而该方法存在操作技术要求高、费时、成活率和脱毒率都较低等局限[4]。近年来,一种将超低温冷冻保存种子资源技术应用在脱毒领域的方法叫cryotherapy,王子成等[5]在2011年将其翻译为低温疗法,笔者认为叫超低温冷冻法更直观。该方法已经成功应用在马铃薯卷叶病毒、马铃薯Y病毒[6]、马铃薯S病毒、马铃薯X病毒[7]脱除上,该操作方法剪取茎尖1~2 mm,比茎尖剥离方法需要的0.2~0.3 mm操作起来容易,操作需要的时间较短,可以避免茎尖受损变褐,培养需要的周期较短、脱毒率较高等,是未来马铃薯脱毒领域一条崭新的途径[8]。
该方法发展时间较短,目前国外研究该方法的较多,国内报道为数不多。本文通过详细阐述马铃薯茎尖超低温冷冻脱毒技术的发展现状、技术原理以及该方法的关键操作技术,为广大从事马铃薯脱毒领域的工作人员开辟一条高效的途径提供基础参考。
1 超低温冷冻脱毒技术的发展现状
超低温冷冻脱毒法脱除植物病毒是超低温保存种质资源技术在植物脱毒方面的最新应用。超低温保存种质资源技术早在1973年就获得了成功,Nag和Street第一次成功利用超低温冷冻技术保存了胡萝卜的细胞[9],获得完整胡萝卜植株。随后许多实验室相继展开了有关研究工作。将超低温保存法首次成功应用在脱毒技术领域的是Brison,他在1997年成功脱除了李树的痘病毒(PPV),得到无病毒植株,病毒脱除率达到50%,而茎尖剥离脱毒只有20%[10]。伴随着超低温冷冻疗法研究的深入,广泛应用于甘薯、草莓、葡萄、马铃薯等多种植物的脱毒方面,并取得了很好的脱毒率。
目前在马铃薯病毒脱毒领域实现了马铃薯卷叶病毒、马铃薯Y病毒、马铃薯X病毒、马铃薯S病毒这四种病毒的成功脱除。Wang等[6]在2006年用该方法成功脱除了马铃薯卷叶病毒(Potato leaf curl disease,PLRV)和马铃薯Y病毒(Potato virus Y,PVY),研究结果显示对马铃薯卷叶病的脱毒率为83%~86%,对马铃薯Y病毒的脱毒率为91%~95%,明显高于茎尖组织培养的脱毒率(56%和62%)。白建明等[7]采用超低温冷冻法和常规三种脱毒法脱除马铃薯X病毒(PVX),比较四种方法的脱毒率,研究结果表明,马铃薯的茎尖在经过超低温冷冻脱毒后,脱毒率为59.13%,高于高温处理结合茎尖脱毒法的56.02%、高温脱毒法的42.16%、茎尖剥离脱毒法的35.83%,并且超低温冷冻后的再生植株在植物形态学上与对照无显著差异[11]。王子成等[5]在2011年成功脱除了马铃薯Y病毒和马铃薯S病毒,研究结果显示PVY的脱除率达83%,比传统茎尖剥离法的脱毒率62%要高,PVS的脱除率为47%,茎尖剥离脱毒法只有17%的脱毒率(表1)。超低温冷冻处理技术具有脱毒效率高、容易实现等优点[5]。但是不同研究者在同一种病毒马铃薯Y病毒脱除上脱毒率有差异,表明今后需要在技术体系上进一步优化。目前超低温脱毒技术主要研究集中在常见的马铃薯四种病毒病上,尚未见在脱除马铃薯A病毒和马铃薯S病毒方面的研究报道。
另外,超低温冷冻法还可以应用在去除病原菌等的感染,如超低温冷冻法可以去除番茄小叶病植原体,其去除率达100%,而采用茎尖培养只有7%[12]。该方法应用在马铃薯病毒脱毒方面时可以同时实现马铃薯内源细菌等微生物感染的脱除。
2 超低温冷冻脱毒技术的原理
超低温冷冻脱毒法是依据超低温对细胞的选择性破坏这一原理,同时结合组织培养技术从而达到脱除植物病毒、获得无病毒再生植株的目的[13]。研究表明,植物病毒在植物体内的分布呈现不均匀状态,感病植株体内的病毒含量呈离分生组织越近的细胞内病毒含量越少,茎尖的分生组织细胞内不含病毒或含有很少的病毒,随着距离分生组织越远病毒的含量就越大[14]。植物茎尖分生组织的细胞较小、细胞质浓度大、液泡小,在超低温冷冻过程中,这些细胞由于含自由水少则形成的冰晶也少,对细胞的破坏力小,因而抗冷冻能力强,不易被冻死,经过液氮超低温处理后再经过培养容易成活[15]而形成植株个体。随着离分生组织细胞越远分化细胞的液泡也越大,水分含量较多,在低温过程中容易形成较多的冰晶,从而破坏细胞而使其致死。经过液氮-196 ℃的超低温处理后大多数细胞受到了损伤而死亡,能够存活下来的仅有生长点的分生组织细胞(图1)[16]。采用该技术可以选取2 mm长度的茎尖,大大提高成功率和脱毒率。超低温冷冻后再经过组织培养手段获得的完整再生植株就是不含病毒的植株,从而达到脱除病毒的目的[17]。该方法在脱除马铃薯病毒方面有广阔的发展前景,为未来马铃薯脱毒技术提供一条高效的新途径。
3 超低温冷冻疗法常用的不同冷冻降温方法
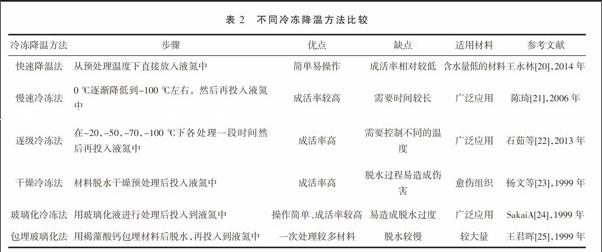
研究表明,不同材料采用超低温冷冻法脱毒时冷冻降温方法直接关系到成苗率,选择合适的冷冻方法对脱毒成功与否至关重要。不同冷冻降温方法各有优缺点,根据材料特性选择适合的方法(表2)。目前常用的冷冻方法[18]有:快速降温法、慢速冷冻法、逐级冷冻法、干燥冷冻法、玻璃化冷冻法、包埋玻璃化法等。直接将预培养材料投入液氮中的快速降温法具有操作简单、不需要特殊设备的优点,但是对含水量高的愈伤组织其成活率为零,不适用该方法。将材料从0 ℃逐渐降到-100℃,使得其细胞中的含水量逐渐流出到细胞外,细胞中的含水量降到最低程度,然后再从-100 ℃直接投入液氮中降到-196 ℃,这样可以避免水分在细胞中结冰而破坏细胞,这种慢速冷冻法可以提高成活率。一般细胞在-10 ℃时细胞外的介质基本形成结晶,而细胞内部并未结冰,这样形成细胞内外的蒸气压差,如果使细胞在不同低温下-20,-50,-70,-100 ℃下各处理一段时间[22],使细胞内的水溶液在蒸气压下向细胞外不断扩散,脱水后细胞内原生质逐渐发生浓缩,其冰点降低,再投入液氮中时就减弱低温结冰对细胞造成的伤害,大大提高回复率和成活率,这种逐级冰冻方法在多数材料超低温保存中获得成功。对于含水量较高的愈伤组织,采用将材料进行脱水预处理,然后迅速投入液氮。这样细胞经过脱水处理后细胞内部含水量大大降低,原生质的浓度大大提高,提高愈伤组织的冷冻处理后的恢复成活率[23]。用一种保护剂PVS2[其组成为:30%(W/V)甘油+15%(W/V)乙二醇+15%(W/V)DMSO+0.4 mol/L蔗糖]对材料进行处理后再迅速投入到液氮中,细胞经过保护剂处理后可以避免细胞胞内外形成冰晶,而形成玻璃化状态,这种方法成活率高[24],但是很容易脱水过度,影响成活率,采取与逐级冷冻法结合处理来提高恢复率。当材料较多时,可以先采用褐藻酸钙将材料进行包埋,然后用高蔗糖浓度的培养基脱水预处理,再用干燥的硅胶进行脱水处理,再迅速投入到液氮中[25]。为了保证成活率,经常结合几种冷冻降温方法合并使用。
4 马铃薯茎尖超低温冷冻脱毒法的关键操作步骤
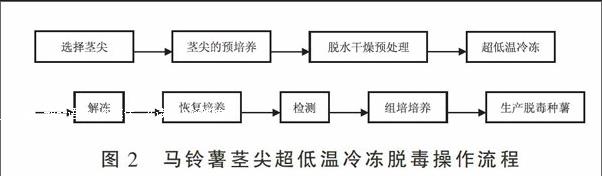
马铃薯茎尖超低温冷冻脱毒方法一般按照选择材料、切取茎尖、预培养、预处理、超低温冷冻、解冻、恢复培养、脱毒效果检测、组织培养扩繁这几个步骤来获得再生植株,经过病毒检测后,无毒植株用于生产脱毒马铃薯种薯(图2)。
4.1 选择材料
马铃薯不同部位的组织经过超低温冷冻处理后细胞的存活力有明显差异。一般细胞体积小、细胞质较浓、液泡少的分生组织细胞会比液泡大的成熟的分化细胞再生能力强、成苗率也高[26]。研究发现选择马铃薯茎尖分生组织作为处理对象,可以提高成苗率,有利于获得脱毒苗[5]。
4.2 预培养材料
材料通过预培养使得细胞适度脱水,减少细胞内自由水含量,可以提高细胞的抗冷冻能力[18],从而提高成活率。目前最常用的预培养方式是在培养基中添加一些使细胞脱水的保护性物质,可以选用蔗糖、二甲基亚砜、甘露醇等。在高浓度保护性物质处理之前选用0~5 ℃的低温驯化,可以明显提高成活率[27]。
马铃薯茎尖可以切取2~3 mm大小,然后放在0.3 mol·L-1高蔗糖浓度的预培养基中预培养一天,光照16 h,光照强度2 000 lx。高浓度的蔗糖可增加培养基的渗透压,使得马铃薯茎尖组织的细胞脱水,从而减少细胞内自由水的含量。
4.3 保护剂处理
常用的抗冷冻保护剂是能够穿透细胞膜的化合物DMSO和各种糖类物质,通过促进细胞膜对水分的通透性,降低细胞内水分冰点温度,避免胞内外冰晶形成,保护细胞内的核酸、蛋白质等生物大分子物质[28]。保护剂的选择是超低温处理成功的关键因素,好的保护剂应该满足对细胞毒性小、易溶于水、解冻后容易从细胞中清洗掉等要求。目前常用Sakai于1990年创立的按照一定配方合成的多种保护剂复合液,被称为植物材料玻璃化溶液(plant vitrification solution,PVS)[24]。
将预培养一天后的马铃薯茎尖加载到PVS2溶液中,其中PVS2液的成分为:MS+30%(W/V)甘油+15%(W/V)乙二醇+15%(W/V)二甲基亚砜(DMSO)+0.4 mol·L-1蔗糖[24]。具体方法是用移液管吸取15 μL的PVS2溶液加在0.03 mm厚的1.0 cm×4.0 cm的铝箔上,然后将预培养后的马铃薯茎尖装载到PVS2液滴中,室温25 ℃下处理20 min,成活率可达90%[5]。
4.4 液氮冷冻处理
将包裹有马铃薯茎尖的铝箔在液氮中蘸一下,然后把铝箔条放入1.5 mL离心管中,再将离心管置于液氮中超低温处理1 h。
4.5 解冻洗涤
对超低温处理后的材料需要马上进行解冻,常用的解冻方法有两种:一是快速解冻法,适合于大多数材料,具体做法是将液氮中冷冻1小时后的材料放于25~40 ℃的水浴锅中进行解冻1~3 min完全融化后取出材料,避免水浴温度对细胞的热伤害以及保护剂对细胞的毒害作用。另一种是慢速解冻法,适用于经过低温驯化或者经过脱水处理的材料,把液氮处理1 h后的材料在0 ℃下慢速解冻30 min左右。
解冻后的材料一般都需要立刻洗涤,为了除去细胞内含的高浓度保护剂,避免对恢复培养的影响。最常用的洗涤方法是室温下用含1~2 mol·L-1蔗糖浓度的培养基洗涤10 min左右[29]。
在无菌超净工作台中,将液氮处理1 h后的包裹马铃薯茎尖铝箔条从离心管中取出,然后迅速放入加有1.2 mol·L-1蔗糖浓度的液体MS培养基中洗涤2~3次,每次10 min[28]。
4.6 恢复培养
经过洗涤后的材料需要立即转移到恢复培养基上进行培养。研究发现将材料先培养在黑暗或弱光下一段时间后,再在正常光照下有利于形成再生植株[28]。
将洗涤后的马铃薯茎尖在无菌超净工作台中取出,用无菌纸吸去残留在材料表面的洗涤培养基,接种到固体恢复培养基(MS+0.1 mg·L-1NAA+0.5 mg·L-1 6-BA+1.0 mg·L-1 GA3)上进行培养。培养条件选择先黑暗培养7 d,再在弱光1 000 lx下培养7 d,然后正常光照2 000 lx培养。当分化出根芽后转移到MS培养基上,1个月就可获得完整植株,统计成活率[11]。
4.7 病毒检测
对再生马铃薯试管苗用酶联免疫法进行病毒检测[30],只有不带病毒的组培苗才可以进行组织培养扩繁,用于生产无毒马铃薯种薯。
5 马铃薯茎尖超低温脱毒技术发展前景展望
传统脱毒方法如茎尖分生组织培养进行脱毒依据的原理是茎尖分生组织不含有病毒,获得脱毒苗的成功率与切取茎尖分生组织的大小是成反比的[30-31],所以采用茎尖分生组织培养进行脱毒时,要求切取0.2~0.5 mm大小的带有1~2个叶原基的茎尖分生组织,切取茎尖越小操作越困难,对茎尖损伤程度也越严重,越容易褐变,越易发生变异,获得再生植株也越困难,使得这种方法的成活率和脱毒率都不高,并且所用周期较长,一般需要2~3个月的时间才可以得到完整植株。而利用超低温冷冻法进行脱毒时所剥取的茎尖一般比较大,为1~3 mm,就有如下优点:操作较容易、过程比较简单且成活率较高、需要的时间周期较短,一般需要1个月左右的时间即可得到成活的试管苗。茎尖超低温冷冻处理为脱毒开辟了一条崭新的途径,已发展成为一项新的生物技术,将逐步替代传统的脱毒方法[32]。
该方法今后主要从如下方面发展,筛选出针对脱出马铃薯特定病毒的操作技术体系,如前所述,同样在脱除马铃薯Y病毒(PVY)的研究中,Wang的脱除率为91%~95%,王子成的研究结果是脱毒率为83%,脱毒效率有明显差异,今后需要针对超低温脱毒方法的具体操作过程中涉及的冷冻保护剂配方、处理时间、处理条件等方面进行深入研究,筛选出适合脱除每一种常见马铃薯病毒需要的保护剂配方以及处理条件,得到最优的技术体系。
通过研究的不断深入,超低温冷冻脱毒技术可以更好更高效地用在马铃薯病毒脱毒方面,为解决马铃薯病毒病危害提供全新的高效途径。
参考文献:
[1] 柳俊,谢从华.马铃薯种薯退化与试管薯应用技术[J].长江蔬菜,1998(8):1-5.
[2]许传俊,黄珺梅,曾碧玉,等.植物组织培养脱毒技术研究进展[J].安徽农业科学,2011,39(3):1318-1320, 1335.
[3]杨小琴,李善才,李增伟,等.马铃薯茎尖脱毒组织培养技术研究综述[J].现代农业科技,2009(22):85-86, 88.
[4]梁一池,杨华.植物组织培养技术的研究进展[J].福建林学院学报,2002,22(1):93-96.
[5]王子成,曲先,薄涛.超低温保存脱除两种马铃薯病毒[J].河南大学学报(自然科学版),2011,41(6):609-614.
[6]WANG Q C,LIU Y,XIE Y H,et al.Cryotherapy of potato shoot tips for efficient elimination of potato leafroll virus (PLRV) and potato virus Y (PVY)[J].Potato Research,2006,49(2):119-129.
[7]白建明,陈晓玲,卢新雄,等.超低温保存法去除马铃薯X病毒和马铃薯纺锤块茎类病毒[J].分子植物育种,2010,8(3):605-611.
[8]王彪.马铃薯茎尖超低温保存及超低温疗法脱毒技术体系的建立[D].杨凌:西北农林科技大学,2011.
[9]NAG K K,STREET H E.Carrot embryogenesis from frozen cultured cells[J].Nature,1973,245(6):270-272.
[10] BRISON M,BOUCAUD M T,PIERRONNET A,et al. Effect of cryopreservation on the sanitary state of a cv. Prunus rootstock experimentally contaminated with plum pox potyvirus[J]. Plant Sci,1997(123):189-196.
[11]宋继玲,刘长臣,孙邦升,等.基因库中马铃薯种质资源超低温保存技术研究[J].中国马铃薯,2009,23(5):268-270.
[12]WANG Q C,VALKONEN J .Efficient elimination of sweetpotato little leaf phytoplasma from sweetpotato by cryotherapy of shoot tips[J].Plant Pathology,2008,57(2):338-347.
[13] SALA F,CELLA R,ROLLO F. Freeze-preservarion of rice cells grown in suspension culture[J]. Plant Physiol,1979,45:170-176.
[14] INKLE B J,ULRICH J M. Protocols of cryopreservation [C]// VANS D A. Handbook of plant cell culture (Vol.1): techniques for propagation and breeding. New York:Macmill an, 1983:806-865.
[15]DING F,JIN S,HONG N,et al.Vitrification-cryopreservation, an efficient method for eliminating Candidatus liberobacter asiaticus, the citrus Huanglongbing pathogen, from in vitro adult shoot tips[J].Plant Cell Reports,2008,27(2):241-250.
[16]FENG C,WANG R,LI J,et al.Production of pathogen-free horticultural crops by cryotherapy of in vitro-grown shoot tips[J].Methods in Molecular Biology, 2013,11013(13):463-482.
[17]FAGGIOLI F.In vitro mierografting of Pyrus eommunis shoot tips[J].Adv Horti Science,1997,11(1):25-29.
[18]马千全,徐立,李志英,等.植物种质资源超低温保存技术研究进展[J].热带作物学报,2007,28(1):105-110.
[19]苗琦,谷运红,王卫东,等.植物组织培养物的超低温保存[J].植物生理学通讯,2005,41(3):350-354.
[20]王永林.马铃薯茎尖超低温保存研究[J].甘肃农业科技,2006 (10):3-5.
[21]陈琦.马铃薯茎尖玻璃化法超低温保存技术研究[J].黑龙江农业科学,2014 (8):12-17.
[22]石茹,王芳,王舰.马铃薯离体茎尖玻璃化法超低温保存[J].江苏农业学报,2013,29(2):272-277.
[23]杨文,刘春艳,卜秀玲,等.香雪兰愈伤组织超低温保存的研究[J].东北师大学报(自然科学版),1999(4):71-73.
[24]SAKAI A,KOBAYASHI S,OIYAMA I.Cryopreservation of nucellar cells of navel orange (Citrus sinensis Osb. var. brasiliensis Tanaka) by vitrification[J].Plant Cell Reports,1990,9(1):30-33.
[25]王君晖,边红武,黄纯农.植物样品包埋脱水法超低温保存的研究进展[J].植物学通报,1999,16(5):582-585.
[26]WANG Q C,PANIS B,ENGELMANN F,et al.Cryotherapy of shoot tips: a technique for pathogen eradication to produce healthy planting materials and prepare healthy plant genetic resources for cryopreservation[J].Annals of Applied Biology,2009,154(3):351-363.
[27]杨智,陈春伶,徐美隆.超低温处理植物脱毒研究进展[J].北方园艺,2013 (12):184-187.
[28]石茹,王芳,王舰.玻璃化法超低温保存技术及其研究进展[J].北方园艺,2011 (24):231-235.
[29]WANG Q,VALKONEN J P.Cryotherapy of shoot tips: novel pathogen eradication method[J].Trends in Plant Science,2009,14(3):119-122.
[30]钟乃琴.ELISA技术检测马铃薯病毒的研究[J].甘肃农业大学学报,1998,33(2):178-181.
[31]郝艾芸,张建军,申集平.马铃薯病毒病的种类及防治方法[J].内蒙古农业科技,2007 (2):62-63.
[32]邱静,汤浩茹,曹会娟,等.园艺植物茎尖冷冻疗法脱毒的技术研究[J].植物生理学报,2014,50(1):1-6.

