危重症患者应激程度与早期肠内营养达标率的关系
梁振杰,刘 俊,刘端绘,磨庆福,黄德旺,莫 毅,陈泽宇
(梧州市红十字会医院重症医学科,广西 梧州 543002)
危重症患者应激程度与早期肠内营养达标率的关系
梁振杰,刘俊,刘端绘,磨庆福,黄德旺,莫毅,陈泽宇
(梧州市红十字会医院重症医学科,广西 梧州543002)
目的:探讨危重症患者不同应激程度与早期肠内营养达标率间的关系。方法:将2014年6月至2015年6月在我院重症监护病房接受治疗的60例患者分为鼻空肠管组和鼻胃管组,每组30例。分析不同应激程度危重症患者的早期肠内营养达标情况。结果:鼻空肠管组前白蛋白水平的上升趋势较鼻胃管组明显,第7天起2组患者的前白蛋白比较出现显著差异(P<0.05),但白蛋白和转铁蛋白水平无显著变化(P>0.05)。鼻空肠管组不同应激程度患者早期肠内营养的达标率均显著高于鼻胃管组(P<0.05),且2组应激程度与达标率呈负相关(r=-0.645、-0.583,P<0.05)。患者不同应激程度与APACHEⅡ评分呈正相关(r=0.324,P<0.05),但与住院时间和机械通气时间无显著相关性(P>0.05)。结论:危重症患者的应激程度越高,其早期肠内营养耐受程度越低,营养达标率越低。
危重症患者;应激程度;早期肠内营养;达标率
优先数字出版地址:http://www.cnki.net/kcms/detail/51.1688.R.20160628.1944.012.html
临床数据统计显示,危重症患者普遍存在营养不良,这可能与其机体受刺激因素影响后发生应激反应使代谢改变有关,也可能与其能量的供给不足从而引起营养状况迅速恶化有关[1]。危重症患者营养不良的严重程度不仅与综合治疗效果直接相关,同时也会对疾病的转归产生较大的影响。因此,目前在危重症患者救治中,营养治疗已成为不可或缺的组成部分,加强其临床研究已成为十分重要的课题。大量的临床实践证明,与肠外营养支持相比,肠内营养(enteral nutrition,EN)支持能更有效地改善危重症患者的营养不良和免疫功能低下症状,能明显改善肠黏膜结构和功能,降低由肠道菌群移位引发的严重感染的概率,降低机体多种器官发生功能障碍综合征的危险性,预防应激性溃疡。尤其在严重的应激状态下,早期肠内营养支持对减轻危重症患者的应激反应和分解代谢具有重要的意义,它可同时促进机体的合成代谢和功能恢复,并增强机体的免疫功能,从而加快康复,改善预后[2]。本研究旨在比较不同应激程度的危重症患者早期肠内营养支持的差异,现将研究结果报告如下。
1 资料与方法
1.1一般资料选取2014年6月至2015年6月入住我院重症监护病房治疗的60例危重症患者,随机分为鼻空肠管组和鼻胃管组,每组30例。鼻空肠管组中:男18例,女12例;年龄18~75岁,平均47.5±3.4岁;平均体质量60.5±11.3 kg;轻度应激13例,中度应激14例,重度应激3例。鼻胃管组中:男20例,女10例;年龄18~77岁,平均48.3±4.1岁;平均体质量61.7±11.6 kg;轻度应激12例,中度应激14例,重度应激4例。2组在年龄、体质量、性别等方面无显著性差异(P<0.05),具有可比性。
1.2纳入与排除标准纳入标准:(1)年龄≥18岁;(2)入科48 h内实施肠内营养;(3)开始EN前无肺部感染;(4)至少需要EN支持1个月以上;(5)无明显肠内营养禁忌证;(6)对本研究知情同意。排除标准:(1)肠梗阻、胃肠道缺血或活动性出血;(2)近期行胃肠道手术;(3)严重精神性疾病无法配合或依从性较差;(4)严重心脑血管、肝肾功能不全或晚期癌症。
1.3方法2组经常规病因治疗、器官功能支持治疗,并在入院72 h内置入EN管,鼻空肠管组使用手法盲插后X线摄片证实,如胃动力不足可在内镜直视下送管至十二指肠Treitz韧带远端;鼻胃管组使用常规方法插入胃管。2组使用相同的营养制剂,以游离氨基酸类、短肽类和整蛋白类营养为主,均使用EN泵24 h滴注。危重症患者均先行游离氨基酸滴注,然后滴注整蛋白配方,起始营养输入速度为20~30 mL/h,其后结合患者胃肠道耐受情况逐渐增加。使用胰岛素泵将血糖控制在6.1~8.3 mmol/L范围内,低于8.3 mmol/L时则停止胰岛素泵入。施行肠内营养时,床头抬高30°,使危重症患者处于30°~45°半卧位,对其消化道症状进行严密观察,定期检查胃肠内液体,确定营养管的位置。分别于入ICU后第1天、第4天、第7天清晨空腹取外周静脉血检测血清前白蛋白、白蛋白、转铁蛋白。
1.4观察指标与诊断标准观察应激指数(体温、呼吸频率、心率、末梢血糖)、APACHEⅡ评分、肠内营养指标(血清前白蛋白、白蛋白、转铁蛋白)、住ICU时间及机械通气时间等指标。应激指数诊断标准:轻度应激为0~4分;中度应激为5~9分;重度应激为≥10分。营养达标标准:患者3 d后肠内营养供给能量达到目标营养供给量[104.67 kJ/(kg·d)]的60%[2]。
1.5统计学方法所有数据在SPSS19.0软件上处理,计数资料采用χ2检验;2组间均数的比较采用t检验,多组间均数的比较采用方差分析;两变量间的相互关系应用直线相关分析。
2 结 果
2.12组早期肠内营养指标比较结果详见表1。

表1 2组早期肠内营养指标比较
注:1)与鼻胃管组比较P<0.05
鼻空肠管组的前白蛋白水平的上升趋势较鼻胃管组明显,第7天起2组的前白蛋白水平具显著性差异(P<0.05)。2组白蛋白和转铁蛋白水平均无显著性差异(P>0.05)。
2.22组不同应激程度患者早期肠内营养达标情况比较结果详见表2。
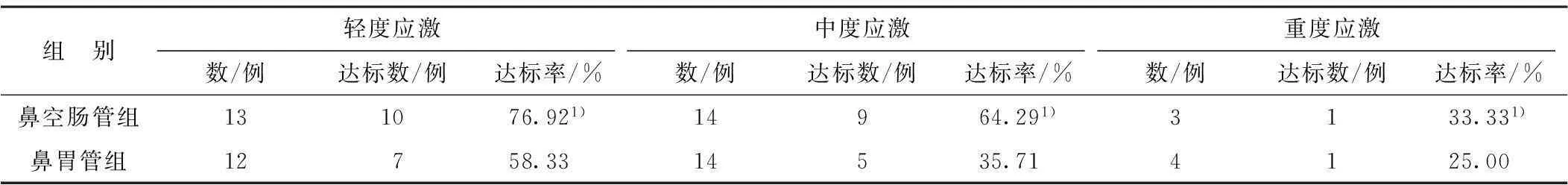
表2 2组不同应激程度患者早期肠内营养达标情况比较
注:1)与鼻胃管组比较P<0.05
2组应激程度与肠内营养达标率均呈负相关(r=-0.645,r=-0.583,P<0.05),且鼻空肠管组不同应激程度患者早期肠内营养的达标率均比鼻胃管组显著升高(P<0.05)。
2.3不同应激程度早期肠内营养达标患者APACHEⅡ评分、入住ICU时间、机械通气时间比较结果详见表3。
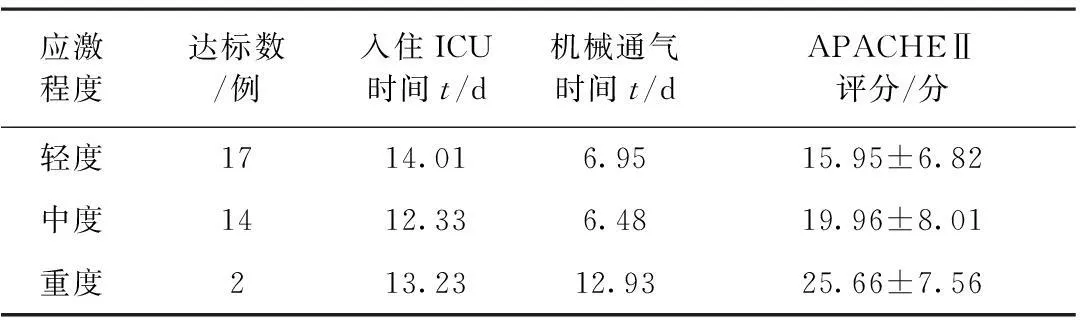
表3 不同应激程度早期肠内营养达标患者APACHEⅡ评分、入住ICU时间、机械通气时间比较
不同应激程度患者的APACHEⅡ评分均存在显著性差异(P<0.05);相关性分析结果显示,随着应激程度的增加,APACHEⅡ评分逐渐增高,两者呈正相关(r=0.324,P<0.05),但不同应激程度患者住院时间和机械通气时间无显著性差异(P>0.05)。
3 讨 论
临床研究表明,当机体处于严重的病理状态时,机体的应激状态会被激活,而处于应激状态下的危重症患者会迅速出现一系列的代谢改变,其中以蛋白分解代谢大于合成代谢为主要表现,并导致肠黏膜萎缩、肠屏障功能障碍,同时会降低机体的免疫力,削弱营养状况而发生营养不良,对患者的预后产生严重影响[3]。因此,对危重症患者实施及时、有效的营养干预,具有积极而现实的意义。
研究认为,在机体的应激反应中,具有屏障功能的肠道占有重要的地位,在应激状态下,危重症患者的免疫状态、内分泌状态均与肠道功能密切相关[4]。肠道具有多种功能,如消化与吸收、黏膜屏障、分泌激素等,并在肠道特异性防御机理中发挥调节IgA水平和抗菌作用[5]。肠内营养较场外营养更符合生理需求,营养摄入后会直接刺激胃肠道分泌消化液和激素,并加快机体的血流速度,从而维持胃肠道功能,显著提高机体的免疫力[6]。研究显示,肠内营养可有效地保护危重症患者的肠屏障功能和肝功能,并显著提高免疫功能,此外也可促进蛋白质的合成,从而降低应激反应以及感染的发生率[7]。研究还发现,危重症患者行肠外营养支持不利于提高机体抵抗细菌与病毒的免疫功能,这可能与肠外营养会减少机体内T细胞、B细胞的数量,增加Th1型细胞因子有关[8]。迄今为止,已有大量的研究证明,给予危重症患者肠内营养支持,可明显改善其营养代谢状态并全面改善或保护器官和组织的功能[9]。然而,危重症患者进行肠内营养支持的时间尚未明确,但也形成了共识,即患者肠道有功能且对肠内营养能耐受,应在48 h内进行肠内营养支持[10]。
研究认为,APACHEⅡ评分能将疾病的严重程度直观地反映出来,可作为预后及对死亡风险的评估与预测指标之一[11]。APACHEⅡ评分与应激指数呈正相关,其分值越高,患者病死率也越高,预测病死率的正确率高达86%[12]。本研究显示相似的结果,随着应激程度的增加,APACHEⅡ评分分值明显增加(r=0.324,P<0.05),提示通过APACHEⅡ评分可推测患者疾病的危重程度及机体的应激程度。
研究发现,处于应激初期的危重症患者并不能充分地利用外源性营养底物,即使给予全部所需的能量[约为104.67~125.60 kJ/(kg·d)],也不能使其高分解代谢问题降低或者解决,同时还会加重脏器的负担,加剧内环境的紊乱,对预后产生不良影响。本研究结果显示,危重症患者应激程度均与达标率呈负相关,且鼻空肠管组不同应激程度患者的达标率均高于鼻胃管组,这可能与应激程度的加重,提高了患者急性胃肠损伤的概率,导致患者胃肠道不耐受,肠内营养量增加缓慢有关。
综上所述,通过检测危重症患者的应激指数,可判断其应激程度。而应激程度越高,其早期肠内营养耐受程度越低,营养达标率越低,故其可作为危重症患者早期肠内营养支持的依据之一。
[1]武斌,李红,张申杰,等.谷氨酰胺在危重症患者营养支持中的应用[J].承德医学院学报,2014,16(4):340-343.
[2]崔玲宏,王小霞.严重烧伤患者肠内营养及护理[J].中国误诊学杂志,2012,12(3):521-522.
[3]黄利红,吴丽娜.肠内营养制剂在ICU重型颅脑损伤患者的应用及护理[J].中国保健营养:下旬刊,2012,22(9):3420-3420.
[4]李宁.重视重症病人代谢免疫和器官功能的营养调理治疗[J].中国实用外科杂志,2010,09(S1):5-7.
[5]王海燕,张文远.益生菌对肠黏膜屏障紧密连接蛋白保护作用的研究进展[J].国际消化病杂志,2012,32(5):284-286.
[6]黄新红,李涛.腹部手术后临床营养支持疗法进展[J].护理实践与研究,2013,10(18):130-132.
[7]于健春.“序贯疗法”优化手术后早期肠内营养[J].中华临床营养杂志,2011,19(3):140-143.
[8]杜鸿雁,费兆霞,孙莉,等.肠内加肠外营养对神经危重症患者早期营养和免疫功能的影响[J].中风与神经疾病杂志,2015,32(4):357-361.
[9]李炜.早期肠内营养加用谷氨酰胺对重症急性胰腺炎患者细胞免疫和营养状态的影响[J].中外医学研究,2013,06(10):3-4.
[10]李健珍.ICU患者在入科48 h内开展早期肠内营养支持对患者营养状况及病情转归的观察[J].医学信息,2015,45(11):259-260, 261.
[11]彭中.APACHEII对危重病患者病情评估的价值及预后[J].中国农村卫生,2014,12(z2):81-82.
[12]陈鑫,严晓铭,柯开富.APACHE Ⅱ与GCS评分预测神经重症监护患者病死率的价值[J].江苏医药,2014,40(4):444-446.
2015-09-16)
梁振杰,liangzhenjie120@163.com
R153.9
A
10.11851/j.issn.1673-1557.2016.04.020
梧州市科学研究与技术开发计划项目(编号201202080)

