慢病毒介导的CRYAB基因沉默对骨肉瘤细胞增殖和迁移能力的影响
王 剑,赵 龙*
(1.兰州大学第一临床医学院,甘肃 兰州 730000;2.兰州大学第一医院东岗院区,甘肃 兰州 730000)
慢病毒介导的CRYAB基因沉默对骨肉瘤细胞增殖和迁移能力的影响
王剑1,2,赵龙1,2*
(1.兰州大学第一临床医学院,甘肃 兰州 730000;2.兰州大学第一医院东岗院区,甘肃 兰州 730000)
目的 应用慢病毒介导的RNA干扰技术,通过体外实验探讨CRYAB基因沉默对人骨肉瘤细胞MG-63增殖和迁移能力的影响。方法 构建靶向CRYAB基因特异性shRNA慢病毒载体并转染人骨肉瘤细胞MG-63细胞株,利用Real-time PCR和Western Blotting技术分别从mRNA和蛋白质水平检测其表达的变化。CCK-8法和细胞克隆实验检测沉默CRYAB基因后细胞的增殖能力,Transwell迁移实验检测细胞的迁移能力。结果 Real-time PCR和Western Blotting结果均表明,成功建立稳定转染shRNA-CRYAB骨肉瘤细胞MG-63细胞株。CCK8实验结果显示shRNA-CRYAB病毒转染组与阴性对照组相比细胞的增殖能力显著降低(P〈0.05),尤其在第四、五、六和第七天表现更明显;细胞克隆实验结果显示,shRNA-CRYAB病毒转染组和阴性对照组的克隆形成率分别为5.2%和26.0%,具有显著性差异(P〈0.05)。Transwell迁移实验结果显示,shRNA-CRYAB病毒转染组的细胞迁移率明显低于阴性对照组(P〈0.01)。结论 shRNA-CRYAB慢病毒干扰载体能有效抑制CRYAB基因在人骨肉瘤细胞MG-63中表达,进而抑制细胞增殖和迁移。
慢病毒;CRYAB基因;骨肉瘤;细胞增殖;细胞迁移
骨肉瘤是原发于骨组织的最常见恶性肿瘤,其来源于间叶组织,好发于儿童与青少年[1-2],恶性程度高,侵袭性强,易发生肺转移,是一种致死率与致残率极高的肿瘤,其发生机制尚未完全阐明,且缺乏有效的防治措施。鉴于其多发于儿童及青少年,这一群体的预期存活期长,故需长期应用化疗药物治疗。而化疗药物对机体有毒副作用及肿瘤细胞对化疗药物可产生抗药性是严重制约长期化疗的关键因素[3-4]。因此,研究维持骨肉瘤细胞恶性表型的分子机制,开发可增加骨肉瘤细胞对化疗药物敏感性的基因疗法是提高疗效的关键。
热休克蛋白(Heat Shock Protein,HSPs)是一组高度保守的肽类蛋白质,在保护细胞免受外界有害刺激方面发挥着重要作用[5]。近年来,小热休克蛋白在肿瘤发生、发展中的作用越来越受到重视,其在调节细胞周期、分化、凋亡以及致瘤性等方面扮演着重要角色,研究[6]发现,小热休克蛋白在肿瘤细胞中通常高表达。aB-晶状体蛋白(CRYAB)是一种小热休克蛋白,在非小细胞肺癌[7]、头颈部鳞状细胞癌[8]和乳腺癌[9]中表达增高,也有研究报道,CRYAB在肝癌细胞中高表达,且对肝癌的侵袭转移有显著促进作用[10],然而目前关于CRYAB对骨肉瘤细胞增殖及迁移能力的研究国内还未见报道,CRYAB作为小热休克蛋白的另一个重要成员,预示其存在潜在的应用价值,本研究通过慢病毒介导的RNA干扰技术沉默CRYAB基因后观察其对骨肉瘤细胞MG-63在体外对细胞增殖活性和迁移能力的影响,为骨肉瘤的基因靶向治疗提供理论依据,现介绍如下。
1 材料和方法
1.1材料
人骨肉瘤细胞MG-63购自中国科学院上海细胞库;
DMEM、胎牛血清、0.25%胰蛋白酶和Opti-mem培养基购自Gibco公司;细胞裂解及蛋白抽提试剂购自Thermo公司;BCA蛋白含量检测试剂盒购自碧云天生物技术有限公司;逆转录试剂盒、SYBR Real-time PCR试剂盒购自Takara公司;CCK-8试剂盒购自日本同仁化学公司;Western Blotting配胶试剂盒、SDS-PAGE上样缓冲液购自碧云天公司;ECL化学发光试剂盒购自Thermo公司;慢病毒载体购自上海吉凯基因化学有限公司;CRYAB抗体购自Abcam公司;CRYAB引物购自上海生工生物技术有限公司。
1.2方法
1.2.1细胞培养 人骨肉瘤细胞MG-63用含有10%胎牛血清的DMEM培养液,在5%CO2、37℃恒温培养箱中培养,待细胞密度达到80%~90%时,用0.25%胰蛋白酶将贴壁细胞消化吹匀,然后将细胞悬液以1×106孔接种于6孔板,用相同条件进行培养。1.2.2构建慢病毒载体和细胞转染 慢病毒由上海吉凯公司设计与合成。同时制备空载体作为对照,并将实验分为阴性对照组和shRNA-CRYAB病毒转染组。
1.2.3Real-time PCR检测mRNA水平CRYAB的表达 采用SYBR Green染料法,以GAPDH为内参照。CRYAB mRNA上游引物序列:5’-CTTTGACCAGTTCTTCGGAG-3’,下游引物序列:5’-CCTCAATCACATCTCCCAAC-3’;内参GAPDH上游引物序列:5’-AAGGTGAAGGTCGGAGTCAAC-3’,下游引物序列:5’-GGGGTCATTGATGGCAACAATA-3’。PCR反应条件为:95℃30秒;95℃5秒;60℃34秒;95℃15秒,共40个循环。1.2.4Western Blotting检测人骨肉瘤细胞 MG-63中CRYAB的表达 SDS-PAGE电泳方法检测蛋白的表达。用Image J软件对蛋白条带进行半定量分析。
1.2.5CCK-8法和克隆形成实验检测细胞增殖能力 取两组对数生长期细胞配置成1×104/mL单细胞悬液接种于96孔板,每孔100 μL,测定1~7天细胞增殖活性。调整细胞密度为5×103/mL,接种至6孔板,10天后,弃去培养液,固定、染色拍照,倒置显微镜下计数,大于50个细胞集落为1个克隆,根据公式计算克隆形成率:克隆形成率(%)=克隆数/5 000×100%。细胞密度调整为1×105/mL。取细胞悬液200 μL加入小室中,下室中加入600 μL 含20%胎牛血清RPMI1640培养液,48小时后拍照,在光学显微镜下观察,并随机选取5个视野进行计数并进行统计学分析。
1.3统计学处理
用SPSS19.0统计软件进行数据分析。计量资料用(x±s)表示,样本数据服从正态分布,组间比较采用t检验和单因素方差分析,P〈0.05表示差异具有统计学意义。
2 结果
2.1shRNA慢病毒转染人骨肉瘤细胞MG-63的转染效率测定
慢病毒转染人骨肉瘤细胞MG-63 72小时后,在荧光显微镜下观察可见细胞中CRYAB绿色荧光蛋白表达。荧光显微镜下随机选取视野计算出人骨肉瘤细胞MG-63细胞的病毒转染效率,然后对同一视野进行白光和荧光拍照(见图1)。20 MOI值的细胞转染率>80%,细胞生长状态良好,提示慢病毒转染成功并稳定表达,可进行后续实验。
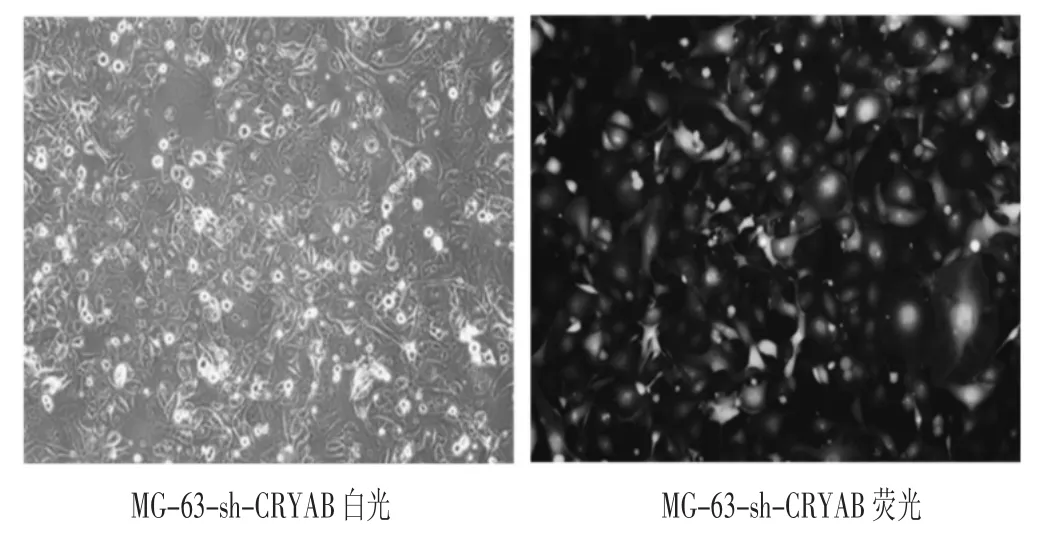
图1 MG-63细胞中sh-CRYAB病毒转染组白光和绿色荧光蛋白的表达(10×)
2.2Real-time PCR检测慢病毒转染后细胞中的CRYAB
病毒转染MG-63细胞后,于转染后72小时分别提取两组细胞的mRNA,通过PCR验证其转染效果。结果显示,shRNACRYAB病毒转染组mRNA水平比阴性对照组下降80%(P〈0.01),见图2。

图2 mRNA水平上MG-63细胞中CRYAB的表达
2.3Western Blotting检测沉默后 MG-63细胞蛋白中CRYAB的表达
在病毒转染MG-63细胞后72小时,提取细胞蛋白进行Western Blotting检测CRYAB的表达。结果显示,shRNACRYAB病毒转染组CRYAB的蛋白表达相比于阴性对照组显著降低、蛋白条带明显减弱(P〈0.01),见图3。
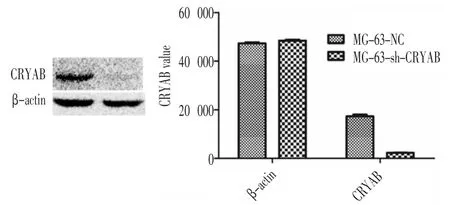
图3 Western Blotting检测转染后MG-63细胞蛋白中CRYAB的表达
2.4CCK-8法和细胞克隆实验检测细胞的增殖能力
shRNA-CRYAB病毒转染组较阴性对照组细胞吸光度值明显减小,结果表示MG-63细胞的增殖能力在沉默CRYAB基因后明显降低(P〈0.05),在第三、四、五和第六天表现更明显,表明shRNA-CRYAB病毒转染组细胞较阴性对照组细胞生长速度减慢,并且在检测的第六天这种生长抑制更为显著(P〈0.01),进一步说明shRNA干扰慢病毒抑制CRYAB在人骨肉瘤细胞MG-63表达后,能够持续有效抑制细胞增殖(见图4)。

图4 CCK-8法检测CRYAB基因沉默后MG-63细胞增殖
在shRNA-CRYAB病毒转染组和阴性对照组接种6孔板10天后,计数细胞数多于50个的克隆。结果表明,shRNACRYAB病毒转染组比阴性对照组的克隆形成能力明显降低,根据公式计算克隆形成率分别为5.2%和26.0%,两者比较,差异具有统计学意义(P〈0.05),见图5。

图5 克隆形成实验检测CRYAB基因沉默后MG-63细胞增殖
2.5Transwell细胞迁移实验和细胞划痕实验检测细胞的迁移能力
在细胞迁移实验中,shRNA-CRYAB病毒转染组平均穿膜细胞数量为(98.5±3.0)个;阴性对照组平均穿膜数量为(390.0± 3.9)个。Transwell迁移实验中,shRNA-CRYAB病毒转染组和阴性对照组相比其细胞穿膜数量减少(P〈0.01)。结果表明,转染shRNA-CRYAB后,MG-63细胞的迁移能力明显下降,见图6。
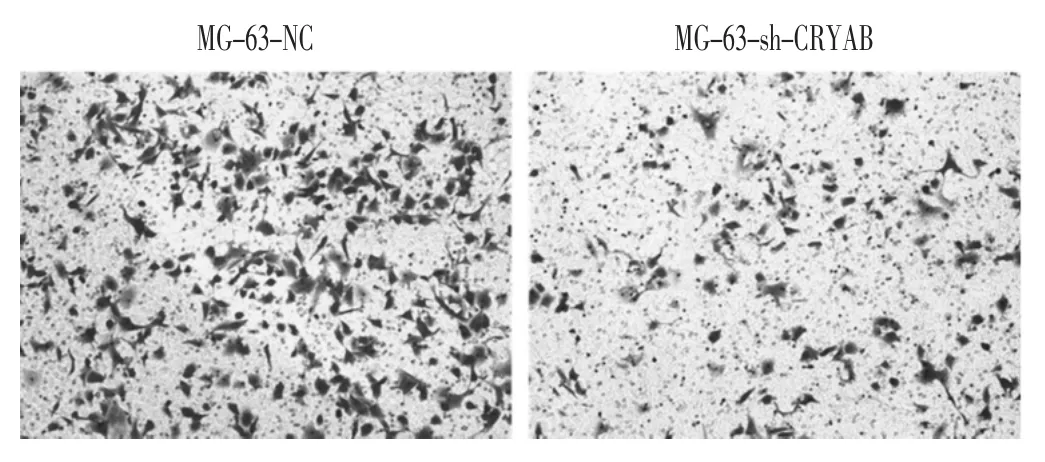
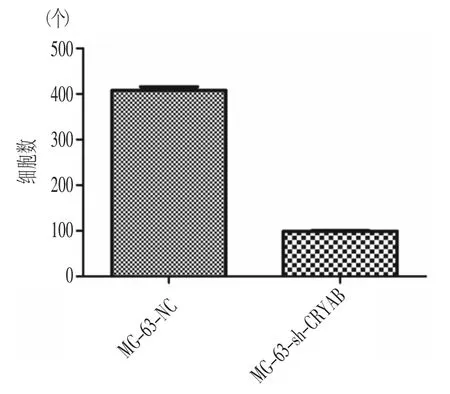
图6 Transwell检测CRYAB基因沉默后MG-63细胞迁移能力(10×)
3 讨论
热休克蛋白是一类在生物进化中高度保守、广泛存在于原核及真核生物中的蛋白质。近年热休克蛋白在免疫中的作用已成为当前研究的热点之一[11]。最近研究资料[12]显示,CRYAB与多种肿瘤发生与发展相关,如神经胶质瘤、肾脏肿瘤、口腔鳞癌、食管癌、肝癌、乳腺基底细胞样癌以及乳腺原位导管癌中表达高于其在正常对照组织中的表达,患者CRYAB高表达与预后呈负相关,且其可作为判断多种肿瘤预后的独立因素。在食管癌中的研究显示,CRYAB可以阻断细胞凋亡信号传递,即影响细胞凋亡过程,从而有利于肿瘤形成[13]。
3.1热休克蛋白CRYAB在其他肿瘤中的表达
CRYAB作为热休克蛋白的一种,与恶性肿瘤密切相关,研究发现其可参与控制肿瘤细胞的增殖与凋亡,在肿瘤发生中充当分子伴侣,使细胞维持增生状态免于凋亡[14-16]。CRYAB是小热休克蛋白家族中非常重要的一员。研究证实,CRYAB在多种人类肿瘤组织中表达水平明显高于癌旁及正常组织,且其表达程度与肿瘤患者的预后密切相关。Aoyama等在神经胶质肿瘤与正常脑组织标本的对比研究中发现,CRYAB在肿瘤细胞中的表达明显高于正常组织[17]。
RNA干扰技术(RNA interference,RNAi)能抑制肿瘤细胞中某些癌基因的表达,同时也能抑制肿瘤的增殖和转移,从而达到预防和治疗肿瘤的目的,具有高效性、特异性和低毒性的特点。因此运用RNAi技术,人工合成短发夹环RNA(shRNA),通过重组慢病毒载体介导的基因转导将外源基因有效地整合到宿主染色体上,特异性、稳定地沉默CRYAB基因在骨肉瘤细胞MG-63中的表达。
3.2热休克蛋白CRYAB对人骨肉瘤细胞MG-63增殖、迁移能力的影响
有研究发现[16],在肝癌细胞系HCCLM3细胞CRYAB表达下调后,Transwell细胞侵袭实验发现,细胞侵袭能力明显下降;HCCLM3-vshCRYAB组和HCCLM3-Mock区别明显。Hep3BCRYAB穿膜能力明显高于Hep3B细胞,这与本组实验结果一致,本研究发现,shRNA慢病毒载体转染后,人骨肉瘤细胞MG-63中CRYAB mRNA和蛋白表达量明显减少,验证了慢病毒载体良好的干扰效果。通过后续实验结果表明,在细胞增殖实验中,shRNA-CRYAB病毒转染组的细胞增殖能力较阴性对照组明显下降;在细胞迁移实验中,shRNA-CRYAB病毒转染组的细胞迁移能力显著下降。由此可见,CRYAB慢病毒干扰载体转染后的人骨肉瘤MG-63细胞,其增殖、迁移能力明显下降,表明CRYAB基因在骨肉瘤的发生发展和侵袭转移中起着重要作用。这可为进一步探究CRYAB基因与肿瘤浸润转移的分子机制提供依据,可作为骨肉瘤治疗的一个新的重要靶点,为骨肉瘤的治疗提供新的思路和方向。
3.3前景与展望
当前,虽然CRYAB作为一种重要的促癌基因,但是关于CRYAB详细的分子促癌作用机制及其相关信号通路的研究尚不深入,如CRYAB在骨肉瘤发生及发展中的具体功能?CRYAB可能通过与哪些信号通路的共同作用促进骨肉瘤的发生与发展?其详尽的机制还需要进一步深入研究。
[1]Wafa H,Grimer R J.Surgical options and outcomes in bone sarcoma[J]. Expert Rev Anticancer Ther,2006,6(2):239-248.
[2]Ottavian G,Jaffe N.The epidemiology of osteosarcoma[J].Cancer Treatment and Research,2009(152):3-13.
[3]Ham S J,Schraffordt Koops H,Van der Graaf W T,et al.Historical,currentand future aspects of osteosarcoma treatment[J].Eur J Surg Oncol,1998,24(6):584-600.
[4]Kager L,Zoubek A,Postchger U,et al.Primary meta-static osteosarcoma:presentation and outcome of patients treatedon neoadjuvant cooperative osteosarcoma study group protocols[J].J Clin Oncol,2003,21(10):2011-2018.
[5]Dudeja V,Vickers S M,Saluja A K.The role of heat shock proteins in gastrointestinal diseases[J].Gut,2009,58(7):1000-1009.
[6]Arrigo A P.SHsp as novel regulators of programmed cell death and tumorigenicity[J].Pathol Biol(Paris),2000,48(3):280-288.
[7]Qin H,Ni Y,Tong J,et al.Elevated expression of CRYAB predicts unfavorable prognosis in non-small cell lung cancer[J].Med Oncol,2014,31 (8):142.
[8]Van de Schootbrugge C,Schults E M,Bussink J,et al.Effect of hypoxia on the expression of αB-crystallin in head and neck squamous cell carcinoma[J].BMC Cancer,2014(14):252.
[9]Chen Z J,Ruan Q,Han S,et al.Discovery of structure-based small molecular inhibitor of alpha B-crystallin against basal-like/triple-negative breast cancer development in vitro and in vivo[J].Breast Cancer Res Treat,2014,145(1):45-59.
[10]Campos-Mora M,Morales R A,Gajardo T,et al.Neuropilin-1 in transplantation tolerance[J].Front Immuno,2013(4):405.
[11]王小平,胥冰,马晓军,等.热休克蛋白与肿瘤免疫[J].现代肿瘤医学,2015,23(1):131-134.
[12]Gruvberger-Saal S K,Parsons R.Is the small heat shock protein alphaB-crystallin an oncogene[J].J Clin Invest,2006,116(1):30-32.
[13]周娟.人食管癌细胞热休克蛋白70肽复合物的提取及其抗瘤活性的研究[D].郑州:郑州大学,2006.
[14]Filomeni G,Aquilano K,Rotilio G,et al.Antiapoptotic response to induced GSH depletion:involvement of heat shock proteins and NF-kappaB activation[J].Antioxid Redox Signal,2005,7(34):446-455.
[15]Lamoureux F,Thomas C,Yin M J,et al.Suppression of heat shock protein 27 using OGX-427 induces endoplasmic reticulum stress and potentiates heat shock protein 90 inhibitors to delay castrate-resistant prostate cancer[J].Eur Urol,2014,66(1):145-155.
[16]Huang X Y,Ke A W,Shi G M,et al.αB-crystallin complexes with 14-3-3ζ to induce epithelial-mesenchymal transition and resistance to sorafenib in hepatocellular carcinoma[J].Hepatology,2013(12):26255.
[17]Gurgis F M,Ziaziaris W,Munoz L.Mitogen-activated protein kinaseactivated protein kinase 2 in neuroinflammation,heat shock protein 27 phosphorylation,and cell cycle:role and targeting[J].Mol Pharmacol,2014,85(2):345-356.
(*通讯作者:赵龙)■
R195
B
1671-1246(2016)16-0143-04

