胰岛素样生长因子-1和转化生长因子-β1在来曲唑诱导多囊卵巢综合征模型大鼠中的表达及意义
陈 巍
(海口市妇幼保健院妇产科,海南 海口 570203)
胰岛素样生长因子-1和转化生长因子-β1在来曲唑诱导多囊卵巢综合征模型大鼠中的表达及意义
陈巍
(海口市妇幼保健院妇产科,海南海口570203)
目的研究胰岛素样生长因子(IGF)-1和转化生长因子(TGF)-β1在来曲唑诱导多囊卵巢综合征(PCOS)模型大鼠中的表达及意义。方法将46只SD雌性大鼠按随机数字表法分为对照组和实验组各23只。实验组应用来曲唑(1 mg·kg-1·d-1)灌胃制备PCOS模型,对照组灌胃等量的羧甲基纤维素,两组均灌胃21 d。每日采集阴道涂片观察大鼠动情周期变化,21 d后收集大鼠血清及卵巢组织切片,采用放射免疫法测定血清中的性激素水平,显微镜下观察卵巢组织的病理组织学改变,应用免疫组化法测定切片中IGF-1和TGF-β1的表达情况。结果实验组大鼠灌胃12 d时即失去动情周期变化,卵巢组织病理学显示呈PCOS相关改变。实验组大鼠血清促黄体生成素(LH)、孕酮(P)水平显著高于对照组(P<0.05),而两组促卵泡刺激素(FSH)、雌二醇(E2)、睾酮(T)水平无统计学意义(P>0.05)。实验组IGF-1在两组卵泡膜细胞和颗粒细胞中的表达高于对照组(P<0.05);TGF-β1在卵泡膜细胞、颗粒细胞和间质细胞中均有表达,且实验组卵泡膜细胞中的表达强于对照组(P<0.05),而在其他细胞中的表达(P>0.05)。结论来曲唑诱导的PCOS模型大鼠与人类PCOS特征相似,而IGF-1、TGF-β1在PCOS大鼠模型中呈高表达,两种指标的检测对人类PCOS的诊断及发病机制研究具有重要参考价值。
多囊卵巢综合征;胰岛素样生长因子Ⅰ;转化生长因子β1
多囊卵巢综合征(PCOS)发病率约6%~12%〔1〕。目前其发病原因尚不十分明确,普遍认为高雄激素血症及胰岛素抵抗是其发生的关键因素。胰岛素样生长因子(IGF)-1与转化生长因子(TGF)-β1作为卵巢内产生的生长因子,在细胞生长、分化、凋亡和血管生成等方面发挥多种生物学作用,也在PCOS的发生发展中起到重要作用。有研究表明,IGF-1和TGF-β1水平异常,将对卵巢组织内卵泡发育和正常细胞的转化等造成影响〔2〕,引起体内内分泌失调。本研究旨在探索二者在PCOS形成过程中的作用。
1 材料与方法
1.1材料
1.1.1实验动物选取6周龄清洁级雌性SD大鼠46只(由海南医学院动物实验中心提供),体重100~150 g,均表现4 d的规律动情周期。于动物实验室自由进食喂养,室温(22.0±3.0)℃,湿度50%~75%,自然光照,适应性喂养1 w。
1.1.2主要试剂与仪器来曲唑片(江苏恒瑞制药厂),放射免疫法(RIA)药盒(天津中新科炬生物制药有限公司),免疫组织化学试剂盒、IGF-1和TGF-β1试剂盒(北京中杉金桥生物技术有限公司),切片机(金华华速科技有限公司),光学显微镜(日本OLYMPUS),图像分析系统(上海山富科学仪器有限公司)
1.2实验方法
1.2.1动物分组与模型制备采用随机数字表法将46只大鼠随机分为实验组与对照组各23只。实验组大鼠通过灌胃来曲唑1 mg·kg-1·d-1(预先溶于体积分数1%的羧甲基纤维素中)建立PCOS模型。对照组每日灌胃等量的羧甲基纤维素,两组均持续灌胃21 d。
1.2.2标本采集实验组造模成功大鼠最后一次灌胃12 h后,禁食12 h,行10%水合氯醛麻醉,对照组于最后一次动情间期麻醉。处死大鼠,经心脏放血收集血液5 ml,2 000 r/min离心20 min取血清,-40℃冻存待用。摘取大鼠双侧卵巢组织,经修剪、称重后,迅速投入10%中性甲醛中固定,常规石蜡包埋,制成厚度为4 μm的切片,经烤片、脱水、苏木精-伊红染色、脱水、封固等处理后保存。部分切片行病理组织学观察,另一部分进行免疫组织化学测定。
1.3观察指标
1.3.1动情周期监测灌胃期间每日进行阴道涂片以监测大鼠动情周期的变化,显微镜下大鼠动情周期判断标准;(1)动情前期:全部显示为有核上皮细胞,偶有少量角化细胞;(2)动情期:全部为无核角化细胞或有少量上皮细胞;(3)动情后期:可见白细胞、角化细胞、有核上皮细胞;(4)动情间期:可见大量白细胞和少量上皮细胞或黏膜。
1.3.2卵巢病理组织学检查。
1.3.3血清性激素采用放射免疫法(RIA)药盒测定血清中的促黄体生成素(LH)、促卵泡刺激素(FSH)、雌二醇(E2)、孕酮(P)及睾酮(T)水平,确定大鼠体内内分泌的改变。
1.3.4卵巢组织中IGF-1和TGF-β1的表达取卵巢组织切片,采用免疫组织化学非生物二步法试剂盒进行组织染色,具体包括脱蜡、梯度酒精水化、抗原修复、一抗孵育、二抗孵育、显色、脱水、透明、封片等。分别采用IGF-1和TGF-β1试剂盒检测卵巢组织中IGF-1和TGF-β1的表达情况。所有操作过程严格按说明书进行。以磷酸盐缓冲液(PBS)代替一抗作阴性对照。每张切片随机观察5个高倍镜视野,在图像分析系统下进行图像灰度值分析。
1.4统计学方法采用SPSS14.0软件进行t检验。
2 结 果
2.1两组大鼠动情周期变化实验组大鼠于灌胃12 d后失去动情周期的规律性变化,均显示为动情间期时相,提示大鼠无排卵。对照组动情周期正常。
2.2两组大鼠卵巢质量及组织病理学改变实验组大鼠卵巢质量为(32.54±6.71)mg/100 g体质量,对照组大鼠为(25.16±5.94)mg/100 g体质量,两组比较差异显著(t=10.430,P<0.05)。显微镜下卵巢切片组织病理学观察可见:对照组卵巢呈现不同发育阶段的卵泡及黄体,卵泡内颗粒细胞多为6~8层;实验组中卵泡内卵母细胞缺失,初级卵泡、囊状扩张的卵泡和闭锁卵泡增多,颗粒细胞层减少至2~3层,卵泡膜增厚,间质细胞增生。
2.3两组大鼠血清性激素水平比较灌胃处理21 d后,实验组大鼠血清中的LH、P水平均显著高于对照组,差异有统计学意义(P<0.05);而两组FSH、E2、T水平无统计学意义(P>0.05)。见表1。

表1 两组大鼠血清性激素水平比较±s,n=23)
2.4两组大鼠卵巢组织中IGF-1、TGF-β1的表达免疫组化法结果显示,IGF-1主要表达于卵泡膜细胞和颗粒细胞中,且实验组的表达高于对照组(P<0.05);TGF-β1在卵泡膜细胞、颗粒细胞和间质细胞中均有表达,在实验组卵泡膜细胞中的表达强于对照组(P<0.05),而在其他细胞中的表达两组无统计学意义(P>0.05)。见表2、表3。
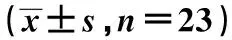
表2 两组大鼠卵巢组织中IGF-1的表达
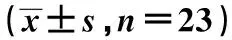
表3 两组大鼠卵巢组织中TGF-β1的表达
3 讨 论
PCOS是妇科常见的内分泌异常和代谢异常所致的排卵功能障碍性疾病,临床主要表现为肥胖、多毛、闭经、月经不调等,患者由于肥胖症、雄激素升高及胰岛素抵抗等多种因素导致患2型糖尿病、心血管疾病、高雄激素血症等病的风险大大增加〔3〕,该病具有反复性、难治性、终身性的特点,对患者的生理与心理健康造成严重危害〔4〕。PCOS的发病机制尚未完全阐明,不同领域的学者们从不同角度进行了大量研究,中医学研究发现,PCOS的发生与患者痰湿质、气郁质体质有关〔5〕;也有研究对PCOS的易感基因进行研究,指出有包括与胰岛素调节、性激素调节和心血管风险相关的共37个基因与PCOS的发生有关〔6〕。而目前普遍认同的观点是,高雄激素血症、高胰岛素血症及胰岛素抵抗是引发PCOS的主要病因。
IGF-1是一类在结构和功能上与胰岛素有较高同源性的多肽生长因子,在促进细胞增殖、分化及血管形成等方面发挥重要作用。TGF-β1是细胞自分泌和旁分泌的细胞内源性生长抑制因子,在控制细胞生长、胚胎发育、免疫调节和细胞凋亡等方面发挥双向调节作用。IGF-1和TGF-β1均可由卵巢合成,在生殖细胞的存活与凋亡中起重要的调控作用,其表达异常可能会引起卵泡的生长和发育障碍,造成体内内分泌功能紊乱。有研究发现,IGF-1和TGF-β1表达异常与卵巢疾病的发生有关〔7,8〕。
本研究说明来曲唑灌胃能成功建立大鼠PCOS模型。此外,本研究还提示IGF-1对PCOS的发生发展起促进作用,其作用机制可能是:(1)IGF-1与胰岛素具有较高的同源性,在分子结构、受体及功能上发生相互重叠〔9〕,在卵巢功能中形成一整套完善的调节系统〔10〕。卵巢在胰岛素和IGF-1的过度刺激下,对卵泡生成素、黄体生成素敏感性显著增加,使初级卵泡增加,卵泡发育减慢甚至停止,而原始卵泡在其刺激下不断启动发育,造成多囊卵巢的形成;(2)IGF-1可协同LH,促进雄激素的合成和分泌〔11〕,IGF-1还能协同胰岛素进一步抑制肝脏,造成游离睾酮水平的升高;(3)IGF-1参与的卵巢血管生成异常也是造成PCOS等多种病变的重要原因〔12〕。
本研究与以往研究结果相符〔13〕,其原因可能为:TGF-β1可诱导发挥血管内皮生长因子(VEGF)发挥作用,促进血管生成,引起多囊卵巢间质纤维化和包膜增厚,阻碍卵泡的发育〔14〕,同时,其对卵泡膜细胞的增殖、分化和FSH受体的形成也有重要影响。此外,TGF-β1还可促进细胞外基质(ECM)的合成和沉积,影响生殖细胞的周期性变化〔15〕。
1黎小斌,梁洁莎,孟君,等.灵术颗粒对多囊卵巢综合症作用机制的实验研究〔J〕.实用医学杂志,2013;29(16):2657-9.
2郭鹏.Ins、IGFs及VEGF在多囊卵巢综合征中的研究〔D〕.延吉:延边大学,2013.
3皮红艳,杨秀敏,杨秀梅,等.多囊卵巢综合征伴胰岛素抵抗的研究进展〔J〕.现代生物医学进展,2013;13(35):6998-7000.
4周莉.多囊卵巢综合征的治疗〔J〕.医药前沿,2014;4(10):144-5.
5王婷婷,沈旸.多囊卵巢综合症体质类型及相关因素的流行病学调查〔J〕.中国卫生产业,2013;7(25):131-2.
6张玉娟.妇女多囊卵巢综合征易感基因的研究〔J〕.实用妇科内分泌电子杂志,2015;2:61-2.
7刘彩艳,曲芃芃.IGF-Ⅰ、TGF-β1在卵巢上皮性肿瘤中的表达及与微血管密度的关系〔J〕.中国肿瘤临床,2012;18:1337-41.
8刘会平.IGF-1、TGF-β1、ER、PR在子宫内膜增生及癌组织中的表达及意义〔D〕.太原:山西医科大学,2013.
9徐碧红,张凤.肥胖与非肥胖多囊卵巢综合征患者内分泌激素对比研究〔J〕.华南国防医学杂志,2011;5(5):36-8.
10Toprak S,Yönem A,Cakir B,etal.Insulin resistance in nonobese patients with polycystic ovary syndrome〔J〕.Horm Res,2001;55(2):65-70.
11罗涌,李启富,宋颖,等.多囊卵巢综合征患者血清IGF-1的变化及其与肥胖、糖脂代谢的关系〔J〕.第三军医大学学报,2011;10(10):1087-8.
12De Groot PC,Dekkers OM,Romijn JA,etal.PCOS,coronary heart disease,stroke and the influence of obesity:a systematic review and meta-analysis〔J〕.Hum Reprod Update,2011;17(4):495-500.
13田俊华,田秀珠,马淑状,等.IGF-1和TGF-β1在多囊卵巢综合征大鼠卵巢中的表达及意义〔J〕.山西医科大学学报,2009;8:700-3,768.
14苗竹林,王自能,杨艳东,等.TGF-β1在PCOS卵巢间质纤维化形成中的作用〔J〕.生殖与避孕,2008;28(3):174-9.
15Singh NN,Ramji DP.The role of transforming growth factor-beta in atheroschlerosis〔J〕.Cytokine Growth Factor Rev,2006;17(6):487-99.
〔2015-10-23修回〕
(编辑滕欣航)
10.3969/j.issn.1005-9202.2016.14.019
陈巍(1979-),女,主治医师,主要从事妇科内分泌研究。
R711.75
A
1005-9202(2016)14-3395-03;

