HPLC测定经不同益生菌发酵前后黄芪中黄芪甲苷和黄芪皂苷Ⅱ的含量
林莎莎,周洪雷*,孙筱林,池雨锋,蒋海强,张玲,楚新红
(1.山东中医药大学药学院,山东 济南 250355;2.三株医药生物研究所,山东 济南 250100)
HPLC测定经不同益生菌发酵前后黄芪中黄芪甲苷和黄芪皂苷Ⅱ的含量
林莎莎1,周洪雷1*,孙筱林2,池雨锋1,蒋海强1,张玲1,楚新红2
(1.山东中医药大学药学院,山东 济南 250355;2.三株医药生物研究所,山东 济南 250100)
摘要:采用HPLC-ELSD法测定黄芪经不同益生菌株发酵前后的黄芪甲苷和黄芪皂苷Ⅱ的含量变化。色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm),采用乙腈-水为流动相,梯度洗脱,流速为:1 mL/min。结果表明,黄芪对照中黄芪甲苷和皂苷Ⅱ的含量分别为0.476 2 mg/g和0.050 3 mg/g。用混合菌种发酵后黄芪甲苷和皂苷Ⅱ的含量分别为0.257 8 mg�g和0.109 4 mg�g。黄芪经益生菌发酵后黄芪甲苷含量降低而皂苷Ⅱ的含量升高,且不同菌种发酵后的黄芪甲苷和皂苷Ⅱ的含量也有差异。
关键词:黄芪;益生菌发酵;HPLC-ELSD;黄芪甲苷;黄芪皂苷Ⅱ
黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.) Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根[1]。黄芪的主要化学成分有皂苷、黄酮和多糖等。药理研究表明,大剂量的黄芪总皂苷有强心苷样的作用,还能够降低老年大鼠全血比粘度、血浆比粘度以及红细胞压积[2],发挥明显抗血栓的作用[3]。其中黄芪甲苷有明显的正性肌力作用,能改善心脏收缩和舒张的功能[4]。还有研究发现,黄芪皂苷Ⅱ对人肝癌多药耐药细胞BEL-7402/FU有逆转耐药作用[5]。
发酵是传统中药加工炮制的重要方法。微生物发酵能增强中药的药效,具有改变药效物质、减毒增效等作用[6],目前微生物发酵技术已经成为中药现代化研究的重要内容。本文采用不同益生菌株对黄芪进行发酵,采用HPLC方法对黄芪甲苷和皂苷Ⅱ进行了含量测定,为黄芪的临床用药及发酵中药的研究提供了科学的依据。
1 仪器与试药
1.1仪器
Waters e2695高效液相色谱仪,Waters 2424 ELSD Detector(美国Waters);ES-J120电子分析天平(上海舜宇恒平科学仪器有限公司);HH恒温水浴锅(江苏金坛市中大仪器厂);OSB-2100旋转蒸发仪(上海爱朗仪器有限公司);KQ5200DB型超声波清洗器( 昆山市超声仪器有限公司)。
1.2试药
黄芪(批号1504134111,购自安国市祁澳中药饮片有限公司)。黄芪液及黄芪发酵液(济南三株集团医药生物研究所)。对照品黄芪皂苷Ⅱ(H-037-130428)、黄芪甲苷(H-013-150626),纯度均大于98%(成都瑞芬思生物科技有限公司)。乙腈为色谱纯(国药集团化学试剂有限公司),水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1色谱条件
Waters e2695 HPLC;Waters 2424 ELSD Detector;Agilent C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱,见表1;进样量33 μL,流速为1.0 mLmin;检测器条件:漂移管温度为60 ℃,增益10,气压为25 Psi(1 Psi=6 895 Pa),雾化器为加热,动力水平为60%。
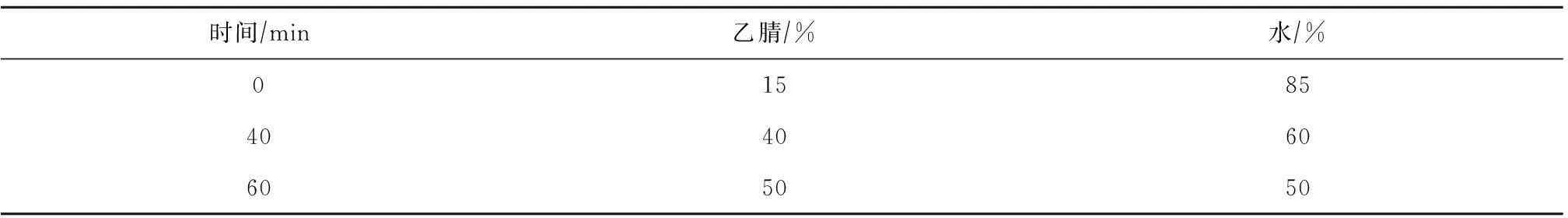
表1 黄芪甲苷和黄芪皂苷Ⅱ的梯度洗脱条件
2.2对照品溶液的制备
精密称定干燥至恒重的黄芪甲苷4.20 mg,用甲醇溶解并定容于10 mL容量瓶中,配成浓度为0.42 mgmL的标准品溶液。精密称定干燥至恒重的黄芪皂苷Ⅱ对照品7.86 mg,甲醇溶解并定容于10 mL容量瓶中,配成浓度为0.786 mgmL的标准品溶液。分别精密量取黄芪甲苷对照品溶液2 mL和黄芪皂苷Ⅱ对照品溶液1 mL定容于10 mL容量瓶中配成黄芪甲苷对照品溶液0.084 mgmL,黄芪皂苷Ⅱ对照品溶液0.078 6 mgmL的混合标准品溶液。
2.3黄芪发酵液的制备
黄芪粉碎,过10目筛,取120 g,分成4份,加11.5倍量的水,浸泡,调pH中性,121 ℃灭菌60 min,冷却后接种预培养的益生菌,37 ℃发酵,期间调控pH,继续发酵至96 h。结束发酵后,加热煮沸,离心,离心液定容至1 200 mL,115 ℃灭菌50 min备用。黄芪对照液的制备过程同上,但不接种益生菌。

表2发酵黄芪样品说明
2.4供试品溶液的制备
精密量取各黄芪发酵液20 mL(相当于黄芪药材2 g),用水饱和正丁醇萃取4次,每次20 mL,合并正丁醇层,蒸干,用甲醇溶解并定容于10 mL容量瓶中,即得供试品溶液。
2.5线性关系的考察
取黄芪甲苷和黄芪皂苷Ⅱ的混合对照品溶液,分别进样3、5、10、15、20、25、30 μL,按2.1色谱条件测定,记录峰面积的积分值。以进样量(μg)的常用对数值为横坐标,峰面积的积分值的常用对数值为纵坐标,测得线性方程。黄芪甲苷:Y=1.284 9X+6.985 3,R=0.999 6,线性范围为0.252 0~2.520 μg;黄芪皂苷Ⅱ:Y=1.383 2X+6.869,R=0.999 6,线性范围为0.235 8~2.358 μg。
2.6精密度实验
吸取黄芪甲苷和黄芪皂苷Ⅱ混合对照品溶液15 μL,连续重复进样5次,测得黄芪甲苷峰面积的RSD为0.64%,黄芪皂苷Ⅱ峰面积的RSD为0.57%,结果表明仪器精密度良好。
2.7重复性实验
取黄芪液,精密量取5份,每份10 mL,按照2.4项下供试品溶液的制备方法,分别制备供试品液,按2.1项的色谱条件测定。结果表明黄芪甲苷和黄芪皂苷Ⅱ的含量的RSD分别为2.0%和1.9%,表明本方法重复性良好。
2.8稳定性实验
取供试品溶液,室温放置,分别在0、2、6、12、24 h进样测定,结果表明黄芪甲苷峰面积RSD值为1.4%,黄芪皂苷Ⅱ峰面积的RSD为1.5%,表明样品溶液在室温放置24 h内稳定性良好。
2.9加样回收率实验
精密量取混合菌发酵黄芪液6份,每份10 mL(相当于1 g黄芪药材),分别精密加入黄芪甲苷对照品0.252 0 mg,黄芪皂苷Ⅱ对照品0.110 0 mg。按照2.4项要求制备供试品溶液。按照2.1项色谱条件进样,得到黄芪甲苷的回收率为99.69%,RSD为2.0%,黄芪皂苷Ⅱ的回收率为100.42%,RSD为2.3%。
2.10样品的含量测定
精密量取各黄芪发酵液20 mL按照2.4项要求制备供试品溶液,按照2.1项色谱条件测定,计算黄芪液中的黄芪甲苷和黄芪皂苷Ⅱ的含量(折合成每克药材的含量)。结果见表3,色谱图见图1。

表3 黄芪发酵前后黄芪甲苷和黄芪皂苷Ⅱ的含量测定结果

1号峰为黄芪甲苷 2号峰为黄芪皂苷Ⅱ图1 HPLC图Fig.1 HPLC map
3 讨论
实验结果表明,黄芪液中黄芪甲苷的含量为0.476 2 mgg,黄芪经过各种益生菌发酵后黄芪甲苷的含量明显降低,其中混合菌发酵黄芪液中黄芪甲苷的含量最低为0.257 8 mgg,含量降低了45.86%。黄芪对照液中黄芪皂苷Ⅱ的测得含量为0.050 3 mgg,黄芪经短双歧杆菌和混合菌发酵后黄芪皂苷Ⅱ的含量分别为0.106 4 mgg和0.109 4 mgg,黄芪皂苷Ⅱ的含量分别增加了52.73%和54.02%。
不同的益生菌发酵的结果不同[7]。短双歧杆菌、婴儿双歧杆菌以及混合菌种有各自的生物转化机制,这些机制可能为:发酵菌种以黄芪甲苷或者一些非有效成分为前体进行代谢或转化成新的活性成分,从而使黄芪甲苷含量降低;不同的益生菌在发酵过程中产生的初生代谢产物、次生代谢产物与黄芪甲苷或者黄芪药材中的某些物质产生了化学反应,生成了新的物质;黄芪中的某些物质可能对不同益生菌的生长或代谢产生促进或抑制作用,且对不同益生菌的促进或抑制的程度不同,从而改变了黄芪甲苷和黄芪皂苷Ⅱ,以及其他活性成分的比例[8]。
微生物发酵不仅改变了中药的活性成分,进而也改变了中药的临床疗效,使中药能在外观和口感上更好地被病人接受,该技术为中药的开发与利用提供了新的思路和方法。本文采用HPLC-ELSD法,以乙腈-水作为流动相,对发酵前后的黄芪中的黄芪甲苷和黄芪皂苷Ⅱ进行含量测定,灵敏度高、分离度好、操作处理简单且重现性好,回收率高,是一种良好的黄芪甲苷和黄芪皂苷Ⅱ的测定方法。
参考文献:
[1]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:中国医药科技出版社,2010:283.
[2]蒋斗发,殷昌好,俞能高,等.黄芪总皂苷对老年大鼠血液流变性的影响[J].基层中药杂志,2002,16(5):15-16.
[3]高建,徐先祥,徐先俊,等.黄芪总皂苷抗血栓形成作用实验研究[J].中成药,2002,24(2):116-118.
[4]刘艳霞,刘在萍,焦建杰,等.黄芪苷Ⅳ对正常和心功能受抑制大鼠左心室心肌力学的影响[J].中草药,2001,32(4):332-334.
[5]王培培,许杜娟,黄灿,等.黄芪皂苷Ⅱ对人肝癌多药耐药细胞BEL-7402/FU的逆转耐药作用.[J].中药临床药理学与治疗学,2014,19(2):139-144.
[6]耿欣.发酵技术在中药研究中的应用[J].中医药信息,2011,28(4):149-150.
[7]李岗,周洪雷,史玉霞,等.不同制备工艺消栓口服液发酵前后HPLC指纹图谱的比较研究[J].时珍国医国药,2015,26(5):1127-1130.
[8]孙静,马琳,吕斯琦,等.中药发酵技术研究进展[J].药物评价研究,2011,34(1):49-51.
DOI:10.3976/j.issn.1002-4026.2016.04.004
收稿日期:2015-12-28
基金项目:山东省科技计划(2013GSF11903);山东省自然科学基金(ZR2015HM080);山东省高校中医药抗病毒协同创新课题(XTCX2014C01-03)
作者简介:林莎莎(1990-),女,硕士研究生,研究方向为中药及天然药物有效成分及质量控制。Email:786429573@qq.com *通信作者,周洪雷(1967-),男,教授,博士生导师,研究方向为中药及天然药物有效成分及质量控制。Email:zhouhongleitcm@163.com
中图分类号:R284.1
文献标识码:A
文章编号:1002-4026(2016)04-0017-04
HPLC based content determination of AstragalosideⅥ and Ⅱ in various probiotics fermented Radix Astragali
LIN Sha-sha1, ZHOU Hong-lei1*, SUN Xiao-lin2,CHI Yu-feng1,JIANG Hai-qiang1, ZHANG Ling1,CHU Xin-hong2
(1. School of Pharmacy,Shandong University of Traditional Chinese Medicine, Jinan 250355, China;2. Medical Institute of San Zhu Co., Jinan 250100, China)
Abstract∶We determined content variation of AstragalosideⅥ and AstragalosideⅡ in various probiotics fermented Radix Astragali with HPLC-ELSD. Determination conditions were chromatographic column of Agilent C18 column (250 mm×4.6 mm,5 μm),mobile phase of acetonitrile and water mixture, a linear gradient elution, 1 mL/min flow rate. The contents of AstragalosideⅥ and AstragalosideⅡ in Radix Astragali were 0.476 2 mg/g and 0.050 3 mg/g. After fermentation with mixed probiotics, the contents of AstragalosideⅥ and AstragalosideⅡ were 0.257 8 mg/g and 0.109 4 mg/g.Results show that the content of AstragalosideⅡ increases through probiotics fermentation,but the content of AstragalosideⅥ decreases. Moreover, the contents of AstragalosideⅥ and AstragalosideⅡare different through various probiotics fermentation.
Key words∶Radix Astragali; probiotic fermentation; HPLC-ELSD;AstragalosideⅥ;Astragaloside Ⅱ
【中药与天然活性产物】

