花魔芋实生种子组织培养研究初探
段龙飞,郭邦利,陈国爱,刘婷
(安康市农业科学研究所, 陕西 安康 725021)
花魔芋实生种子组织培养研究初探
段龙飞,郭邦利*,陈国爱,刘婷
(安康市农业科学研究所, 陕西 安康 725021)
摘要:[目的]探索花魔芋实生种子组织培养中外源激素最佳配比,提高分化率,生产优质魔芋种芋。[方法]以花魔芋实生种子为外植体,比较不同激素浓度配比对愈伤诱导、芽分化以及生根的影响。[结果]花魔芋实生种子愈伤诱导最佳配方为MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA,诱导率高达90%,增重倍数为7.8;不定芽分化配方为MS+2.0 mg·L-16-BA+0.5 mg·L-1NAA,分化率高达100%,增殖系数为4.6;生根配方为1/2MS+1 mg·L-1NAA,生根率为84%,平均生根数为 38条。[结论]通过优化培养基激素配比,4个月可生产优质组培苗,水培可生产出15 g左右的种芋。
关键词:花魔芋;实生种子;配方优化;诱导率;水培
魔芋(Amorphophalmskonjac)又名蒟蒻,为天南星科魔芋属多年生草本植物,主要分布在亚洲和非洲的热带及亚热带的一些国家和地区,我国为原产地之一[1]。魔芋球茎内含丰富的葡甘聚糖,还含有果胶、生物碱、淀粉、灰分及17种氨基酸和多种微量元素,魔芋加工食品具有降血脂、降血糖、减肥等功效[2,3]。
魔芋种类繁多,全世界约有170种,我国有21种,主要分布于南方各省山地丘陵区[4,5]。目前,我国栽培种主要为花魔芋和白魔芋,而且多为地方群体种,品种性状参差不齐,加上长期的无性繁殖,造成品种退化,品质降低、抗病性减弱[6,7]。因此,加快魔芋新品种的选育,成为当前魔芋产业发展中急需解决的问题。杂交育种是培育魔芋新品种的有效途径,可从杂交实生种子中筛选性状优良的魔芋株系[8]。然而,魔芋开花的环境条件要求严格,加上开花、结果所需的时间较长(3~5年),因此,收获到魔芋实生种子(杂交魔芋种子)的量相对比较少,从而给育种工作带来很大困难。利用组织培养技术对魔芋实生种子(杂交魔芋种)进行培养,可以迅速扩大魔芋杂交后代群体基数,便于从中筛选优良的魔芋新品种。
目前,国内尚无花魔芋实生种子组培技术的相关研究报道。基于此,本研究以花魔芋实生种子作为外植体,研究不同激素配比对愈伤组织诱导、不定芽分化、不定芽生根、组培苗移栽的影响,以期建立适于花魔芋实生种子组织快繁培养技术体系,为魔芋新品种选育奠定基础。
1 材料与方法
1.1材料
安康当地花魔芋实生种子即魔芋杂交种子(即将成熟的魔芋浆果,在无菌条件下分离出实生种子)见图1A。

图1 花魔芋实生种子组培Fig.1 Tissue culture of Amorphophallus Seed 注:A:魔芋果实;B:不定芽分化;C:不定芽生根;D:组培苗Note:A: Konjac fruit; B: Redifferentiation bud; C: Rooting; D: Seedling
1.2方法
1.2.1愈伤组织诱导试验
选择健康的花魔芋实生种子,自来水清洗干净,晾干;将消毒处理的魔芋外植体在超净工作台前接入不同激素浓度配比的MS培养基中进行培养。其中蔗糖30 g·L-1,琼脂4.5 g·L-1,pH 5.8~6.0,温度为25 ℃,光照强度2 000 lx,光照时间12 h·d-1,培养30 d,每个处理60瓶,每瓶接种1个外植体,统计愈伤组织诱导率和增重倍数。
1.2.2芽分化试验
选择质地相同,均匀一致的愈伤组织诱导不定芽的分化,将愈伤组织接种到不同的芽分化培养基中培养,30 d后统计芽分化率、出芽数以及增殖系数(有效芽≥1 cm)。
1.2.3生根试验
选择大小一致的不定芽进行生根试验,设有培养基浓度和NAA浓度两个因素,培养基浓度为MS和1/2 MS(大量元素减半),30 d后统计生根率、生根数以及根长。
1.2.4组培苗的移栽
移栽前,先在室内打开瓶盖,自然光下培养7 d左右,降低温度,增加光照后,再将幼苗移出转入不同营养液中培养,观察生长情况,30 d后统计成活率,90 d后统计球茎重量。
1.3指标分析
愈伤诱导率=出愈外植体块数/接种总块数×100%
增重倍数=愈伤重量/接种前外植体重量
出芽率=产生不定芽的外植体数/接种愈伤块数×100%
增殖系数=每瓶的有效芽数/接种愈伤块数
生根率=生根数/接种总块数×100%
成活率=成活组培苗/移栽总苗数×100%
2 结果与分析
2.1不同激素浓度配比对花魔芋实生种子愈伤组织分化的影响
在植物组织培养中,激素的浓度配比是诱导外植体产生愈伤组织的主要方法。将外植体接种到不同激素浓度配比的培养基中,7 d后外植体与培养基接触处出现“水环”,表面出现轻微褐化现象;14 d后可以明显看到愈伤组织形成,呈球状,颜色为白色;21 d后愈伤组织继续膨大,但颜色呈现淡绿色;30 d后统计各处理愈伤组织诱导率、增重倍数等指标(表1)。由表1可见,不同激素配比对花魔芋实生种子的愈伤组织分化有明显的影响,而对其颜色、质地无显著影响。具体表现为,当6-BA浓度为1.0 mg·L-1时,随着NAA浓度的增大,愈伤的分化率逐渐升高;同时,当NAA浓度为0.5 mg·L-1时,随着6-BA浓度的增大,愈伤的分化率逐渐降低。由此表明,低浓度的NAA或高浓度的6-BA都不适宜花魔芋实生种子愈伤的分化,最适培养基配方应为MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA,愈伤诱导率为90%,增重倍数为7.8。
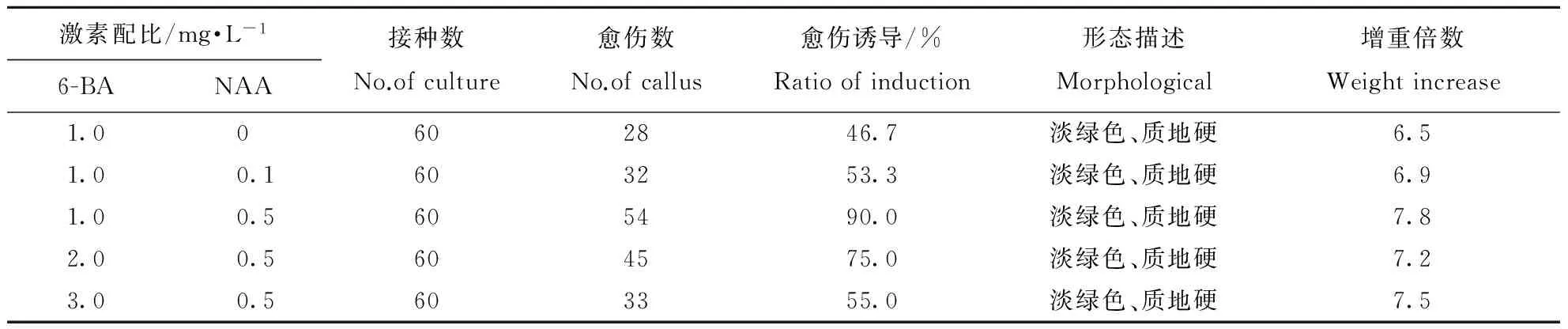
表1 不同激素浓度配比对花魔芋实生种子愈伤组织分化的影响
2.2不同激素浓度配比对花魔芋实生种子不定芽分化的影响
选择同一批生长旺盛、质地硬的愈伤组织进行不定芽分化试验。7 d后愈伤组织逐渐褐变,但不影响生长;14 d后愈伤组织在原有基础上出现膨大,并且出现芽点;21 d可以明显看到不定芽,颜色呈绿色;30 d后统计各处理芽分化率、增殖系数等指标(见表2)。由表2可见,不同激素配比均能分化出淡绿色的不定芽。然而,不定芽分化率、有效芽数量以及长势存在差异。进一步分析发现,当BA浓度为1.0 mg·L-1时,随着NAA 浓度的增加,分化率出现明显降低趋势;当NAA浓度为0.5 mg·L-1时,随着6-BA 浓度的增加,分化率出现先增加后降低的趋势。由此表明,低浓度的NAA和中浓度的6-BA配合使用有利于不定芽分化。结合本试验发现,最适合花魔芋实生种子不定芽分化的培养基为MS+2.0 mg·L-1NAA+0.5 mg·L-16-BA,分化率为100%,增殖系数为4.6。
表2不同激素浓度配比对花魔芋实生种子不定芽分化的影响
Table 2Effect of hormone concentration ratio on adventitious bud differentiation ofAmorphophallus

激素配比/mg·L-16-BANAA接种数No.ofculture芽分率/%Ratioofinduction芽分化数No.ofredifferen-tiation增殖系数Multipli-cation1.0060902043.41.00.160801562.61.00.560401202.02.00.5601002764.63.00.560761672.8
2.3不同培养基配方对魔芋实生种子不定芽生根的影响
促进不定芽生根是植物组培快繁中生产组培苗的关键步骤,只有组培苗生根后才能进行炼苗和移栽。将出芽的愈伤组织转入生根培养基中,14 d后可观察到根的生长点,21 d 后根系明显生长,30 d后统计生根率、根条数等指标(见表3)。由表3可知,不同培养基配方对不定芽的生根率、根条数的影响存在差异,但对生根长度无显著影响。其中1/2 MS+1 mg·L-1NAA,生根效果最好,生根率高达84%,生根条数最多(38条)。进一步分析发现,在1/2 MS基础上,随着NAA浓度的增加,生根率明显降低,生根数减少;然而在MS基础上,随着NAA浓度的增加,生根率及生根数也在减少,但影响相对较小。由此表明,1/2 MS和MS两个基础培养基对于不定芽生根存在差异。结合本试验发现,1/2 MS基础培养基在低浓度NAA的情况下更有利于不定芽生根。
2.4不同营养液配方对组培苗生长的影响
将魔芋组培苗炼苗后,移栽到不同配方的营养液中培养,30 d后统计成活率以及生长情况(表4)。由表4可知,不同营养液配方对魔芋组培苗成活率以及生长情况的影响存在差异。具体表现为,同等激素浓度下,1/2MS培养基培养组培苗的成活率略高于MS;进一步分析发现,随着NAA浓度的增加,组培苗的成活率呈先高后低的趋势。值得一提的是,不添加NAA的情况下,组培苗的长势一般,反之,添加NAA后,组培苗生长旺盛。由此推测,低浓度NAA可能有利于根系的生长,进而对组培苗的生长起到一定作用。然而,不同营养液对组培苗子芋的膨大影响不大,培养3个月左右,子芋的平均鲜重可达15 g左右。
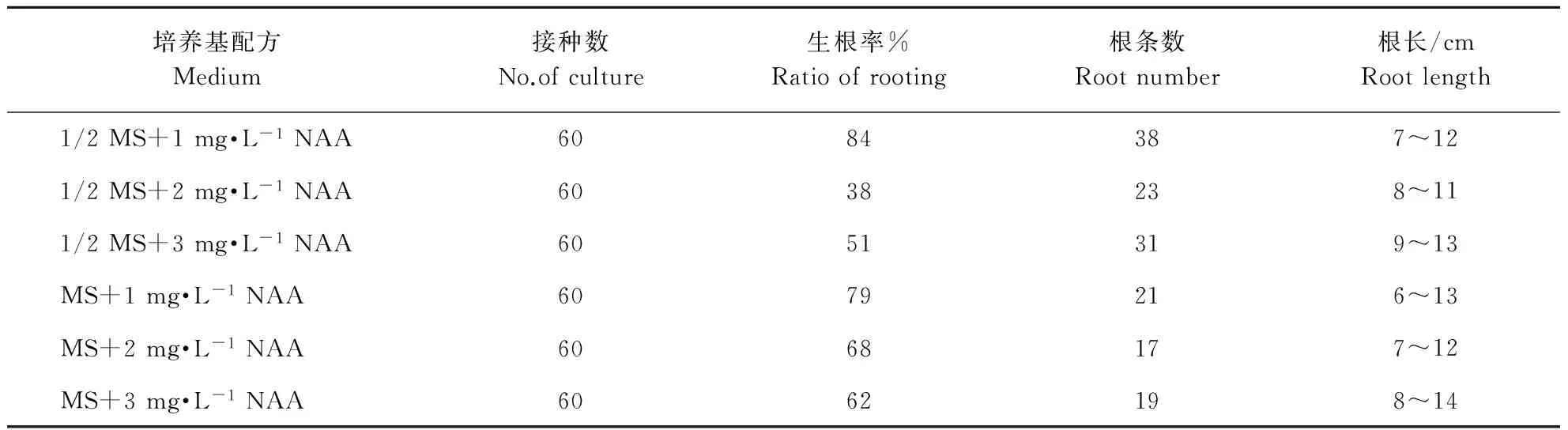
表3 不同培养基配方对花魔芋实生种子不定芽生根的影响

表4 不同营养液对花魔芋组培苗生长的影响
3 结论与讨论
不同植物愈伤组织形态分化对外源激素的要求存在差异,这是由于外植体本身内源激素水平差异造成的,从而使不同的外植体在组培过程中对外源激素需求不同[10]。已有研究表明,最适合花魔芋愈伤组织诱导以及芽分化的培养基范围为MS+(1.0~2.0) mg·L-16-BA+(0.01~0.2) mg·L-1NAA[11]。结合本试验发现,以花魔芋实生种子为外植体,最佳愈伤组织培养基为MS+1.0mg·L-16-BA+0.5 mg·L-1NAA,最佳不定芽培养基为MS+2.0 mg·L-16-BA+0.5 mg·L-1NAA。由此可知,花魔芋实生种子愈伤组织诱导和芽分化所需6-BA的用量与已有研究[11]较为一致,然而NAA的用量明显超出了(0.01~0.2) mg·L-1。这可能是由于外植体材料的差异导致的。
不定芽生根是组织培养体系的最后一步,生根的质量直接决定组培苗移栽后的成活率以及后期的生长,根数越多更有利于从营养液中摄取营养,进而有利于组培苗的生长。刘贵州等研究表明NAA能促进根的形成,最佳的生根配方为1/2 MS+5 mg·L-1NAA[11,12]。本试验研究表明,NAA的确有利于不定芽生根,然而,较高的NAA浓度却不利于根的形成。魔芋组培苗水培的研究相对较少,笔者认为,魔芋水培技术的核心在于炼苗、水培营养液配方以及培养环境。因此,在移栽前,应先在室内打开瓶盖,在自然光下培养10 d左右,降低温度,增加光照后,再将幼苗移栽到营养液中培养。本试验研究表明1/2MS基础上添加低浓度的NAA有利于组培苗的生长。
利用魔芋不同外植体进行组织培养研究的报道较多,其中包括魔芋主芽、侧芽、芽鞘、叶柄、根状茎以及球茎等[9],但由于魔芋长期的无性繁殖,导致品种退化、抗性以及品质下降,因此,利用以上材料作为外植体进行组培快繁时,虽然提高了魔芋的繁殖系数,但是生产出来的魔芋种芋在抗性、品质以及产量上基本保持原有的特性。然而,利用魔芋杂交后产生的实生种子进行组织培养研究,一方面可以快速繁育优质种芋,解决种源问题;另一方面,由于杂交优势也可从魔芋实生种子群体中快速筛选出具有优良性状的魔芋株系,这对于魔芋的育种工作意义重大。目前,关于魔芋实生种子组织培养技术研究未见报道。因此,本研究首次利用未成熟的花魔芋实生种子作为外植体,筛选出了愈伤诱导、不定芽的分化、生根以及水培营养液的最佳配方,同时,掌握了组培苗移栽的关键技术,形成了一套花魔芋实生种子组培关键技术,为魔芋的新品种选育奠定了基础。
参考文献
[1]刘佩瑛.魔芋学[M].北京:中国农业出版社,2004:3-5.
[2]谢建华,庞杰,朱国辉,等.魔芋葡甘聚糖功能研究进展[J].食品工业科技,2005,26(12):180-183.
[3]吴绍艳,张升晖.魔芋葡甘聚糖在食品中的应用[J].食品研究与开发,2005,26(2):7-9.
[4]牛义,张盛林,王志敏,等.中国魔芋资源的研究与利用[J].西南农业大学学报(自然科学版),2005,27(5):635-637.
[5]牛义,张盛林,王志敏,等.中国的魔芋资源[J].西南园艺,2005,33(2):22-24.
[6]陈国爱,郭邦利,刘婷,等.魔芋新品种选育研究进展[J].长江蔬菜,2015,4(2):45-47.
[7]钟伏付,苏娜,杨廷宪,等.魔芋品种选育与改良研究进展[J].湖北农业科学,2011,50(3):447-449.
[8]张盛林,刘佩瑛,孙原名,等.魔芋属种间杂交技术研究[J].西南农业大学学报,1998,20(1):219-222.
[9]谢庆华,吴毅歆,谢世清,等.花魔芋不同外植体分化及生根条件研究[J].云南农业大学学报,2004,19(6):696-699.
[10]谢从华,柳俊.植物细胞工程[M].北京:高等教育出版社,2004:10-12.
[11]吝祥根.花魔芋组织培养快繁体系的建立及其分化机理的研究[D].成都:四川农业大学,2012.
[12]刘贵周,谢世淸,赵庆云,等.优质魔芋组培苗瓶外生根的研究[J].中国农学通报,2005,21(4):62-63.
(编辑:武英耀)
收稿日期:2016-04-15 修回日期:2016-05-13
作者简介:段龙飞(1987-),男(汉),陕西西安人,硕士,助理农艺师,研究方向:植物组织培养
*通讯作者:郭邦利,高级农艺师。Tel:13098009806,Emai:1304531689@qq.com
基金项目:陕西省科学技术研究发展计划项目(2013K01-24)
中图分类号:S632.3
文献标识码:A
文章编号:1671-8151(2016)09-0639-05
Study on tissue culture ofAmorphophalluskonjac seed
Duan Longfei, Guo Bangli*, Chen Guoai, Liu Ting
(AnkangAgriculturalScienceResearchInstitute,ankang725021,China)
Abstract:[Objective]This study aimed to explore the best ratio hormones of Amorphophallus konjac seedling seed tissue culture, to increase differentiation rate and quality of konjac seed. [Methods]Amorphophallus seeds were taken as explants, with various concentrations BA and NAA were studied.[Results]The results showed that the best callus medium of seed was MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA, the ratio of induction was 90%, the weight increase was 7.8; the best redifferentiation bud medium was MS+2.0 mg·L-16-BA+0.5 mg·L-1NAA, the ratio of redifferentiation was 100%, the multiplication factor was 4.6. The best rooting medium was 1/2 MS+1 mg·L-1NAA, the rooting rate was 84%, the number of root was 38. [Conclusion]Finally, high quality seedlings were produced in 4 months, 15g of Konjac were obtained by hydroponic Technology.
Key words:Konjak; Seed; Formulation optimization; Ratio of induction; Hydroponics

