大豆高代新品系草甘膦抗性的检测与筛选
王鹏,郭玮,马艳芸,李贵全
(山西农业大学 农学院,山西 太谷 030801)
大豆高代新品系草甘膦抗性的检测与筛选
王鹏,郭玮,马艳芸,李贵全*
(山西农业大学 农学院,山西 太谷 030801)
摘要:[目的]对大豆杂交高代品系草甘膦抗性进行检测,并从中筛选综合性状优良的抗草甘膦大豆新品系。[方法]以普通大豆晋大73为母本,抗草甘膦转基因大豆RR1为父本进行杂交,采用常规育种方法,早代以农艺性状为标记进行选择,F7代对34个后代品系进行蛋白脂肪含量测定和大田草甘膦抗性测定,并以大豆凝集素基因(lectin)为内置标准,对大豆外源CaMV35S启动子、NOS终止子、抗草甘膦基因(CP4-EPSPS)进行PCR检测。[结果]27个品系对草甘膦具有完全抗性,且均检测到CaMV35S启动子、NOS终止子和CP4-EPSPS基因;5个品系未检测到CP4-EPSPS基因,田间测定也均为完全不抗;另有2个品系PCR检测结果一致,但田间抗性测定1个为完全抗性、1个为完全不抗。[结论]田间测定结果与PCR检测结果基本一致,符合率达到了94.1%。筛选出27个具备抗草甘膦特性的新品系,其中4个品质优良,表现为超亲优势。
关键词:杂交;常规育种;抗草甘膦大豆
转基因大豆是世界上商品化较早,且推广种植面积最大的转基因作物[1,2]。其中,发展最为迅速的当属抗除草剂转基因大豆,它在杂草防治上的便捷性、经济性,以及产量上都具有无可比拟的优势[3,4],尤以美国Monsanto公司的耐草甘膦大豆(Roundup Ready Soybean,简称RR大豆)为代表[5]。我国研究转基因大豆起步较晚,特别是抗除草剂转基因大豆仍在起步试验阶段,没有真正投入到生产中。因此,迫切需要培育具有自主知识产权的抗除草剂转基因大豆,这也是我国发展转基因大豆的新途径。大部分获得抗除草剂转基因大豆材料的途径,都是利用现代生物技术手段,直接将抗除草剂基因导入具有特定性状的普通大豆中。中科院岳绍先等将龙葵中的抗阿特拉津基因psbA转入夏大豆新品系83117叶绿体DNA中,成功获得转基因植株,并通过表型和分子鉴定证实该基因能够成功遗传到子代中[6,7];上世纪90年代,他们又研究将抗阿特拉津基因导入黑龙江大豆品种中,并获得了4个抗性稳定遗传的转基因大豆新品种[8,9];天津大学荣非等利用“微创法”对大豆胚尖生长点进行转化,将EPSPS基因成功导入大豆中,获得了抗草甘膦大豆植株[10]。对于利用常规育种手段,从普通优质大豆品种与抗除草剂转基因大豆杂交后代群体中选择具有抗除草剂基因的大豆新品种,国内外研究的都较少,朱洪德等曾对其杂交后代产量性状及抗除草剂基因进行过遗传分析,并证实抗除草剂基因受一对显性核基因控制,可以通过杂交转移到普通大豆中[11~13]。本研究旨在将转基因技术成果与常规育种手段相结合,采用当地优质大豆品种与抗草甘膦转基因大豆品种进行杂交,通过多年选择及多代自交纯合,拟选育品质优良、遗传性状稳定的抗草甘膦大豆新品种,从而实现抗性、适应性及产量性状的同步改良,为今后培育适合本生态区种植的抗草甘膦大豆品种提供一定的实践基础和理论依据。
1 材料与方法
1.1材料
以山西主推品种晋大73为母本、抗草甘膦大豆品种RR1为父本杂交,按系谱法选育到F7代得到34个稳定的新品系。
1.2田间试验
2006年7月在山西农大育种基地,以晋大73为母本、RR1为父本进行人工杂交,次年F1代选择优良单株第三年种植成株系,连续多代进行单株选择,淘汰不良株系。F7代于2013年5月6日播种,随机选取3个小区进行3次重复,一个小区在临近开花期时喷施草甘膦溶液(浓度为1%),另外选择长势基本相同的一个小区作为对照组,剩余的一个小区则用于测定产量及品质性状。喷药一个星期后统计各个材料在田间对草甘膦的抗药性。生长期间,按照当地田间管理水平进行管理,并及时做好田间观察记录。

表1 引物序列及目标产物长度
1.3PCR检测
1.3.1引物相关信息
以大豆凝集素基因(lectin)为内置标准[14],对大豆外源CaMV35S启动子、CP4-EPSPS、NOS终止子进行PCR检测。相关引物的名称、序列、扩增产物的长度和这些引物在基因库中的序列号见表1[15~17]。
1.3.2DNA提取
供试材料长出第五出复叶时,取最顶端
幼嫩的叶片为材料提取DNA;SDS法提取大豆叶片总DNA;UV-240紫外分光光度计检测样品DNA质量与浓度,若DNA较为纯净则A260/ A280=1.8±0.1;1 ×TE 稀释至30 ng备用,-20 ℃冰箱保存备用。
1.3.3PCR扩增
总反应体积25 μL,95 ℃预变性5 min,40个循环,每个循环94 ℃变性1 min ,退火30 s,72 ℃延伸1 min,循环结束后72 ℃延伸5 min,4 ℃保存。CaMV35S 启动子、NOS 终止子和CP4-EPSPS引物扩增时的退火温度分别为59 ℃、56 ℃和58 ℃。取PCR扩增产物6 μL,0.8%琼脂糖凝胶电泳检测,TY4133型凝胶成像分析系统紫外灯下拍照。
2 结果与分析
2.1草甘膦抗性的大田检测
抗感类型以整株枯死为界限,由表2可知,共计5个新品系整株全部枯死,存活率为0,为完全不抗;22个新品系存活率为100%,6个新品系存活率达到90%以上,均为完全抗性;只有13号出现抗性分离,存活率为11%。

表2 不同品系对草甘膦抗性一览表
2.2大豆内参基因的检测
针对大豆凝集素引物的PCR扩增结果显示,全部材料均在436 bp处检测到了lectin基因片段(图1)。由此可知所提取的DNA均为大豆基因组DNA,且纯度较高,符合后续PCR要求。
2.3大豆外源基因的检测
由图2可以看出,通过CaMV35S 启动子引物进行PCR扩增,共计31个新品系在165 bp处出现CaMV35S特异性扩增产物,说明这些材料成功转入了外源基因的启动子CaMV35S。而在19、30、31中未检测到外源基因的启动子CaMV35S,由此我们可认为这3个材料不存在转基因成分。
通过CP4-EPSPS基因引物进行PCR扩增,共计29个新品系在146 bp处出现CP4-EPSPS特异性扩增产物,说明这些材料成功导入了目的基因CP4-EPSPS。而在13、19、30、31、32中则未检测到目的基因CP4-EPSPS,说明这5个材料不存抗草甘膦基因。
通过NOS终止子引物进行PCR扩增,共计28个新品系在180 bp处出现NOS终止子特异性扩增产物,说明这些材料成功导入了NOS终止子。而在4、10、13、19、31、32中则未检测到NOS终止子,说明NOS终止子并未导入这6个材料中。
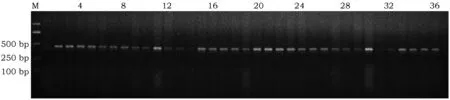
图1 大豆内源基因lectin 的PCR检测电泳图谱Fig.1 Banding patterns amplified by lectin in soybean

图2 大豆外源基因PCR检测的电泳图谱Fig.2 Banding patterns amplified by foreign gene primer in soybean
2.4蛋白脂肪含量的测定
通过对亲本及后代品系蛋白质和脂肪含量的测定可以看出,35号品系蛋白含量高于双亲,达到44.1%,表现为超亲优势;3、16、21号3个品系蛋白脂肪总含量高于双亲,分别为65%、64.54%和65.4%(表3),在综合考虑品质性状时,可将这3个品系作为育种过程中优先考虑的品系。
3 讨论
3.1利用常规杂交获得抗草甘膦大豆
抗草甘膦大豆在降低生产成本、提高大豆产量等方面具有巨大优势,已成为转基因大豆育种的一个热门领域。当前,主要是通过生物技术手段将抗性基因直接导入到大豆品种中,如农杆菌介导转化法、基因枪法等。但这些方法存在一些弊端,如基因枪转化后拷贝数过多[18,19],一些转化获得的植株只能作为中间材料而无法直接应用于生产等[20]。因此,可以利用已有的抗草甘膦转基因大豆,通过常规杂交的方法,将抗草甘膦基因转入农艺性状优良的普通大豆品种中,进而选择培育出抗除草剂大豆新品种。这样不仅能有效解决试验条件下转化率低,转入品种农艺性状表现不好等问题[21],而且可以扩展到其他不同目标基因。另外,在世代选择的过程中,可以通过南繁加代,以加快和完善目标性状导入的进程,缩短育种年限。
3.2检测中出现的问题
经过多代自交,1、2、3、5、6、7、8、9、11、12、14、15、16、17、18、20、21、22、23、24、25、26、27、28、29、35、36等27个新品系对草甘膦具有完全抗性,并且均检测到了CaMV35S启动子、NOS终止子和CP4-EPSPS基因,表明已经是纯合的抗草甘膦品系;13、19、30、31、32均未检测到CP4-EPSPS基因,田间测定也均为完全不抗。以上结果可见,田间抗性测试和实验室PCR检测结果保持一致。而4和10检测结果虽然完全一样,包含CP4-EPSPS基因和CaMV35S启动子,未检测到NOS终止子,但其田间抗性测定结果却大相径庭,4为完全不抗,10为完全抗性,可能存在抗性的分离,也可能是PCR检测出现假阳性结果[22],需要进一步采用Southern 杂交等方法进一步证实PCR检测结果的可靠性。
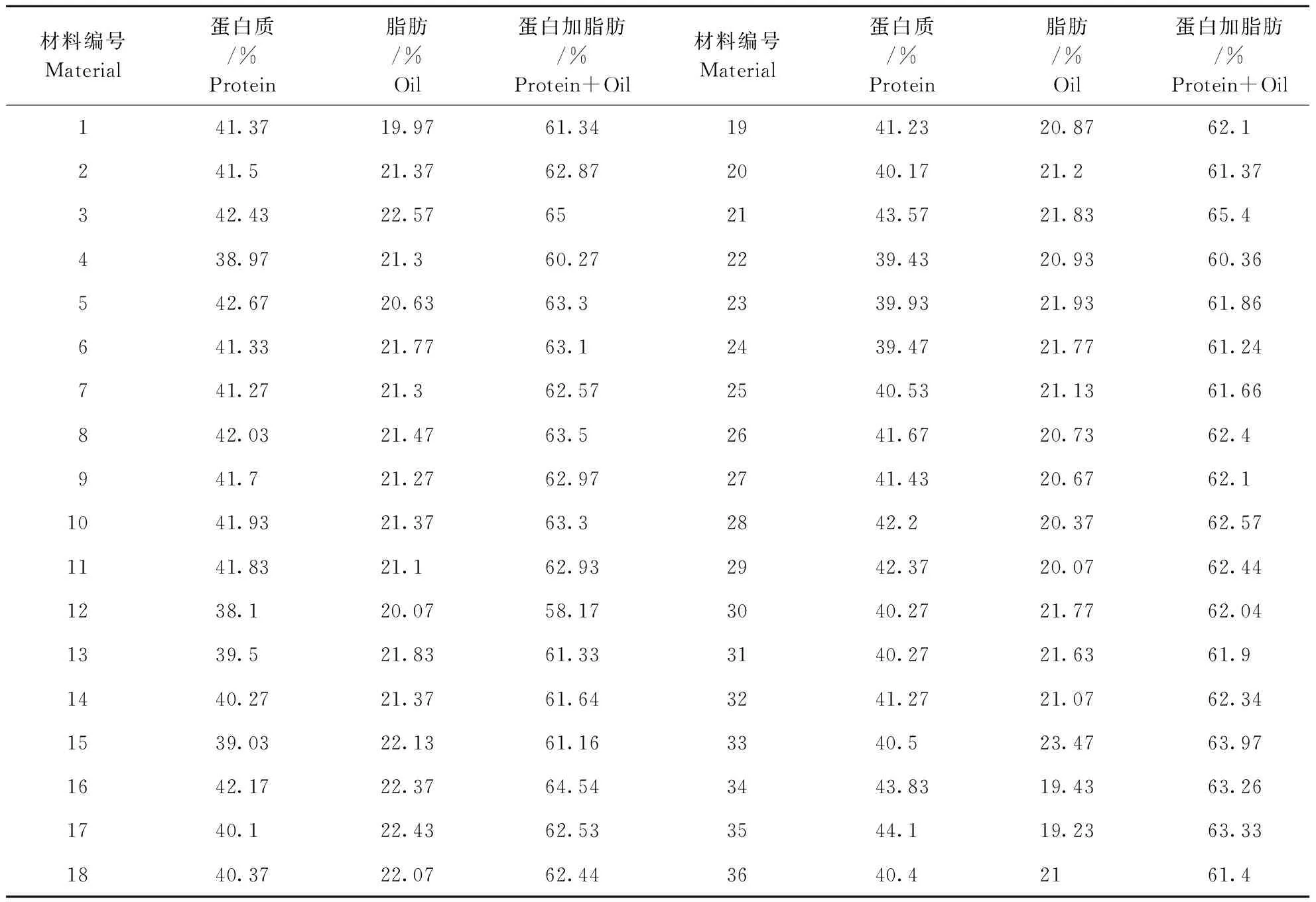
表3 候选材料36个品系蛋白与脂肪含量表
4 结论
利用抗草甘膦转基因大豆与优良非转基因品种杂交,早代以农艺性状为标记进行选择,到稳定的F7代再进行草甘膦抗性检测及品质测定,在27个抗草甘膦后代品系中,35号蛋白含量丰富,3、16、21号综合品质性状优良,这4个品系可作为品质育种优先考虑的材料。
参考文献
[1]潘良文,陈家华,沈禹飞,等.进口转基因抗草甘膦油菜籽和大豆中CP4-EPSPS基因的监测比较研究[J].农业生物技术学报,2001,12(3):175-177.
[2]罗振锋,李启云.转基因大豆产业化现状及展望[J].大豆科学,2005,24(3):220-223.
[3]梁雪莲,王引斌,卫建强,等.作物抗除草剂转基因研究进展[J].生物技术通讯,2001,(2):17-21.
[4]杨加银.转基因大豆生产的现状与趋势[J].世界农业,2007,278(6):40-42.
[5]Phillip A C.RAPD analysis of seed purity in a commercial hybrid cabbage (Brassica oleracavar Capital) cultivar[J].Genome,2000,43:317.
[6]岳绍先,刘博林,毛大璋,等.抗阿特拉津基因大豆植株后代的遗传分析[J].植物学报,1990,32(5):343-349.
[7]刘博林,岳绍先,胡乃璧,等.龙葵阿特拉津抗性基因向大豆叶绿体基因组的转移及在转基因植株中的表达[J].科学通报,1988,19:1519-1520.
[8]岳绍先,傅骏骅,李连城,等.抗Atrazine基因导人黑龙江大豆品种及其表达和遗传[J].中国农业科学,1996,29(1):78-83.
[9]朱立煌,胡乃璧,翟文学.龙葵阿特拉津抗性生物型的鉴定和阿特拉津抗性基因的克隆[J].遗传学报,13(6):403-410.
[10]荣非,王罡,季静,等.利用“微创刷”法获得抗草甘膦转基因大豆[J].大豆科学,2015,34(2):217-223.
[11]高中利,朱洪德,刘敏,等.优质大豆品种与抗除草剂转基因大豆品种杂种后代的遗传分析[J].大豆科学,2011,30(1):46-49.
[12]刘敏,朱洪德,高中利,等.抗除草剂转基因大豆遗传分析[J].大豆科学,2010,29(1):34-36.
[13]Zhang Y,Yang BY,Chen SY,et al.Inheritance Analysis of Herbicide-Resistant Transgenic Soybean Lines[J].Acta Genetica Sinica,2006,33(12):1105-1111.
[14]吕山花,常汝镇.抗草甘膦转基因大豆PCR检测方法的建立与应用[J].中国农业科学,2003,36(8):883-887.
[15]曹际娟,陈明生,卢行安,等.PCR检测转基因玉米及其粗加工食品[J].玉米科学,2001,9(2):87-91.
[16]Lipp M,Brodmann P,Pietsch K,Pauwels J,et al.IUPAC collaborative trial study of a method to detect genetically modified soybeans and maize in dried powder[J].Journal of AOAC International,1999,82(4):923-928.
[17]Vaitilingom M,Pijnenburg H,Gendre F,et al.Real-Time quant itative PCR detection of genetically modified Maximizer Maize and Roundup Ready Soybean in some representative foods[J].Journal of Agricultural and Food Chemistry,1999,47:5261-5266.
[18]Schnbrunn E,Eschenburg S,Shuttleworth W A,et al.Interaction of the herbicide glyphosate with its target enzyme5-enolpyruvylshikimate-3-phosphate synthaseinatomic detail[J].Proceedings of the National Academic Sciences,2001,98(4):1376-1380.
[19]冯道荣,邱国华,许新萍,等.多基因植物表达载体的构建[J].西北植物学报,2001,21(4):609-614.
[20]Shaner D L.The impact of glyphostate to lerant crops on the use of other herbicides and on resistance management[J].Pest Manage Science,2000,56:320-326.
[21]刘海坤,卫志明.大豆遗传转化研究进展[J].植物生理与分子生物学学报,2005,31(2):126-134.
[22]胡汉桥.抗草甘膦转基因大豆PCR检测及问题探讨[J].生物技术通报,2007(1):113-116,132.
(编辑:邢国芳)
收稿日期:2016-04-27 修回日期:2016-05-28
作者简介:王鹏(1983-),男(汉),山西阳泉人,博士研究生,研究方向:大豆新品种选育 *通讯作者:李贵全,教授,博士生导师。Tel:0354-6288374,E-mail:li-gui-quan@126.com
基金项目:山西农业大学科技创新项目(20142-03);山西省财政支持农业科技成果转化资金项目;国家农业综合开发存量资金土地治理项目
中图分类号:S565.1
文献标识码:A
文章编号:1671-8151(2016)09-0609-05
Detection and screen of soybean new strains resistant to glyphosate in high generation
Wang Peng, Guo Wei, Ma Yanyun, Li Guiquan*
(CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:[Objective] The purpose of this study is to detect the resistance to glyphosate and screen the new glyphosate-resistant soybean materials from Jinda73×RR1 hybrid descendants according to conventional breeding method. [Methods]First, we obtained the homozygous recombinant inbred line F7 group from Jinda73 and RR1 by pedigree method. Second, primers were designed to amplify the CaMV35S promoter, the NOS terminator, the foreign gene cp4-epsps, and the soybean lectin which used as intemal standards. Then, PCR result was confirmed with the test for resistance to glyphosate in the field and quality determination. [Results]The results indicated that CaMV35S promoter, the NOS terminator, and the cp4-epsps were detected in 27 lines, which resistant to glyphosate, There was no cp4-epsps in 5 lines, while they had no resistant to glyphosate. PCR results were not consistent with the test for resistance to glyphosate in the field in 2 lines. [Conclusion]Spraying glyphosate on 34 strains in the field was consistent 94.1% with PCR detection, there were 4 strains with excellent quality characters in 27 strains which resistant to glyphosate.
Key words:Hybrid; Conventional breeding; Soybean resistant to glyphosate

