GPER介导雌激素对兔耳增生性瘢痕的影响
邵 宁, 程代薇, 曾 琪, 郑庆桂, 钱 宁, 吴曙光
作者单位:563003 贵州 遵义,遵义医学院(邵 宁,曾 琪);贵州省人民医院 烧伤整形科(程代薇,郑庆桂);贵阳中医学院 实验动物中心(钱 宁,吴曙光)
GPER介导雌激素对兔耳增生性瘢痕的影响
邵 宁, 程代薇, 曾 琪, 郑庆桂, 钱 宁, 吴曙光
G蛋白偶联雌激素受体; 增生性瘢痕; 转化生长因子
皮肤及其附件是雌激素(E2)的重要靶器官之一,所以,E2对于瘢痕的形成具有影响作用[1]。有研究表明,通过阻断E2来治疗瘢痕增生是有效的[2]。但是,如果单纯为了阻断瘢痕生长而直接抑制E2会带来各种严重的不良反应,如骨质疏松、心血管疾病、更年期综合征等[3],而这些不良反多以E2核受体为主导,G蛋白偶联雌激素受体(G protein coupled estrogen receptorgper, GPER)对其影响相对较小。研究还发现,GPER与多种肿瘤细胞的增殖存在密切关系,而增生性瘢痕与肿瘤也有相似的细胞学特性。自2015年3~9月,我们通过建立兔耳增生性瘢痕模型,局部应用17-β-雌二醇(E2)、GPER特异性激动剂(G1)和拮抗剂(G15)来观察瘢痕的增生情况,并检测瘢痕增生的相关因子和GPER的mRNA表达量,以探讨GPER在对增生性瘢痕的影响,为临床治疗增生性瘢痕提供新的药物靶点。
1 材料与方法
1.1 实验动物
选择3~6个月龄健康的新西兰大耳兔36只(由第三军医大学实验动物中心提供),均为雌性;体质量2.5~3.0 kg。将36只兔造模后随机分为6组:空白对照组、DMSO组、E2组、G1组、 E2+G15组、G1+G15组;每组6只。
1.2 主要材料与仪器
17-β-雌二醇(E2)和二甲基亚砜(DMSO;美国SIGMA公司);GPER特异性激动剂(G1)及其特异性拮抗剂(G15;美国CAYMAN公司);盐酸氯胺酮(英国TOCRIS公司);盐酸塞拉嗪(英国LGC公司);戊巴比妥钠(德国MERCK公司)。
1.3 实验方法
1.3.1 兔耳瘢痕模型制备 参照文献[4]方法:每只兔给予肌注氯胺酮(40 mg/kg)和盐酸塞拉嗪(4 mg/kg)麻醉后,用无菌手术刀在兔的单侧耳腹面共做6个直径为10 mm的圆形创面,间距大于15 mm,深达软骨层并刮除软骨膜,创面暴露,自然愈合。每日观察创面情况,确保创面干燥无感染。
1.3.2 分组给药及组织处理 参照小鼠的皮下给药剂量[5],根据体表面积直接换算法[6],设计出给药方案。E2组、G1组、 E2+G15组、G1+G15组4个给药组分别用微量注射器在兔耳根部皮下注射。注射剂量:E2(0.025 mg/kg·d),G1(0.06 mg/kg·d),G15(0.06 mg/kg·d)。DMSO组注射经PBS稀释为10%DMSO溶液;对照组不予任何处理。从第15天开始给药[7],连续给药15 d后取标本。采用戊巴比妥钠90 mg/kg于兔心内注射,将其处死;距瘢痕边缘0.5 mm切取标本,并经瘢痕最高点将其一分为二,分别放入10%甲醛及RNAiso Plus液中固定,保存于-80℃冰箱中。
1.3.3 组织学检测 将切取标本在10%甲醛中固定24 h后,石蜡包埋,并切成5 μm厚,分别进行HE染色和MASSON 染色,用于光镜下组织学观察及瘢痕增生指数测量(图1)[8]。
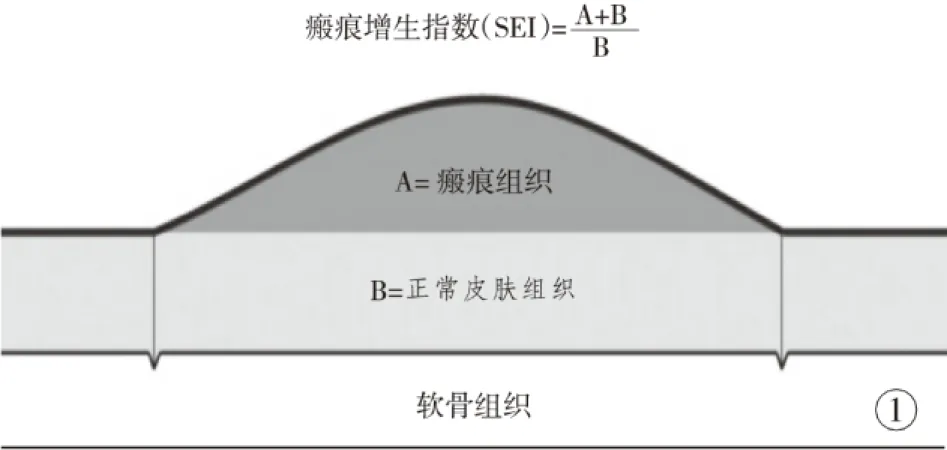
图1 瘢痕增生指数
1.3.4 RT-PCR法检测增生性瘢痕组织中TGF-β1、collagenⅠ、collagen Ⅲ和GPER的mRNA表达 将兔耳瘢痕组织标本浸于TRIZOL试剂并提取总RNA后,利用PrimeScript®RT Master Mix试剂盒逆转录合成cDNA。根据其在目的基因ncbi库中的对应序列,利用PRIMER 5软件分别设计特异引物(表1)。最后选择GAPDH 为内参,通过SYBR®Premix Ex TaqTMⅡ试剂盒进行qRT-PCR检测。记录各样本Ct值作为统计参数,利用 2-ΔΔCt公式计算各个基因mRNA相对表达。实验至少重复3次。

表1 各基因引物序列及产物大小
1.4 统计学处理
2 结果
2.1 瘢痕形态学观察
E2和G1组较对照组瘢痕明显凸出皮表,颜色较深,多呈暗红色,中央部最为厚实,质地较硬;经G15处理后,瘢痕中央厚度明显降低,颜色较浅呈粉红色,部分与正常皮肤接近,质地明显变软;而DMSO组与对照组差别较小(图2)。
2.2 组织学观察
2.2.1 HE 染色 经HE染色后镜检,E2组和G1组存在大量的成纤维细胞,血管生长丰富,细胞外基质有大量沉积,胶原纤维多且粗大;经G15处理后,成纤维细胞明显减少,血管分布较少,细胞外基质沉积减少,胶原纤维也相对减少;DMSO组相对于空白对照组的变化不明显。见图3。
2.2.2 Masson 染色 经Masson染色后镜检,E2组和G1组的胶原纤维致密粗大,排列紊乱;经G15处理后,胶原纤维稀疏,排列较整齐;DMSO组相对于空白对照组的胶原纤维差别较小(图4)。
2.3 瘢痕增生指数
E2和G1明显高于空白对照组(P<0.05),E2+G15组和G1+G15组分别低于E2和G1组(P<0.05),而空白对照组和DMSO组比较,其差异无统计学意义(P>0.05)。见图5。
2.4 兔耳瘢痕组织中TGF-β1、collagenⅠ、collagen Ⅲ和GPER的mRNA表达
结果显示:E2和G1组的表达量均明显高于空白对照组(P<0.05);而E2和G1组经G15处理后的表达量均明显降低(P<0.05);DMSO组与空白对照组比较,其差异无统计学意义(P>0.05,图6)。
3 讨论
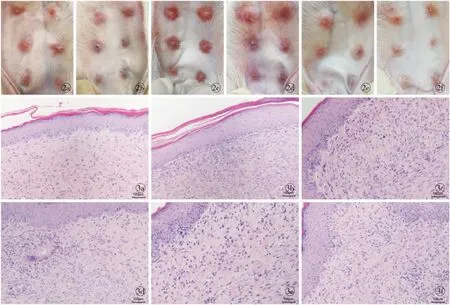
图2 各组兔耳瘢痕形态对比 a.对照组 b.DMSO组 c.E2组 d.G1组 e.E2+G15组 f.G1+G15组 图3 兔耳瘢痕组织HE染色(×200) a.对照组 b.DMSO组 c.E2组 d.G1组 e.E2+G15组 f.G1+G15组
Fig 2 Comparison of the morphology of rabbit scar in each group. a.control group. b.DMSO group. c.E2 group. d.G1 group. e.E2+G15 group. f.G1+G15 group. Fig 3 HE staining of rabbit scar tissue (×200). a.control group. b.DMSO group. c.E2 group.d.G1 group. e.E2+G15 group. f.G1+G15 group.
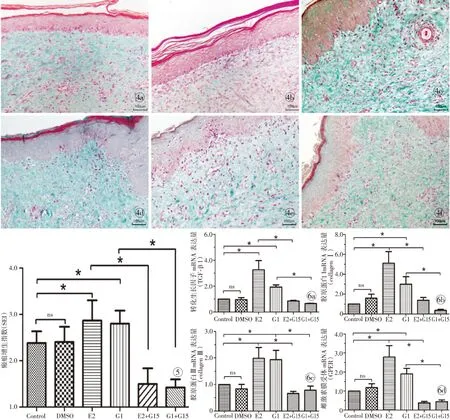
图4 兔耳瘢痕组织Masson染色(×200) a.对照组 b.DMSO组 c.E2组 d.G1组 e.E2+G15组 f.G1+G15组 图5 E2、G1和G15组对于瘢痕指数的影响[ns:无显著差异,*:P<0.05 (n=18)] 图6 Real-time PCR检测瘢痕组织中TGF-β1、collagenⅠ、collagen Ⅲ和GPER的mRNA表达[ns:无显著差异,*:P<0.05 (n=6)] a.TGF-β1的mRNA的表达 b.胶原Ⅰ的mRNA的表达 c.胶原Ⅲ的mRNA的表达 d.GPER的mRNA的表达
Fig 4 Masson staining of rabbit scar tissue (×200). a.control group. b.DMSO group. c.E2 group. d.G1 group. e.E2+G15 group. f.G1+G15 group. Fig 5 The effect of E2、G1 and G15 on SEI [ns: not significant,*:P<0.05 (n=18)]. Fig 6 Expression of TGF-β1, collagen Ⅰ, collagen Ⅲ and GPER determined by real-time PCR analysis [ns: not significant,*:P<0.05 (n=6)].a. expression of TGF-β1 mRNA. b. expression of collagen Ⅰ. c. expression of collagen Ⅲ. d. expression of GPER.
雌激素通过与雌激素受体特异性结合,形成E2-受体复合物才能发挥其生物学效应,包括E2核受体Erα和Erβ 2个亚型。随后研究发现,E2还存在1个G蛋白偶联受体。2009年,国际药理学联合会正式将其命名为GPER。E2通过GPER快速激活细胞的第二信使系统,间接调节第一系列基因转录,从而在各种细胞类型中发挥生物学效应[9]。大量的研究发现,GPER在多种癌细胞中均有表达并促进其增殖和存活[10]。如恶性乳腺癌[11]、套细胞淋巴瘤[12]、肺癌[13]、平滑肌瘤[14]等。而增生性瘢痕的细胞病理学特性与肿瘤极为相似,因此,本实验探究GPER对于增生性瘢痕是否有影响。在观察中发现,使用E2相比对照组的兔耳瘢痕增生明显,并且检测瘢痕组织中TGF-β1 、collagen Ⅰ、collagen Ⅲ[15]和GPER的mRNA表达量也同比增高。这与之前文献报道一致[16]。E2能够促进瘢痕增生,但GPER是否在其中产生影响,尚未确定。因此,本实验设计给药GPER特异性激动剂(G1)和拮抗剂(G15),并观察瘢痕增生的情况。我们发现,使用G1与使用E2的兔耳瘢痕增生情况十分相似,经G15处理后的兔耳瘢痕比G1和E2组明显扁平、变软,颜色接近周围正常皮肤,而且成纤维细胞及胶原纤维减少,且排列整齐;观察检测瘢痕组织中,TGF-β1、collagen Ⅰ、collagen Ⅲ和GPER的mRNA表达量也明显下降。这表明:⑴GPER对于瘢痕有明显的影响作用,而激活GPER可促进瘢痕形成,反之则抑制。⑵GPER拮抗剂(G15)同样能抑制E2对瘢痕的促进作用,进一步说明GPER在E2促进瘢痕增生中发挥着重要作用。但是,E2核受体对瘢痕有无影响尚需进一步研究证实。
综上所述,E2在增生性瘢痕的作用中GPER发挥着十分重要的作用。GPER不仅是肿瘤治疗的新型靶点,而且也是治疗增生性瘢痕的潜在靶点。但是,由于GPER是新兴的研究热点,其介导的信号通路纷繁复杂,究竟是哪条信号通路起作用,还有待进一步研究。
[1] 江 华, 张盈帆. 瘢痕研究的现状和展望[J]. 中国美容整形外科杂志, 2015,26(3):129-131.
[2] 陈 卫, 杨蓉娅. 增生性瘢痕和瘢痕疙瘩药物注射治疗进展[J]. 实用皮肤病学杂志, 2014,(6):447-449.
[3] Lobo RA, Davis SR, De Villiers TJ, et al. Prevention of diseases after menopause[J]. Climacteric, 2014,17(5):540-556.
[4] Al-Qattan MM, Abd-Elwahed MM, Hawary K, et al. Myofibroblast expression in skin wounds is enhanced by collagen Ⅲ suppression[J]. Biomed Res Int, 2015,2015:958695.
[5] Wang C, Dehghani B, Li Y, et al. Membrane estrogen receptor regulates experimental autoimmune encephalomyelitis through up-regulation of programmed death 1[J]. J Immunol, 2009,182(5):3294-3303.
[6] 赵 伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息, 2010,2010(5):52-53.
[7] Brown RJ, Lee MJ, Sisco M, et al. High-dose ultraviolet light exposure reduces scar hypertrophy in a rabbit ear model[J]. Plast Reconstr Surg, 2008,121(4):1165-1172.
[8] Ko JH, Kim PS, Zhao Y, et al. HMG-CoA reductase inhibito-rs (statins) reduce hypertrophic scar formation in a rabbit ear wounding model[J]. Plast Reconstr Surg, 2012,129(2):252e-261e.
[9] Tang H, Zhang Q, Yang L, et al. GPR30 mediates estrogen rapid signaling and neuroprotection[J]. Mol Cell Endocrinol, 2014,387(1-2):52-58.
[10] Bartella V, De Francesco EM, Perri MG, et al. The G protein estrogen receptor (GPER) is regulated by endothelin-1 mediated signaling in cancer cells[J]. Cell Signal, 2016,28(2):61-71.
[11] Scaling AL, Prossnitz ER, Hathaway HJ. GPER mediates estrogen-induced signaling and proliferation in human breast epithelial cells and normal and malignant breast[J]. Horm Cancer, 2014,5(3):146-160.
[12] Rudelius M, Rauert-Wunderlich H, Hartmann E, et al. The G protein-coupled estrogen receptor 1 (GPER-1) contributes to the proliferation and survival of mantle cell lymphoma cells[J]. Haematologica, 2015,100(11):e458-461.
[13] Huff MO, Todd SL, Smith AL, et al. Arsenite and cadmium activate MAPK/ERK via membrane estrogen receptors and G-protein coupled estrogen receptor signaling in human lung adenocarcinoma cells[J]. Toxicol Sci, 2016,152(1):62-71.
[14] Jiang X, Ye X, Ma J, et al. G protein-coupled estrogen receptor 1 (GPER 1) mediates estrogen-induced, proliferation of leiomyoma cells[J]. Gynecol Endocrinol, 2015,31(11):894-898.
[15] Zhou XL, Liu DW, Mao YG, et al. Effect of tetrandine on gene expression of collagen type Ⅰ, collagen type Ⅲ and TGF-beta1 in scar tissue′s of rabbits ear[J]. Zhonghua Zheng Xing Wai Ke Za Zhi, 2013,29(6):406-412.
[16] 李红霞, 武丽蕊, 王宏利, 等. 雌激素受体在育龄女性皮肤病理性瘢痕中表达的研究[J]. 中国临床医生杂志, 2016,44(1):79-81.
Influences of estrogen mediated by GPER on hypertrophic scar in rabbit ears
SHAONing,CHENGDai-wei,ZENGQi,ZHENGQing-gui,QIANNing,WUShu-guang.
(ZunyiMedicalCollege,Zunyi563003,China)
ChengDai-wei,Email:dwcheng0851@163.com
Objective To observe the influences of G protein-coupled estrogen receptor (GPER) on hypertrophic scar of rabbit ears. Methods Thirty-six New Zealand white rabbits were chosen to establish the models of hyperplastic scar in rabbit ears. Rabbit models were randomly assigned to 6 groups, in which E2, G1, E2+G15, G1+G15, DMSO and blank control groups; Specimens were taken at 15 days after receiving subcutaneous injection at the ear roots of the rabbits and observations were made in each group. The scar elevation index (SEI), fibroblasts quantity, orientation of collagen fiber and real-time quantitative PCR detected the expressions of TGF-β1, collagen Ⅰ, collagen Ⅲ and GPER mRNA. Results Compared with the blank control group, the scar hyperplasia in the E2 and G1 groups was obvious with more fibroblasts and higher collagen density with irregularly arrangement; that in the E2 and G1 groups significantly reduced after G15 treatment by gross observation and microscopic examination. The SEI and the expression of TGF-β1, collagenⅠ, collagen Ⅲ, and GPER mRNA were significantly higher in those in the E2 and G1 groups compared with the blank control group (P<0.05), which were lower in the E2 and G1 groups treated with G15 treatment (P<0.05); the DMSO group. The blank control group had few obvious differences (P>0.05). Conclusion Estrogen mediated by GPER has a promoting effect on hypertrophic scar in rabbit ears.
GPER; Hypertrophic scar; TGF-β1
贵州省科学技术基金(黔科合J字[2012]2237号)
作者单位:563003 贵州 遵义,遵义医学院(邵 宁,曾 琪);贵州省人民医院 烧伤整形科(程代薇,郑庆桂);贵阳中医学院 实验动物中心(钱 宁,吴曙光)
邵 宁(1985-),男,河南人,硕士研究生.
程代薇,550002,贵州省人民医院 烧伤整形科,电子信箱:dwcheng0851@163.com【摘要】 目的 观察G蛋白偶联雌激素受体(GPER)对于兔耳增生性瘢痕的影响。方法 选取36只新西兰大耳兔建立模型,随机分为6个组,分别为E2组(17-β-雌二醇)、G1组(雌激素受体激动剂)、E2+G15组(17-β-雌二醇+雌激素受体拮抗剂)、G1+G15组、DMSO组(溶剂)和空白对照组。于兔耳根部皮下持续注射给药15 d后切取标本,观察各组瘢痕增生情况。瘢痕增生指数(SEI)、成纤维细胞数量、胶原纤维排列以及通过实时定量PCR检测TGF-β1、collagen Ⅰ、collagen Ⅲ和GPER的mRNA表达情况。 结果 通过大体观察及显微镜检发现,E2和G1组相比空白对照组的瘢痕增生明显,成纤维细胞数量明显增多,胶原排列紊乱;E2和G1组经G15处理后,瘢痕明显缩小;检测并分析数据SEI以及TGF-β1、collagen Ⅰ、collagen Ⅲ和GPER的mRNA表达量,E2和G1组相对于空白对照组均明显升高(P<0.05),而E2和G1组经G15处理后则显著降低(P<0.05);DMSO组相对于空白对照组,其差异无统计学意义(P>0.05)。结论 GPER介导雌激素对于兔耳增生性瘢痕具有促进作用。
10.3969/j.issn.1673-7040.2016.09.019
R619.6
A
1673-7040(2016)09-0572-05
2016-06-10)

