一株耐镉细菌的分离鉴定及其吸附条件的优化①
沈秋悦,曹志强,朱月芳,施维林*( 苏州科技学院环境科学与工程学院,江苏苏州 5009; 苏州市环境监测中心,江苏苏州 5009)
一株耐镉细菌的分离鉴定及其吸附条件的优化①
沈秋悦1,曹志强1,朱月芳2,施维林1*
(1 苏州科技学院环境科学与工程学院,江苏苏州 215009;2 苏州市环境监测中心,江苏苏州 215009)
摘 要:从镉污染场地筛选分离得到一株耐镉细菌F7,经过形态学观察以及16S rDNA同源性对比分析,鉴定菌株F7属于芽孢杆菌(Bacillus),最大耐Cd2+浓度为50 mg/L。实验研究了Cd2+初始浓度、pH及投菌量对菌株吸附Cd2+的影响,利用FTIR探究菌株吸附的机理。结果表明:菌株F7在Cd2+初始浓度为1.0 mg/L、投菌量为1.0 g/L、pH为6.1时,对Cd2+的吸附率达到93.9%;吸附符合Langumir模型,最大吸附容量为1.83 mg/g。对比分析吸附前后的红外光谱图,发现菌株F7表面的官能团羟基、胺基、烷基、蛋白酰胺Ⅱ带及磷酸基团在吸附过程中起主要作用。
关键词:耐镉细菌;分离鉴定;生物吸附;吸附机理
随着工业(电镀、采矿、冶金等)的迅速发展,重金属以“三废”的形式不断向城乡土壤或水体中排放,能够被植物吸收在体内积聚[1],或通过土壤中动物的皮肤和消化道在体内积聚,通过食物链在人体内聚集;另一方面,土壤中的重金属会随着水分迁移污染地下水或者地表水,从而危害人类健康。重金属镉(Cd)是一种毒性很强的元素,长期在人体蓄积可引起骨痛病、心血管功能障碍等疾病[2]。相比较传统的物理法和化学法,生物吸附法因为费用低、高效,不易造成二次污染而逐渐广泛运用[3]。很多微生物可以通过氧化还原、甲基化作用和脱烃作用等将重金属离子转化为无毒或低毒的化合物形式[4],一些细菌还能通过产生一些酶类还原重金属[5-6]。目前已发现的能高效吸附重金属离子的微生物众多,如枯草芽孢杆菌[7]、铜绿假单胞菌[8]、螺旋藻[9]、啤酒酵母[10]、浮游球衣菌[11]。
考虑到污染场地筛选的微生物有较高的耐受性,可能存在多种吸附机理以及许多微生物能够同时降解或吸附多种污染物[12],有助于高效降低污染场地重金属的浓度。因此,本研究从镉污染土壤中分离纯化得到一株耐镉菌株,通过生理生化及分子生物学分析对该菌进行了初步鉴定,并且研究了影响菌株吸附Cd2+的最优化条件,初步探究了其吸附机理。研究结果有助于了解场地原位微生物的重金属修复能力,以期为今后的重金属污染微生物修复实践提供理论参考。
1 材料与方法
1.1 实验材料
供试土壤样品采自苏州地区重金属污染工业场地,采用五点取样法,剥去土壤表层的覆盖物,取10 ~20 cm土层的新鲜土壤。土样的主要理化性质:pH 7.88,含水率28.2%,阳离子交换量10.8 cmol/kg,有机质8.08 g/kg,Cr 260 mg/kg,As 28 mg/kg,Cd 2.34 mg/kg。
牛肉膏液体培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、去离子水1 000 ml、pH 7.0 ~ 7.2。
镉储备液:称取一定量的优级纯硫酸镉溶于1 000 ml的去离子水中,得到1g/L的镉储备液。
1.2 耐镉菌株的富集、筛选及鉴定
1.2.1 耐镉菌株的分离 在 Cd2+含量为 20 mg/L的牛肉膏液体培养基中加入过筛的新鲜混合土样,于振荡培养箱下25℃、150 r/min驯化培养72 h。取适量的驯化后的悬浊液,采用稀释涂布法均匀涂布在Cd2+浓度为20 mg/L的固体培养基平板上,置于37℃恒温培养箱中倒置培养48 h,挑选菌落形态不同的优势单菌落划线分离,纯化后制作斜面保存。
1.2.2 耐镉菌株的抗镉能力 将分离到的纯菌株接种到带Cd2+培养基上,适宜温度下培养,2 ~ 3天后观察培养基中是否有该特异菌株长出,无特异菌株长出的培养基浓度为该菌株最大耐Cd2+浓度。每个浓度设置3个平行样。
1.2.3 耐镉菌株的鉴定 菌落形态观察:将活化的菌株在固体培养基上培养 24 h,观察菌落形态和颜色。16S rDNA序列分析:将菌株送往上海生物工程有限公司测序,所测得的序列结果在 Genbank中进行blast同源性比对。鉴定参考《伯杰氏系统细菌学手册》、《常见细菌系统鉴定手册》和相关文献[13-15]。
1.3 耐镉菌株吸附条件研究
1.3.1 菌悬液的制备 将菌株F7接种到牛肉膏液体培养基中,放在28℃、120 r/min的恒温摇床上振荡培养24 h,取培养液在5 000 r/min下离心10 min,用去离子水清洗菌体3次,收集菌体测定其鲜重并待用。
1.3.2 吸附实验方法 1) Cd2+的初始浓度对菌株吸附Cd2+的影响。取一定量的镉储备液配制Cd2+的初始质量浓度分别为0.1、0.5、1.0、5.0 mg/L的溶液于50 ml的锥形瓶中,加入1 ml的菌悬液,使得最终溶液体系中菌浓度为1.0 g/L、pH为6 ~ 7,体系的总体积为20 ml。设置平行实验,以不加菌的体系为空白对照。于28℃ 120 r/min的恒温培养箱中振荡2 h,样品于5 000 r/min 离心10 min,取上清液过0.45 μm水系滤膜,用ICP测定溶液中残余的Cd2+含量。
2) 投菌量对菌株吸附Cd2+的影响。取一定体积的菌悬液于50 ml的锥形瓶中,加入1.0 mg/L的Cd2+溶液,使得溶液中菌浓度为0.01、0.1、0.5、1.0、2.0 g/L,溶液pH为6 ~ 7,总体积控制为20 ml。设置平行实验,以不加菌的体系为空白对照。其余同上。
3) 吸附时间对菌株吸附Cd2+的影响。取一定的菌悬液和镉储备液于150 ml的锥形瓶中,使得菌浓度为1 g/L、Cd2+浓度为1 mg/L,pH为6 ~ 7,总体积控制为100 ml。设置平行实验,以不加菌的体系为空白对照。其余同上。
4) pH对菌株吸附Cd2+的影响。取一定的菌悬液和镉储备液于50 ml的锥形瓶中,使得菌浓度为1 g/L、Cd2+浓度为1 mg/L,pH分别调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0,总体积控制为20 ml。设置平行实验,以不加菌的体系为空白对照。其余同上。
1.3.3 红外光谱实验 将吸附重金属后的菌体真空冷冻干燥后,取少量干燥菌体加入 KBr粉末混合研磨,将混合好的粉末压成薄皮,放置在傅里叶变换红外吸收光谱仪上进行检测并记录其光谱。
1.4 数据处理
采用 Microsoft Excel 2010 处理实验数据并进行误差分析;采用 Origin 7.5对数据进行拟合。
2 结果与分析
2.1 耐镉菌株的分离鉴定
2.1.1 耐镉菌株的形态鉴定 经过富集培养、分离纯化,筛选得到一株对镉具有较高耐性的细菌菌株,编号为F7。菌株F7在固体培养基上的形态见图1所示。菌落为不透明,黏稠,菌落较大,表面隆起,颜色为乳白色。革兰氏染色为阳性。菌株在固体牛肉膏培养基上能耐受Cd2+浓度为50 mg/L。
图1 菌株F7在固体培养基上的形态
2.1.2 16S rDNA序列分析 菌株F7的16S rDNA由上海生工测定,得到长度为1 452 bp的16S rDNA序列。将序列在NCBI中与Genbank中已发表的核酸序列进行同源性比对,并在MEGA5.0中利用邻位相连法构建系统发育树(图2)。结果显示,菌株F7 与Bacillus weihenstephanensis和 Bacillus sp.的16S rDNA具有 99.9% 的同源性,而由图2可知,菌株F7与这两种菌进化距离近,因此判断菌株F7属于芽孢杆菌(Bacillus)。
2.2 耐镉菌株吸附条件研究
2.2.1 Cd2+初始浓度 菌株 F7在不同初始浓度的Cd2+溶液中的吸附率如图3所示。从图3可知,当Cd2+的初始浓度从0.1 mg/L增加到1.0 mg/L时,菌株F7对Cd2+的吸附率逐渐增加,在Cd2+浓度为1.0 mg/L时达到最大值为88.42%。说明在Cd2+的一定初始浓度范围内,随 Cd2+浓度增加有利于菌株对其的吸附,原因可能是,Cd2+浓度的增加使得其与菌株的有效碰撞概率增大、吸附位点增加,吸附率增大;其次,Cd2+在固相和液相之间的传质阻力能因为镉提供的驱动力而被克服,从而增加了吸附率[16-17]。在Cd2+浓度达到1.0 mg/L时,随着Cd2+浓度增加,吸附率降低,可能是因为,高浓度的Cd2+会抑制微生物的生长代谢过程如酶活性机制,另外,也会抑制微生物生长导致微生物表面吸附量的减少[18]。

图2 菌株F7的系统发育树
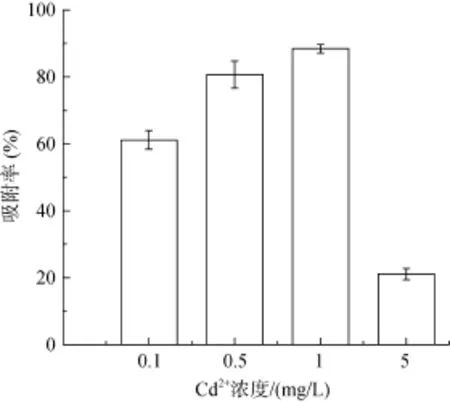
图3 Cd2+不同初始浓度对菌株吸附Cd2+的影响
2.2.2 投菌量 不同生物量对Cd2+吸附的影响如图4所示。随着投菌量从0.01 g/L增加到2.0 g/L,菌株对重金属Cd2+的吸附率从32.62% 增到88.64%,投菌量在1.0 g/L时吸附率达到最大值。可能是由于随着投菌量的增加,使得吸附位点增加导致吸附率提高。而在吸附率达到最大值后,随着投菌量的增加,吸附率反而下降,这可能是金属离子的总量不变,单位菌体吸附重金属的量减少[19-20]。
2.2.3 pH 一般而言,溶液pH主要是通过影响细菌表面官能团的电性及金属离子在溶液中的存在形态来干扰吸附过程。图5所示是不同 pH对菌株吸附Cd2+的影响。随着pH升高,菌株吸附Cd2+量呈现先上升后下降的趋势,在pH达到6.1时,吸附率达到最大值93.9%。在pH较低时,溶液中存在的大量水合氢离子占据菌体细胞壁的吸附活性位点,活性基团被质子化从而增加了细胞表面的静电斥力,阻碍了离子交换作用,因此pH越小阻力越大。而随着pH增加,细胞表面的负电荷量增加,大大增加了对带正电荷重金属离子的吸附。当 pH达到6后,溶液中出现微量沉淀,重金属离子形态被改变,导致金属离子被吸附量减小[21]。
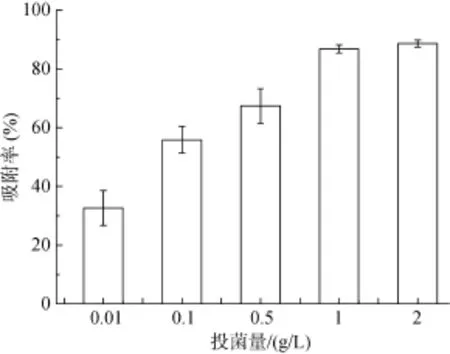
图4 投菌量对菌株吸附Cd2+的影响
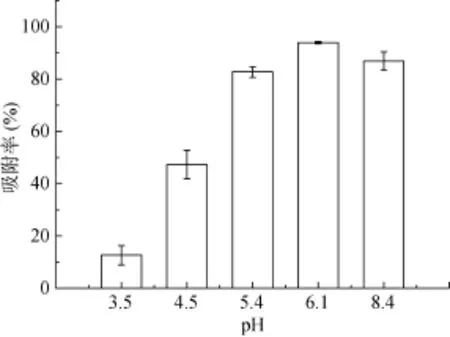
图5 pH对菌株吸附Cd2+的影响
2.3 耐镉菌株吸附Cd2+的等温模型
Langmuir吸附模型假设吸附是均一的单分子层吸附,其单层的表面吸附位点有限及能量相等,吸附分子之间无相互作用。Freundlich吸附模型一般适用于非均质固体表面的可逆吸附作用。本文采用Langumir和Feundlich方程拟合菌株F7对Cd2+的等温吸附过程,方程分别如下:

式中:qe是菌株对Cd2+的平衡吸附量,mg/g;Ce是吸附平衡时溶液中残留 Cd2+的浓度,mg/L;KL是Langmuir等温方程常数,L/mg;qm是理论最大吸附量,mg/g;KF(L/mg)和n分别是Freundlich等温方程常数。
从表1可以看出,Langumir和Freundlich等温吸附方程的拟合度分别为 0.915 6和 0.843 3。通过Langumir方程模拟计算所得的 Cd2+的吸附容量为1.83 mg/g,与实际测得的1.739 mg/g较接近。因此可以判断,Langumir更适合描述菌对Cd2+的等温吸附过程,说明溶液中 Cd2+在菌表面是单分子层的表面吸附。
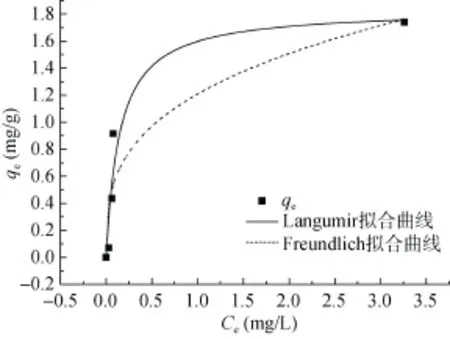
图6 Langumir和Freundlich 吸附等温模型
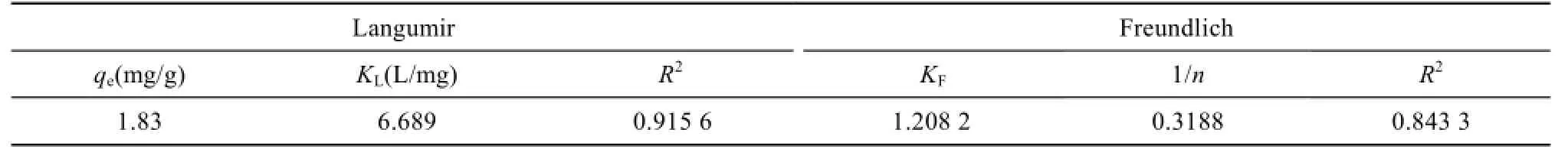
表1 菌株吸附Cd2+的等温吸附参数
2.4 红外光谱吸收分析(FTIR)
通过红外光谱分析,可以判断菌体表面吸附重金属过程中发生变化的官能团。对菌株 F7吸附Cd2+前后的红外光谱进行分析,结果如图7所示。3 290 cm-1处显示的是氨基和羟基伸缩振动的重叠吸收带。2 930 cm-1处对应的吸收峰是饱和烷基C-H键的伸缩振动峰,在菌株吸附完成后迁移至2 920 cm-1处,表明烷基参与了菌株吸附重金属的过程[19]。1 650 cm-1处的吸收峰是-C=O伸缩振动引起的。1 539 cm-1、1 530 cm-1处的吸收峰是-N-H弯曲变形振动引起,峰值在吸附前后移动了9 cm-1,表明菌株细胞壁上的蛋白质酰胺Ⅱ带(N-H的弯曲振动与C-N伸缩振动的叠加)表现活跃,参与吸附过程[22]。1 240 cm-1、1 229 cm-1处的吸收峰是蛋白质分子O-H的面内伸缩振动,可能还有磷酸二酯基团PO2-的不对称伸缩振动[23],峰值吸附前后发生了位移,表明羧基在吸附时与Cd2+离子发生了配位作用[24]。1 070 cm-1、1 062 cm-1处吸收峰是C-O伸缩带及磷酸二酯基团 PO2-的对称伸缩带,峰值在吸附前后移动的12 cm-1说明磷酸基团可能参与了吸附过程。上述说明,菌株吸附前后有羟基、氨基、烷基、酰胺Ⅱ带及磷酸基团参与反应,而吸收峰是向低波数迁移,说明Cd2+发生络合反应时,基团的活性会降低[25]。
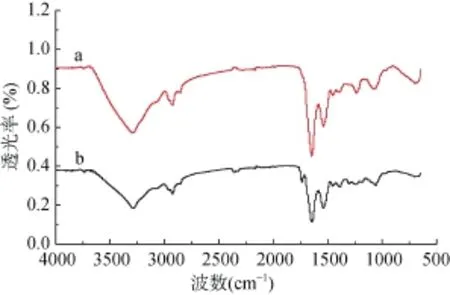
图7 菌株吸附Cd2+的FTIR谱图
3 结论
1) 本实验从苏州某典型Cd污染场地分离筛选得到一株耐镉的细菌F7,革兰氏染色为阳性菌,最大耐Cd2+浓度为50 mg/L,经鉴定该菌属于芽孢杆菌。
2) 菌株F7对Cd2+有较好的吸附效果,在Cd2+初始浓度1.0 mg/L,投菌量1.0 g/L,pH 6.1时,对Cd2+的吸附率可达到93.9%。运用吸附等温模型拟合菌株吸附Cd2+过程,发现菌株F7符合Langumir模型,最大吸附容量为1.83 mg/g,表明菌株F7在吸附过程中是单分子层的表面吸附。
3) 对比吸附前后的红外光谱谱图,发现菌株F7表面的官能团羟基、胺基、烷基、蛋白酰胺Ⅱ带及磷酸基团在吸附、络合或螯合金属离子或原子过程中起主要作用。
参考文献:
[1] 曾希柏, 徐建明, 黄巧云, 等.中国农田重金属问题的若干思考[J].土壤学报, 2013, 50 (1): 188-196
[2] 黄银华, 李铖, 李芳柏, 等.广州市农业表层土壤镉和铅多尺度空间结构[J].土壤, 2015, 47(6): 1 144-1 150
[3] Groudev S, Georgiev P, Spasova I, et al.Decreasing the contamination and toxicity of a heavily contaminated soil by in situ bioremediation[J].Journal of Geochemical Exploration, 2014, 144: 374-379
[4] 马莹, 骆永明, 滕应, 等.根际促生菌及其在污染土壤植物修复中的应用[J].土壤学报, 2013, 50(5): 1 022-1 032
[5] Urrutia M M, Beveridge T J.Remobilization of heavy metals retained as oxyhydroxides or silicates by bacillus subtilis cells[J].Applied & Environmental Microbiology,1994, 59(12): 4 323-4 329
[6] 马琳娜, 张胜, 李政红, 等.六价铬还原细菌的筛选及还原特性研究[C].北京:中国地质学会, 2010
[7] 陈尚智, 胡勇有.枯草芽孢杆菌对微污染水体的净化作用[J].环境科学学报, 2011, 31(8): 1 594-1 601
[8] Wang C L, Michels P C, Dawson S C, et al.Cadmium removal by a new strain of Pseudomonas aeruginosa in aerobic culture [J].Applied & Environmental Microbiology,1997, 63 (10): 4 075-4 078
[9] Costa A C A D, França F P D.Cadmium uptake by Spirulina maxima: toxicity and mechanism[J].World Journal of Microbiology & Biotechnology, 1998, 14(14): 579-581
[10] 代群威, 邓涛, 王岩, 等.吸附 Sr2+后酵母细胞的絮凝特性研究[J].环境科学学报, 2015, 35 (6):1 786-1 791
[11] Beolchini F, Pagnanelli F, Toro L, et al.Biosorption of copper by Sphaerotilus natans immobilised in polysulfone matrix: equilibrium and kinetic analysis[J].Hydrometallurgy,2003, 70 (s 1/2/3): 101-112
[12] Tripathi M, Vikram S, Jain R K, et al.Isolation and growth characteristics of chromium(VI) and pentachlorophenol tolerant bacterial isolate from treated tannery effluent for its possible use in simultaneous bioremediation[J].Indian Journal of Microbiology, 2011, 51 (1): 61-69
[13] 布坎南.伯杰细菌鉴定手册.北京: 科学出版社, 1984
[14] 刘国红, 刘波, 林乃铨, 等.芽胞杆菌的系统进化及其属分类学特征//中国微生物学会第二届全国芽胞杆菌研究与应用学术研讨会.2012.
[15] 王桂萍, 郭明志, 陈亚华, 等.两株抗铜细菌的筛选、鉴定及对碳酸铜的溶解作用[J].土壤, 2014, 46(3): 498-503
[16] Yalçın E, Çavuşoğlu K, Kınalıoğlu K.Biosorption of Cu2+and Zn2+by raw and autoclaved Rocella phycopsis [J].Journal of Environmental Sciences, 2010, 22 (3): 367-373
[17] 邱云云, 尹华, 叶锦韶, 等.嗜麦芽窄食单胞菌对镉的吸附[J].环境污染与防治, 2011, 33(4): 40-45
[18] González Paola S, Ambrosio Laura F, Paisio Cintia E, et al.Chromium (VI) remediation by a native strain: Effect of environmental conditions and removal mechanisms involved[J].Environmental Science and Pollution Research,2014, 21(23): 13 551-13 559
[19] 廖佳, 冯冲凌, 李科林, 等.耐性真菌HA吸附铅、锌的影响因素及吸附机理研究[J].微生物学通报, 2015, 42(2): 254-263
[20] 金羽, 曲娟娟, 李影, 等.一株耐铅细菌的分离鉴定及其吸附特性研究[J].环境科学学报, 2013, 33 (8): 2 248-2 255
[21] Gonte R, Balasubramanian K.Heavy and toxic metal uptake by mesoporous hypercrosslinked SMA beads: Isotherms and kinetics[J].Journal of Saudi Chemical Society, 2013, 4: 1-12
[22] 林晓燕, 牟仁祥, 曹赵云, 等.耐镉细菌菌株的分离及其吸附镉机理研究[J].农业环境科学学报, 2015, 34(9): 1 700-1 706
[23] 周艾平, 尹华, 叶锦韶, 等.酵母融合菌对 Cr的吸附性能及机理分析[J].环境科学与技术, 2011, 34(6): 37-42
[24] 藏婷婷, 胡晓婧, 顾海东, 等.黑木耳菌糠对Cu2+的生物吸附及其机理[J].环境科学学报, 2014, 34(6): 1 421-1 428
[25] Qi B C, Aldrich C.Biosorption of heavy metals from aqueous solutions with tobacco dust[J].Bioresource Technology, 2008, 99 (13): 5 595-5 601
中图分类号:X172
DOI:10.13758/j.cnki.tr.2016.03.029
基金项目:①国家自然科学基金项目(31570515)、苏州科技支撑计划项目(SYN201402)和苏州科技学院土壤污染与修复协同创新项目(051410017)资助。
* 通讯作者(weilin-shi@163.com)
作者简介:沈秋悦(1991—),女,江苏苏州人,硕士研究生,主要从事土壤污染机理及生态修复研究工作。E-mail:sqy10911@163.com
Isolation of a Cd-resistant Bacterium and Optimization of Its Bio-accumulation Condition
SHEN Qiuyue1, CAO Zhiqiang1, ZHU Yuefang2, SHI Weilin1*
(1 School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou, Jiangsu 215009,China; 2 Environmental Monitoring Center of Suzhou, Suzhou, Jiangsu 215009, China)
Abstract:A native bacterial strain, named F7, with strong Cd resistance ability was isolated from Cd-contaminated soil.According to its morphological and biochemical characteristics and 16S rDNA sequences analysis, it was identified as Bacillus.The bacterial strain F7 could grow on the beef extract peptone medium that concentrated Cd2+, which can reach to 50 mg/L.The effects of initial Cd2+concentration, pH and biosorbent dosage on Cd2+adsorption efficiency were studied.And the adsorption mechanism of bacterial strain was explored by FTIR.The experimental results showed that the Cd2+adsorption efficiency achieved 93.9% when initial Cd2+concentration was 1.0 mg/L, biosorbent dosage was 1.0 g/L, and pH was 6.1.The biosorption equilibrium conformed to the Langumir equations and the maximum adsorption capacity was 1.83 mg/L.The functional groups on the cell wall of bacterial strain F7 before and after adsorption process were observed by FTIR, the results indicated that the main functional groups participated in Cd adsorption were-OH,-NH2,-CH3, Protein amide Ⅱ and Phosphate group.
Key words:Cd-resistant bacterium; Isolation and identification; Biosorption; Adsorption mechanism

