不同浓度Fe-H2O体系的溶解组分优势区域图和Pourbaix图*
黄旺银,桑世华,饶胡敏
(1.成都理工大学材料与化学化工学院,四川成都610059;2.四川省地质工程勘察院)
研究与发展
不同浓度Fe-H2O体系的溶解组分优势区域图和Pourbaix图*
黄旺银1,2,桑世华1,饶胡敏2
(1.成都理工大学材料与化学化工学院,四川成都610059;2.四川省地质工程勘察院)
对25℃、总铁浓度分别为1.0×10-2mol/L和1.0×10-5mol/L时的Fe-H2O体系可能存在的组分做了热力学和电化学分析,计算了各溶解组分的浓度,运用浓度比较法为判据,确定液相和液相、液相和固相以及各固相之间的分界线,绘制了不同浓度时Fe-H2O体系溶解组分的优势区域图和Pourbaix图。对比发现,在一定的温度和压力下,总铁浓度对Fe3+、Fe(OH)2+、HFeO2和FeO2-的优势区域影响不大,但对Fe2+、HFeO2-、Fe(OH)+的优势区域影响明显。随着总铁浓度的减小和碱化程度的逐步加强,Fe(OH)2和Fe3O4会发生一系列复杂的质子化作用。总铁浓度越高,多核组分Fe(s)、Fe3O4(s)、Fe(OH)2(s)和FeOOH(s)的稳定区域越大,性质越稳定。
不同浓度;Fe-H2O体系;优势区域图;Pourbaix图;浓度比较法
铁在自然界分布很广,是地壳中含量第二高的金属元素。目前,几乎世界的每个角落都存在铁矿的开采、冶炼、机械制造、钢铁生产、腐蚀等现象,从而导致环境中的铁含量急剧升高,对人体健康和环境安全构成潜在的威胁[1-3]。此外,人类的生产活动、自然风化、地下水与围岩接触溶解等过程,又会导致铁不断由岩石、水、土壤等载体中溶出,流向人类生活的环境中。水溶液中铁和铁的化合物之间存在着一系列复杂的平衡关系,在不同的pH、电位条件下,含铁物质的主要存在形态也不同。在一定温度下,水溶液中含铁物质的浸出和沉淀分离过程可以通过控制溶液的pH来实现。因此,对不同条件下不同形态含铁物质在溶液中的优势分布区域和沉淀区域展开研究,是制定铁污染控制及处理工艺的基础和前提。
电势-pH图主要应用于分析化学、矿物地质学、生物学、核电技术、金属的腐蚀与防腐等领域[4-9],有很强的实用性。它相当于研究相平衡时的电化学相图,可直观地反应体系中各形态物种间的反应进行方向、反应限度、生成物的稳定性及某种组分的优势区域等重要信息。对于多价态元素铁,其聚集状态和区域分布与总铁浓度和氧化还原性能密切相关。工业生产中研究高温磁黄铁矿、含铁闪锌矿及热液矿床体系的较多[8-9],而针对25℃不同浓度的铁水体系电势-pH图文献报道则较少。笔者采用浓度比较法[10-12]对Fe-H2O体系中可能存在的组分做了热力学分析和电化学分析,计算绘制了25℃时总铁浓度分别为1.0×10-2mol/L和1.0×10-5mol/L时溶解态物种的优势区域图和Pourbaix图,并对溶解态和固相的电势-pH图分别做了深入的分析。
1 Fe-H2O体系溶解组分的优势区域图
在25℃时,Fe-H2O体系中总铁浓度及溶液的pH、电位值等都对溶解组分的聚集状态产生影响。总铁浓度不同的溶液中,铁溶解组分均以单核形式存在。随着总铁浓度的增加,溶液的pH也影响其聚集状态变化。当总铁浓度[cT(Fe)]分别为1.0× 10-2mol/L和1.0×10-5mol/L时,可能存在的溶解组分有 Fe、Fe2+、FeOH+、HFeO2-、Fe3+、FeOH2+、HFeO2、FeO2-以及e-、H+、OH-、H2O等[13],存在的平衡反应:
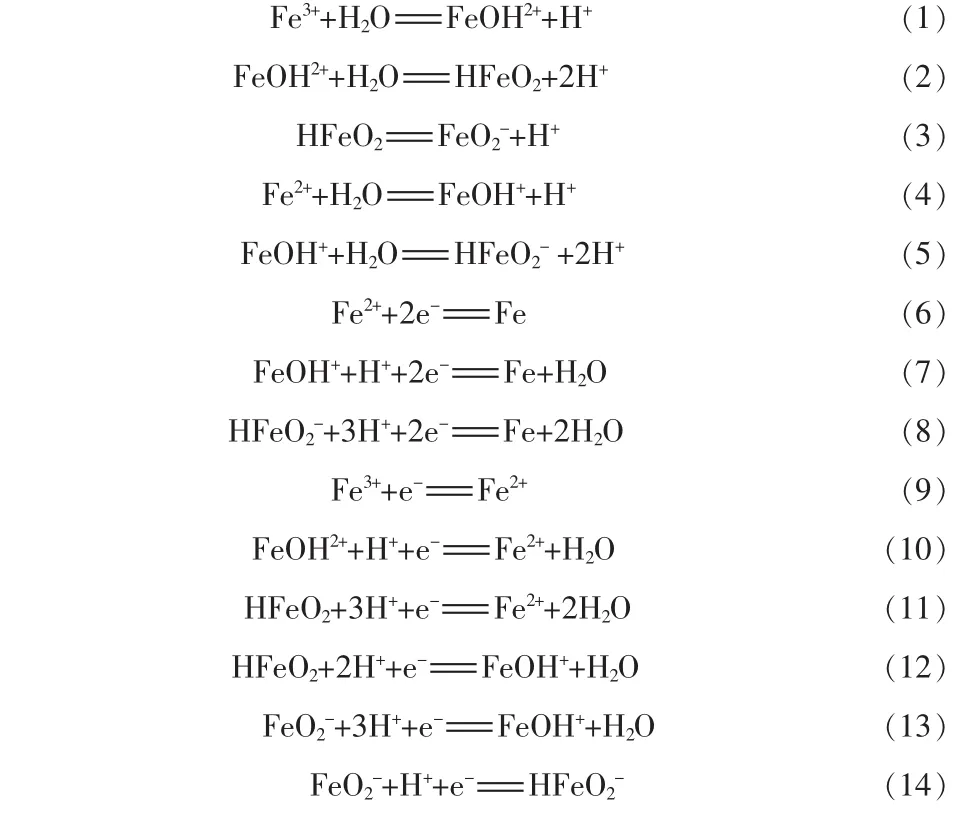
1.1独立反应的确定
由前文可知,Fe-H2O体系中可能存在含铁的溶解态物种有8种,共有14个化学反应方程式与其对应。各化学反应的化学计量系数可以表示为一个14×8的矩阵,称为化学计量系数矩阵(B):
式中,vij是第j个化学反应方程式中化学物种Fei的化学计量系数。经矩阵计算,得到该矩阵的秩为7,确定体系中有7个独立反应。
1.2相率分析
根据相律,铁水体系自由度F的计算公式:
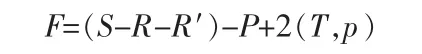
在Fe-H2O体系中,含有铁元素(Fe)的物种数为8,独立反应数为7,加上e-、H+、OH-和H2O,则总物质数S=12;独立的反应数R=7+1(水电离)=8;限制条件R′=1(即设定溶液的总铁浓度为 1.0×10-2mol/L或者1.0×10-5mol/L);相数P=1。固定温度和压力,此时“2(T,p)”项为零,则体系的自由度F=(12-8-1)-1+0=2。
由此可见,一旦确定了溶液的电位值E和pH,就能够计算出各溶解态物种的浓度。
1.3计算过程
通过矩阵转置及一系列的初等变化后得到最简矩阵,其中与线性无关的独立反应方程为式(1)~(5)、(8)。溶液中总铁浓度的表达式为:
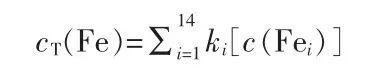
式中,[c(Fei)]表示第i种铁物种的浓度,ki表示铁物种Fei中含有铁原子的个数。
建立一个有唯一解的非线性方程组:
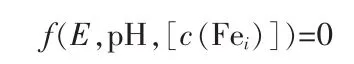
代入E、pH,计算一个组分的浓度,根据同时平衡原理,得到其他组分的浓度。根据浓度比较法可确定E、pH所对应的优势点物种,进而可绘制各组分优势区域图。
1.4优势区域的判定
采用浓度比较法构建优势区域图,遵循的原则:优势区中组分Fei所含有活性元素的总浓度大于其他任一组分Fej所含有活性元素的总浓度。即:
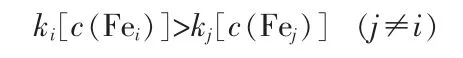
式中,ki、kj为物种Fei、Fej含有铁原子的个数。即在组分Fei的优势区域内,Fei的浓度大于其他组分的浓度。当组分Fei和Fej的浓度相等时,处于2种物种优势区域的边界线上。
1.5计算结果
采用浓度比较法,经编程求解,E为-2.0~2.0、pH为0~14时的Fe-H2O体系在298 K、cT(Fe)=1.0× 10-2mol/L和cT(Fe)=1.0×10-5mol/L时的优势区域图(见图1、2)。图中关键点数据见表1、2。
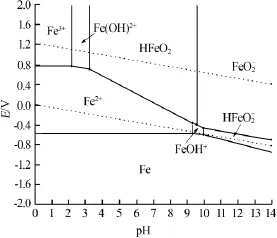
图1 cT(Fe)=1.0×10-2mol/L时Fe-H2O体系的优势区域图
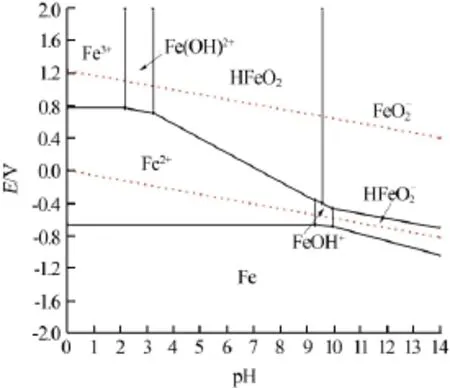
图2 cT(Fe)=1.0×10-5mol/L时Fe-H2O体系的优势区域图
由图1、2可见,Fe-H2O体系的优势区域图均由14条平衡线构成,将平面划分为8个区域,分别为Fe、Fe2+、Fe3+、Fe(OH)+、Fe(OH)2+、HFeO2、HFeO2-和FeO2-的优势区域。在不同浓度铁溶液中,溶解组分均以单核形式存在。随着总铁浓度的增加,其聚集状态保持不变,优势区域大小开始随溶液的pH改变而改变。
将图1和图2的优势区域图比较发现,在高电位氧化环境,在pH为0~14时存在的组分有Fe3+、Fe(OH)2+、HFeO2和FeO2-。随着溶液中总铁浓度的增加,Fe3+、Fe(OH)2+、HFeO2和FeO2-的优势区域位置和大小基本相同,说明高电位氧化环境和体系酸碱度是各组分稳定存在的主要条件,而总铁浓度对这些组分的影响不大;在低电位还原环境中,整个酸碱度范围内存在的组分有Fe2+、HFeO2-、Fe(OH)+。其优势区域随体系总铁浓度的变化发生较明显的改变。说明在低电位还原环境里,酸碱度和总铁浓度是影响各组分稳定存在的主要因素。在高电势区域,强碱性介质中,三价铁以FeO2-形式存在,二价铁以HFeO2-形式存在,随着酸度的增强,在相同的E、pH条件下,cT(Fe)=1.0×10-2mol/L体系中存在Fe的优势区域被cT(Fe)=1.0×10-5mol/L体系中的Fe2+、Fe(OH)+、HFeO2-优势区域取代,铁被腐蚀溶解。

表1 cT(Fe)=1.0×10-2mol/L时Fe-H2O体系溶解态物种优势区域图关键点数据
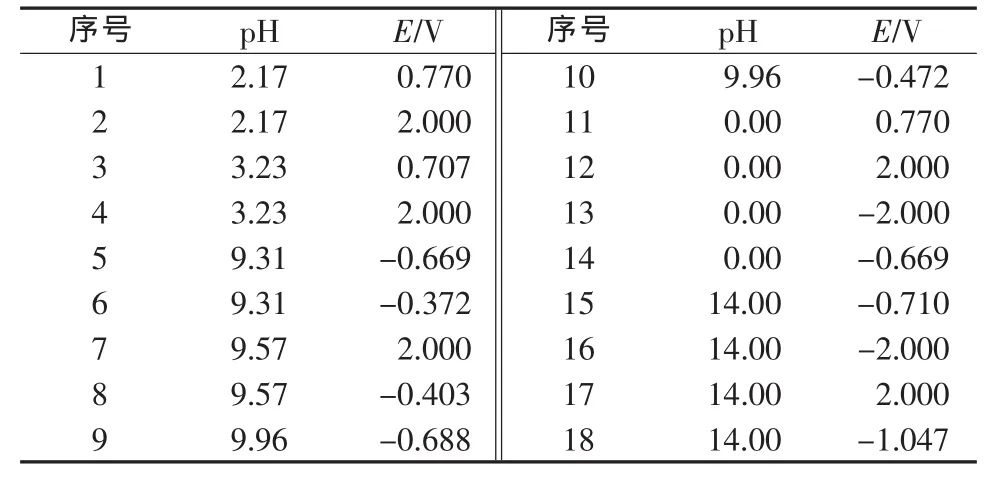
表2 cT(Fe)=1.0×10-5mol/L时Fe-H2O体系溶解态物种优势区域图关键点数据
2 Fe-H2O体系的Pourbaix图
在25℃时,不考虑体系可能存在的气相组分,总铁浓度分别为 1.0×10-2mol/L和 1.0×10-5mol/L 的 Fe-H2O体系中存在的固相有 Fe(s)、FeO(s)、Fe2O3(s)、Fe3O4(s)、Fe(OH)2(s)、Fe(OH)3(s)和FeOOH(s)[13-15]。体系的固-液、固-固平衡方程式:


由式(15)~(28)可知,Fe-H2O体系中与固相平衡的可能溶解组分有Fe2+(aq)、Fe3+(aq)、FeOH+(aq)、Fe(OH)2+(aq)、HFeO2-(aq)、FeO2-(aq)和HFeO2-(aq);式(15)~(28)中,固相组分有Fe(s)、FeO(s)、Fe2O3(s)、Fe3O4(s)、Fe(OH)2(s)、Fe(OH)3(s)和FeOOH(s)。联立平衡方程式,以浓度比较法作为判断依据,对方程组编程求解,绘制的25℃,cT(Fe)=1.0×10-2mol/L和cT(Fe)=1.0×10-5mol/L,电位E为-2~2 V、pH=0~14时的Fe-H2O体系Pourbaix图,见图3~4。图中的关键点数据见表3~4。
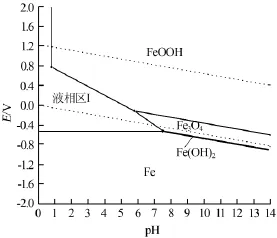
图3 cT(Fe)=1.0×10-2mol/L时Fe-H2O体系的Pourbaix图
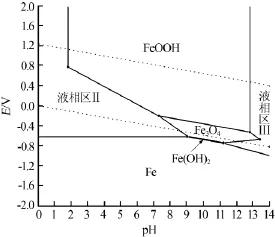
图4 cT(Fe)=1.0×10-5mol/L时Fe-H2O体系的Pourbaix图
对比图3和图4可见,图3有1个液相区Ⅰ,含有溶解组分Fe2+(aq)、Fe3+(aq);图4含有2个液相区Ⅱ、Ⅲ,彼此之间由固相Fe3O4(s)和Fe(OH)2(s)隔开。对比液相区Ⅱ和Ⅲ,发现2个相区中含有不同的溶解组分,分别为Ⅱ中的Fe2+(aq)、Fe3+(aq)和Ⅲ中的FeO2-(aq)、HFeO2-(aq);随着总铁浓度的增大,铁的液相区Ⅰ和Ⅱ减小,而液相区Ⅲ稳定区域减小直至消失。在铁水体系中,溶解组分以单核形式存在。
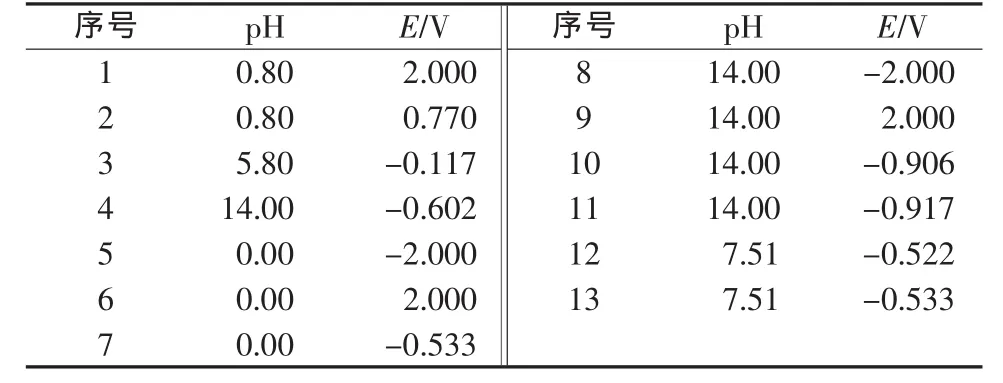
表3 cT(Fe)=1.0×10-2mol/L时Fe-H2O体系Pourbaix图关键点数据
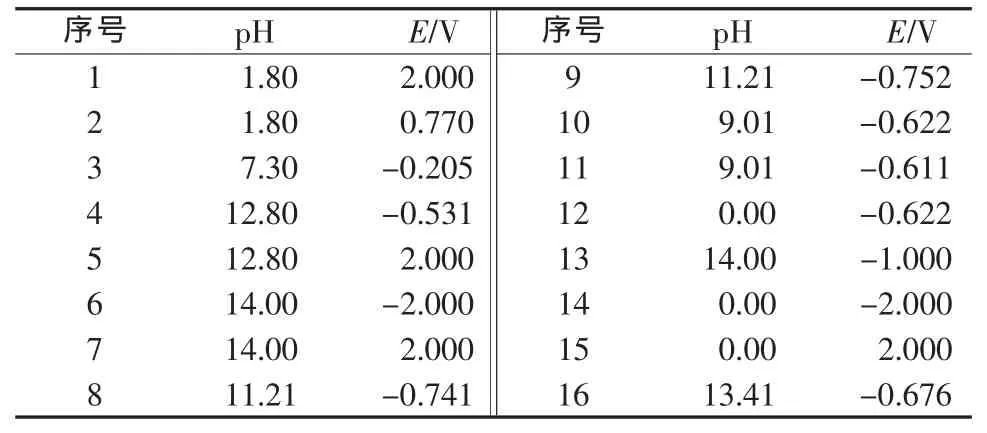
表4 cT(Fe)=1.0×10-5mol/L时Fe-H2O体系Pourbaix图关键点数据
对比不同浓度Fe-H2O体系的Pourbaix图可见,体系中的固相组分以单核和多核形式存在。随着体系中总铁浓度的减小,固相组分Fe(s)、Fe3O4(s)、Fe(OH)2(s)和FeOOH(s)的稳定区域明显减小,而相应的溶液区域面积有所增大。由于固相Fe(s)的稳定区域横跨整个pH范围,所以当溶液中总铁浓度发生改变时,固相Fe(s)的区域基本保持不变,说明溶液中总铁浓度的变化对固相Fe(s)的影响不大。
3 结论
在25℃时,绘制了总铁浓度分别为1.0×10-2mol/L 和1.0×10-5mol/L的Fe-H2O体系溶解组分优势区域图和Pourbaix图。对比优势区域图发现,总铁浓度的大小对铁元素(Fe)和三价铁离子[Fe3+、Fe(OH)2+、HFeO2和FeO2-]的优势区域影响不大,但对二价铁离子[Fe2+、HFeO2-、Fe(OH)+]的优势区域影响明显。对比Pourbaix图可见,在cT(Fe)=1.0×10-2mol/L体系中还有1个液相区,而在cT(Fe)=1.0×10-5mol/L体系中含有2个液相区,均以单核形式存在;在不同浓度Pourbaix图中含有相同的固相组分Fe(s)、Fe3O4(s)、Fe(OH)2(s)和FeOOH(s),以单核和多核形式存在。随着总铁浓度的减小和碱化程度的逐步加强,Fe3O4、Fe(OH)2向着生成HFeO2-和FeO2-的方向进行,固相组分Fe(s)、Fe3O4(s)、Fe(OH)2(s)、和FeOOH(s)的稳定区域明显减小,而相应的溶液区域面积有所增大。
[1]宋冠宇,赵杰,程从前,等.核电用奥氏体不锈钢表面铁素体污染的影响及对策[J].腐蚀与防护,2011,32(10):813-816.
[2]李茂东.工业锅炉铁杂质污染与控制[J].腐蚀与防护,2002,23(9):414-416.
[3]曾英,马旻锐.高浓度V-H2O体系的溶解组分优势区域图和Pourbaix图[J].物理化学学报,2009,25(5):953-957.
[4]丁明刚,曾英,孙世林.电位-pH图及其研究进展[J].世界科技研究与发展,2005,27(3):20.
[5]李洪桂.湿法冶金学[M].长沙:中南大学出版社,2002:38-62.
[6]梁成浩,黄乃宝,扈显琦.铜在55%LiBr溶液中的电势-pH图[J].腐蚀科学与防护技术,2006,18(3):157-160.
[7]吴玉林,徐志峰,郝士涛.炼铜烟灰碱浸脱砷的热力学及动力学[J].有色金属:冶炼部分,2013(4):34-37.
[8]赵开乐.磁黄铁矿微生物浸出机理研究[D].长沙:中南大学,2010.
[9]程琍琍.含铁闪锌矿的难选铅锌硫化矿电位调控浮选工艺原理与应用[D].赣州:江西理工大学,2008.
[10]吴进明,曾英.V-H2O体系的溶解组分优势区域图和电势-pH图[J].物理化学学报,2007,23(9):1411-1414.
[11]易清风,赵红钢,刘小平,等.Cu-S-H2O系和Zn-S-H2O系E-pH图[J].湘潭矿业学院学报,2002,17(1):51-54.
[12]易清风,用同时平衡原理绘制综合平衡电势-pH图[M].北京:化学工业出版社,2003:67-86.
[13]尚久方,操时杰,辛无名,等译.兰氏化学手册[M].北京:科学出版社,2003:67-86.
[14]Lide D R.CRC handbook of chemistry and physics[M].Florida:CRC Press,2004:5-86.
[15]吴维昌,冯洪清,吴开治译.标准电极电位数据手册[M].北京:科学出版社,1991:234-239.
联系方式:yyhxhwy@163.com
Predominance diagram and Pourbaix diagram of dissolved species of Fe-H2O system at different iron concentrations
Huang Wangyin1,2,Sang Shihua1,Rao Humin2
(1.College of Materials and Chemistry&Chemical Engineering,Chengdu University of Technology,Chengdu 610059,China;2.Sichuan Institute of Geological Engineering Investigation)
The predominance diagram and Pourbaix diagram of dissolved species of the Fe-H2O system with different iron concentrations were studied at 25℃by a concentration comparison method.The concentration of dissolved species,borderlines for liquid phases or solid phases and borderlines between the liquid and solid phase were calculated on the basis of thermodynamic analysis and electrochemical analysis with total Fe concentrations of 1.0×10-2mol/L and 1.0×10-5mol/L.The predominance diagram of dissolved species and the Pourbaix diagram of the Fe-H2O system were then plotted.Comparisons made between predominance diagrams for different iron concentrations showed that at a specific temperature and pressure the total concentration of iron had little effect on the stable predominance regions of Fe3+,Fe(OH)2+,HFeO2,and FeO2-.But these conditions had a remarkable effect on Fe2+,HFeO2-,and Fe(OH)+.A series of hydroxylation reactions may occur with Fe(OH)2and Fe3O4with the decreasing of the total iron concentration and with the enhancement of basification.A higher total concentration of iron will result in a larger stable area and a more stable quality of Fe(s),Fe3O4(s),Fe(OH)2(s),and FeOOH(s).
different iron concentration;Fe-H2O system;predominance diagram;Pourbaix diagram;concentration comparison method
TQ138.11
A
1006-4990(2016)02-0013-05
国家自然科学基金(41373062)、四川省科技支撑项目(2014GZ0189)及四川省高校科研创新团队(15TD0009)联合资助项目。
2015-08-12
黄旺银(1983—),男,博士,主要从事地下水、地表水体环境污染化学研究,已公开发表文章6篇。

