三孢布拉霉菌发酵番茄红素提取工艺的优化
庞昆云, 吴嘉琦, 王泽建, 储 炬, 庄英萍, 张嗣良
(华东理工大学生物反应器工程国家重点实验室,国家生化工程技术研究中心(上海),上海 200237)
三孢布拉霉菌发酵番茄红素提取工艺的优化
庞昆云,吴嘉琦,王泽建,储炬,庄英萍,张嗣良
(华东理工大学生物反应器工程国家重点实验室,国家生化工程技术研究中心(上海),上海 200237)
番茄红素作为一种类胡萝卜素,具有提高免疫力、延缓衰老等多种功能。利用发酵法生产番茄红素是满足市场需求的重要途径。为了更好地提升番茄红素的提取收率,降低发酵过程中各种杂质的含量。研究了不同的溶媒及处理方法对湿菌体进行直接高效萃取的新方法。将番茄红素发酵液经过抽滤、洗涤处理得到湿菌丝体,采用有机溶剂和超声波破碎结合的处理方法,考察了菌丝体状态、皂化条件、脱水剂、提取溶剂、菌丝量与提取溶剂的料液比例、提取时间和提取温度对番茄红素提取率的影响。实验结果表明,利用湿菌体直接提取番茄红素的方法是可行的,并确定了湿菌体直接提取的最优条件:用0.6 mol/L NaOH溶液皂化,乙醇脱水处理10 min,乙酸乙酯作为提取剂,菌丝体质量(g)与提取溶剂体积(mL)之比为1∶75,在45 ℃超声处理20 min,可获得最高的番茄红素提取率。
三孢布拉霉菌; 番茄红素; 有机溶剂; 提取
番茄红素是红色天然色素,是胡萝卜素的异构体,属于脂溶性化合物,不具有维生素A的生理活性[1-3],难溶于乙醇,可溶于丙酮、氯仿等[4]。番茄红素存在于多种植物及人体组织器官中[5],具有多种生理功能,广泛应用于食品、医药、化妆品等行业[6-11]。
番茄红素提取方法主要包括超临界CO2萃取法、色谱法、有机溶剂萃取法等[12]。有机溶剂法提取简单方便,回收率高。但由于植物、真菌等细胞具有细胞壁,有机溶剂渗透穿过细胞壁和细胞膜的能力较差。因此为了促进番茄红素从细胞壁中溶出,较多采用超声破碎结合有机溶剂提取的方法,以提高番茄红素提取率[13]。
番茄红素的提取方法,多数是从番茄浆中直接提取,它是基于干菌丝体,经过干燥、研磨等方式提取,工作繁琐,效率低。刘义庆[14]利用正交试验法优化了西瓜中番茄红素的提取工艺,使用体积比为7∶1的乙酸乙酯-丙酮混合溶剂提取的最佳工艺为:料液比(西瓜果肉与提取剂)为1∶4,温度为45 ℃,时间为50 min,pH 6.0。王超等[15]研究认为,用乙酸乙酯为提取剂提取番茄红素的最佳条件为:提取温度55 ℃、浸提时间70 min、料液(番茄滤饼与提取溶剂)比1∶7,此时每克番茄滤饼中番茄红素的产量为0.52 mg。
本文利用微生物发酵法,以发酵液为实验原料,采用有机溶剂萃取与超声波相结合的方法,探究了三孢布拉霉菌菌丝体中的番茄红素提取工艺。探讨了用湿菌体对番茄红素直接提取的可行性,及菌丝体状态对番茄红素提取率的影响,从高效液相色谱(HPLC)图谱分析脱水处理对番茄红素提取率的影响,比较了不同皂化溶剂、溶媒及混合溶媒对提取率的影响,为工业化提取和制备番茄红素提供了重要的参考。
1 材料和方法
1.1材料
三孢布拉霉菌(国家生化工程技术研究中心,上海);50 L发酵罐(上海国强生化工程装备有限公司);番茄红素标品(上海源叶生物科技有限公司)。
1.2仪器和设备
恒温水浴锅,超声波破碎仪,pH计,安捷伦高效液相色谱,离心机,冷冻干燥机。
1.3试剂
石油醚,二氯甲烷,丙酮,正己烷,乙酸乙酯,环己烷,氢氧化钠,氢氧化钾,碳酸钠,盐酸,甲醇,乙醇,乙腈,以上试剂均为分析纯。
1.4检测及处理方法
1.4.1干重的测定取发酵液30 mL,在4 000 r/min转速下离心30 min,将沉淀洗涤、离心、再洗涤,在40 ℃烘箱中烘干至恒重后称干重。
1.4.2湿重的测定取30 mL发酵液,将发酵液抽滤、洗涤、再抽滤,得到湿菌体并称湿重。
1.4.3样品处理将获得的湿菌体置于-80 ℃冷冻过夜,并在冷冻干燥机中低温抽干。称取一定量的干菌体或湿菌体,加入皂化液皂化30 min,用盐酸调pH至中性,离心弃上清。向沉淀中加入脱水剂,摇匀,在一定温度下超声,离心弃上清。将获得的菌体沉淀按照一定的料液比加入提取溶剂,40 ℃超声,将提取液经膜过滤后使用HPLC进行测定。
1.4.4番茄红素的测定分离柱:WondaSilTMC18(4.6 mm×250 mm),粒径5 μm;流动相为乙腈和二氯甲烷(体积比为3∶1);检测波长450 nm;柱温为28 ℃。
1.4.5提取率的测定称取一定体积的发酵液,用1.4.3节中的方法对菌体沉淀进行多次提取。当沉淀物为无色时,认为菌体中番茄红素已被提取完全。此时合并提取液,称量,作为所称取菌丝体中的实际番茄红素含量,记为A。称量不同条件下对菌体沉淀进行一级提取时的番茄红素含量,记为A0。提取率测定:提取率=(A0/A)×100%。
1.4.6番茄红素收率的测定将1.4.3节中获得的提取液,采用真空旋转蒸发获得番茄红素粗品。然后使用冲洗剂对粗品进行冲洗、抽滤,并将获得的抽滤液使用1.4.4节的方法进行测定,得到其收率。
2 结果与分析
2.1菌体处理对提取的影响
在对番茄红素提取时,通常采用的有干菌体和湿菌体两种方法。干菌体提取是将获得的菌丝体经过低温干燥,研磨后使用提取溶剂对番茄红素进行提取。湿菌体提取则没有低温干燥程序而是经过皂化后,在超声条件下使用溶剂提取。为了研究使用湿菌体进行番茄红素提取的可行性,本文选用极性较强的丙酮和极性较弱的石油醚作为提取溶剂,分别探究了两种菌丝状态对提取结果的影响,结果见表1。
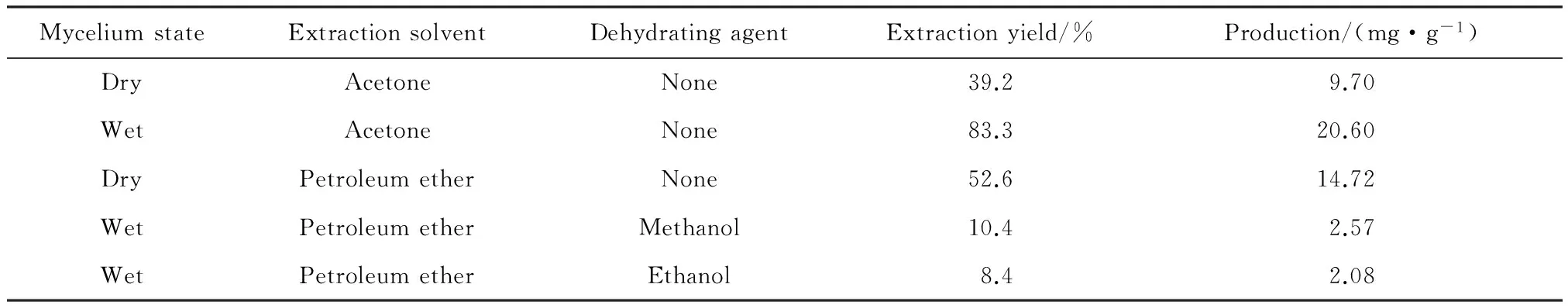
表1 不同菌丝体状态对番茄红素提取率的影响Table 1 Effect of mycelium state on the extraction yield of lycopene
实验结果表明,在番茄红素的提取过程中,用极性较强的丙酮作为提取溶剂时,湿菌体提取效果最好,提取率为83.3%,产量为20.6 mg/g;用极性较弱的石油醚作为提取溶剂时,干菌体提取效果较好,提取率达到52.6%,产量为14.72 mg/g。在用极性相对较弱的石油醚时,由于湿菌体中有多余的水分,石油醚不溶于水,菌体的表面形成一层水膜,石油醚无法与菌体充分接触,造成提取效果很差。在石油醚进行提取前,用脱水剂如甲醇/乙醇除去湿菌体中的部分水分,收到良好的效果,提取率分别达到10.4%和8.4%,产量分别为2.57 mg/g和2.08 mg/g,但仍与采用石油醚对干菌体的提取率相差5倍,与采用丙酮提取时的湿法提取相差9倍。对干菌体提取时,需要经过冷冻和低温干燥等处理,操作繁琐,误差较大。另一方面,番茄红素在高温和可见光条件下,性质不稳定,易造成番茄红素的氧化分解和异构化。从以上结果可以看出,利用湿菌体进行番茄红素提取的方法是可行的。用湿菌体提取时,极性较强的溶剂提取效果更好;用干菌体提取时,极性较弱的溶剂提取效果较好。
2.2皂化条件对提取的影响
在番茄红素提取过程中,NaOH、KOH、Na2CO3是常用皂化剂。番茄红素属于脂溶性物质,皂化剂可与菌体细胞壁中脂肪酸和游离的其他脂类物质发生皂化反应,使存在于番茄红素周围的脂肪酸形成盐,从而有利于番茄红素的释放[16]。这与皂化前后的菌丝体状态变化一致。经过皂化的菌丝体更蓬松,趋于分散,而未经皂化的菌丝体多聚集成团,如图1。王燕燕等[17]通过显微镜观察到,经过皂化的番茄红素提取物中产品杂质少,且有部分番茄红素晶体存在,说明皂化能有效去除包裹番茄红素的油脂类物质。在皂化过程中,样品中的部分可溶性类胡萝卜素也可通过皂化反应进入到皂化液,降低样品中杂质的含量,有利于后续提取。

图1 皂化对菌丝体状态的影响Fig.1 Effect of saponification on the mycelium state
研究证实,皂化反应的碱性环境不会造成由于结构发生变化而引起的有效成分破坏。当加入一定量皂化剂时,随着皂化剂浓度的增加,培养基残留的油脂物质及菌体中的其他脂肪酸就会更多地形成盐,增大了提取溶剂与番茄红素的接触面积,提取率得到相应提高。但是当碱性过高时,番茄红素会趋于不稳定,易造成氧化或分解,提取率反而会下降。表2比较了常用的皂化剂及其浓度对番茄红素提取率的影响。从表2中可以看出,当以0.3 mol/L的NaOH溶液作为皂化剂时,番茄红素提取率为53.5%,产量为11.42 mg/g;当NaOH浓度增加到0.6 mol/L时,番茄红素提取率有较大程度提高,可达到81.0%,产量达到19.75 mg/g。以KOH作为皂化剂,当KOH浓度从0.3 mol/L增加到0.6 mol/L时,提取率从45.7%提高到70.0%,产量也从9.75 mg/g提高到14.95 mg/g,但是相对于以NaOH作为皂化剂,其番茄红素的提取率均略低。当以0.3 mol/L和0.6 mol/L的Na2CO3分别作为皂化剂时,番茄红素提取率差别不大。当Na2CO3浓度为0.3 mol/L时,提取率较高,达到77.2%,是同浓度NaOH提取率的1.5倍,但与0.6 mol/L,NaOH溶液的81.0%提取率相比仍然偏低。综合以上实验结果,选用0.6 mol/L的NaOH溶液作为皂化剂。
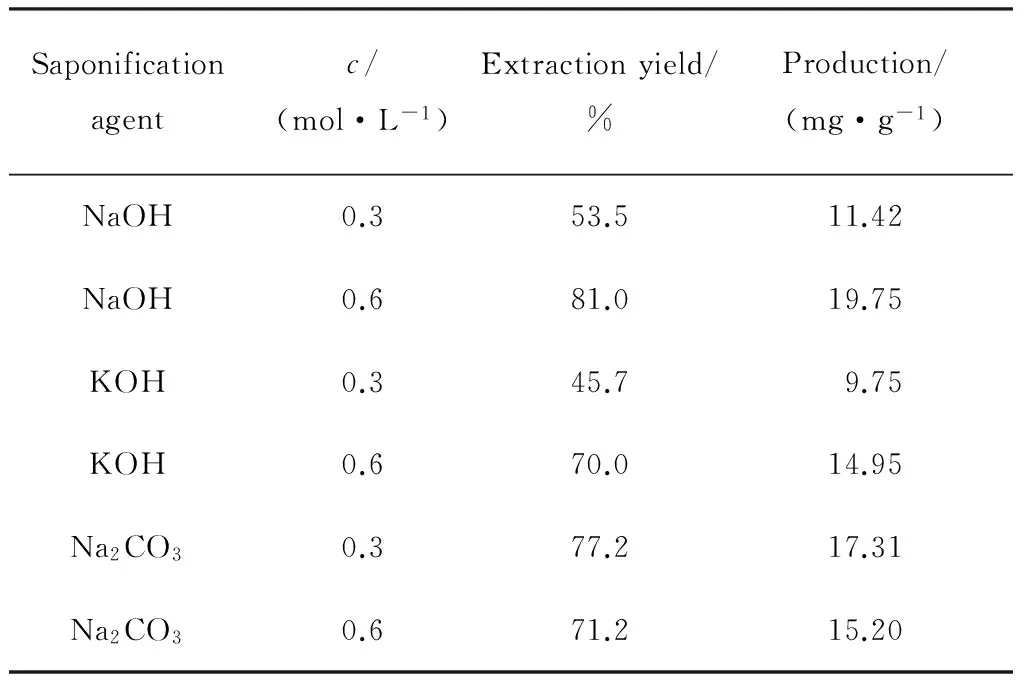
表2 皂化溶剂对番茄红素提取率的影响Table 2 Effect of saponification solvents on the extraction yield of lycopene
2.3脱水处理剂对提取的影响
经皂化处理后,菌丝体中含有大量水分,而提取溶剂一般为脂溶性,使部分提取溶剂(如石油醚)难以进入菌丝体中,影响提取效果。根据番茄红素难溶于甲醇和乙醇,而甲醇与乙醇与水互溶的特点,将皂化后的菌丝体进行脱水处理,可促进萃取剂进入菌丝体提高番茄红素溶出的速率。
表3示出了脱水剂对湿菌体提取蕃茄红素的影响。表3中,在分别以丙酮和石油醚作为提取溶剂时,使用脱水剂处理组比未经脱水处理组的提取率均有提高,前者最高提取率可达80.6%,产量19.90 mg/g。在作为番茄红素脱水剂时,甲醇和乙醇的提取效果相差不大,这可能与甲醇和乙醇的性质较为相似有关。同时可以看出,湿菌体是石油醚提取番茄红素的限制因素。使用脱水剂后,石油醚对湿菌体的提取效果仍然不理想。与丙酮组相比,脱水剂处理对石油醚组影响不大。
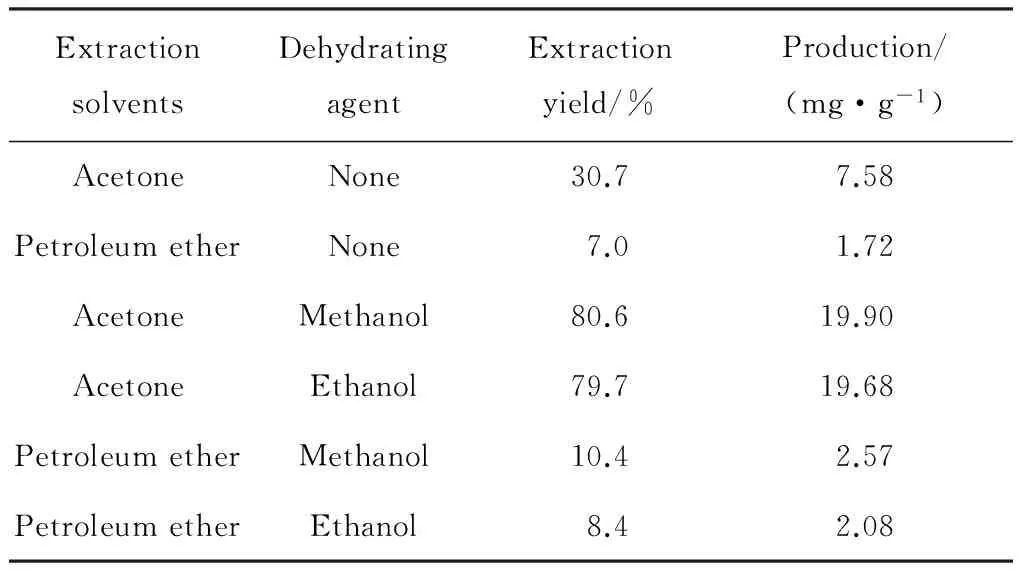
表3 脱水剂对湿菌体提取番茄红素的影响Table 3 Effect of dehydrating agent on the extraction yield of lycopene from wet mycelium
从表3可以看出,在皂化后进行脱水处理很有必要。由于甲醇相比乙醇有更大的毒性,我们选择乙醇作为理想的脱水处理剂。进一步考察乙醇作为脱水剂时,脱水时间对提取率的影响,结果见图2。结果表明,在使用乙醇处理样品时,随着处理时间的延长,提取率有较大的提高,在10 min处达到最高提取率83.7%,产量16.69 mg/g;但是10 min以后,随着脱水时间的延长,提取率有明显的下降,并慢慢趋于平衡。这可能是因为在脱水过程中,较长的超声时间造成细胞破碎,使得一部分的番茄红素释放进入溶液中。但是由于番茄红素在乙醇中溶解度较低,很快达到平衡,样品中的产物不再降低。

图2 乙醇处理时间对番茄红素提取率和产量的影响Fig.2 Effect of ethanol processing time on the extraction yield and production of lycopene
在脱水过程中,样品中多数的水溶性杂质或脂溶性杂质溶于乙醇,可达到纯化样品目的。图3(a)示出了经乙醇脱水后的样品出峰,图3(b)示出了脱水后乙醇溶液出峰。从图中可以看出,经脱水处理后,脱水剂乙醇中溶解了较多杂质,其中对杂质峰1与杂质峰2吸收效果最明显,而且,乙醇上清中番茄红素的含量极少。图3(a)中产物出峰前的杂质峰较少。由此可以看出,脱水剂可以有效去除样品中的杂质,纯化样品。
表4列出了脱水剂对番茄红素提取比例的影响。经过脱水剂处理后,样品中杂质的比例明显降低。丙酮组经甲醇/乙醇脱水后,番茄红素的峰面积从61.6%分别提高到68.1%和71.7%;石油醚组从41.5%分别达到54.5%和57.3%。这表明脱水剂可有效降低发酵过程中复杂杂质组分含量,提高番茄红素提取纯度。
2.4提取溶剂对提取的影响
极性不同的溶剂对番茄红素的提取效果有较大差异。称取相同质量的湿菌体,分别加入不同溶剂或其混合液,考察不同提取溶剂对番茄红素提取率的影响。
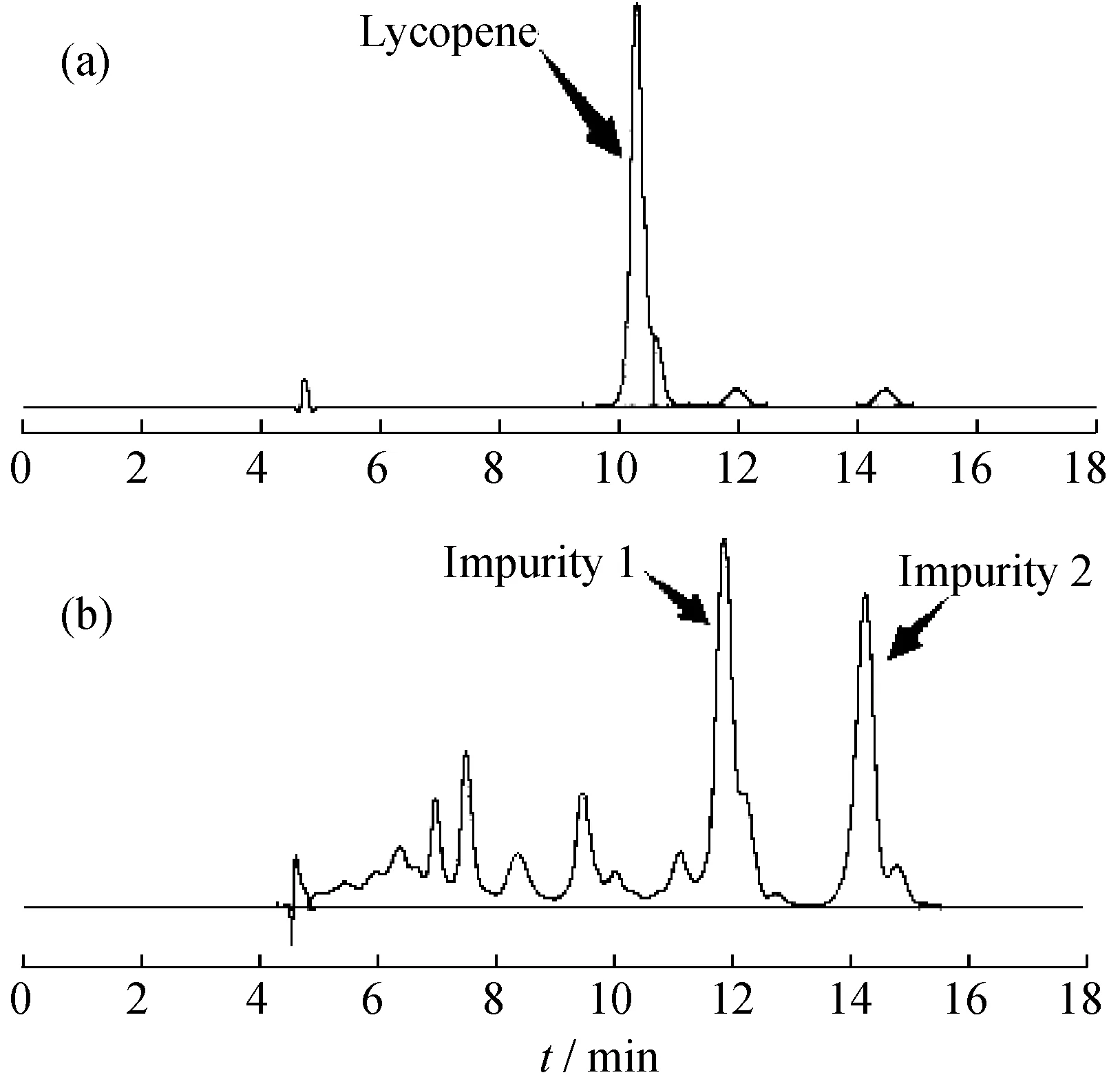
图3 乙醇处理对纯化番茄红素的影响Fig.3 Effect of ethanol processing on the purification of lycopene表4 脱水剂对番茄红素提取比例的影响Table 4 Effect of dehydrating agent on the extraction rate of lycopene
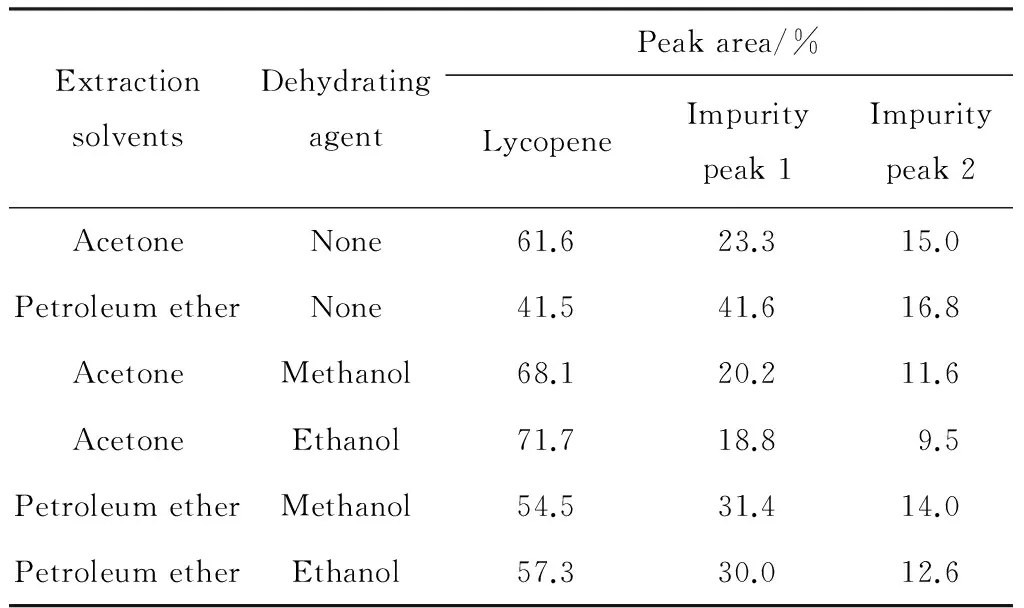
ExtractionsolventsDehydratingagentPeakarea/%LycopeneImpuritypeak1Impuritypeak2AcetoneNone61.623.315.0PetroleumetherNone41.541.616.8AcetoneMethanol68.120.211.6AcetoneEthanol71.718.89.5PetroleumetherMethanol54.531.414.0PetroleumetherEthanol57.330.012.6
由表5可知,当采用单一提取溶剂时,乙酸乙酯提取效果最好,可达到87.5%,其次为丙酮、二氯甲烷。而极性较差的石油醚、正己烷、环己烷中提取效果很差。当极性较弱的溶剂按照一定比例与极性较强的乙酸乙酯、丙酮等混合后,提取率得到一定程度的提高。极性差的环己烷和正己烷混合后,提取率仍较低,与最佳的乙酸乙酯溶剂提取率相差26倍。
2.5菌丝体质量与提取溶剂体积之比对提取效果的影响
在40 ℃条件下,分别考察了菌丝体质量(g)与提取溶剂体积(mL)之比为1∶5,1∶25,1∶50,1∶75,1∶100,1∶125,1∶150,1∶175,1∶200,1∶250时对番茄红素提取效果的影响(图4)。由图4可见,相同质量菌丝体,提取溶剂体积很小如1∶5时,液体明显很少,影响超声中的空化效应,不利于细胞的破碎及菌丝体中番茄红素的充分释放。当提取溶剂体积增加时,超声过程对细胞作用力增强,加快了番茄红素从细胞中的释放以及番茄红素从细胞到提取剂的溶解速率。随着溶剂中番茄红素浓度的增加,固相与液相间物质传递逐渐达到相对饱和。因此随着菌丝体质量与提取溶剂体积之比的增加,细胞中的番茄红素的提取率逐渐提高。当菌丝体质量与提取溶剂体积之比达到1∶75时,提取率达到最大。之后,菌丝体质量与提取溶剂体积之比的增加对提取率的影响不大,提取保持相对平衡,提取率略有下降。因为在菌丝体质量与提取溶剂体积之比为1∶75时,细胞中的番茄红素已经基本溶解在提取溶剂中,继续增加提取溶剂,不会使得更多的番茄红素溶出。另外,当溶剂过多,提取体积过大时会影响超声的效率,也在一定程度上造成提取剂浪费,使得回收困难。从另一方面考虑,随着菌丝体质量与提取溶剂体积之比从1∶25增加到1∶75,番茄红素的产量从8.04 mg/g提高到18.07 mg/g,这与番茄红素在不同固液比例时的溶出速率关系密切。

表5 提取溶剂对番茄红素提取率的影响Table 5 Effect of extraction agent on the extraction yield of lycopene
A—Petroleum ether;B—Dichloromethane;C—Acetone;D—n-Hexane;E—Ethyl acetate;F—Cyclohexane
2.6超声萃取时间对提取的影响
在其他条件相同时,考察了不同萃取时间对提取率的影响。从图5可以看出,从超声5 min至超声25 min,番茄红素的提取率呈逐步增加的趋势,产量从10.08 mg/g提高到14.12 mg/g。超声时间25 min时,提取率最高,达到87.4%,之后番茄红素的产量随着提取率逐渐降低,在超声50 min时,产量降至11.44 mg/g。超声波对细胞破碎的作用是通过空化效应来实现,整个过程在一段极短的时间就可以完成[18]。在超声初期,随着时间的增加,超声对经过皂化后的细胞作用更明显,使得细胞破碎得更完全。细胞内的番茄红素没有周围脂肪酸的影响,更易透过细胞膜,与提取剂的接触面积增大,逐渐扩散到溶剂中,并与提取液间的物质传递逐渐达到平衡,此时提取率达到最大。但由于番茄红素具有不稳定性,超声时间过长,番茄红素易倾向于转化为异构体或由于受到光等的影响而被氧化。因此随着超声的继续增加,番茄红素的产量略有下降。
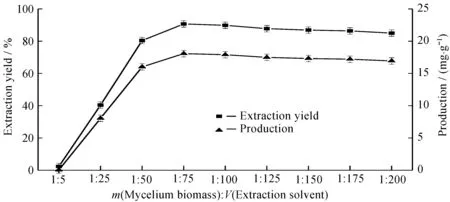
图4 菌体质量与提取溶液体积之比对番茄红素提取率和产率的影响Fig.4 Effect of the ratio of mycelium biomass and extraction solvent on the extraction yield and production of lycopene
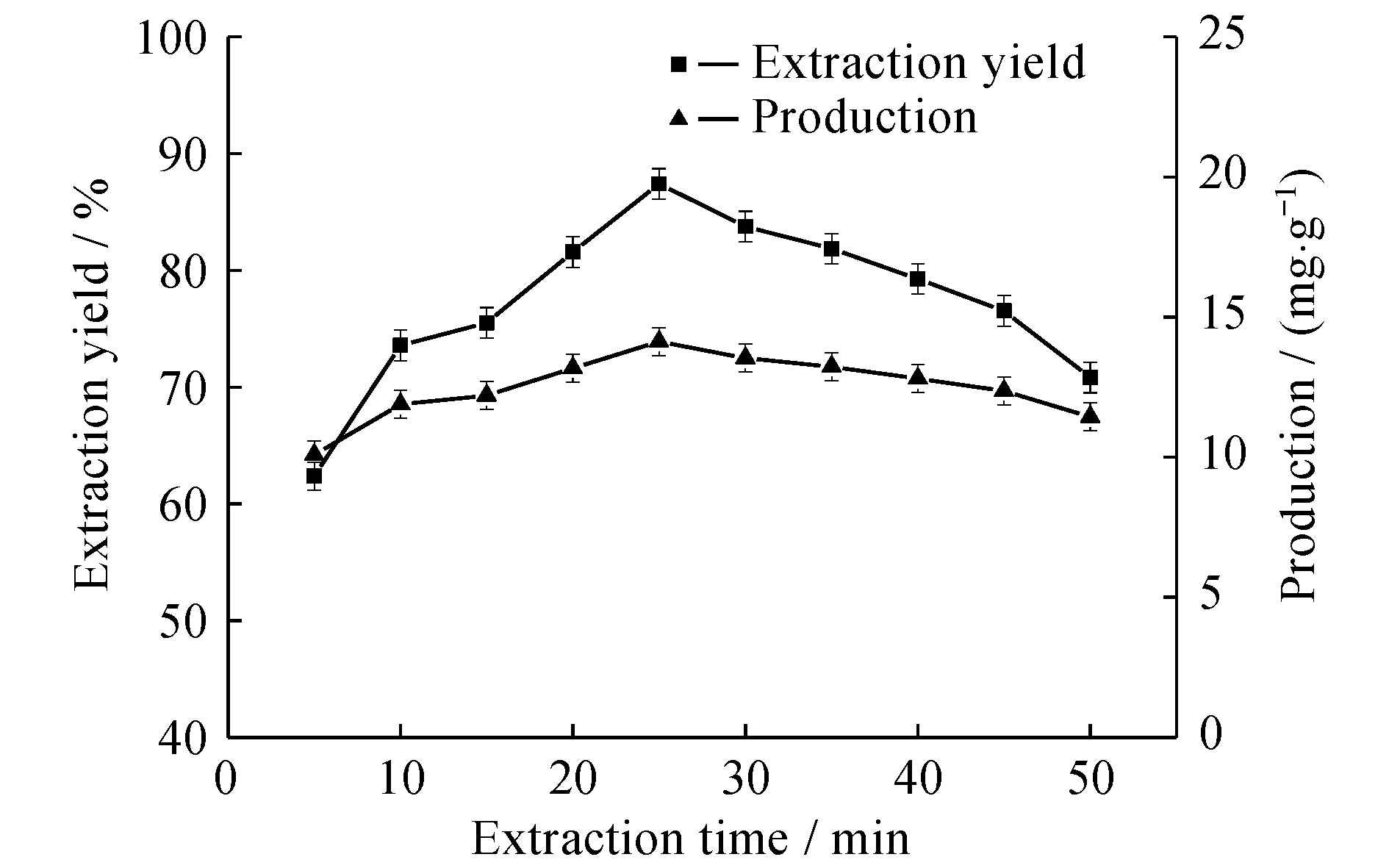
图5 提取时间对番茄红素提取率和产率的影响Fig.5 Effect of extraction time on the extraction yield and production of lycopene
2.7萃取温度对提取的影响
图6所示为不同萃取温度对番茄红素提取率的影响。从图中可以看出,当提取温度从25 ℃升温至40 ℃时,提取率逐渐从72.87%增加至84.37%,产量从15.82 mg/g提高到18.32 mg/g。当温度超过40 ℃后,随着温度的升高,提取率逐渐降低。当提取温度超过65 ℃时,随着温度的增加,提取率下降速率加快。在65 ℃时,提取率为79.10%,产量为17.17 mg/g,而在70 ℃时,提取率降低至74.26%,产量为16.12 mg/g。在提取时,除了超声波的破碎细胞作用外,提取溶剂与番茄红素间的扩散速率以及番茄红素的稳定性对番茄红素的提取率也有较大的影响。在温度较低时,分子的运动速率较慢,不利于提取溶剂与番茄红素分子间的相互扩散。随着温度的升高,分子运动速率加快,提取溶剂与番茄红素间的扩散加快,在更短时间内达到平衡。此外,番茄红素在较高温度下,结构不稳定,易分解,当温度超过65 ℃后,番茄红素提取率下降速率加快。因此,选择40 ℃作为番茄红素超声萃取的最佳温度。
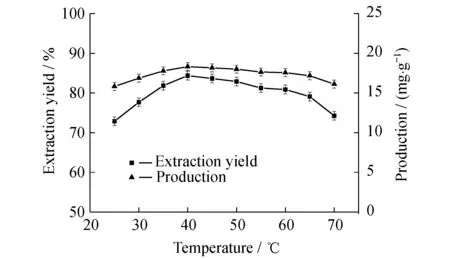
图6 提取温度对番茄红素提取率和产率的影响Fig.6 Effect of extraction temperature on the extraction yield and production of lycopene
2.8番茄红素提取条件正交试验结果分析
为了综合考察各提取条件对番茄红素提取率的影响,优化提取工艺,在单因素考察的基础上,选取提取温度(A)、菌丝体质量与提取溶剂体积之比(B)、提取时间(C)3个因素进行考察。正交试验设计及结果如表6所示。试验中每个因素有3个水平,共9组实验,每组实验3个平行。由表6及表7可以看出,3个因素对提取过程的影响从大到小的顺序为提取温度>菌丝体质量与提取溶剂体积之比>提取时间,得到最优的番茄红素提取条件组合A3B2C1,即提取温度45 ℃,菌丝体质量与提取溶剂体积之比1∶75,提取20 min。对最优组合进行试验验证结果表明采用最优组合的提取条件,番茄红素的提取率达到89.28%,产量达到19.39 mg/g。
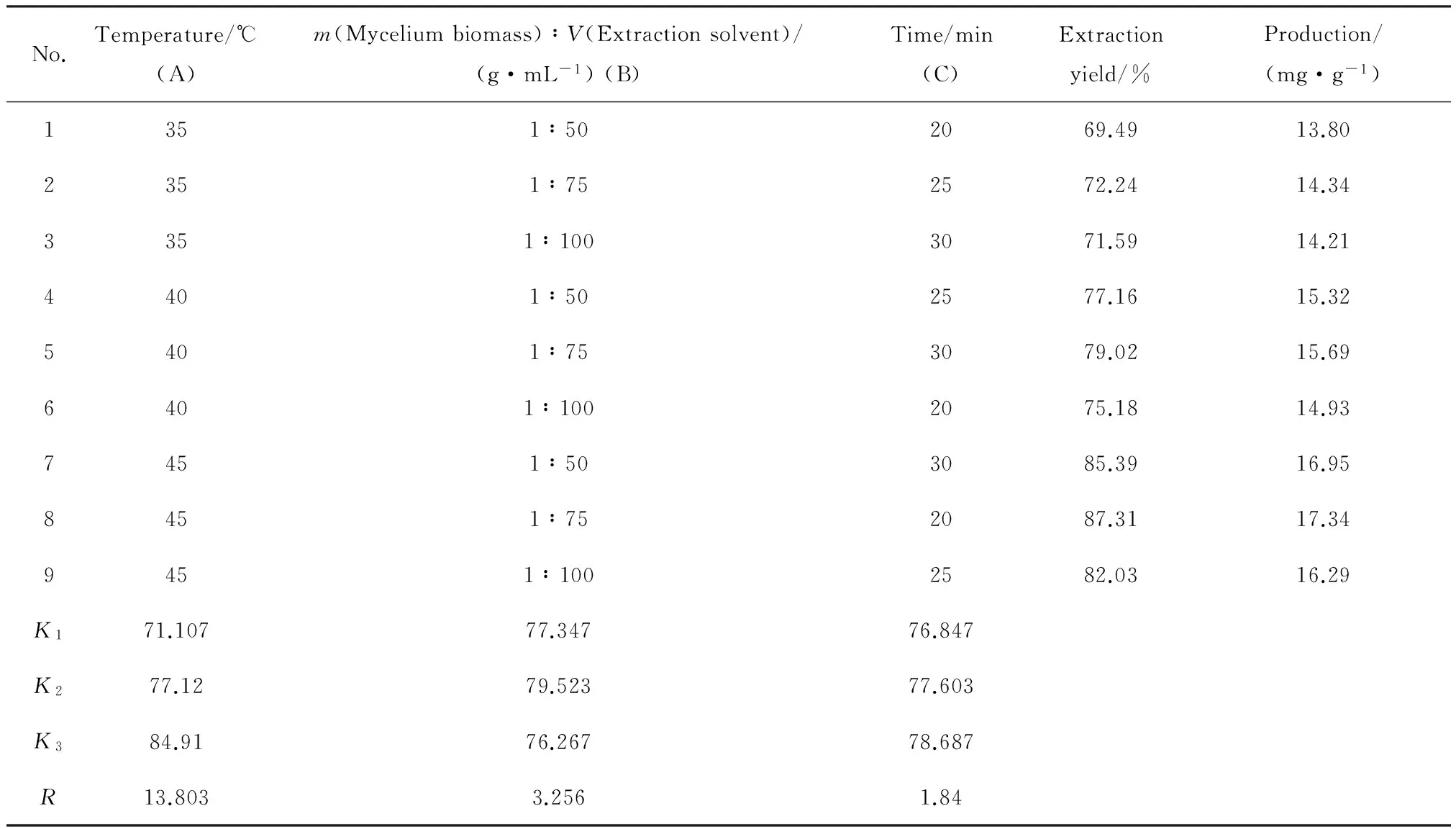
表6 正交试验设计与结果分析Table 6 Design and analysis of the results of orthogonal experiments
2.9番茄红素收率分析
由于经过萃取得到的提取液中含有较多的杂质,需要对在优化的提取工艺条件下的番茄红素进行纯度的测定。将经过提取的番茄红素提取液进行抽滤,采用真空旋转蒸发仪进行纯化,得到番茄红素粗品[19]。使用丙酮对番茄红素的粗品进行冲洗、抽滤,并对抽滤液进行液相测定(图7),番茄红素的纯度达到95.3%。
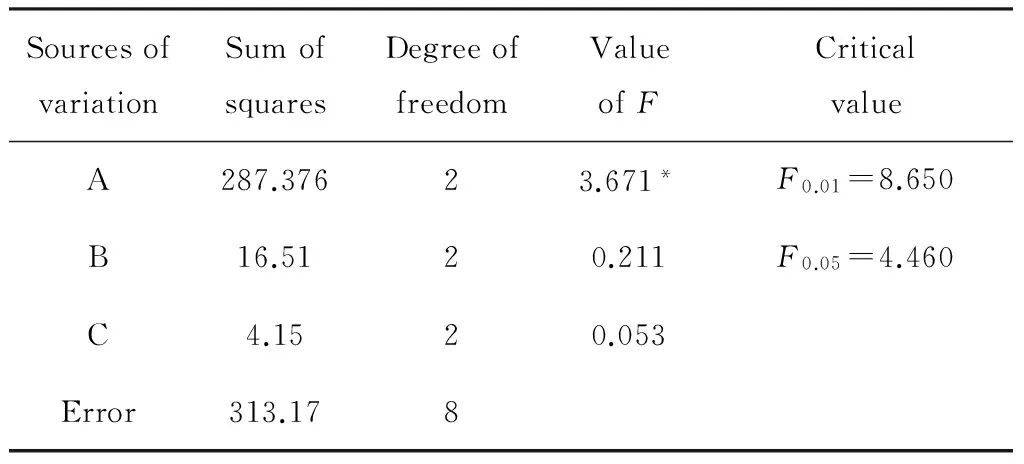
表7 正交试验方差分析Table 7 Analysis of variance of orthogonal experiments
*Significant
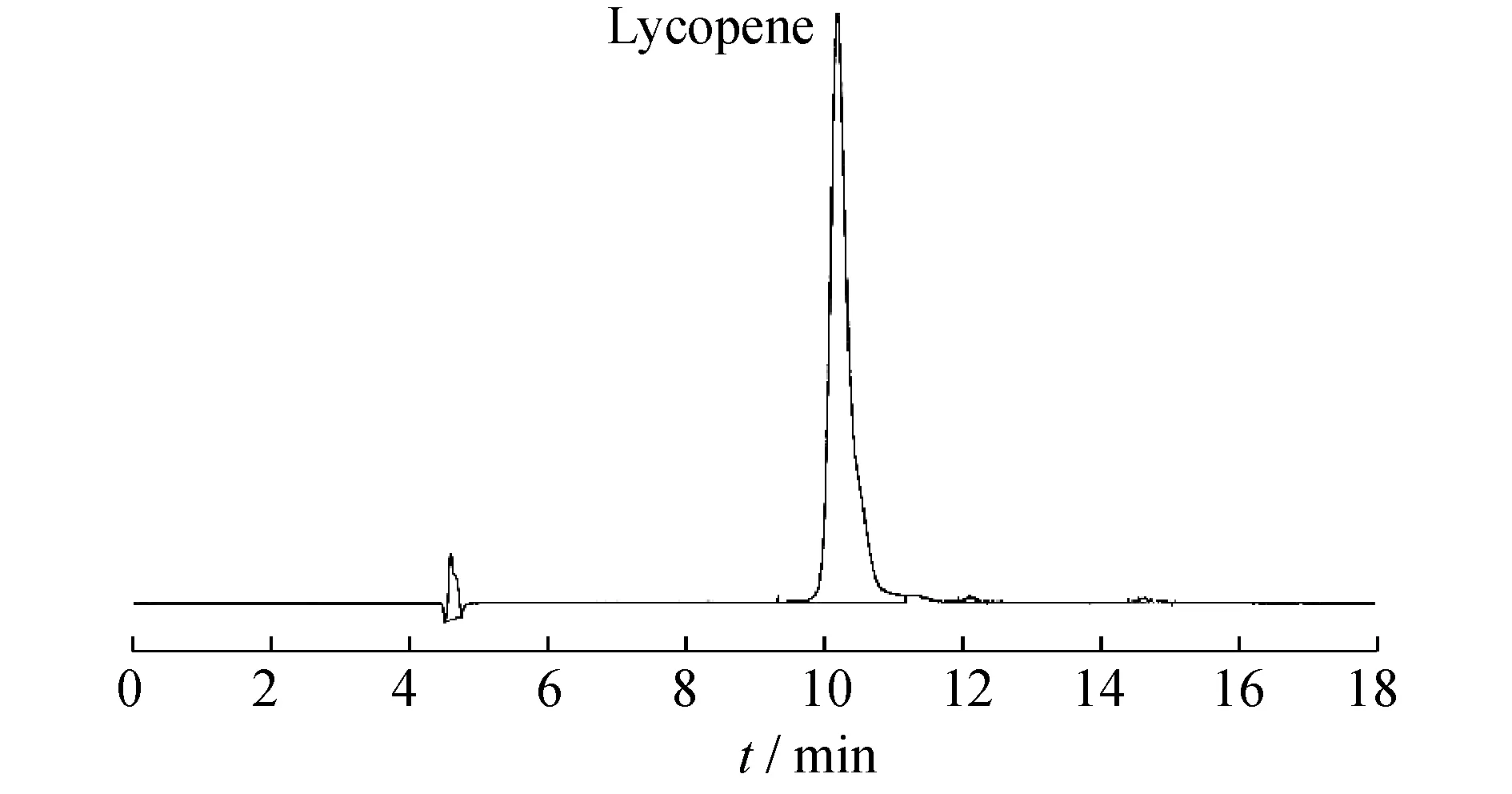
图7 番茄红素纯化后液相色谱图Fig.7 HPLC analysis of lycopene after purification
3 结 论
在番茄红素的提取过程中,菌丝体的处理,皂化条件,脱水处理及提取剂的选择,菌体与提取溶剂比例及提取时间对提取率均有显著的影响。文中通过比较干菌体和湿菌体两种不同菌丝状态对提取率的影响,证实了用湿菌体直接提取番茄红素的可行性,简化了测定方法;确定了湿菌体直接提取番茄红素的最优条件为:用0.6 mol/L的NaOH溶液皂化,乙醇脱水处理10 min,乙酸乙酯作为提取剂,菌丝体质量与提取溶剂体积之比1∶75,在45 ℃超声处理20 min,可获得最高的番茄红素提取率和含量,番茄红素纯度可达95.3%。
[1]NGUYEN M L,SCHWARTZ S J.Lycopene:Chemical and biological properties[J].Food Technology,1999,53(2):38-45.
[2]RAO A V,AGARWAL S.Role of lycopene as antioxidant and carotenoid in the prevention of chronic diseases[J].Nutrition Research,1999,19(2):305-323.
[3]范立海.浅谈番茄红素的生理功能[J].生物学通报,1999,34(9):16-17.
[4]HAKALA S H,MARINA-HEINONEN I.Chromatographic purification of natural lycopene[J].Journal of Agricultural and Food Chemistry,1994,42(6):1314-1316.
[5]解书怀.三孢布拉霉发酵番茄红素工艺的研究[D].江苏无锡:江南大学,2008.
[6]CHOKSI P M,JOSHI V Y.A review on lycopene-extraction,purification,stability and applications[J].International Journal of food properties,2007,10(2):289-298.
[7]MASCIO P D,KAISER S,SIES H.Lycopene as the most efficient biological carotenoid singlet oxygen quencher[J].Archives of Biochemistry and Biophysics,1989,274(2):532-538.
[8]邓宇,张卫强.番茄红素提取方法的研究[J].现代化工,2002,22(2):25-28.
[9]BASU A,IMRHAN V.Tomatoes versus lycopene in oxidative stress and carcinogenesis:conclusions from clinical trials[J].European Journal of Clinical Nutrition,2007,61(3):295-303.
[10]STEINMETZ K A,POTTER J D.Vegetables,fruit,and cancer prevention:A review[J].Journal of the Academy of Nutrition and Dietetics,1996,96(10):1027-1039.
[11]ABETE I,PEREZ-CORNAGO A,NAVAS-CARRETERO S,etal.A regular lycopene enriched tomato sauce consumption influences antioxidant status of healthy young-subjects:A crossover study[J].Journal of Functional Foods,2013,5(1):28-35.
[12]姚佳,蒲彪.番茄红素提取工艺及检测方法的研究进展[J].食品与发酵科技,2010,46(3):18-21.
[13]杨新辉,孟宪军,宋宇宁.三孢布拉霉发酵生产番茄红素的提取工艺及残留溶剂去除[J].微生物学杂志,2010,30(2):46-50.
[14]刘义庆.正交实验法优化西瓜番茄红素的提取工艺[J].食品研究与开发,2014,35(23):47-50.
[15]王超,张昭.番茄红素的提取与稳定性研究[J].江苏科技大学学报(自然科学版),2010,24(2):188-192.
[16]王燕燕.番茄红素的提取纯化工艺及稳定性研究[D].天津:河北工业大学,2003.
[17]王燕燕,邸进申,郑宇.皂化对番茄红素提取的影响研究[J].食品与发酵工业,2003,29(3):71-74.
[18]左爱仁.超声波萃取番茄红素的研究[J].食品工业,2003(5):36-38.
[19]杨屏,李君良,马思阳.番茄红素提取工艺的研究[C]//“以岭医药杯”第八届全国青年药学工作者最新科研成果交流会.石家庄:中国新药与临床杂志,2007.
Optimization of Extraction of Lycopene from Fermentation by Blakeslea trispora
PANG Kun-yun,WU Jia-qi,WANG Ze-jian,CHU Ju,ZHUANG Ying-ping,ZHANG Si-liang
(State Key Laboratory of Bioreactor Engineering,National Engineering Research Center of Biotechnology(Shanghai),East China University of Science and Technology,Shanghai 200237,China)
As a kind of carotenoids,lycopene has the functions such as enhancing immunity,anti-aging,which is mainly produced by microorganism fermentation to meet the market demand.To enhance the extract yield,and reduce complex impurity components in the fermentation broth,different solvents and methods are used to process wet mycelium in this paper.By the combination of organic solvents extraction and ultrasonication,the extract effects of mycelium state,saponification conditions,dehydrating agent,extraction solvents,the ratio of mycelium biomass and extraction solvent,extraction time and extraction temperature were tested and all the samples used had been filtered and washed before.The results showed that it was feasible to extract lycopene directly from wet mycelium,and the optimum conditions were listed below:the saponification agent of 0.6 mol /L NaOH,ethanol dehydrating time of 10 min,the ratio of mycelium biomass (g) and extraction solvent volume (mL) of 1∶75,ultrasonic processing time of 20 min at 45 ℃ with ethyl acetate as extraction agent.
Blakesleatrispora; lycopene; organic solvents; extraction
A
1006-3080(2016)03-0343-08
10.14135/j.cnki.1006-3080.2016.03.008
2015-11-18
中荷国际项目(2013DFG32630)
庞昆云(1990-),女,山东人,硕士生,研究方向为生物化工。E-mail:huiqiufengkun@163.com
通信联系人:庄英萍,E-mail:ypzhuang@ecust.edu.cn
Q815
——基于正交试验优化的皂化反应法△

