饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响
翟少伟 史庆超 陈学豪
(集美大学水产学院, 厦门 361021)
饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响
翟少伟 史庆超 陈学豪
(集美大学水产学院, 厦门 361021)
为研究饲料中添加抗菌肽Surfactin对吉富罗非鱼(GIFT, Oreochromis niloticus)肠道健康指标的影响, 实验将平均体重为(12.01±0.03) g/尾的320尾吉富罗非鱼, 随机分为4组, 每组4个重复, 每个重复20尾鱼, 分别投喂抗菌肽Surfactin添加水平为0(对照组)、50、100和200 mg/kg的试验饲料7周。结果显示: 与对照组相比, 吉富罗非鱼饲料中添加抗菌肽Surfactin可使肠道皱襞高度显著增加(P<0.05), 肌层厚度无显著变化(P>0.05); 大肠杆菌数量显著降低(P<0.05), 乳酸杆菌数量显著增加(P<0.05), 细菌总数无显著变化(P>0.05); 显著提高肠道总抗氧化能力水平、谷胱甘肽过氧化物酶活性和超氧化物歧化酶活性(200 mg/kg抗菌肽添加组除外)(P<0.05), 显著降低肠道丙二醛水平(P<0.05), 对过氧化氢酶活性无显著影响(P>0.05); 吉富罗非鱼肠道健康指标以50 mg/kg抗菌肽Surfactin添加组最佳。试验表明, 吉富罗非鱼饲料中适量添加抗菌肽Surfactin可增加肠道皱襞高度、调节肠道菌群和提高肠道抗氧化能力而改善肠道健康状态。
抗菌肽; 吉富罗非鱼; 肠道健康
近年来, 抗菌肽(Antimicrobial peptides, AMPs)作为饲用抗生素替代品的研究与应用成为饲料添加剂研究领域的热点之一。目前, 应用于水产动物饲料的抗菌肽主要从动物中提取或基因重组表达所得, 对水产动物的生长或免疫能力具有明显效果[1—3]。而微生物自然分泌的抗菌肽类物质报道较少。随着该领域研究的不断深入, 微生物源AMPs的高效抗菌作用越来越引起人们的重视[4]。Surfactin是芽孢杆菌属不同菌株次级代谢产生的一种脂肽类物质, 不仅具有广谱抗菌作用, 而且对病毒、支原体和原虫等也有抑制效果; 因其还具有很强的表面活性作用, 又被称为表面活性素[5—7]。研究表明, 抗菌肽Surfactin添加到饲料中, 可提高罗非鱼(Oreochromis niloticus)肠道消化酶活性, 改善血液生化指标, 调节脂肪代谢, 改善肝胰脏功能, 提高生长性能[8—11];可提高中华鳖(Pelodiscus sinensis)稚鳖增重率, 调节血液生化指标[12]。此外, NT-6抗菌脂肽(Surfactin、Fengycin和Iturin混合物)可促进凡纳滨对虾(Litopenaeus vannamei)生长, 提高机体免疫, 抑制养殖水体病原菌增殖[13, 14]。但还鲜见抗菌肽Surfactin对水产动物肠道健康影响的报道。肠道健康是水产动物健康养殖的关键, 其对于机体的整体健康起到非常重要的作用, 肠道病变往往引起鱼体其他器官(如肝胰脏)的损伤和功能障碍, 进而影响自身健康和水环境“健康”[15, 16]。通过测定肠道对营养物质消化、肠道生长发育、肠道黏膜免疫、肠道微生态、肠道黏膜屏障等方面的生理生化指标可反映水产动物的肠道健康状况[15—19]。鉴于此, 本试验旨在通过吉富罗非鱼饲料中添加不同水平的抗菌肽Surfactin, 研究肠道消化酶活性、肠道细菌数量以及肠道抗氧化能力等肠道健康指标的变化, 为其在渔用饲料中的应用提供参考。
1 材料与方法
1.1 试验动物与 试验设计
试验用鱼为吉富罗非鱼, 购于福建省漳州市水产开发中心。暂养2周后, 将320尾健康健壮、均重为(12.01±0.03) g的吉富罗非鱼随机分为4组, 每组4个重复, 每个重复20尾鱼, 对照组饲喂基础饲料,其他组分别饲喂在基础饲料中添加50、100和200 mg/ kg抗菌肽Surfactin的试验饲料, 试验期为7周。
1.2 试验饲料
基础饲料根据SC/T 1025-2004《罗非鱼配合饲料》标准[20]配制, 其组成和营养水平见表 1(风干基础)。根据试验设计的添加水平, 在基础饲料中添加抗菌肽Surfactin(由福建正源饲料有限公司提供,有效含量为80%)制作试验饲料。各种饲料原料经粉碎后过筛, 混合均匀后加工成3 mm直径的颗粒饲料, 室温自然风干后于-20℃冷藏保存。

表 1 基础饲料组成及营养水平Tab. 1 The ingredients and nutrient levels of the basal diet
1.3 饲养管理
试验鱼饲养于开有循环系统的养殖室水族箱内, 水族箱体积约为100 L, 规格为120 cm×60 cm× 70 cm。试验用水为曝气自来水, 光源为自然光源。水族箱水温保持在22—28℃, pH 7.4±0.3, 溶氧度大于7.0 mg/L, 氨氮浓度小于0.2 mg/L。每天分别在07:00、13:00和19:00定时饱食投喂, 每次投喂量为鱼体重的3.0%—5.0%。每次投喂30min后, 用虹吸管吸取剩余饲料和粪便, 每日的换水量约为30%。试验过程中用增氧机持续增氧。试验期间,吉富罗非鱼生长正常, 成活率为100%。
1.4 样品采集与组织匀浆的制备
试验鱼于试验结束后禁食24h, 对每缸所有鱼称重并记录总重, 每缸随机取6尾, 用适量浓度的丁香酚麻醉, 解剖试验鱼分离肠道, 除去肠道粘连的脂肪, 并用冷却的质量分数为0.86%生理盐水冲洗干净, 装于冻存管中保存于-80℃冰箱内, 用于肠道抗氧化指标的测定。另外每缸随机捞取6尾鱼, 其中3尾用于肠道细菌的培养与计数, 剩余3尾用于肠道组织形态切片的观察。
从-80℃冰箱中取出肠道组织样品置于冰上解冻, 制备10%的组织匀浆液。剪取1—3 g肠道组织,用冰浴过的生理盐水漂洗去除组织上的血液, 用滤纸拭干后称重, 再放入匀浆玻璃管中, 按组织∶生理盐水=1∶9加入0.86%冰冷生理盐水, 用匀浆机进行匀浆(10s/次, 间隙30s), 连续匀浆3—5次。最后把制备好的组织匀浆在4℃离心机下离心(3000 r/min,10min), 所得上清液分装到离心管中以备测定。
1.5 测定指标及方法
肠道组织切片制作及有关指标测定 肠道组织切片的制作参考翟秋玲等[17]的方法并略作修改, 主要步骤如下: 将试验鱼肠道样品用PBS冲洗干净后, 取前肠中间部分0.5 cm, Bouin氏液(饱和苦味酸水溶液75 mL+甲醛25 mL+冰醋酸5 mL)固定24h, 取出后置于75%的酒精中浸泡, 更换数次以去除样品中苦味酸的黄色, 然后经乙醇溶液(70%—85%—95%—100%)梯度洗脱, 二甲苯透明, 石蜡包埋, 在室温下切成6 µm的切片, 苏木精-伊红(HE)染色, 封片。每个肠道样品取5张切片, 每个切片选取5个完整、走向平直的肠皱襞位置, 采用光学显微镜(奥林巴斯BX80-JPA)拍照, 于200倍下测量5肠皱襞高度及肌层厚度, 而后使用Image-pro plus 6.0图像分析软件进行图像数据测量。
肠道细菌的培养与计数 肠道菌群样品采集参考杨伟[19]的方法并略作修改, 具体操作如下:用蒸馏水冲洗鱼体表面, 拭干, 再用酒精棉球擦拭鱼体表消毒。用已灭菌的解剖工具打开试验鱼腹腔, 取出肠道, 酒精擦拭肠道外部, 并以磷酸盐缓冲溶液(PBS, pH=7.3)冲洗肠道2—3次去除内容物, 保留肠壁样品, 置于无菌离心管内。超净工作台上称取肠道样品0.5 g左右, 并以1∶9的质量体积比加入预先配好的无菌PBS, 冰浴中用灭菌匀浆器5000 r/ min充分匀浆, 制成肠道原液, 然后进行梯度稀释至10-7稀释液。取适宜梯度稀释液各100 μL, 分别涂布在准备好的选择性培养基MRS培养基、EMB 培养基和TTC培养基平板上(培养基均购自广州环凯微生物科技有限公司), 每个稀释度每种培养基做两个重复, 然后将涂布好的平板置于28℃恒温生化培养箱(科力仪器PYX-250 S-B)中培养24—48h。培养结束后, 选取细菌生长疏密适当、菌落清晰的平板进行计数, 并将结果换算成每克样品中菌落数的对数值log10 CFU/g 进行统计分析。
肠道抗氧化指标 肠道总抗氧化能力(Total antioxidant capacity, T-AOC)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathion peroxide,GSH-Px)活性及丙二醛(Malondialdehyde, MDA)水平等指标均采用南京建成生物工程技术研究所生产的试剂盒进行测定, 测定步骤详见说明书。
1.6 数据统计与分析
试验结果均以平均值±标准差(Mean±SD)表示,使用SPSS 17.0统计软件进行单因素方差分析(One-way ANOVA), 采用Duncan's法进行多重比较, P<0.05表示差异显著。
2 结果
2.1 不同水平抗菌肽Surfactin 对吉富罗非鱼肠道组织形态的影响

表 2 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道皱襞高度和肌层厚度的影响Tab. 2 Effects of dietary AMPs-surfactin supplementation on intestinal tract folds height and muscular thickness of GIFT
由表 2可以看出, 各抗菌肽添加组罗非鱼肠皱襞高度显著高于对照组(P<0.05), 50 mg/kg添加组肠皱襞高度显著高于100和200 mg/kg添加组(P<0.05),各处理组肌层厚度无显著差异(P>0.05)。
2.2 不同水平抗菌肽Surfactin 对吉富罗非鱼肠道菌群的影响
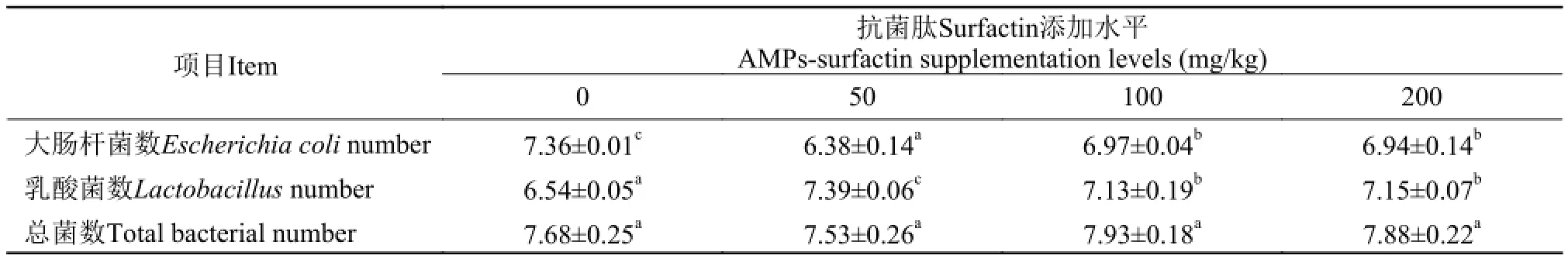
表 3 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道微生物数量的影响Tab. 3 Effects of dietary AMPs-surfactin supplementation on intestinal tract microflora of GIFT (lg CFU/g)
由表 3可知, 与对照组相比, 各抗菌肽添加组大肠杆菌数量显著降低(P<0.05), 乳酸菌数量显著增加(P<0.05); 随抗菌肽添加水平的升高, 大肠杆菌数量呈先降低后升高的趋势, 50 mg/kg添加组数量最少, 显著低于100和200 mg/kg添加组(P<0.05); 乳酸菌数量呈先升高后降低趋势, 50 mg/kg添加组数量最高, 显著高于100和200 mg/kg添加组(P<0.05)。各处理组肠道总菌数无显著差异(P>0.05)。
2.3 不同水平抗菌肽Surfactin 对吉富罗非鱼肠道抗氧化能力的影响
由表 4可知, 各抗菌肽添加组吉富罗非鱼肠道T-AOC水平和GSH-Px活性均显著高于对照组(P<0.05), 50 mg/kg添加组T-AOC水平显著高于100和200 mg/kg添加组(P<0.05), 50和100 mg/kg添加组GSH-Px活性显著高于对照组和200 mg/kg添加组(P<0.05), 且50和100 mg/kg添加组间GSH-Px活性无显著差异(P>0.05)。50和100 mg/kg添加组肠道SOD活性显著高于对照组(P<0.05); 200 mg/kg添加组和对照组之间、50和100 mg/kg添加组间无显著差异(P>0.05)。各抗菌肽添加组的肠道MDA含量均显著降低(P<0.05), 50 mg/kg添加组MDA含量最低, 显著低于对照组和200 mg/kg添加组(P<0.05)。各处理组肠道CAT活性无显著差异(P>0.05)。
3 讨论
3.1 抗菌肽Surfactin 对吉富罗非鱼肠道组织形态的影响
小肠是鱼类营养物质吸收的主要场所, 肠道的皱襞及绒毛不仅在营养物质吸收方面起着重要作用, 而且其随着肠蠕动而剧烈强有力的摆动, 有助于排斥肠壁上有害物质的定植, 其对肠道功能的维持以及肠道健康状况至关重要。肠黏膜的肌层厚度反映肠道收缩能力的强弱, 其肌层厚度增加使得肠道收缩力增强, 有助于肠道食糜的混匀、消化和排空[21, 22]。

表 4 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道抗氧化能力的影响Tab. 4 Effects of dietary AMPs-surfactin supplementation on antioxidant ability in intestinal tract of GIFT
在本试验中, 吉富罗非鱼饲料添加抗菌肽Surfactin可使肠皱襞的高度显著增加, 且50 mg/kg添加组显著高于其他添加组, 说明添加一定水平的抗菌肽Surfactin对肠皱襞绒毛的生长发育具有促进作用。研究表明, AMPs可以促进肠道上皮细胞的增殖和胞外基质蛋白生成, 修复肠道损伤[23, 24]; 提高肠道上皮内淋巴细胞、肥大细胞和杯状细胞的数量, 提高肠道的免疫屏障功能[22]; 还可优化肠道菌群结构, 改善肠道微生态, 对肠道发育也有重要的作用[7, 23, 24]。
3.2 抗菌肽Surfactin对吉富罗非鱼肠道菌群的影响
研究表明, 在饲料中添加适宜剂量的AMPs可以促进动物肠道中乳酸杆菌、双歧杆菌等有益菌的增殖, 降低肠道中大肠杆菌的数量[24, 25]。本试验结果表明, 饲料中添加抗菌肽Surfactin可显著增加吉富罗非鱼肠道中乳酸菌数量, 降低大肠杆菌数量,而不影响肠道总菌数量。表明抗菌肽Surfactin能够抑制鱼类肠道有害菌, 促进肠道有益菌的增殖, 从而改善肠道微生态, 促进肠道健康。目前, 大多学者认为Surfactin的抗菌活性与其表面活性作用密切相关, 可通过攻击病原菌细胞膜, 造成膜崩解或渗透压失衡而发挥抑菌作用[5, 6]; 此外, Surfactin还能通过抑制蛋白质合成胞内代谢酶的活性, 影响病原菌正常代谢和增殖[5—7]。
3.3 抗菌肽Surfactin 对吉富罗非鱼肠道抗氧化能力的影响
在正常生理情况下, 动物体内自由基处于一种产生和清除的动态平衡状态。SOD、CAT和GSHPx是机体内清除自由基的主要抗氧化酶, 可减少脂质过氧化损伤, 维持机体自由基的动态平衡状态。T-AOC 可以反映机体的总抗氧化水平, 它通过分解体内过氧化物, 阻断过氧化链, 来清除体内自由基和活性氧。MDA是自由基与脂质发生过氧化反应的主要产物, 其含量多少可以间接反映机体的脂质过氧化程度和自由基产生情况[26]。
研究表明, 枯草芽孢杆菌Y-6产生的抗菌肽(活性成分为Surfactin、伊枯草菌素和丰原素)是一种高效的抗氧化剂, 可清除O2-、OH-和H2O2等自由基, 抑制MDA生成[27]。在本研究中, 适量添加抗菌肽Surfatin提高了肠道SOD、GSH-Px活性以及TAOC水平, 降低了MDA水平。这与我们研究Surfactin对吉富罗非鱼肝胰脏抗氧化指标影响的结果类似[11]。Surfactin提高机体抗氧化能力的作用也在小鼠[28]和肉仔鸡[29]中得到证实。Surfactin提高动物抗氧化能力的机制可能是: (1)通过提高有益菌数量, 降低有害菌数量, 减少自由基生成。益生菌具有较强的抗氧化功能, 其能够释放SOD、GSHPx和巯基化合物等抗氧化物质, 清除周围的活性氧和自由基, 减少脂质抗氧化损伤[30]; 此外, 有害菌的减少还可以降低内毒素的积累, 降低诱发氧衍 生为自由基的可能性[31]。(2)其分子中含有疏水性氨基酸, 如亮氨酸和缬氨酸可与氧结合或抑制脂质中氢的释放, 促进肽链与脂肪酸之间的相互作用, 从而延缓脂质过氧化链反应[5, 6, 32]; (3)通过分子内的谷氨酸和天冬氨酸与Fe2+、Fe3+和Cu2+等金属离子螯合, 可降低金属离子的催化活性和氧化反应速度,减少自由基生成[28]。值得注意的是肠道MDA水平随着Surfactin添加水平升高有所上升, 这可能与Surfactin发挥表面活性作用的方式有关[33, 34], 也可能与抗菌肽类物质具有一定的抗原性有关[5, 6, 24], 具体原因还有待查明。
在本试验中, 吉富罗非鱼肠道健康指标状况并未随抗菌肽Surfactin水平的增加而得到进一步的改善。这与本课题组研究其对吉富罗非鱼生长性能、血液生化指标、脂肪代谢指标和肝胰脏生理生化指标的影响, 以及对中华鳖稚鳖增重率和血液生化指标作用的结果类似, 即超过适量添加水平的抗菌肽Surfactin对试验动物的作用效果无显著提高[8—12]。这可能主要与抗菌肽Surfactin的表面活性有关。研究表明, Surfactin的多种生物学活性以表面活性作用为基础。当发挥表面活性作用时, 其乳化效果与用量直接相关, 在临界胶束浓度以下时,其乳化能力随着用量的增加而增加; 但超过临界胶束浓度后, 乳化性能趋于稳定, 即使加大用量, 乳化效果也不会有太大变化[33, 34]。
4 小结
在饲料中添加抗菌肽Surfactin可提高吉富罗非鱼肠道皱襞高度, 调节肠道菌群, 提高肠道抗氧化能力, 而改善吉富罗非鱼肠道健康状态。在本试验条件下, 50 mg/kg的抗菌肽Surfactin即可对吉富罗非鱼肠道健康指标产生有益影响。
[1]Peng K S, She R P, Yang Y R, et al. Anti-adherence of antibacterial peptides and oligosaccharides and promotion of growth and disease resistance in tilapia [J]. Asian-Australasian Journal of Animal Sciences, 2007, 20(4):569—576
[2]Zhou X X, Wang Y B, Li W F. Effect of feeding apidaecin on common carp (Cyprinus carpio) growth performances and immune function [J]. Aquaculture, 2008, 279:108—112
[3]Shi Q C. The effects of dietary surfactin supplementation on the growth and intestinal health of GIFT strain of Nile tilapia (Oreochromis niloticus) [D]. Thesis for Master of Science. Jimei University. Xiamen. 2015 [史庆超. 抗菌肽Surfactin对吉富罗非鱼生长及肠道健康的影响. 硕士学位论文, 集美大学. 厦门. 2015]
[4]Hassan M, Kjos M, Nes I F, et al. Natural antimicrobial peptides from bacteria: characteristics and potential applications to fight against antibiotic resistance [J]. Journal of Applied Microbiology, 2012, 113(4): 723—736
[5]Seydlova G, Svobodova J. Review of surfactin chemical properties and the potential biomedical applications [J]. Central European Journal of Medicine, 2008, 3(2):123—133
[6]Chen W C, Juang R S, Wei Y H. Applications of a lipopeptide biosurfactant, surfactin, produced by microorganisms [J]. Biochemical Engineering Journal, 2015,103: 158—169
[7]Zhai S W, Li J, Shi Q C. Antimicrobial lipopeptide surfactin: antimicrobial activity and applications [J]. Chinese Journal of Animal Nutrition, 2015, 27(5): 1333—1340[翟少伟, 李剑, 史庆超. 抗菌脂肽Surfactin的抗菌活性及应用. 动物营养学报, 2015, 27(5): 1333—1340]
[8]Shi Q C, Lu J J, Lu P, et al. Effects of antimicrobial lipopeptides supplementation on growth performance and intestinal digestive enzyme activities of genetic improvement of farmed tilapia (GIFT, Oreochromis niloticus) [J]. Journal of Feed Industry, 2014, 35(12): 6—10 [史庆超,卢俊姣, 陆鹏, 等. 饲料中添加抗菌脂肽对吉富罗非鱼生长性能和肠道消化酶活性的影响. 饲料工业, 2014,35(12): 6—10]
[9]Zhai S W, Li J, Sun X W. Effects of surfactin supplementation on growth performance, serum biochemical indexes and lipid metabolism of genetically improved farmed tilapia (Oreochromis niloticus) [J]. Chinese Journal of Animal Nutrition, 2015, 27(12): 3959—3967[翟少伟, 李剑, 孙秀文. 饲料中添加表面活性素对吉富罗非鱼生长性能、血清生化指标及脂肪代谢的影响.动物营养学报, 2015, 27(12): 3959—3967]
[10]Zhai S W, Shi Q C, Lu P, et al. Effects of different types of antimicrobial lipopeptides supplementation on the weight gain rate, serum biochemical indexes and non-specific immune ability of GIFT strain of Nile tilapia (Oreochromis niloticus) [J]. Guangdong Agriculture Science,2015, (21): 129—133 [翟少伟, 史庆超, 陆鹏, 等. 不同抗菌脂肽添加物对吉富罗非鱼增重率、血清生化指标和非特异性免疫指标的影响. 广东农业科学, 2015, (21):129—133]
[11]Zhai S W, Li J, Chen X H et al. Effect of dietary surfactin supplementation on some physiological-biochemical parameters in hepatopancreas of GIFT tilapia [J]. Feed Research, 2015, (23): 46—48, 54 [翟少伟, 李剑, 陈学豪,等. 饲料中添加表面活性素对罗非鱼肝胰脏生理生化指标的影响.饲料研究, 2015, (23): 46—48, 54]
[12]Zhai S W, Shi Q C, Sun P X, et al. Effect of dietary surfactin supplementation on weight gain rate and blood biochemical parameters of juvenile chinese soft-shelled turtle (Pelodiscus sinensis) [J]. Feed China, 2015, (22): 39—41[翟少伟, 史庆超, 孙培新, 等. 表面活性素对中华鳖稚鳖增重率及血液生化指标的影响. 饲料广角, 2015, (22):39—41]
[13]Shi G J, Sun L J, Wang Y L, et al. Effects of antibacterial lipopeptides produced by Bacillus subtilis NT-6 in solidstate fermentation on growth performance and non-specific immunity of Litopenaeus vannamei [J]. Guangdong Agriculture Science, 2014, (22): 99—102, 108 [石广举,孙力军, 王雅玲, 等. 纳豆芽孢杆菌NT-6 抗菌脂肽对凡纳滨对虾生长性能及非特异性免疫指标的影响. 广东农业科学, 2014, (22): 99—102, 108]
[14]Shi G J, Sun L J, Wang Y L, et al. Effects of NT-6 antimicrobial lipopeptide on growth performance of Litopenaeus vannamei and Vibrio number during breeding process [J]. Guangdong Agriculture Science, 2014, (12):119—122 [石广举, 孙力军, 王雅玲, 等. NT-6抗菌脂肽对凡纳滨对虾生长性能及养殖源头弧菌数的影响. 广东农业科学, 2014, (12): 119—122]
[15]Zhou X Q. Relationship between Nutrient and Fish In-testi- nal Health [A]. In: Liu J X (Eds.), Advanced Research in Animal Nutrition (2012 edition) [C]. Beijing:China Agriculture Science and Technology. 2012,246—260 [周小秋. 营养物质与鱼肠道健康的关系. 见:刘建新, 动物营养研究进展(012年版). 北京: 中国科学技术出版社. 2012, 246—260]
[16]Mi H F, Sun R J, Zhang L, et al. Research progress of fish intestinal health [J]. China Feed, 2015, (15): 19—22 [米海峰, 孙瑞健, 张璐,等.鱼类肠道健康研究进展. 中国饲料, 2015, (15): 19—22]
[17]Zhai Q L, Zhang C X, Sun Y Z, et al. Effects of tributyrin and mannan-oligosaccharide on growth performance,body composition and intestinal health indices of tawny puffer (Takifugu flavindus) [J]. Chinese Journal of Animal Nutrition, 2014, 26(8): 2197—2208 [翟秋玲, 张春晓, 孙云章, 等. 三丁酸甘油酯和甘露寡糖对菊黄东方鲀生长性能、体组成及肠道健康指标的影响. 动物营养学报, 2014, 26(8): 2197—2208]
[18]Wang M Q, Huang X L, Jin M, et al. Improvement effect of dietary plant essential oil on growth performance and intestinal health of Litopenaeus vannamei [J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1163—1171[王猛强, 黄晓玲, 金敏, 等. 饲料中添加植物精油对凡纳滨对虾生长性能及肠道健康的改善作用. 动物营养学报, 2015, 27(4): 1163—1171]
[19]Yang W. Effects of dietary amylase/amylopectin ratios on the growth, feed utilization and intestinal health of tilapia,Oreochromis niloticus [D]. Thesis for Master of Science. Jimei University. Xiamen. 2012 [杨伟. 饲料中直链/支链淀粉比对罗非鱼生长、饲料利用及肠道健康的影响.硕士学位论文, 集美大学. 厦门. 2012]
[20]The Ministry of Agriculture of the People's Republic of China. SC/T 1025—2004 Formulated Feed of Tilapia [S]. China Standard Press. 2004 [中华人民共和国农业部. SC/T 1025—2004罗非鱼配合饲料. 北京: 中国标准出版社. 2004]
[21]Zheng Y H, Peng C, Wu X F, et al. Effects of hydrolyzed yeast on growth performance, lipids metabolism and intestinal structure of largemouth bass (Micropterus salmoides) [J]. Chinese Journal of Animal Nutrition, 2015,27(5): 1605—1612 [郑银桦, 彭聪, 吴秀峰, 等. 酵母酶解物对大口黑鲈生长性能、脂类代谢及肠道组织结构的影响. 动物营养学报, 2015, 27(5): 1605—1612]
[22]Li Y L, Gao Q P, Shuai K, et al. Effects of soybean meal replacement by fermented soybean meal on growth performance and intestinal tissue structure of common carp (Cyprinus carpio) [J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 469—475 [李云兰, 高启平, 帅柯, 等.发酵豆粕替代豆粕对鲤鱼生长性能和肠道组织结构的影响. 动物营养学报, 2015, 27(2): 469—475]
[23]Ostaff M J, Stange E F, Wehkamp J. Antimicrobialpeptides andgutmicrobiota in homeostasis and pathology [J]. Embo Molecular Medicine, 2013, 5(10):1465—1483
[24]Wang S, Thacker P A, Watford M, et al. Functions of antimicrobial peptides in gut homeostasis [J]. Current Protein and Peptide Science, 2015, 16: 582—591
[25]Xiao H, Shao F Y, Wu M M, et al. The application of antimicrobial peptides as growth and health promoters for swine [J]. Journal of Animal Science and Biotechnology,2015, 6(1): 19
[26]Wu K, Huang X S, Jin J N, et al. Effects of feeding with faba bean (Vicia faba) on the antioxidant capability and immune functions of grass carp (Cenopharyngodon idellu) [J]. Acta Hydrobiologica Sinica, 2015, 39(2):250—258 [吴康, 黄晓声, 金洁南, 等. 饲喂蚕豆对草鱼抗氧化能力及免疫机能的影响. 水生生物学报, 2015,39(2): 250—258]
[27]Zhang J, Ding H Y, Qi X Y, et al. Antioxidant activities in vitro of antimicrobial peptide produced by Bacillus subtilis Y-6 [J]. Journal of Nuclear Agricultural Sciences,2011, 25(3): 518—522, 558 [张捷, 丁韩英, 戚向阳, 等.枯草芽孢杆菌Y-6产抗菌肽的体外抗氧化效果研究. 核农学报, 2011, 25(3): 518—522, 558]
[28]Yalçın E, Çavuşoglu K. Structural analysis and antioxidant activity of a biosurfactant obtained from Bacillus subtilis RW-I [J]. Turkish Journal of Biochemistry Turk Biyokimya Dergisi, 2010, 35(3): 243—247
[29]Du H M, Lu Z X, Wang T. Effect of antimicrobial peptides on antioxidant capacity and biochemical indicators in broilers [J]. Animal Husbandry and Veterinary Medicine, 2010, 42(6): 8—13 [都海明, 陆兆新, 王恬. 抗菌脂肽对肉鸡抗氧化能力及血清生化指标的影响. 畜牧与兽医, 2010, 42(6): 8—13]
[30]Wang J B, Chu J L, Qi L L, et al. The relationship between probiotics and animal intestinal free radical [J]. Chinese Journal of Animal Nutrition, 2014, 26(12):3545—3549 [王进波, 初佳丽, 齐莉莉, 等. 益生菌与动物肠道自由基的关系. 动物营养学报, 2014, 26(12):3545—3549]
[31]Wang T, Du H M, Lu Z X. Advance of antimicrobial lipopeptide and its application in animal production [A]. In: Liu J X (Eds.), Advanced Research in Animal Nutrition (2012 edition) [C]. Beijing: China Agriculture Science and Technology. 2012, 327—337 [王恬, 都海明, 陆兆新. 抗菌脂肽及其在动物生产中的应用研究进展. 见:刘建新, 动物营养研究进展(2012年版). 北京: 中国科学技术出版社. 2012, 327—337]
[32]Xiao M Z, Jin X B, Zhu J Y. Antioxidant mechanism and application prospective of antibacterial peptides [J]. Food Science, 2010, 31(11): 312—315 [肖明珠, 金小宝, 朱家勇. 抗菌肽抗氧化作用机制及其应用前景. 食品科学,2010, 31(11): 312—315]
[33]Li Y, Zou A H, Ye R Q, et al. Effects of molecular struc-ture on surfactin micellization activity [J]. Acta Physico-Chimica Sinica, 2011, 27(5): 1128—1134 [李翌, 邹爱华,叶汝强, 等. 表面活性素分子结构对其胶束化行为的影响. 物理化学学报, 2011, 27(5): 1128—1134]
[34]Sahnoun R, Mnif I, Fetoui H, et al. Evaluation of Bacillus subtilis SPB1 lipopeptide biosurfactant toxicity towards mice [J]. International Journal of Peptide Research and Therapeutics, 2014, 20(3): 333—340
EFFECT OF DIETARY ANTIMICROBIAL PEPTIDES-SURFACTIN SUPPLEMENTATION ON PARAMETERS OF INTESTINAL HEALTH INDICES OF GENETICALLY IMPROVED FARMED TILAPIA (GIFT, OREOCHROMIS NILOTICUS)
ZHAI Shao-Wei, SHI Qing-Chao and CHEN Xue-Hao
(Fisheries College of Jimei Univeristy, Xiamen 361021, China)
A 7-week feeding trial was conducted to evaluate effects of antimicrobial peptides-surfactin on intestinal health indices of genetically improved farmed tilapia (GIFT, Oreochromis niloticus). Three hundred and twenty fish with initial average weight of (12.01±0.12) g were randomly divided into four treatment groups with four replicates and 20 fish in each replicate. The fish were fed experimental diets supplemented with 0 (control group), 50, 100, and 200 mg/kg antimicrobial peptides-surfactin, respectively. Surfactin supplementation increased intestinal folds height of GIFT (P<0.05), but did not impact the muscular thickness (P>0.05). Surfactin supplementation significantly decreased the number of Escherichia coli of GIFT (P<0.05) and significantly increased the number of Lactobacillus (P<0.05). There was no significant difference in the total bacterial number among all treatment groups (P>0.05). Surfactin supplementation significantly increased the total antioxidant capacity level and activities of glutathion peroxidase and superoxide dismutase (except 200 mg/kg Surfactin supplementation group) (P<0.05) but significantly decreased the content of malondialdehyde (P<0.05). Surfactin supplementation had no effect on catalase activity (P>0.05). The intestinal health parameters of 50 mg/kg antimicrobial peptides-surfactin supplementation group were the best among all supplementation groups. In conclusion, surfactin supplementation at 50 mg/kg could improve intestinal health status of GIFT by increasing the intestinal folds height and regulating intestinal microbial population and antioxidant ability.
Antimicrobial peptides; Genetically improved farmed tilapia; Intestinal health
S963
A
1000-3207(2016)04-0823-07
10.7541/2016.106
2015-12-29;
2016-01-11
“十二五”农村领域国家科技计划课题“功能性肽产品的创制与应用”(2013BAD10B03)资助 [Supported by Key Project of National Science and Technology R&D Program During the Twelfth Five-Year Plan Period “Development and Application of Functional Peptide Products”(2013BAD10B03)]
翟少伟 (1973—), 男, 河北晋州人; 博士, 副教授; 主要研究方向为动物营养与饲料资源开发。E-mail: shaoweizhai@163.com

