光周期对葛仙米生长和光合系统活性的影响
安彦君,饶本强,郑春杰,代真真,李敦海,刘其芳,刘永定
(1.中国科学院 水生生物研究所,湖北 武汉 430072;2.常德炎帝生物科技有限公司,湖南 常德 415707;3.信阳师范学院 生命科学学院,河南 信阳 464000)
0 引言
葛仙米(NostocsphaeroidesKutzing)学名拟球状念珠藻,俗称水木耳、天仙菜、珍珠菜、田木耳,蓝藻纲,念珠藻科.藻体呈胶质状、由多数细胞连成念珠状群体,外观呈球状,蓝绿色或黄褐色.葛仙米是我国传统出口的一种珍贵野生食药两用蓝藻[1].
据古医书记载,葛仙米有治疗夜盲症、脱肛、烫伤等功效,另外还具有明目益气、解热清膈、利肠胃、久食延年、消除疲劳、收敛等功效.现代医学动物试验表明,葛仙米不但能够显著促进小鼠的生长发育,而且具有抗氧化、提高免疫力的功效,此外,还具有一定的抗癌功效[2,3];现代营养检测分析技术表明,葛仙米富含蛋白质、维生素和微量元素,还可分泌多种具生物活性的胞外多糖;其中,葛仙米藻胆蛋白抗氧化[4]和提高免疫力[5]的功效已得到验证,已有学者开始开展葛仙米藻胆蛋白的消化特性研究[8].
据调查,葛仙米常见于河溪石块和水稻田中,在我国大部分地区有分布,其中湖北省鹤峰县产量之多,尤为罕见,而在世界范围内其分布稀少,产量甚微.随着现代农业生产技术的发展,葛仙米的大部分生境已遭到破坏,鹤峰县葛仙米年产量已从20年前的25×103kg锐减至0.5×103kg[7].因此开发葛仙米人工培植技术势在必行.本文通过研究光周期对葛仙米生长和光合系统活性的影响,探索较佳的光暗周期比,旨在提高葛仙米产量,降低能耗,为室内人工培植技术提供参考.
1 材料与方法
1.1 实验材料
葛仙米(NostocsphaeroidesKutzing)藻种由中国科学院水生生物研究所淡水藻种库提供.实验采用过80目筛后的小群体作为初始接种材料,群体直径≤0.5 mm.
1.2 实验处理
按照表1设置3个不同的光暗周期比处理组,每组处理设置3个平行.

表1 3个不同的光周期处理组
培养容器为500 mL锥形瓶中.采用BG110液体培养基,置于23 ℃±1 ℃恒温培养间静止培养,光源为冷白荧光灯,光照强度为40~50 μmol·m-2·s-1.
实验为3个批次的连续培养.第一个批次将过80目筛后直径小于0.5 mm的小群体分装于500 mL锥形瓶中,另取500 mL锥形瓶,加入300 mL BG110培养基,接入鲜质量为2.5 g的葛仙米小群体,培养25 d后,将所有葛仙米收获.将每组处理的葛仙米过80目筛后再次分装于500 mL锥形瓶中,另取500 mL锥形瓶,加入300 mL BG110培养基,接入2.5 g葛仙米小群体,用相同的光周期设置开始第二个批次的培养,第二个批次培养17 d后,将所有葛仙米收获.将每组处理的葛仙米过80目筛并再次分装于500 mL锥形瓶中,另取500 mL锥形瓶,加入300 mL BG110培养基,接入2.5 g葛仙米小群体,用相同的光周期设置开始第三个批次的培养,第三个批次的培养持续20 d结束.
1.3 生物量测定
采用鲜质量法表示葛仙米的生物量.每次均匀取20 mL藻液,滤去水分,称量鲜质量.在第一个批次的培养中,每6~7 d取一次样,测定鲜质量.最后,在每个批次的培养结束时收集葛仙米,测定鲜质量进行比较.
1.4 叶绿素荧光参数测定
采用脉冲调制荧光仪Phyto-PAM(WALZ,Germany)测定葛仙米叶绿素荧光参数Fv/Fm和光合系统Ⅱ天线色素含量.测量Fv/Fm之前将样品暗适应20 min.
1.5 数据处理
实验数据运用SPSS16.0统计软件处理,通过单因素方差分析(One-Way ANOVA)比较各处理组同一时间采样点间差异的显著性,通过两配对样本t检验(Paired-Samples t test)比较同一处理组不同时间采样点之间差异的显著性,显著性水平为0.05.
2 实验结果
2.1 光周期对葛仙米生长的影响
在第一个培养批次中,3个光周期处理下的葛仙米鲜质量在第6 d、第12 d和第19 d 3个处理组均没有显著性差异(P>0.05),到第一个批次结束时,3个处理组均具有显著性差异(P<0.05),24 h连续光照组单位体积的鲜质量最高,光暗比为1处理组次之,光暗比为0.5处理组最低(图1).在第一个批次结束时收获的每瓶葛仙米的鲜质量也出现了同样的结果(P<0.05)(图2).
图2为每个培养批次结束时各处理组总鲜质量比较.第一培养批次结束时,24 h光照处理组总鲜质量显著高于光暗比为1和光暗比为0.5处理组(P<0.05).第二批培养结束时,24 h光照处理组的总鲜质量降到最低水平,光暗比为1处理组的总鲜质量处于最高,此时3个光周期处理组的总鲜质量两两之间没有显著性差异(P>0.05);第三批培养结束时,24 h光照处理组的总鲜质量仍然最低,光暗比为1处理组的总鲜质量显著高于24 h光照处理组和光暗比为0.5处理组,光暗比为0.5处理组的总鲜质量也显著高于24 h处理组(P<0.05);3个培养批次结束时24 h光照处理组总鲜质量表现出显著的依次降低的趋势(P<0.05).

图1 第一个培养批次鲜质量随时间的变化趋势(平均值±标准误)

图2 每个培养批次结束时各处理组每瓶总鲜质量之间的比较
)
图3对每个培养批次每个处理组的始末鲜质量和始末鲜质量的增加量进行了对比.第一个培养批次末每瓶收获的鲜质量以及鲜质量的始末增加量与光照时长成正比,并且处理组之间的差异显著(P<0.05)(图3a).第二个培养批次中则不存在这种正比关系,光暗比为1光周期处理组的终止鲜质量和增加量最高,但是3个光周期处理组之间不存在显著差异(P>0.05)(图3b).而在第三个培养批次中3个光周期处理组之间又出现显著差异(P<0.05),光暗比为1光周期处理组的终止鲜质量和增加量都显著高于其他两组,并且24 h连续光照组的鲜质量出现了负增长(图3c).从图3d中可以看出,24 h连续光照处理组的始末鲜质量增加量在第一个培养批次中最高,而光暗比为1和光暗比为0.5光周期处理组的最高值都出现在第二个培养批次中.


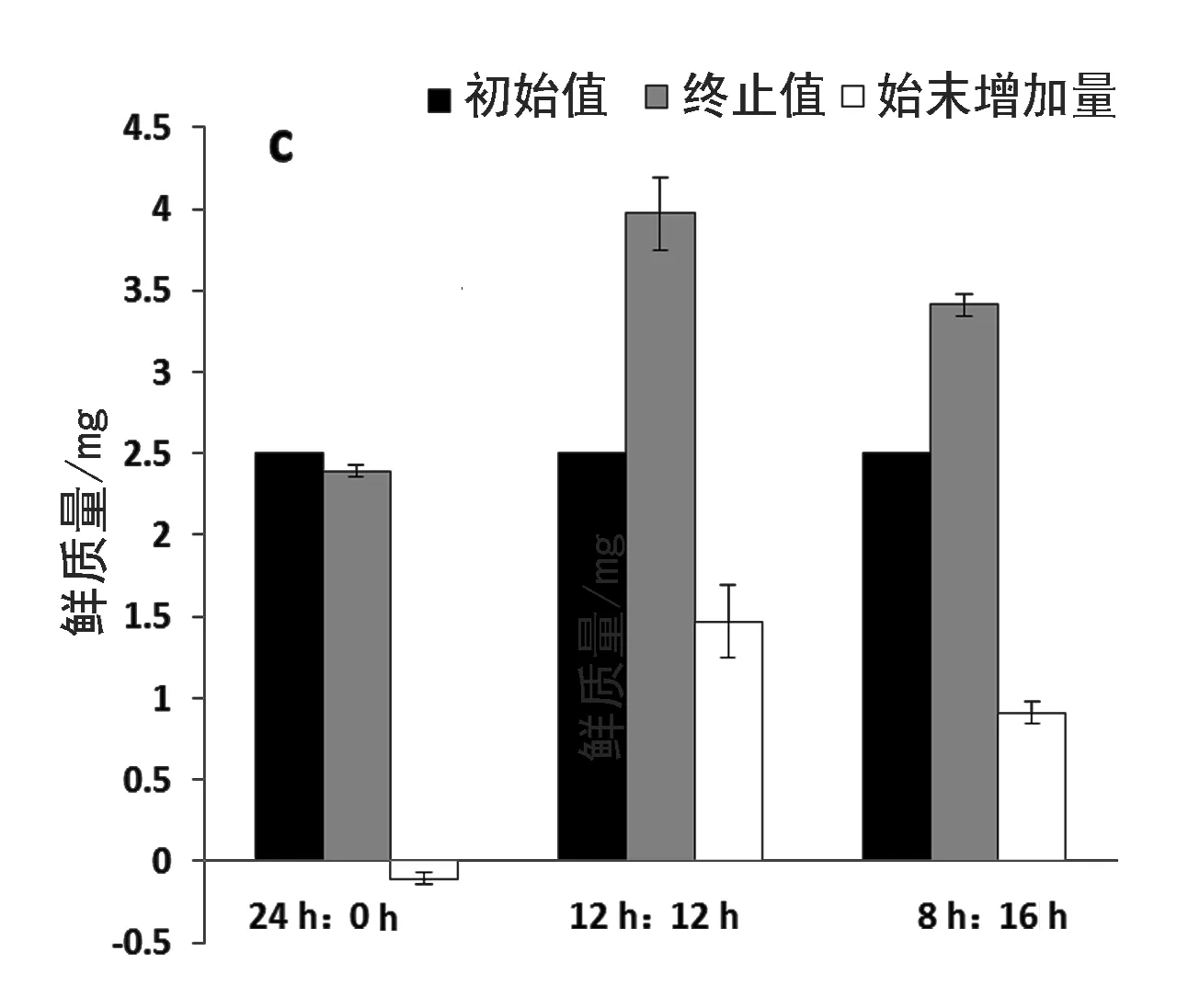

图3 3个光周期下不同培养批次鲜质量初始值、终止值和增加量及平均日增加量的比较Fig. 3 Fresh weight comparison of the beginning value,ending value,increasing amount and the average daily increasing amount in each culture batch culture
2.2 光周期对葛仙米光合系统活性的影响
光合系统Ⅱ的最大光合量子产率Fv/Fm在第一个批次的培养过程中呈显著下降的趋势,第25 d和第6 d的数据之间存在显著性差异(P<0.05),每个采样点的各处理组之间没有显著性差异(P>0.05)(图4).在此培养阶段,光合系统Ⅱ的天线色素含量总体呈现小幅度下降的趋势,光暗比为1处理组的数值有些不稳定波动,24 h光照处理组和光暗比为0.5处理组之间没有显著性差异(P>0.05)(图5).每个培养批次结束时,各处理组的Fv/Fm均没有显著差异(P>0.05),第二批和第三批结束时每个处理组的Fv/Fm均显著高于第一批(P<0.05),第二批和第三批之间没有显著性差异(P>0.05)(图6).
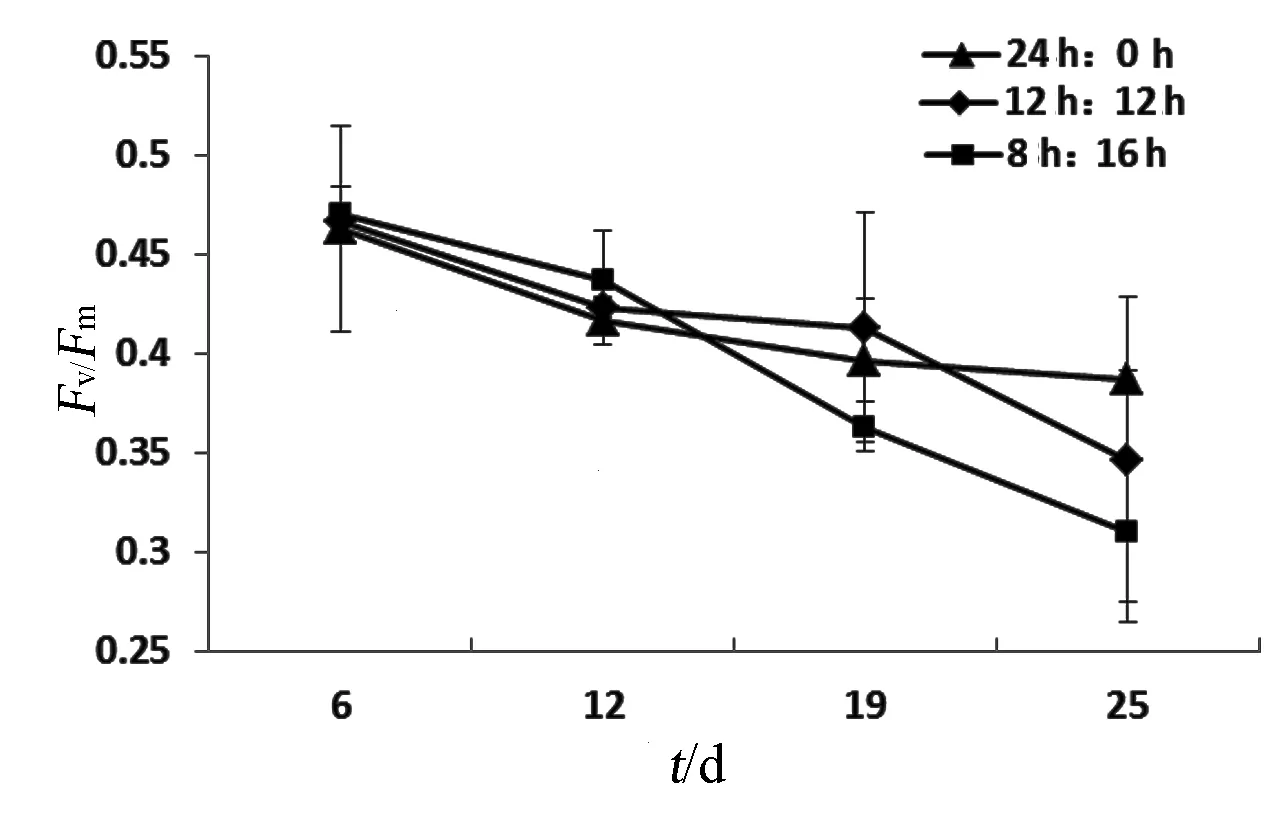
图4第一个培养批次不同光周期处理的Fv/Fm随时间的变化趋势(平均值±标准误)Fig. 4 The variation trend of Fv/Fm during the first batch culture(mean±SE)

图5 第一个培养批次光系统Ⅱ天线色素含量随时间的变化趋势(平均值±标准误)Fig. 5 The variation trend of the content of light-harvesting pigment in the antenna of PSⅡduring the first batch culture(mean±SE)
图7对每个培养批次结束时各处理组光合系统Ⅱ天线色素的含量进行了比较.第一批培养结束时各处理组光合系统Ⅱ的天线色素含量没有显著差异(P>0.05).第二批培养结束时24 h光照处理组光合系统Ⅱ的天线色素含量最低,显著低于光暗比为1和光暗比为0.5处理组(P<0.05).第三批培养结束时仍然是24 h光照处理组的含量最低,光暗比为0.5处理组的最高,三个处理组之间差异显著(P<0.05).24 h光照处理组光合系统Ⅱ的天线色素含量从第二个培养批次开始显著降低(P<0.05),之后一直处于最低水平.光暗比为1处理组光合系统Ⅱ的天线色素含量在第三个批次培养时出现显著降低(P<0.05).光暗比为0.5处理组光合系统Ⅱ的天线色素含量在三个批次的培养中一直维持在较高的水平,没有显著差异(P>0.05).

图6 每个培养批次结束时各个处理组Fv/Fm之间的比较

图7 每个培养批次结束时各处理组光合系统Ⅱ天线色素含量之间的比较
3 讨论
3.1 光周期对葛仙米生长的影响
光抑制是自然界植物生长中普遍存在的一种现象,这种现象也同样普遍存在于藻类的室内培植.降低光抑制的程度对提高葛仙米产量具有重要意义.自然界中在较长的日照时长和较低的光照强度下植物的生长速率最高,淡水红藻在低光照强度下的生长状态最好[8].因此选择相对较低的光照强度40~50 μmol·m-2·s-1作为葛仙米室内的培养光强.在本研究中,24 h光照处理组在第一个培养批次末具有显著的生长优势,光暗比为1光周期处理组次之,光暗比为0.5光周期处理组的生物量增长最慢.但24 h连续光照的生长优势很快消失,在第二个和第三个培养批次,光暗比为1光周期处理组的生长超过了24 h连续光照处理组,处于最高水平,而24 h连续光照处理组的生长降至最低,说明在第二个和第三个培养批次中连续光照对葛仙米的生长产生了明显的抑制作用.在第三个批次的培养中,光暗比为1光周期处理组的生物量显著高于光暗比为0.5光周期处理组,说明在一定范围内生物量的累积和光照时长成正比,而24 h连续光照处理组仅在第一个培养批次遵循这一正比关系,在后来两个批次的培养中表现出明显的后劲不足,甚至出现显著的生物量负增长,足以表现24 h连续光照培养对葛仙米的生长抑制是不可逆的.24 h连续培养带来的生长上的抑制,可能是由于过长的光照使得光合系统持续运转,造成细胞内部影响生长的代谢秩序紊乱.孙岁寒等[9]在四列藻(Tetraselmistetrathele)对光周期改变的响应研究中也认为过长的光周期影响了藻细胞的代谢过程,扰乱了其正常的分裂模式,导致衰亡加快,寿命缩短.在相同的光照强度和培养温度下,锥状斯氏藻和塔玛亚历山大藻也表现出与本实验葛仙米第一个培养批次相似的特性,在一定的光暗周期范围内,这两种藻生物量的累积与光照时间基本成正比,所不同的是,连续光照条件下,这两种藻生物量的累积也进一步增加,但并没有随光照时间的延长呈比例增加[10].此外,还有很多学者进行了24 h连续光照培养和光暗周期培养的比较研究,Price和Yin等人通过比较海洋球石藻(Emilianiahuxleyi)等11种海洋浮游植物对光周期的响应发现其结果具有很大的物种特异性,有的在连续光照培养下具有显著的生长优势,有的在一定的光暗周期培养下具有生长优势[11].由于上述报道中藻类的培养实验都只进行了10~25 d,仅相当于本实验的第一个培养批次,所以并不知道是否会在后期培养批次中表现出类似本实验中连续光照培养条件下葛仙米生长上的负增长以及不可逆的生长抑制.
由此可见,24 h连续光照在连续批次培养的早期阶段最有利于生长进行,但是更容易使细胞的内部资源耗竭,虽然后期的批次培养中每次都更换新鲜培养基,但是却无法扭转其生长速率降低的趋势,可见24 h连续光照对细胞的确造成了不可逆的光损伤.与24 h连续光照相比,光暗比为1和光暗比为0.5光周期处理组的生长速率均在第二个培养批次中出现最高值,但在第三个培养批次中也表现出一定程度的下降.可见葛仙米在三个光周期的长期连续批次培养下都会或早或晚地表现出生长速率的下降,可能和藻细胞的衰亡有关.
3.2 光周期对葛仙米光合系统活性的影响
从Fv/Fm在第一个培养批次中全部显著下降的趋势来看,光抑制已经在3个光周期处理组中普遍存在.然而Fv/Fm在第二个培养批次结束时全部显著上升,说明光抑制在第二个培养批次中开始得到缓和,葛仙米光合系统应对光抑制的调控机制已经开始发挥作用.24 h光照处理组在第二个批次的培养中光合系统Ⅱ天线色素含量开始出现显著下降,因此认为该处理组的葛仙米为了应对长时间的光照,及时降低了其吸收光能并将能量传递到反应中心的捕光天线色素含量.光暗比为1光周期处理组接受光照的时间是24 h光照处理组的一半,并且由于其具有与光照期相同时长的暗周期进行恢复,因此在第三个批次的培养中,该处理组的光合系统Ⅱ天线色素含量才开始出现显著降低.光暗比为0.5光暗比处理组接受光照的时长最短,其光合系统Ⅱ天线色素含量在三个批次的培养中没有显著的变化,仅在第一个批次的培养中和其他两个处理组一样小幅度的下调了其光合系统Ⅱ天线色素的含量.可见对光合色素含量的调整是藻类植物光合系统中存在的较为普遍的一种重要调控手段,当光能的供应超过了藻类的利用能力时下调捕光色素含量;当光能供应不能满足藻类的利用时则增加捕光色素含量.从光合系统Ⅱ天线色素含量的变化趋势和光照时长来判断,24 h连续光照处理组的光抑制程度最深,但是葛仙米能够通过下调其光合系统Ⅱ天线色素的含量来降低光抑制对光合系统的破坏,从而获得较高的光合作用效率.
4 结论
从长期连续批次培养的结果来看,虽然24 h的连续光照使得葛仙米在第一个培养批次中具有显著的生长优势,但此生长优势在接下来的培养批次中很快受到抑制.尽管葛仙米具有应对光抑制的调控机制,但是24 h光照处理组在第二个和第三个批次生长上的抑制是不可逆的,倘若将24 h连续光照应用于室内生产中,在后期的批次培养中将会出现严重的生物量上的损失.相比之下,光暗比为1和光暗比为0.5光周期下培养的葛仙米,其生长比24 h连续光照培养更具潜力,可见暗周期的运行在葛仙米的生长中发挥着重要作用,本实验结果表明,光暗比为1光周期下葛仙米的生长状态最佳.

