废弃线路板分选尾渣微生物浸出过程中的参数优化
夏明晨,王亚萍,彭堂见,周洪波,刘学端,姜 涛,邱冠周,曾伟民(1. 中南大学 资源加工与生物工程学院,长沙410083;2. 中南大学 生物冶金教育部重点实验室,长沙410083)
废弃线路板分选尾渣微生物浸出过程中的参数优化
夏明晨1, 2,王亚萍1, 2,彭堂见1, 2,周洪波1, 2,刘学端1, 2,姜 涛1, 2,邱冠周1, 2,曾伟民1, 2
(1. 中南大学 资源加工与生物工程学院,长沙410083;2. 中南大学 生物冶金教育部重点实验室,长沙410083)
采用微生物浸出技术,选用4种中度嗜热浸矿菌:嗜铁钩端螺旋菌(Leptospirillum ferriphilum),嗜酸喜温硫杆菌(Acidithiobacillus caldus),嗜热硫氧化硫化杆菌(Sulfobacillus thermosulfidooxidans)和嗜热嗜酸铁质菌(Ferroplasma thermophilum),作为混合菌回收废弃线路板分选尾渣中的金属铜。通过摇瓶浸出实验,研究混合菌在不同浓度分选尾渣中的浸出过程,并探究初始pH、初始Fe2+质量浓度、培养温度及粉末粒径对铜浸出的影响;并将优化条件应用至3L搅拌槽中,实现浸出体系的扩大。结果表明:摇瓶驯化过程中,混合菌种在分选尾渣中的生长情况较好,且能实现金属铜的有效浸出;在优化参数为初始pH 1.5、ρ(Fe2+) 1 g/L、45 ℃条件下的放大实验中,浸出至第7 d时,铜浸出率最高达到93.09%。
微生物浸出;混合菌种;废弃线路板分选尾渣;铜浸出率
随着电子工业的发展,电子设备的更新换代速度加快,使用寿命缩短,使得电子废弃物的数量迅速增加。线路板作为电子产品的重要组成部分,也成为电子废弃物的来源之一[1]。中国大陆每年需要处理的废弃线路板约50万t以上[2]。预计至2016年底,我国产出的线路板将占据全世界46%的产值,成为全球最大的线路板生产基地[3]。
废弃线路板中含有大量可回收的金属,如 Au、Ag、Cu、Fe、Al、Pt等,其品位普遍高于矿石中的金属品位,如金属铜的品位高达 13%以上[4]。同时,废弃线路板中含有Cd和溴化阻燃剂等有毒有害成分,如果处理不当,会对环境及人类健康造成严重危害[5]。因此,如何实现废弃线路板的资源化已成为当今的热点问题。目前,废弃线路板的处理方法有机械处理[6]、火法处理[7]、湿法处理[8]等。但这些方法都存在不同程度的二次污染,且成本较高,能源消耗大。
微生物湿法冶金技术是借助微生物的催化氧化作用,将矿物中的有价金属以离子形式溶解到溶液中,再加以回收利用[9]。该技术具有流程短,成本低、环境友好和低污染等优点,尤其在低品位、复杂难处理矿产资源的开发利用中,显示出强大的优势。目前该技术已应用于电子废弃物的处理中,BRANDL等[10]利用Penicillium simplicissimum与Aspergillus niger两种真菌浸出电子废物中的金属,Cu与Sn浸出率均达到65%,Al、Ni、Pb、Zn的浸出率高达95%以上;周培国等[11]利用氧化亚铁硫杆菌浸出旧电视机主板中的铜,浸出率可达到90%。ZHU等[12]在优化条件下,利用混合嗜酸菌通过两步法浸出废弃线路板金属富集物,45 h后,浸出96.8%Cu;98 h后,浸出88.2%Al、91.6%Zn。BRYAN等[[13]利用黄铁矿作为生物浸出电子废弃物的浸滤剂来源,研究了混合菌在不同金属离子及不同浓度线路板中的浸出情况与群落结构变化;RODRIGUES等[14]在转鼓反应器中利用中度嗜热菌Sulfobacillus thermosulfidooxidans提取粗磨线路板中金属铜,在优化条件下,8 d后铜浸出率达到85%。
由于线路板成分的复杂性与异质性,且微生物对重金属离子的耐受性有限,采用微生物浸出技术直接处理废弃线路板粉末时处理量较低。目前,工业生产中大多采用物理分选(如水力摇床分选)—火法冶金的工艺回收废弃线路板中有价金属,但物理分选后的非金属尾渣中仍含有少量的有价金属,如铜的含量一般为0.5%~2%(质量分数),没有得到有效利用,一般只能作为废弃物堆存,不仅浪费资源,而且对周围环境造成较大的潜在威胁。本文作者以废弃线路板经水力摇床分选后的非金属尾渣为研究对象,拟采用生物湿法冶金技术回收其中的金属铜,旨在降低非金属尾渣中有价金属的含量,为其加工成建筑材料提供预处理工艺,同时提高金属资源回收率,减少“城市矿山”对环境的污染。
1 实验
1.1 废弃线路板分选尾渣的制备
线路板为废弃电脑主板(不含元器件),首先经人工破碎为1 cm×1 cm左右的碎片,然后使用振动磨样机粉碎1.5 min,将粉碎后的线路板粉末经国家标准分析筛筛分,取76~1000 μm粒度的粉末,经水力摇床分选得到含铜金属富集物和非金属尾渣,收集非金属尾渣作为实验材料,同时将部分非金属尾渣过筛(450~1000 μm、150~450 μm、76~150 μm)备用,废弃线路板经中南大学现代分析测试中心ICP-AES分析,得到分选尾渣的金属含量如表1所示。此外,经检测,450~1000 μm尾渣含铜率为4.05%,150~450 μm尾渣含铜率为1.90%,76~150 μm尾渣含铜率为0.89%。

表1 实验用分选尾渣金属含量分析Table 1 Analysis for metal contents of nonmetal slags used in the experiment (mass fraction, %)
1.2 菌种来源与培养
实验中所用的 4种浸矿菌:嗜铁钩端螺旋菌(Leptospirillum ferriphilum)、嗜酸喜 温硫 杆菌(Acidithiobacillus caldus)、嗜热硫氧化硫化杆菌(Sulfobacillus thermosulfidooxidans)和嗜热嗜酸铁质菌(Ferroplasma thermophilum)均取自生物冶金教育部重点实验室。
采用改良后的 9K 液体培养基(2L):3.0 g/L (NH4)2SO4、2.1 g/L Na2SO4、0.5 g/L MgSO4·7H2O、0.05 g/L K2HPO4、0.1 g/L KCl、0.01 g/L Ca(NO3)2,用5 mol/L 的H2SO4调节pH至2.0左右;投加1%的黄铜矿,由于从实验室取得的4种浸矿菌均为纯菌,在浸出过程中的群落结构变化及最佳比例尚未研究,故首先按照1:1:1:1的比例接种,采用搅拌浸出的方式对菌种进行活化。待混合菌种生长至稳定期时,取浸出液,10000 r/min,20 min离心收菌,将离心收集的菌体洗至新鲜的9K培养基(pH为2.0左右)中,为后续实验做准备。
1.3 中度嗜热混合菌在不同浓度分选尾渣中的浸出过程
采用摇瓶浸出方式研究混合菌种在不同浓度分选尾渣中的浸出过程,实验在500 mL锥形瓶中进行。浸出体系组成与条件:200 mL改良的9K液体培养基,接种量5.6×107mL−1菌液,添加44.68 g/L FeSO4·7H2O 和2 g/L单质硫,分选尾渣添加量分别设定为1%、3%、5%;用5 mol/L的H2SO4调节初始pH为2.0,于45 ℃气浴恒温振荡器中培养,转速180 r/min,每天补加一次蒸馏水补充因蒸发损失的水分。
1.4 废弃线路板分选尾渣微生物浸出体系中的参数优化
参数优化过程采用摇瓶浸出方式,在500 mL锥形瓶中进行。探究初始pH、初始Fe2+质量浓度、培养温度及粉末粒径对混合菌种浸出废弃线路板分选尾渣中金属铜的影响。分选尾渣的添加量均为 5%。初始pH分别设定为1.5、2.0、2.5;初始Fe2+质量浓度分别设定为0、1、3、6、9 g/L;培养温度分别设定为35、45、55 ℃;粉末粒径分别设定为450~1000 μm、150~450 μm和76~150 μm。
1.5 搅拌反应器中微生物浸出废弃线路板分选尾渣的研究
参数优化后的生物浸出工艺在3 L搅拌反应器中进行扩大实验。浸出体系组成与条件:2L改良的9K液体培养基,接种量1.3×108mL−1,添加2 g/L单质硫,分选尾渣添加量为5%,浸出体系初始pH、初始Fe2+质量浓度及培养温度均根据参数优化实验结果而定。搅拌速度350 r/min,采用电磁式空气压缩机向体系中通气,每天补加两次蒸馏水。
浸出体系pH与氧化还原电位(Oxidation-reduction potential, ORP)采用PHS−3C型pH计测定;菌浓由血球计数板计数法测定;铜离子浓度采用双环已酮草酰二腙分光光度法测定;Fe2+及总铁浓度由邻菲罗啉分光光度法测定。
2 结果与讨论
2.1 不同浓度分选尾渣的生物浸出过程
微生物浸出废弃线路板中的有价金属主要是通过溶液中的 H+和 Fe3+在酸性体系下的氧化分解作用(如式(1)和(2)所示)。而微生物可通过自养作用将溶液中的Fe2+持续氧化成Fe3+(如式(3)所示),为废弃线路板的分解提供持续的氧化剂。但是随着溶液中废弃线路板和有价金属离子浓度的提高,微生物的生长会受到一定的抑制,主要是由于线路板本身含有的 Pb、Cd等重金属离子对细菌的生长是不利的,而分选尾渣中的大量非金属成分也会对微生物产生一定毒害作用。因此,提高微生物对高浓度废弃线路板的耐受性具有较大的实践意义。

图 1所示为不同浓度分选尾渣的微生物浸出过程。图 1(a)所示为浸出过程中的细菌生长曲线。由图1(a)可见,1%浓度下细菌生长延滞期最短,进入稳定生长期的时间仅为 6 d,最大细胞浓度为 3.20×108mL−1;而当分选尾渣浓度提高至 5%时,细菌生长受到了一定的抑制,在第10 d左右进入稳定期,最大细胞浓度为2.17×108。
图1(b)所示为浸出过程中的体系pH与ORP变化曲线。由图1(b)可见,不同分选尾渣浓度下的体系pH 与ORP变化规律相似。体系pH均呈先上升后下降趋势,5%浓度下的体系pH最终稳定在2.0左右,一方面,由于线路板中含有碱性物质[15],在投加分选尾渣之后体系pH快速升高;Fe2+的氧化也是一个耗酸的过程(如式(3)所示)。而随着Fe3+的累积,开始出现水解,这是一个产酸的过程(如式(4)、(5)和(6)所示)。由于5%分选尾渣浓度下细菌生长相对缓慢,氧化铁与单质硫的能力相对较弱,致使体系pH保持在相对较高的水平。
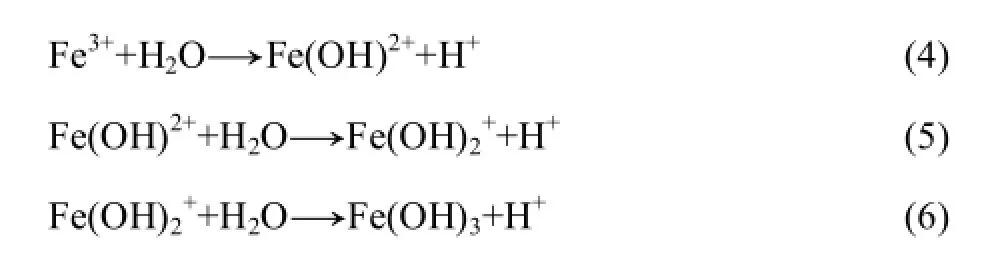
各浓度下的体系ORP均呈现初期缓慢上升、中期快速上升、后期达到稳定的趋势。5%浓度下的 ORP最高达到600 mV。这与混合细菌的氧化作用是密切相关的。在铁氧化细菌的作用下Fe2+的氧化速率加快,并且细菌的快速生长使得Fe3+氧化Cu生成Fe2+的速率低于Fe2+的氧化速率。而硫氧化细菌的产酸作用,对Fe3+氧化Cu生成Fe2+有一定的抑制作用,所以体系ORP最终能保持稳定。而5%浓度下的体系pH相对较高,有利于Fe3+的水解及黄钾铁矾等沉淀的生成(如式(7)所示),使得体系ORP相对较低。

图 1(c)所示为浸出过程中的总铁变化曲线。由图1(c)可看出,不同分选尾渣浓度下的总铁含量均呈下降趋势。1%与3%时的总铁含量变化相接近,在浸出初期,下降较慢,随后快速下降,最终趋于稳定;而5%浓度时的总铁含量下降相对平缓,浸出结束时,溶液中总铁浓度为 1.88 g/L。这都与相应体系下的细菌生长情况及体系pH的变化等是基本一致的。细菌生长处于延滞期时,亚铁的氧化速率较慢,相应的Fe3+水解减慢;随着细菌生长进入对数期,亚铁氧化加快,产生大量Fe3+的同时,也利于黄钾铁矾等沉淀的生成,但随着体系pH值的下降,对黄钾铁矾的生成也会产生一定的抑制作用。
图1(d)所示为浸出过程中的铜浸出率变化曲线。由图1(d)可看出,随着分选尾渣浓度的提高,铜浸出率表现为降低,最高铜浸出率依次为87.05%、78.38%、71.79%。由于添加量的提高,增加了溶液的剪切力不利于微生物生长,也影响溶液中的O2传质。此外,浸出体系中黄钾铁矾等沉淀的生成,没有建立起良好的Fe2+/Fe3+循环,且生成的黄钾铁矾覆盖在浸渣表面,造成钝化作用,阻碍铜的持续浸出[16]。文献[17]中报道,Cu与线路板中其他金属成分的电耦合作用也会影响其浸出。虽然高浓度分选尾渣中的铜浸出率相对较低,但浸出液中Cu2+的浓度却有提高。说明采用微生物浸出技术回收分选尾渣中的金属铜是可行的。
2.2 参数优化过程
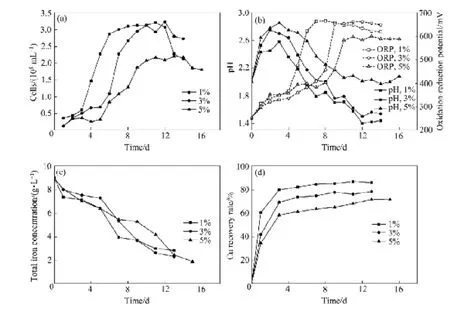
上述研究中,5%分选尾渣浓度下细菌生长受到了一定的抑制,但最终铜浸出率仍能达到70%以上,而为了进一步提高微生物在 5%分选尾渣浓度下的浸出效率,开展了浸出参数(初始pH、初始Fe2+质量浓度、温度和粒径)的优化研究。图2所示为不同初始pH(1.5、2.0、2.5)、不同初始Fe2+质量浓度(0、1、3、6、9 g/L)、不同培养温度(35、45、55 ℃)与不同粉末粒径(450~1000 μm、150~450 μm、76~150 μm)下的最高铜浸出率比较。可见,初始pH 1.5、初始Fe2+质量浓度1 g/L、45 ℃培养条件下的铜浸出效果较好;粉末粒径在450~1000 μm与76~150 μm时铜浸出率均较高。
在不影响微生物活性的前提下,较低的初始 pH有利于抑制Fe3+水解及黄钾铁矾等沉淀生成,维持浸出体系中相对较高的铁离子浓度,这对浸出铜是有利的;初始Fe2+质量浓度提高至3g/L时最高铜浸出率降低,且随后提高Fe2+添加量对铜的浸出影响不大。据文献报道,较低的初始Fe2+浓度时,溶液中的Fe3+在水解之后,没有足够量的Fe3+与Fe(OH)3反应产生复盐沉淀。反之,高Fe2+浓度下易于复盐沉淀的生成,从而影响铜的浸出[18]。可见,适当的Fe2+浓度在浸出铜过程中起着重要作用。此外,本研究中所用的分选尾渣含铜率相较于分选前的线路板材料大大降低,因此,添加较低浓度Fe2+就能实现较高的Cu浸出率是合理的。
由于黄钾铁矾的形成是一个吸热过程,提高温度有利于其形成[19],而实验中检测到 55 ℃培养条件下的总铁下降最快,且观察到大量黄色沉淀物生成并覆盖在分选尾渣表面,严重影响细菌与分选尾渣的接触。而综合实验所用 4种中度嗜热浸矿菌的适宜生长温度,45 ℃培养条件更有利于混合菌的生长[20−22]。
不同粉末粒径下铜浸出率存在差异的原因可能与金属铜在不同粒径粉末中的分布及细菌在不同粒径粉末上的吸附程度不同有关。据文献[23−24]中报道,线路板的破碎程度不同,会使各个粒级中金属解离度与金属分布率有所不同;SILVA等[25]通过半透膜实验研究细菌吸附对线路板中铜浸出的影响,结果表明:阻止细菌吸附在线路板表面比存在细菌吸附时铜浸出率降低了25%。且由于水力摇床分选过程中会有少量金属碎片进入到非金属尾渣中,使得450~1000 μm粒径下铜的浸出相对容易。
2.3 优化条件下的放大实验
将摇瓶浸出实验中得到的优化工艺参数应用于2L搅拌浸出体系中,考虑到分选尾渣中的含铜率较低,在放大实验中不再分粒径浸出。浸出体系初始pH设定为1.5,初始Fe2+质量浓度为1 g/L,添加5%浓度分选尾渣,其他条件如1.5所述。在放大实验开始的第12 h,测定浸出体系pH、ORP、菌浓度、铜离子浓度、亚铁离子及总铁浓度,以后每24 h测定一次。

图2 不同初始pH、初始Fe2+浓度、温度、粒径下的最高铜浸出率比较Fig. 2 Comparison of maximum Cu recovery rate under condition of different parameters: (a) Different initial pH; (b) Different initial Fe2+concentration; (c) Different temperature; (d) Different particle size
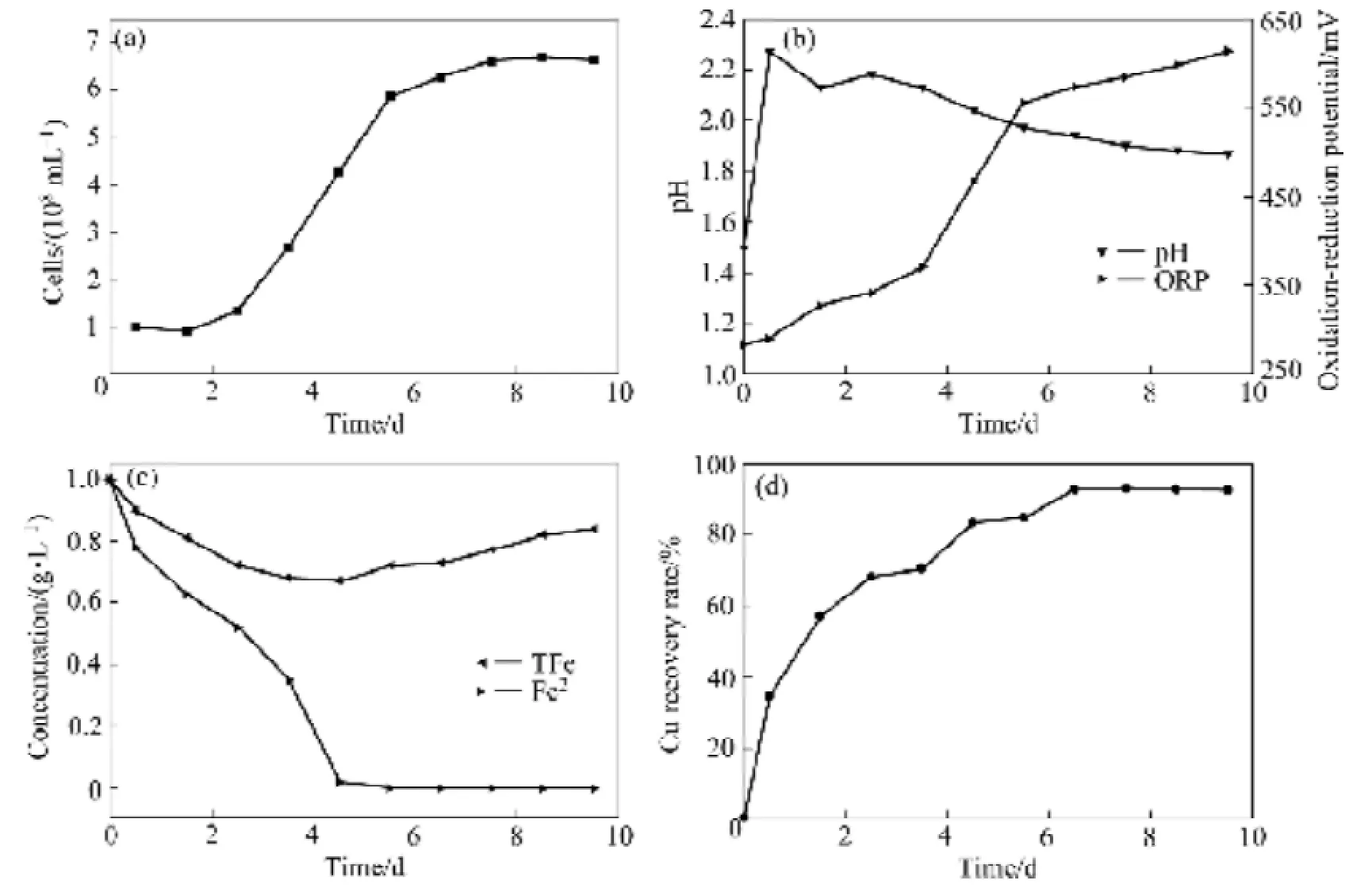
图3 放大实验中的菌浓、体系pH和ORP、亚铁及总铁、铜浸出率的变化Fig. 3 Variation of bacterial concentration, pH, ORP, ferrous iron, total iron and copper recovery rate in amplified experiment
图3(a)所示为放大体系中细菌生长曲线。由图3(a)可见,混合菌在搅拌浸出体系中适应性良好,培养至第3 d时即进入对数生长期,第7 d左右进入稳定期,最高菌浓度达到6.70×108。这与放大体系中的通气及O2传质均优于摇瓶浸出有一定关系[26]。
图3(b)所示为放大体系中pH与ORP变化曲线。由图3(b)可见,体系pH与ORP基本呈相反的变化趋势,第3 d至第5 d分别是体系pH下降与ORP上升较快的阶段,这与此阶段细菌处于对数生长期基本一致,停止浸出时体系pH稳定在1.88左右,体系ORP达到613 mV。
图 3(c)所示为放大体系中亚铁离子及总铁浓度变化曲线。由图3(c)可见,亚铁离子浓度呈快速下降趋势,在第5 d时,全部被氧化,表明铁氧化细菌的活性较好。在浸出前5 d时,总铁浓度都为下降趋势,之后缓慢上升。分析前5 d浸出体系中Fe3+较多,且pH相对较高,容易出现Fe3+水解及沉淀生成;之后体系pH降低,对Fe3+的水解及沉淀生产有一定的抑制作用,且分选尾渣中含有的少量单质铁也可直接由酸溶解。
图3(d)所示为放大体系中铜浸出率变化曲线。由图 3(d)可见,铜浸出率在第 7 d时达到最大(为93.09%)。但仍有一部分铜尚未浸出。
对浸出结束后的分选尾渣进行 XRD分析,得到XRD谱见图4。检测结果显示,浸渣中主要含两种物相:60.8%(质量分数)Ba(SO4)与 39.2%(质量分数)KFe3(SO4)2(OH)6,由表1可知,废弃线路板分选尾渣中含有一定量的元素Ba,因此,检测到Ba(SO4)沉淀是合理的;而浸出过程中总铁浓度有减少趋势,同时体系pH>2有利于黄钾铁矾的生成。两种沉淀物质覆盖在尾渣表面,在一定程度上阻碍了铜的持续浸出。

图4 浸出尾渣的XRD谱Fig. 4 XRD patterns of slags leached
3 结论
1) 对经过水力摇床分选后的废弃线路板尾渣进行微生物浸出研究发现,微生物在 5%分选尾渣浓度下依然具有较高的浸出水平,通过参数优化后(初始pH 1.5,初始Fe2+质量浓度1 g/L,培养温度45 ℃),在搅拌浸出体系中微生物浸出7 d时铜的浸出率可以达到93.09%。
2) XRD谱显示,浸出尾渣中含有硫酸钡与黄钾铁矾两种沉淀物,在一定程度上阻碍了铜的持续浸出。为了进一步提高分选尾渣的浸出浓度,后续将对浸矿菌的协同作用机制、分选尾渣的毒性影响、分选尾渣−微生物的界面作用行为等方面开展研究,旨在提高微生物在高浓度分选尾渣下的浸出效率,为废弃线路板高效利用提供一条绿色可行的道路。
REFERENCES
[1] 张文治, 谢武明, 刘敬勇, 孙水裕, 曾锡辉, 钟 胜. 废弃电子线路板资源化方法评述[J].再生资源与循环经济, 2014, 7(6): 33−37. ZHANG Wen-zhi, XIE Wu-ming, LIU Jing-yong, SUN Shui-yu,ZENG Xi-hui, ZHONG Sheng. Review on recycling method of waste printed circuit boards[J]. Renewable Resources and Recycling Economy, 2014, 7(6): 33−37.
[2] 赵良庆, 潘利祥, 李朝晖, 张智海, 吴 轩, 史利芳, 李 冬. 废PCB处理技术探讨[J]. 环境工程, 2014, 32(S1): 753−757. ZHAO Liang-qing, PAN Li-xiang, LI Zhao-hui, ZHANG Zhi-hai,WU Xuan, SHI Li-fang, LI Dong. Review on treatment technology of waste PCB[J]. Environmental Engineering, 2014,32(S1): 753−757.
[3] 唐德文, 邹树梁, 刘衣昌, 刘益强. 废弃电路板回收技术与方法研究进展[J]. 南华大学学报(自然科学版), 2014, 28(1): 46−53. TANG De-wen, ZOU Shu-liang, LIU Yi-chang, LIU Yi-qiang. Research development of printed circuit board recycling technologies and methods[J]. Journal of University of South China (Science and Technology), 2014, 28(1): 46−53.
[4] 曾伟民, 朱海珍, 叶子婕, 夏明晨, 喻子凌, 王新天. 生物湿法冶金技术回收废弃线路板中有价金属的研究进展[J]. 有色金属科学与工程, 2013, 4(1): 26−30. ZENG Wei-min, ZHU Hai-zhen, YE Zi-jie, XIA Ming-chen, YU Zi-ling, WANG Xin-tian. Review on recovering precious metals from wasted circuit board by bio-hydrometallurgy technology[J]. Nonferrous Metals Science and Engineering, 2013, 4(1): 26−30.
[5] 刘维桥, 尚通明, 雷卫宁, 周全法. 废弃印刷线路板资源化与无害化处理研究进展[J]. 环境科学与技术, 2011, 34(4): 48−54. LIU Wei-qiao, SHANG Tong-ming, LEI Wei-ning, ZHOU Quan-fa. Progress in study of recycling and innocuous treatment of waste printed circuit boards[J]. Environmental Science & Technology, 2011, 34(4): 48−54.
[6] 温雪峰, 李金惠, 朱雪梅, 朱芬芬, 邹 亮. 我国废弃电路板资源化现状及其对策[J]. 矿冶, 2005, 14(1): 66−69. WEN Xue-feng, LI Jin-hui, ZHU Xue-mei, ZHU Fen-fen, ZOU Liang. Reutilization status of waste printed circuit boards and corresponding countermeasures in China[J]. Mining & Metallurgy, 2005, 14(1): 66−69.
[7] 刘 旸, 刘静欣, 郭学益. 电子废弃物处理技术研究进展[J].金属材料与冶金工程, 2014, 42(2): 44−49. LIU Yang, LIU Jing-xin, GUO Xue-yi. Progress of electronic waste treatment[J]. Metal Materials and Metallurgy Engineering,2014, 42(2): 44−49.
[8] 谭之海, 何亚群, 周国平, 伍玲玲, 周春侠. 废弃线路板资源化研究现状[J]. 中国资源综合利用, 2011, 29(4): 24−26. TAN Zhi-hai, HE Ya-qun, ZHOU Guo-ping, WU Ling-ling,ZHOU Chun-xia. The development of the reutilization of waste printed circuit boards[J]. China Resources Comprehensive Utilization, 2011, 29(4): 24−26.
[9] 李晶莹, 徐秀丽. 电子废弃物中生物冶金技术的研究进展[J].黄金科学技术, 2010, 18(6): 58−62. LI Jing-ying, XU Xiu-li. Research progress of biological metallurgical technology from the electric and electronic Wastes[J]. Gold Science & Technology, 2010, 18(6): 58−62.
[10] BRANDL H, BOSSHARD R, WEGMANN M. Computermunching microbes: metal leaching from electronic scrap by bacteria and fungi[J]. Hydrometallurgy, 2001, 59: 319−326.
[11] 周培国, 郑 正, 彭晓成, 王艳锦, 王先鹏. 氧化亚铁硫杆菌浸出线路板中铜及过程中铁的变化研究[J]. 环境污染与防治,2007, 29(2): 119−122. ZHOU Pei-guo, ZHENG Zheng, PENG Xiao-cheng, WANG Yan-jin, WANG Xian-peng. Leaching of copper from printed circuit board by Thiobacillus ferrooxidans[J]. Environmental Pollution & Control, 2007, 29(2): 119−122.
[12] ZHU Neng-wu, XIANG Yun, ZHANG Ting, WU Ping-xiao,DANG Zhi, LI Ping, WU Jin-hua. Bioleaching of metal concentrates of waste printed circuit boards by mixed culture of acidophilic bacteria[J]. Journal of Hazardous Materials, 2011,192(2): 614−619.
[13] BRYAN C G, WATKIN E L, MCCREDDEN T J, WONG Z R,HARRISON S T L, KAKSONEN A H. The use of pyrite as a source of lixiviant in the bioleaching of electronic waste[J]. Hydrometallurgy, 2015, 152: 33−43.
[14] RODRIGUES M L M, LEAO V A, GOMES O, LAMBERT F,BASTIN D, GAYDARDZHIEV S. Copper extraction from coarsely ground printed circuit boards using moderate thermophilic bacteria in a rotating-drum reactor[J]. Waste Management, 2015, 41: 148−158.
[15] YANG Tao, XU Zheng, WEN Jian-kang, YANG Li-mei. Factors influencing bioleaching copper from waste printed circuit boards by Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2009,97(1/2): 29−32.
[16] YANG Yuan-kun, CHEN Shu, LI Shi-chen, CHEN Meng-jun, CHEN Hai-yan, LIU Bi-jun. Bioleaching waste printed circuit boards by Acidithiobacillus ferrooxidans and its kinetics aspect.[J]. Journal of Biotechnology, 2014, 173(6): 24−30.
[17] HONG Y, VALIX M. Bioleaching of electronic waste using acidophilic sulfur oxidising bacteria[J]. Journal of Cleaner Production, 2014, 65(4): 465−472.
[18] 周培国, 郑 正, 张齐生, 彭晓成. 不同初始条件对细菌浸出电子线路板中铜的影响[J]. 湿法冶金, 2010, 29(3): 191−194. ZHOU Pei-guo, ZHENG Zheng, ZHANG Qi-sheng, PENG Xiao-cheng. Leaching of copper by bacteria from printed circuit board at various initial conditions[J]. Hydrometallurgy of China, 2010, 29(3): 191−194.
[19] 王长秋, 马生凤, 鲁安怀, 周建工. 黄钾铁矾的形成条件研究及其环境意义[J]. 岩石矿物学杂志, 2005, 24(6): 607−611. WANG Chang-qiu, MA Sheng-feng, LU An-huai, ZHOU Jian-gong. The formation conditions of jarosite and its environmental significance[J]. Acta Petrologica et Mineralogica, 2005, 24(6): 607−611.
[20] 余润兰, 石丽娟, 周 丹, 邱冠周, 曾伟民. 生物浸出过程中微生物协同作用机制的研究进展[J]. 中国有色金属学报,2013, 23(10): 3006−3014. YU Run-lan, SHI Li-juan, ZHOU Dan, QIU Guan-zhou, ZENG Wei-min. Research development of microorganism synergy mechanisms during bioleaching[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 3006−3014.
[21] 黄海炼, 黄明清, 刘伟芳, 尹升华, 肖云涛. 生物冶金中浸矿
微生物的研究现状[J]. 湿法冶金, 2011, 30(3): 184−189.
HUANG Hai-lian, HUANG Ming-qing, LIU Wei-fang, YIN
Sheng-hua, XIAO Yun-tao. Current status of microorganisms in
biohydrometallurgy[J]. Hydrometallurgy of China, 2011, 30(3):
184−189.
[22] 周洪波, 彭娟花, 张瑞永, 陈 晨, 张汝兵, 顾帼华, 邱冠周.嗜中高温嗜酸古菌 Ferroplasma thermophilum的培养条件优化[J]. 生物工程学报, 2008, 24(6): 1040−1045. ZHOU Hong-bo, PENG Juan-hua, ZHANG Rui-yong, CHEN Chen, ZHANG Ru-bing, GU Guo-hua, QIU Guan-zhou. Optimization of culture condition of a moderately thermophilic acidophilic Ferroplasma thermophilum[J]. Chinese Journal of Biotechnology, 2008, 24(6): 1040−1045.
[23] 温雪峰, 李金惠, 邹 亮, 胡利晓, 朱芬芬, 赵卫凤. 废印刷线路板的常温粉碎特性研究[J]. 矿冶, 2005, 14(4): 57−61. WEN Xue-feng, LI Jin-hui, ZOU Liang, HU Li-xiao, ZHU Fen-fen, ZHAO Wei-feng. Study on comminution performance of waste printed wiring boards at ambient temperature[J].Mining & Metallurgy, 2005, 14(4): 57−61.
[24] 任彦斌, 夏志东, 雷永平, 史耀武. 废弃印刷线路板的粉碎与分离研究[J]. 有色金属再生与利用, 2004(10): 15−17. REN Yan-bin, XIA Zhi-dong, LEI Yong-ping, SHI Yao-wu. Study on comminution and separation of waste printed wiring boards[J]. Non-ferrous Metals Recycling and Utilization, 2004(10): 15−17.
[25] SILVA R A, PARK J, LEE E, PARK J, CHOI S Q, KIM H. Influence of bacterial adhesion on copper extraction from printed circuit boards[J]. Separation & Purification Technology, 2015, 143: 169−176.
[26] KARWOWSKA E, ANDRZEJEWSKA-MORZUCH D, LEBKOWSKA M, TABERNACKA A, WOJTKOWSKA M, TELEPKO A, KONARZEWSKA A. Bioleaching of metals from printed circuit boards supported with surfactant-producing bacteria[J]. Journal of Hazardous Materials, 2014, 264(2): 203−210.
(编辑 李艳红)
Parameter optimization during micro-bioleaching slags separated from waste printed circuit boards
XIA Ming-chen1, 2, WANG Ya-ping1, 2, PENG Tang-jian1, 2, ZHOU Hong-bo1, 2, LIU Xue-duan1, 2,JIANG Tao1, 2, QIU Guan-zhou1, 2, ZENG Wei-min1, 2
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China)
According to micro-bioleaching technology, four moderately thermoacidphilic strains, i.e., Leptospirillum ferriphilum, Acidithiobacillus caldus, Sulfobacillus thermosulfidooxidans and Ferroplasma thermophilum, were used as mixed culture to recover copper from nonmetal slags, which was separated from waste printed circuit boards(WPCBs) by water power shaker. Firstly, the bioleaching experiments with different concentration of nonmetal slags in shake flasks were carried out. Then, the effects of initial pH, initial Fe2+concentration, incubation temperature and particle size on the bioleaching were investigated. Finally, under the optimized conditions, the bioleaching experiment was conducted in a stirred tank with volume of 3L to achieve system amplified. The results show that the growth of mixed culture is good in the existence of nonmetal slags. Besides, under the conditions of initial pH 1.5, initial ρ(Fe2+) 1 g/L and 45 ℃, 93.09% copper recovery is achieved in 7 d in the amplified system.
micro-bioleaching; mixed culture; waste printed circuit boards separated slags; copper recovery
Projects(31200382, 31470230, 51320105006) supported by the National Natural Science Foundation of China (NSFC); Projects(2013M540643, 2014T70791) supported by the China Postdoctoral Science Foundation; Project(2013FJ4068) supported by the Planned Science and Technology Project of Hunan Province, China
date: 2015-08-11; Accepted date: 2015-11-20
ZENG Wei-min; Tel: +86-731-88836045; E-mail: zengweimin1024@sina.com
Q939
A
1004-0609(2016)-04-0928-08
国家自然科学基金资助项目(31200382,31470230,51320105006);中国博士后科学基金资助项目(2013M540643,2014T70791);湖南省科技计划项目(2013FJ4068)
2015-08-11;
2015-11-20
曾伟民,副教授,博士;电话:0731-88836045;E-mail: zengweimin1024@sina.com

