不同镉浓度处理下水稻植株镉含量变化及其镉调控相关基因表达分析
周全 王宏 张迎信 董青 孟帅 曹立勇 邵国胜 沈希宏
(中国水稻研究所, 杭州 310006; *通讯联系人, E-mail: shaoguosheng@caas.cn; xihongshen@126.com)
不同镉浓度处理下水稻植株镉含量变化及其镉调控相关基因表达分析
周全王宏张迎信董青孟帅曹立勇邵国胜*沈希宏*
(中国水稻研究所, 杭州 310006;*通讯联系人,E-mail:shaoguosheng@caas.cn;xihongshen@126.com)
ZHOUQuan,WANGHong,ZHANGYingxin,etal.Changesincadmiumconcentrationinriceplantsunderdifferentcadmiumlevelsandexpressionanalysisofgenesretatedtocadmiumregulation.ChinJRiceSci, 2016, 30(4): 380-388.
周全, 王宏, 张迎信, 等. 不同镉浓度处理下水稻植株镉含量变化及其镉调控相关基因表达分析. 中国水稻科学, 2016, 30(4): 380-388.
摘要:以地上部镉含量不同的籼稻和粳稻品种各6个为材料,采用水培试验,设置6个镉浓度,研究了不同浓度镉处理对不同水稻品种植株生长、镉含量和相关重金属转运蛋白基因表达水平的影响。结果表明,镉胁迫对水稻生长有抑制作用,表现为苗高、地上部干物质量和叶绿素含量下降。在不同镉浓度处理下,植株根部和地上部的镉含量存在显著的基因型差异,植株中镉从根部向地上部的转运可能是水稻品种间以及籼粳亚种间地上部镉含量差异的主要原因,根部镉的吸收量影响较小。在0.50到2.00 mg/kg的高镉处理梯度间,部分水稻品种地上部出现镉积累饱和现象(镉含量增加较少,部分水稻品种地上部镉含量甚至显著降低);在此镉浓度处理下,OsNRMAP1、OsIRT2和OsNAS2的表达水平显著上调,这可能与植株对镉的吸收调节作用相关。
关键词:水稻; 镉; 基因型; 植株生长; 基因表达
镉(Cd)作为有毒重金属,主要通过食物链进入人体,对人类的健康产生危害。镉在农田土壤中的污染,通常是由成土母质镉含量高、污水灌溉、污泥农用、含镉磷肥和含镉农药的施用引起的[1-3]。近年来,我国南方由于农田重金属镉污染或成土母质高镉等因素,多省份发生了严重稻米镉污染事件,如何控制稻米镉污染已是十分迫切需要解决的问题[4]。
研究和生产实践均已表明,水稻对镉的吸收与积累存在明显的基因型差异[5-7],同时这些差异也与土壤重金属污染程度、气候环境和土壤环境密切相关。比如,据调查,浙江省一些水稻品种籽粒镉含量为0.1~0.4mg/kg[8]。He等[9]研究发现,在参试的38个中国长江下游地区的水稻品种中,糙米镉含量为0.06~0.99mg/kg;Liu等[10]对来自不同区域的52个水稻品种的镉积累特性进行了比较,发现其稻米镉含量为0.22~2.86mg/kg。镉主要通过根系细胞膜的二价金属转运蛋白而被水稻吸收,从而进入植株体内。OsNRAMP家族蛋白(如OsNRAMP1、OsNRAMP5)[11,14]、ZIP家族转运蛋白(如OsIRT1、OsIRT2)[15]、OsHMA2[16-17]等均具有很强的镉转运功能。而OsHMA3位于液泡膜上,可将胞质中的镉泵入液泡,不仅对根系镉向地上部的转运具有调控作用,而且对植株的镉耐性具有重要作用[18];OsLCT1则参与植株节点韧皮部的镉运输,对籽粒镉积累具有重要的调控作用[19,20]。
二价金属离子如Fe2+、Mn2+、Zn2+等对植株镉吸收与转运都具有调控作用。这种调控作用主要表现在两个方面,一是通过调控具有镉转运作用的转运蛋白基因的表达水平,进而调控镉吸收和转运能力;二是这些金属离子对Cd2+的吸收与转运过程产生竞争作用。邵国胜等[21]发现铁处理浓度上升可显著降低水稻植株的镉积累,这主要是因为铁浓度上升降低了水稻根系镉吸收能力,从而导致根系和地上部镉含量均大幅降低。脱氧麦根酸(MAs)对三价铁具有螯合作用,参与根系铁的吸收等过程。Cheng等[22]发现,脱氧麦根酸前体尼克酰胺氨基转移酶基因(NAAT)发生突变直接影响脱氧麦根酸的合成,抑制水稻根系对铁的吸收,导致植株产生缺铁现象;而缺铁会诱导根系金属离子吸收相关基因表达水平的提高,进而促进镉的吸收。同时也有研究发现,脱氧麦根酸处理有利于抑制根系的镉吸收。OsNAS2作为脱氧麦根酸前体合成中的一个重要酶,也参与了铁吸收与转运的调控[23]。
大量研究表明,随着镉浓度的提高,水稻植株镉吸收和积累量也随之增加[24-26]。然而我们前期的研究表明,在一定镉浓度下,植株镉吸收和积累水平确实随着镉浓度的提高而增加,但进一步提高镉浓度,不论是根系还是地上部的镉浓度却出现了下降趋势。本研究选用了前期已经验证稻草(不含籽粒)镉含量差异显著的籼稻和粳稻材料各6份进行了多水平镉梯度处理,以进一步验证此现象并初步从镉转运相关基因表达水平上对此加以解析。
1材料与方法
1.1材料与处理
前期水培苗期水稻(镉浓度为1.00mg/kg),筛选出地上部Cd含量高(日本晴、鄂宜105)、中(武运粳7号、嘉45)、低(丙814、矮辐粳)水平共6个粳稻品种和地上部Cd含量高(台中1号、粳籼89)、中(万利籼、辐品36)、低(9311、舟903)水平共6个籼稻品种作为本研究供试材料。
2015年6月在杭州市富阳区中国水稻研究所试验基地,将12个供试材料的种子浸泡在10%的H2O2溶液中消毒30min,再用去离子水冲洗干净。浸种催芽后播于经稀硫酸处理的沙床,15d后移植至装有营养液的黑色不透明塑料桶中,塑料桶容积为4.5L,每桶种7穴,每穴3株,用树脂塑料板分隔各穴,海绵固定(营养液按照国际水稻研究所的配方配制)。预培养14d后进行Cd胁迫处理,共设0.00,0.01,0.10,0.50,1.00和2.00mg/kg6个Cd处理,每个处理重复3次,以CdSO4为Cd源,培养液每3d更换1次,并用HCl和NaOH调节pH至5.0。
于Cd处理15d后测定各个品种不同处理下植株的叶绿素含量(SPAD法)和苗高,其中,叶绿素含量的测定样本量为9,苗高样本量为12。对植株取样,一部分用于根部和地上部重金属Cd、Mn、Cu、Zn、Fe含量的测定;另一部分取根部保存于-80℃下,用于重金属转运蛋白相关基因的表达分析。
1.2重金属含量测定及重金属转运系数
植株根系用0.1mol/L的盐酸短暂浸洗后,用蒸馏水冲洗2次以去除根表面附着元素。而后将植株分为根部和地上部两部分,于105℃下杀青1h,并于70℃下烘干至恒重,称取根部和地上部干物质量。粉碎成粉后经HNO3-H2O2消煮,利用全谱直读电感耦合等离子发射光谱仪(ICP-AES)测定Cd,Mn,Cu,Zn,Fe含量。
Zhou等[1]用重金属转运系数(TF)来判定不同水稻品种重金属积累和转运的能力,本研究以茎叶重金属含量与根部重金属含量之比来衡量不同水稻品种重金属Cd由根向地上部转运能力(TFrs)。
1.3水稻重金属转运蛋白基因表达分析
水稻根系总RNA采用天根RNAprepPure植物总RNA提取试剂盒提取,用TOYOBO定量反转录试剂盒逆转录为cDNA。实时定量PCR体系按照TaKaRa的SYBRPremixExTaqTMⅡ定量试剂盒的要求配制,并用LightCycler480 定量PCR仪(Roche)进行分析,反应步骤如下:95℃下预变性30s; 95℃下变性5s,57℃下退火30s,72℃下延伸30s,共40个循环;熔解曲线分析, 95℃下5s,60℃下1min,95℃下 0s; 50℃下降温30s。以OsActin基因作为内参基因,采用2-△△Ct法估算各个Cd处理下根系样品中重金属转运蛋白基因的表达水平。所用基因引物均能单扩增其各自的基因,且熔解曲线均为单峰,引物序列见表1。其中,OsIRT2,OsNAS2和OsZIP4引物序列参照Lee等[27]的研究。
表1内参及重金属转运蛋白基因引物序列
Table1.Sequencesoftheprimersofreferenceandheavymetaltransportergenes.

基因Gene正向引物序列Sequenceofforwardprimer(5'-3')反向引物序列Sequenceofreverseprimer(5'-3')OsActinCAGGCCGTCCTCTCTCTGTAAAGGATAGCATGGGGGAGAGOsHMA2CGCCATCTCCCAATCCCAAATTTCTCACTGCCGTTCCCATAAOsHMA3GGGTGGAGATGTTCTTGAATCACTTGGCCATTGGGTGGCTTGACTTGCTCTOsNramp1GGAAACTGGAGGTTGTGGTCTTTGCTGATGCGGGTGTATTOsNramp5AGCAGTAAGAGCAAGATGGGGCTTGGGGAGGTCGTTGTGGATGAOsIRT2TGCATGATGTATAGGTGAAGGTGCGGCAGAAGCTGGTCTTTATTAOsNAS2CGTCTGAGTGCGTGCATAGTAGAAGCACAAACACAAACCGATAOsZIP4GCGAAAGCAACAGTGATCATGGCGACTTTCGCAGCTCTTGGTTGCTCTGAAGATCTCATG
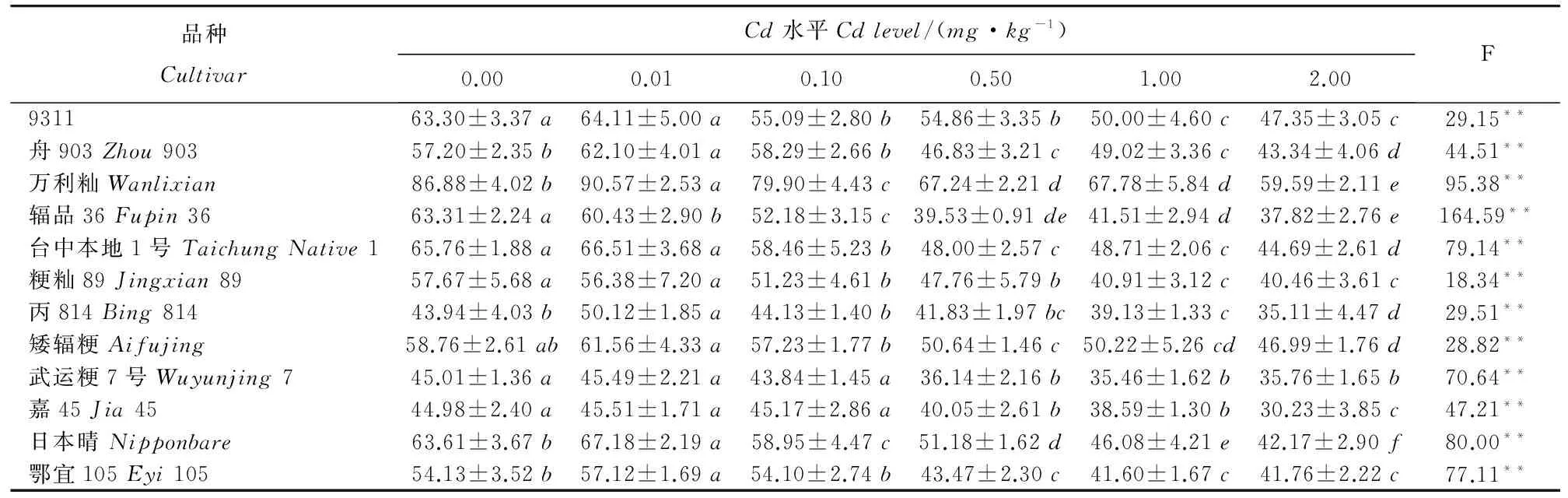
表2不同Cd浓度处理对12个水稻品种苗高的影响(平均数±标准差)
Table2.EffectsofdifferentCdlevelsonplantheightof12ricecultivars(Mean±SD).
cm
*P<0.05;**P<0.01。不同小写字母表示处理间在0.05水平上差异显著(新复极差法,n=9)。
*P<0.05;**P<0.01.Differentlowercaselettersindicatesignificantdifferenceamongtreatmentsat0.05levelbySSR(n=9).
1.4数据分析
采用Excel进行数据统计,用SPSS19.0软件进行方差分析,Duncan新复极差法检验处理间差异。
2结果与分析
2.1Cd胁迫对水稻生长的影响
0.01mg/kg低Cd水平促进了10个水稻品种的生长(表2)。其中,5个品种与对照相比差异显著;随着Cd处理浓度的提高,Cd处理对水稻生长表现为抑制作用。在0.10mg/kgCd处理下时,有10个品种苗高已经显著下降;当Cd处理≥0.50mg/kg时,12个水稻品种苗高均显著下降。
Cd处理对植株地上部干物质量的影响与苗高相似。由图1可见,在0.01mg/kg低Cd处理下,大部分品种的地上部干物质量均有所增加。不同水稻品种的干物质量受Cd处理浓度的影响程度不同,如日本晴和舟903在0.01、0.10、0.50mg/kg镉处理下与对照相比干物质量变化不大,而9311和台中本地1号的干物质量随Cd处理浓度的变化波动较大。
在0.01和0.10mg/kgCd处理下,除9311和日本晴外,其余10个水稻品种的叶绿素含量与对照相比,无显著差异。在2.00mg/kgCd处理下,12个水稻品种植株叶片叶绿素含量与对照相比均显著下降(表3),但降幅不如苗高明显(6.62%~11.83%)。
表3不同Cd浓度处理对12个水稻品种叶片叶绿素含量(SPAD值)的影响(平均数±标准差)
Table3.EffectsofdifferentCdlevelsonchlorophyllcontent(SPADvalue)inleavesof12ricecultivars(Mean±SD).
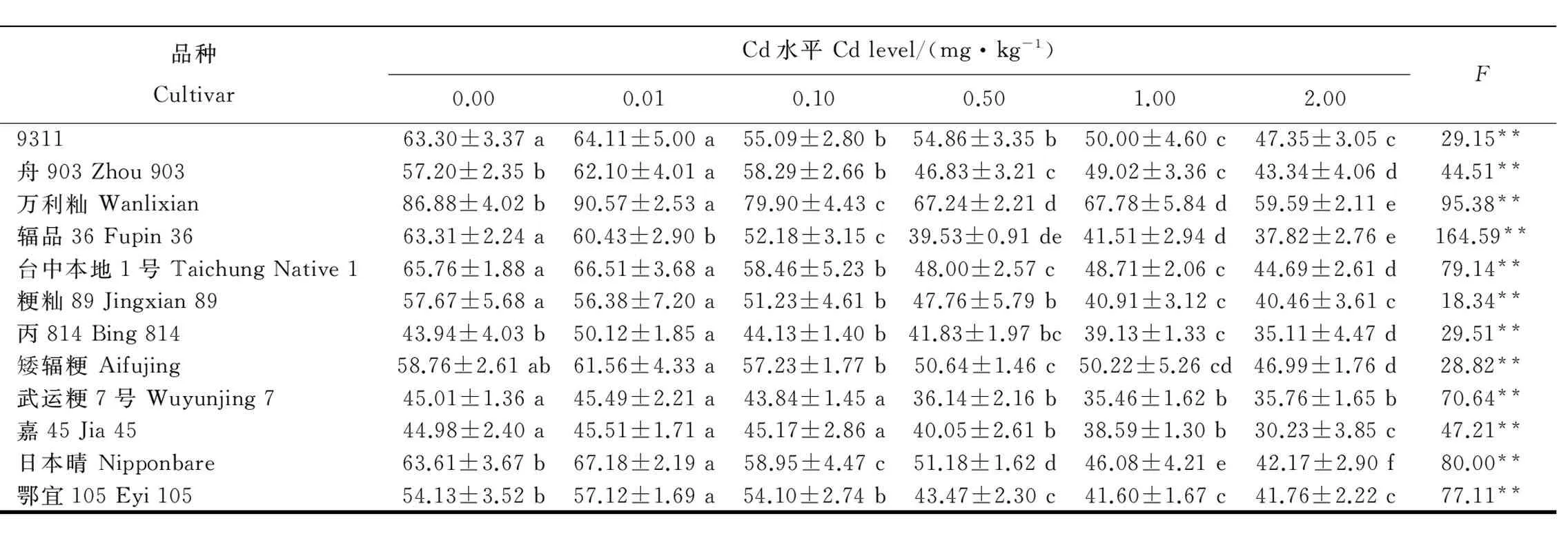
品种CultivarCd水平Cdlevel/(mg·kg-1)0.000.010.100.501.002.00F931143.66±3.67a41.93±4.04ab39.75±3.05bc39.46±2.31bc38.97±2.01c38.49±3.46c4.75**舟903Zhou90340.48±1.83a38.92±1.29a39.59±2.10ab39.01±1.64ab37.38±2.82b37.35±2.33b4.32**万利籼Wanlixian38.39±2.43a38.79±3.95a37.15±2.32ab36.81±2.39ab35.36±3.36b34.90±4.30b2.83*辐品36 Fupin3638.17±1.40a36.48±1.51abc37.72±4.06ab37.54±2.48ab35.63±2.81bc35.18±2.13c2.69*台中本地1号TaichungNative141.84±1.86a41.24±5.15ab39.33±3.46ab38.03±2.54c39.68±2.83ab38.68±2.58bc2.49*粳籼89Jingxian8938.98±3.15a38.48±3.50a38.68±2.33a36.58±3.07ab34.86±1.20b34.50±3.13b5.94**丙814Bing81441.32±1.23a39.47±2.63ab39.95±1.59ab38.49±1.43b39.55±1.99ab38.01±4.06b2.90*矮辐粳Aifujing44.42±1.46a43.73±1.82ab43.63±2.04ab41.78±2.74bc41.80±2.50bc41.01±3.07bc4.12**武运粳7号Wuyunjing741.24±1.78a40.91±2.42a40.49±2.22a38.13±2.67b37.93±2.90b36.76±2.74b6.80**嘉45Jia4540.65±1.89a41.79±2.53a40.22±1.72a37.88±2.56b37.63±3.06b36.15±3.18b8.58**日本晴Nipponbare41.83±1.82a41.08±3.28ab39.56±1.55bc40.60±2.01ab40.08±0.90ab38.20±2.14c4.44**鄂宜105Eyi10540.05±1.91a40.76±1.60a39.64±2.20a37.80±2.10b37.11±2.23b37.40±2.19b6.81**
*P<0.05;**P<0.01。不同小写字母表示处理间在0.05水平上差异显著(新复极差法,n=12)。
*P<0.05,**P<0.01.Differentlowercaselettersindicatesignificantdifferenceamongtreatmentsat0.05levelbySSR(n=12).
总体上看,0.01mg/kg的低浓度Cd处理对水稻生长有一定的促进作用,表现为苗高增长、干物质量增大,对叶绿素含量影响不大;而0.10mg/kg以上的高浓度Cd处理对水稻生长表现出抑制作用,表现为苗高降低、干物质量减少,并且当Cd处理浓度达到2.00mg/kg时,叶绿素含量均显著下降。
2.2植株Cd含量
12个品种根部与地上部Cd含量的测定与前期筛选的结果相似。从不同浓度Cd处理结果来看,在镉浓度为0.00到0.50mg/kg范围内,12个水稻品种地上部和根部Cd含量都随着Cd浓度的提高而显著增加(图2)。然而,在高浓度Cd处理(0.50~2.00mg/kg)下,12个水稻品种植株地上部或者根部Cd含量增加较少甚至显著降低。12个水稻品种间植株地上部Cd浓度存在显著差异,而这种差异不仅与根部Cd浓度相关,还与Cd从根部到地上部的转运速率相关。从表4可以看出,不同水稻品种茎叶中Cd含量与根系镉含量之比(TFrs)存在显著的品种间差异。分析发现,在0.50、1.00和2.00mg/kgCd处理下籼粳亚种间Cd的TFrs差异显著(P<0.05),整体上粳稻Cd的TFrs较小。
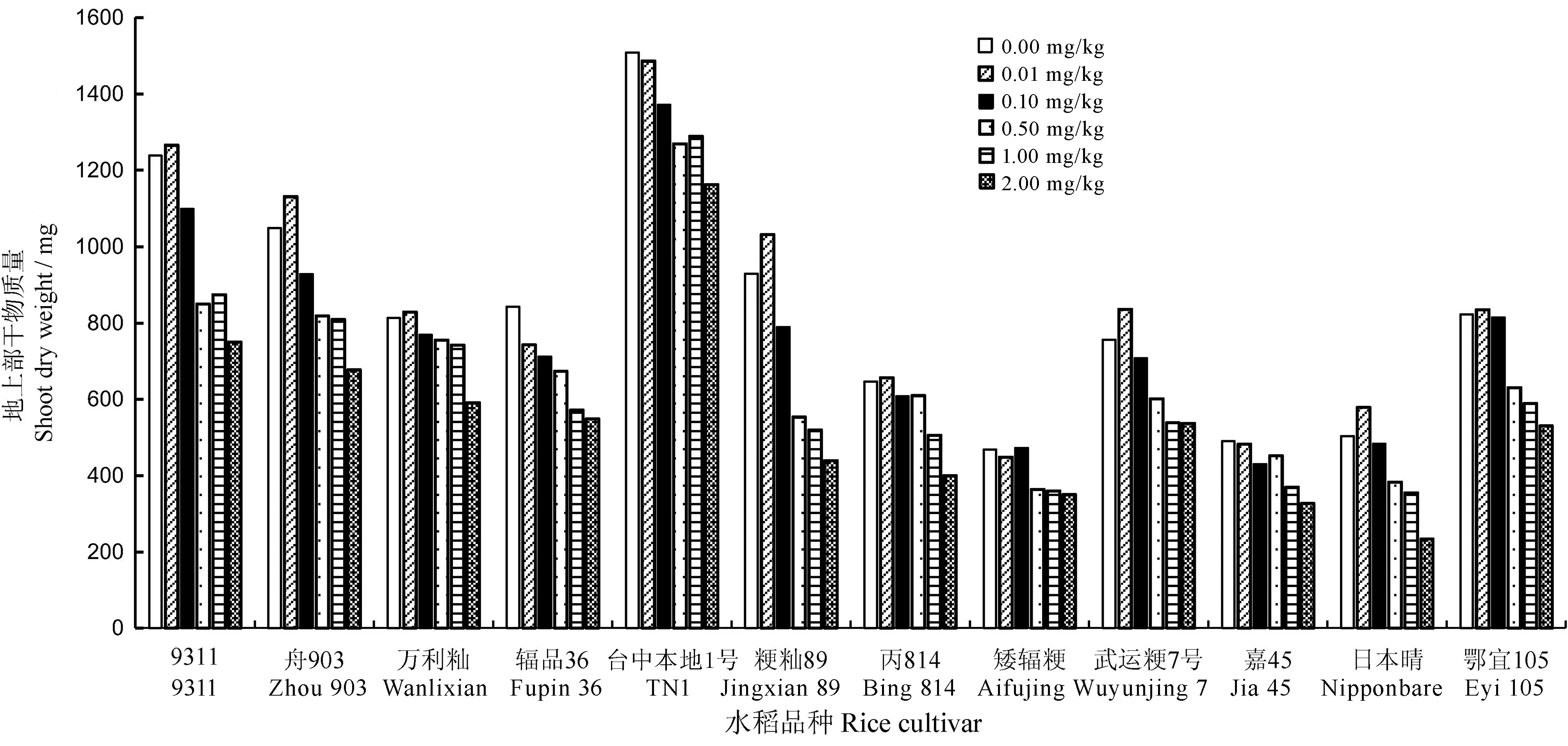
图1不同Cd浓度处理对12个水稻品种地上部干物质量的影响
Fig. 1.EffectsofdifferentCdlevelsonshootdryweightof12ricecultivars.
2.3Cd积累相关转运蛋白基因表达分析
选取了12个代表性的水稻品种对7个镉积累相关的重金属转运蛋白基因在苗期水培Cd梯度处理下的表达特征进行了分析(图3)。其中OsNRAM1、OsNRAMP5、OsIRT2和OsZIP4参与水稻根系Cd、Fe、Mn、Zn的吸收; OsHMA2参与Cd和Zn从根部向地上部的转运,OsHMA3通过将Cd区隔化在液泡中减少Cd向地上部的转运;而OsNAS2主要参与植株体内Fe和其他金属的平衡。结果发现OsNRAMP1、OsIRT2和OsNAS2这3个基因在对照以及0.01和0.10mg/kg的低Cd处理下表达量变化不显著且表达量很低,但是在高Cd处理(0.50~2.00mg/kg)下被大量诱导表达,并且不同品种间表达水平存在显著差异。与OsNRAMP1、OsIRT2和OsNAS2相比,OsHMA2、OsHMA3、OsNRAMP5和OsZIP4在对照以及0.01和0.10mg/kg的低Cd处理下便具有较高的表达水平,并且随着Cd处理浓度的变化其表达量变化的趋势因品种而异,但变幅远不如OsNRAMP1、OsIRT2和OsNAS2。

图2不同浓度Cd处理下12个水稻品种植株地上部和根系Cd含量
Fig. 2.ConcentrationsofCdintherootsandshootsof12ricecultivarstreatedwithCdatdifferentlevels.
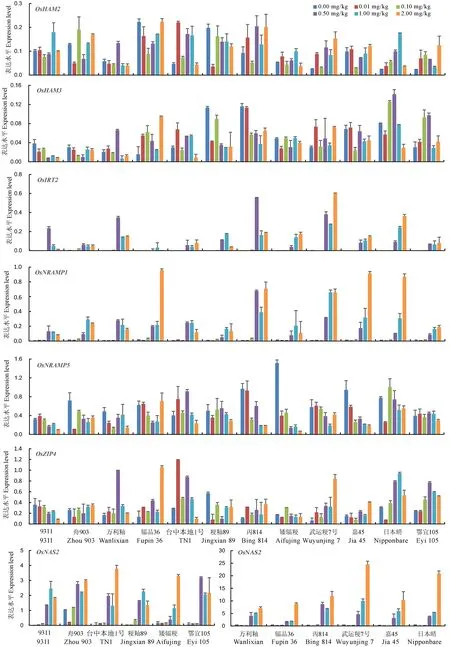
图3不同Cd处理下12个水稻品种根部重金属转运蛋白基因的实时定量表达分析
Fig. 3.Real-timePCR-basedexpressionlevelsofheavymetaltransportergenesinrootsof12ricecultivarsunderdifferentCdtreatments.
表4不同Cd浓度处理下12个水稻品种重金属Cd的转运系数TFrs
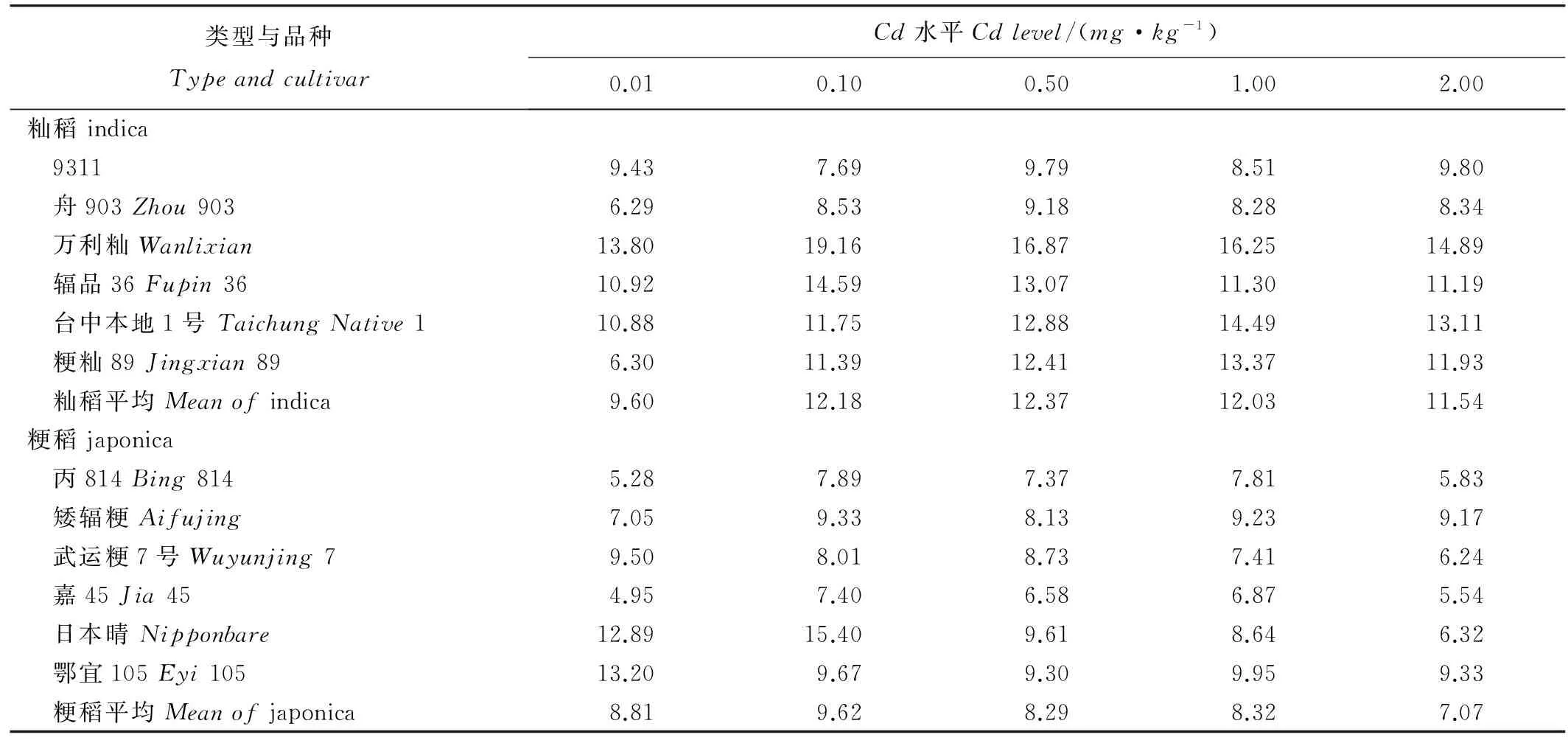
Table 4. TFrs of Cd of 12 rice cultivars under different Cd levels. %
3讨论
植株在镉胁迫下通常表现为生长矮小和叶片失绿[28]。而本研究发现,0.01mg/kg低Cd水平处理对大多数水稻品种的生长有一定的促进作用,这与邵国胜等[24]在0.10μmol/L镉处理下观察到的现象一致。在高Cd处理(0.50~2.00mg/kg)下,水稻植株对Cd的耐性表现出了显著的品种间差异,其中,辐品36耐性最差,在2.00mg/kgCd处理下苗高和干物质量与对照相比分别降低了40.26%和52.70%,而武运粳7号耐性较好,分别降低了20.55%和25.28%。
在水稻中,有关镉吸收积累的品种间差异的研究国内外已有不少报道,并且以往许多研究都以根系Cd吸收能力来解释不同生态型、品种以及株系间地上部Cd积累的差异[29-32]。而本研究发现,籼稻品种台中本地1号和舟903在高Cd处理(0.50~2.00mg/kg)下根系Cd含量虽然差异不显著,但台中本地1号地上部的Cd浓度却极显著高于舟903;而Cd转运系数最高的籼稻品种万利籼与转运系数最低的粳稻品种嘉45相比,在高Cd处理(0.50~2.00mg/kg)下虽然嘉45根系中Cd含量极显著高于万利籼,但地上部中嘉45的Cd含量却极显著低于万利籼。这表明Cd由根部向地上部的转运能力(茎叶重金属含量与根部重金属含量之比)才是决定部分水稻籼粳品种地上部Cd积累的关键过程,这与Uraguchi等[33]最新的研究结果一致,而且本研究还表明亚种间不同品种地上部Cd积累差异也是由该过程引起的。
本研究发现,在高Cd处理(0.50~2.00mg/kg)下,12个水稻品种植株地上部或者根部Cd含量增加较少甚至部分品种Cd含量反而显著降低,这种水稻植株对Cd吸收饱和的现象可能是植株对非必需元素Cd吸收的自我调节,即当植株中Cd含量上升到一定浓度时,植株为了减少Cd的毒害作用,可能通过分泌络合物来降低有效态的Cd及其移动性,也可能通过调节相关转运蛋白的活性来降低对Cd的转运。如在本研究中发现的OsNRAMP1、OsIRT2和OsNAS2在高Cd处理下被大量诱导表达可能与植株对Cd的吸收调节作用相关,然而是否存在这种调节方式,尚需进一步研究。此外,还可能存在Cd的外排蛋白,当体内Cd上升到一定水平时可将部分Cd排出体外,如在水稻根系中已发现砷的外排蛋白[34]。
参考文献:
[1]ZhouH,ZengM,ZhouX,etal.Heavymetaltranslocationandaccumulationinironplaquesandplanttissuesfor32hybridrice(Oryza sativaL.)cultivars. Plant & Soil, 2015, 386(1/2): 317-329.
[2]KikuchiT,OkazakiM,ToyotaK,etal.Theinput-outputbalanceofcadmiuminapaddyfieldofTokyo. Chemosphere, 2007, 67(5): 920-927.
[3] 王英英, 钱蜀, 邓星亮. 成都平原西部农业土壤中金属元素分布特征研究. 三峡环境与生态, 2012, 34(5): 11-14, 18.
WangYY,QianS,DengXL.InvestigationintoheavymetalsdistributioninthefarmlandsoilsinthewesternofChengduplain. Environ Ecol Three Gorg, 2012, 34(5): 11-14, 18. (inChinese)
[4] 詹杰, 魏树和, 牛荣成. 我国稻田土壤镉污染现状及安全生产新措施. 农业环境科学学报, 2012, 31(7): 1257-1263.
ZhanJ,WeiSH,NiuRC.AdvancesofcadmiumcontaminatedpaddysoilresearchandnewmeasureofitssafeproductioninChina:Areview. J Agro-Environ Sci, 2012, 31(7): 1257-1263. (inChinesewithEnglishabstract)
[5] 甄燕红, 成颜君, 潘根兴, 等. 中国部分市售大米中Cd,Zn,Se的含量及其食物安全评价. 安全与环境学报, 2008, 8(1): 119-122.
ZhenYH,ChengYJ,PanGX,etal.Cd,ZnandSecontentsofthepolishedricesamplesfromsomeChineseopenmarketsandtheirrelevancetofoodsafety. J Safe Environ, 2008, 8(1): 119-122. (inChinesewithEnglishabstract)
[6]LiuJ,ZhuQ,ZhangZ,etal.Variationsincadmiumaccumulationamongricecultivarsandtypesandtheselectionofcultivarsforreducingcadmiuminthediet. J Sci Food Agric, 2005, 85: 147-153.
[7]LiuJ,QianM,CaiG,etal.UptakeandtranslocationofCdindifferentricecultivarsandtherelationwithCdaccumulationinricegrain. J Hazard Mater, 2007, 143(1): 443-447.
[8] 胡培松. 土壤有毒重金属镉毒害及镉低积累型水稻筛选与改良. 中国稻米, 2004, 14(3): 165-169.
HuPS.Cadmiumdetoxificationinsoilandbreedingofnewricewithlesscadmiumaccumulation. China Rice, 2004, 14(3): 165-169. (inChinese)
[9]HeJ,ZhuC,RenY,etal.Genotypicvariationingraincadmiumconcentrationoflowlandrice. J Plant Nutr Soil Sci, 2006, 169(5): 711-716.
[10]LiuJ,ZhuQ,ZhangZ,etal.Variationsincadmiumaccumulationamongricecultivarsandtypesandtheselectionofcultivarsforreducingcadmiuminthediet. J Sci Food&Agric, 2005, 85(1): 147-153.
[11]TakahashiR,IshimaruY,SenouraT,etal.TheOsNRAMP1irontransporterisinvolvedinCdaccumulationinrice. J Exp Bot, 2011, 62(14): 4843-4850.
[12]TakahashiR,IshimaruY,NakanishiH,etal.RoleoftheirontransporterOsNRAMP1incadmiumuptakeandaccumulationinrice. Plant Signal & Behav, 2011, 6(11): 1813-1816.
[13]SasakiA,YamajiN,YokoshoK,etal.Nramp5isamajortransporterresponsibleformanganeseandcadmiumuptakeinrice. Plant Cell, 2012, 24(5): 2155-2167.
[14]IshikawaS,IshimaruY,IguraM,etal.Ion-beamirradiation,geneidentification,andmarker-assistedbreedinginthedevelopmentoflow-cadmiumrice. Proc Natl Acad Sci, 2012, 109(47): 19166-19171.
[15]NakanishiH,OgawaI,IshimaruY,etal.IrondeficiencyenhancescadmiumuptakeandtranslocationmediatedbytheFe2+transportersOsIRT1andOsIRT2inrice. Soil Sci &Plant Nutr, 2006, 52(4): 464-469.
[16]YamajiN,XiaJ,Mitani-UenoN,etal.PreferentialdeliveryofzinctodevelopingtissuesinriceismediatedbyP-typeheavymetalATPaseOsHMA2. Plant Physiol, 2013, 162(2): 927-939.
[17]TakahashiR,IshimaruY,ShimoH,etal.TheOsHMA2transporterisinvolvedinroot-to-shoottranslocationofZnandCdinrice. Plant, Cell & Environ, 2012, 35(11): 1948-1957.
[18]MiyadateH,AdachiS,HiraizumiA,etal.OsHMA3,aP1B-typeofATPaseaffectsroot-to-shootcadmiumtranslocationinricebymediatingeffluxintovacuoles. New Phytol, 2011, 189(1): 190-199.
[19]UraguchiS,KamiyaT,SakamotoT,etal.Low-affinitycationtransporter(OsLCT1)regulatescadmiumtransportintoricegrains. Proc Natl Acad Sci, 2011, 108(52): 20959-20964.
[20]UraguchiS,KamiyaT,ClemensS,etal.CharacterizationofOsLCT1,acadmiumtransporterfromindicarice(Oryza sativa). Physiol Plant, 2014, 151(3): 339-347.
[21]ShaoG,ChenM,WangW,etal.Ironnutritionaffectscadmiumaccumulationandtoxicityinriceplants. Plant Growth Regul, 2007, 53(1): 33-42.
[22]ChengL,WangF,ShouH,etal.MutationinnicotianamineaminotransferasestimulatedtheFe(II)acquisitionsystemandledtoironaccumulationinrice. Plant Physiol, 2007, 145(4): 1647-1657.
[23]InoueH,HiguchiK,TakahashiM,etal.Threericenicotianaminesynthasegenes, OsNAS1, OsNAS2,andOsNAS3areexpressedincellsinvolvedinlong-distancetransportofironanddifferentiallyregulatedbyiron. Plant J, 2003, 36(3): 366-381.
[24]邵国胜,MuhammadJH, 章秀福, 等. 镉胁迫对不同水稻基因型植株生长和抗氧化酶系统的影响. 中国水稻科学, 2004, 18(3): 239-244.
ShaoGS,MuhammadJH,ZhangXF,etal.Effectsofcadmiumstressonplantgrowthandantioxidativeenzymesystemindifferentricegenotypes. Chin J Rice Sci, 2004, 18(3): 239-244. (inChinesewithEnglishabstract)
[25]何俊瑜, 任艳芳, 朱诚, 等. 镉胁迫对不同水稻品种种子萌发, 幼苗生长和淀粉酶活性的影响. 中国水稻科学, 2008, 22(4): 399-404.
HeJY,RenYF,ZhuC,etal.Effectsofcadmiumstressonseedgermination,seedlinggrowth,andamylaseactivitiesinrice. Chin J Rice Sci, 2008, 22(4): 399-404. (inChinesewithEnglishabstract)
[26]覃都, 陈铭学, 周蓉, 等. 锰-镉互作对水稻生长和植株镉, 锰含量的影响. 中国水稻科学, 2010, 24(2): 189-195.
QinD,ChenMX,ZhouR,etal.Effectsofinteractionbetweenmanganeseandcadmiumonplantgrowthandcontentsofcadmiumandmanganeseinrice. Chin J Rice Sci, 2010, 24(2): 189-195. (inChinesewithEnglishabstract)
[27]LeeS,PerssonDP,HansenTH,etal.Bio-availablezincinriceseedsisincreasedbyactivationtaggingofnicotianaminesynthase. Plant Biotechnol J, 2011, 9(8): 865-873.
[28]DasP,SamantarayS,RoutGR.Studiesoncadmiumtoxicityinplants:Areview. Environ Pollut, 1997, 98(1): 29-36.
[29]HartJJ,WelchRM,NorvellWA,etal.Characterizationofcadmiumbinding,uptake,andtranslocationinintactseedlingsofbreadanddurumwheatcultivars. Plant Physiol, 1998, 116(4): 1413-1420.
[30]HartJJ,WelchRM,NorvellWA,etal.Characterizationofcadmiumuptake,translocationandstorageinnear‐isogeniclinesofdurumwheatthatdifferingraincadmiumconcentration. New Phytol, 2006, 172(2): 261-271.
[31]ZhaoFJ,HamonRE,LombiE,etal.CharacteristicsofcadmiumuptakeintwocontrastingecotypesofthehyperaccumulatorThlaspi caerulescens. J Exp Bot, 2002, 53(368): 535-543.
[32]ChanDY,HaleBA.DifferentialaccumulationofCdindurumwheatcultivars:Uptakeandretranslocationassourcesofvariation. J Exp Bot, 2004, 55(408): 2571-2579.
[33]UraguchiS,MoriS,KuramataM,etal.Root-to-shootCdtranslocationviathexylemisthemajorprocessdeterminingshootandgraincadmiumaccumulationinrice. J Exp Bot, 2009, 60(9): 2677-2688.
[34]ZhaoFJ,McGrathSP,MehargAA.Arsenicasafoodchaincontaminant:mechanismsofplantuptakeandmetabolismandmitigationstrategies. Ann Rev Plant Biol, 2010, 61: 535-559.
收稿日期:2016-02-29; 修改稿收到日期: 2016-04-21。
基金项目:公益性行业(农业)科研专项(201403015); 国家自然科学基金资助项目(31571616); 中国农业科学院(协同)创新工程资助项目; 国家863计划资助项目(2014AA10A603-15)。
中图分类号:Q945.48; S511.01
文献标识码:A
文章编号:1001-7216(2016)04-0380-09
ChangesinCadmiumConcentrationinRicePlantsUnderDifferentCadmiumLevelsandExpressionAnalysisofGenesRetatedtoCadmiumRegulation
ZHOUQuan,WANGHong,ZHANGYing-xin,DONGQing,MENGShuai,CAOLi-yong,SHAOGuo-sheng*,SHENXi-hong*
(China National Rice Research Institute, Hangzhou 310006, China;*Corresponding author, E-mail: shaoguosheng@caas.cn; xihongshen@126.com)
Abstract:Using six indica and six japonica cultivars, differed in cadmium concentrations in the above-ground parts, the growth, heavy metal contents and expression levels of heavy metal transporter related genes were studied in a hydroponic experiment at six cadmium levels. Cadmium stress reduced plant height, shoot dry weight and chlorophyll content in rice leaves, inhibiting rice growth. Significant difference in cadmium content in rice roots and shoots among rice cultivars were found under different cadmium treatments, and the results showed that root-to-shoot translocation may be a key process that determine the difference in cadmium contents between rice cultivars and subspecies, while cadmium absorption by roots had little effect. At various cadmium levels (from 0.50 to 2.00 mg/kg), saturation of cadmium accumulation in rice shoots were found in some cultivars that cadmium content stopped increasing or even decreased. Besides, the expression levels of OsNRMAP1,OsIRT2 and OsNAS2 were significantly increased at such cadmium treatment, which might be attributed to the regulation of rice plants.
Key words:rice; cadmium; genotype; plant growth; gene expression

