过表达一个疣粒野生稻的Ricin_B 凝集素基因OmR40c1增强水稻耐盐性
陈贤 董岩 周洁 王栩鸣 严成其, * 陈剑平, *
(1浙江大学 农业与生物技术学院, 杭州 310029; 2浙江省农业科学院 病毒与生物技术研究所, 杭州 310021; 3南京农业大学 植物保护学院, 南京 210095 ; *通讯联系人, E-mail: jpchen2001@126.com, yanchengqi@163.com)
过表达一个疣粒野生稻的Ricin_B 凝集素基因OmR40c1增强水稻耐盐性
陈贤1, 2董岩2, 3周洁2王栩鸣2严成其2, *陈剑平1, 2, *
(1浙江大学 农业与生物技术学院, 杭州 310029;2浙江省农业科学院 病毒与生物技术研究所, 杭州 310021;3南京农业大学 植物保护学院, 南京 210095 ;*通讯联系人, E-mail: jpchen2001@126.com, yanchengqi@163.com)
CHEN Xian, DONG Yan, ZHOU Ji, et al. Over-expression ofOmR40c1, a ricin_B lectin fromOryzameyerianaL. enhances salt tolerance in transgenic pants. Chin J Rice Sci, 2016, 30(4): 335-344.
陈贤, 董岩, 周洁, 等. 过表达一个疣粒野生稻的Ricin_B 凝集素基因OmR40c1增强水稻耐盐性. 中国水稻科学, 2016, 30(4): 335-344.
摘要:盐胁迫是影响盐/碱稻区水稻产量的主要逆境因素。研究耐盐相关基因,对于培育水稻抗逆品种具有重要意义。OmR40c1是从疣粒野生稻(Oryza meyeriana)中分离获得cDNA序列,与已报道的受脱落酸与盐诱导的OsR40c1的CDS序列完全相同,但在5′端UTR和3′端UTR区域有差别。有关OmR40c1基因功能的研究还未见报道。本研究的主要目的是初步分析OmR40c1在水稻耐盐性中的作用。对栽培稻日本晴(Oryza sativa L. var. Nipponbare)进行脱落酸(abscisic acid,ABA)和盐胁迫处理,OsR40c1基因均上调表达。构建基因定位载体并注射烟草表皮细胞,其结果表明OmR40c1定位于细胞质膜和细胞核上。构建超表达载体并转染日本晴,PCR及qRT-PCR结果均显示OmR40c1在转基因材料中成功表达。OmR40c1可能参与种子萌发。174 mmol/L盐胁迫下,野生型种子的发芽率下调一半左右,转OmR40c1基因水稻种子发芽未受影响;转OmR40c1水稻苗期的株高是未经盐处理转基因水稻株高的一半左右;而野生型的株高是未经盐处理野生型水稻株高的1/6左右。盐胁迫下,水稻叶片、根长等都受到不同程度的影响。盐胁迫下,转OmR40c1基因水稻植株内的Na+浓度是野生型的1.38倍; K+浓度是野生型的1.25倍。综上,OmR40c1一定程度提高了水稻的耐盐性,且苗期的耐盐性高于成株期。
关键词:疣粒野生稻; OmR40c1; 转基因; 耐盐性
水稻是我国主要的粮食作物之一,盐胁迫是影响盐/碱稻区水稻产量的主要逆境因素[1]。我国盐/碱稻区占水稻栽培总面积的20%左右,其面积在逐年扩大,严重威胁粮食安全[2]。盐胁迫对植物的伤害主要包括脱水、离子毒害和营养缺乏[3]。水稻受盐胁迫后在发育和形态上主要表现为发芽率降低[4]、分蘖数减少[5]、产量和品质下降[6]。培育耐盐/碱水稻品种是发展盐/碱稻区水稻生产最为经济有效的途径之一[7],而挖掘和利用盐/碱新基因则是培育耐盐/碱水稻品种的核心和基础。
盐胁迫机制和植物耐盐适应性的分子机理十分复杂。盐胁迫会造成植物叶片中的叶绿素含量降低[8]、光合作用减弱[9]、诱导活性氧(Reactive Oxygen Species,ROS)合成[10]、细胞膜受损[11]、Ca2+及K+外渗[12]和Na+大量积累[9]等。水稻则通过液泡[13]、可溶性小分子有机物[14]及无机盐离子调控细胞渗透压[15],通过抗氧化物酶清除活性氧维持细胞膜的完整性来增强耐盐性[16]。OsMSR2是一个水稻类钙调节蛋白,它可能通过ABA信号途径增强拟南芥的耐盐性[17]。亲环素蛋白OsCYP2可通过离子再平衡和削弱ROS的积累来增强烟草的耐盐性[18]。OsMyB2是一个水稻转录因子,它可通过正调控抗氧化酶的活性和增加脯氨酸的积累及促进可溶性糖的合成来提高水稻的耐盐性[19]。
水稻中有许多受到盐胁迫诱导表达的基因,也可被ABA诱导表达,暗示ABA信号途径在参与调控水稻应对盐胁迫中有着重要的作用[20]。OsR40c1是一个受ABA和盐胁迫诱导表达的栽培稻的Ricin_B蛋白[21]。本研究从疣粒野生稻中获得的OmR40c1的CDS序列与已报道的OsR40c1完全相同,仅在UTR区域有差异。而有关OmR40c1耐盐性的研究还未见报道。本研究通过对转OmR40c1基因水稻T1代种子盐胁迫下发芽率、株高、苗期的鲜质量及干质量、Na+及K+离子含量等耐盐相关指标的分析,以期为进一步研究OmR40c1参与水稻的抗逆提供新的依据。
1材料与方法
1.1材料与试剂
1.1.1植物材料与菌株
疣粒野生稻(OryzameyerianaNees et Arn. ex Hook. e.)由云南省农业科学院陶大云教授和中国水稻研究所魏兴华研究员提供,大量用疣粒野生稻由浙江省农业科学院病毒学与生物技术研究所繁育和保存。栽培稻日本晴种子(OryzasativaL. var. Nipponbare)由本实验室繁育和保存。大肠杆菌DH5α (EscheriachiacoliDH5α)和根癌农杆菌EHA105 (Agrobacteriumtumefaciens, EHA105)以及ccdBr2菌株均由本实验室保存。本氏烟草(Nicotianabenthamiana, NB)、日本晴和疣粒野生稻均种植于浙江省农业科学院病毒学与生物技术研究所智能阳光温室。
1.1.2质粒载体与试剂
克隆载体pJET 1.2购自于赛默飞世尔科技(中国)有限公司(Thermo Fisher Scientific),pMD19T购自TaKaRa公司,pX2E-T、pCAMBIA-1300UR-DEST、pGWB505及 pGWB506质粒购自Invitrogen公司。Pyrobest DNA聚合酶和rTaqDNA聚合酶均购自TaKaRa公司,phsuion 高保真 DNA聚合酶购自NEB公司,TRIzol购自上海普飞生物公司,无核糖核酸酶水购自QIAGEN公司,三氯甲烷购自南京化学试剂有限公司,异丙醇购自AMRESCO公司,无水乙醇购自MREDA公司,第一链cDNA合成试剂盒购自Bio-Rad公司,第一链cDNA合成试剂盒购自NEB公司,反转录cDNA第一链合成试剂盒购自Clontech公司,实时荧光定量PCR试剂盒(SYBR Green Real time PCR Master Mix)购自TOYOBO公司,DNA 连接试剂盒购自TaKaRa公司。其他试剂购自国药集团化学试剂有限公司。
1.2方法
1.2.1OsR40c1的诱导表达特征分析
为了研究OsR40c1对激素及环境因子胁迫的响应,我们利用0.1 mol/L ABA和100 mmol/L NaCl对长势一致的野生型日本晴小苗(3叶期)根部处理6 h和24 h,每组3株幼苗。利用TRIzol法[22]提取叶片总RNA,逆转录成cDNA后,以OsActin为内参基因,采用相对定量法检测分析OmR40c1的表达量。OsActin: F_5′GAGTATGA
TGAGTCGGGTCCAG3′,R_5′ACACCAACAATC
CCAAACAGAG3′;OsR40c1:F_5′CAAGGACGA
GGAAGGCTA3′, R_5′_CGAAGTTGAGGTAGA
1.2.2Gateway体系入门载体的构建
根据RGAP(http://rice.plantbiology.msu.edu/index.shtml)中公布的OmR40c1(Os03g21040.2)的核苷酸序列,设计基因全长引物:F_5′ ATGTTCGGCTTCGGGCACCAC3′和R_5′GCTTACC AGGGGACGATCTTCCA3′。利用本实验室保存的PJET-OmR40c1为模板,在KOD-FX高保真聚合酶作用下进行PCR扩增,具体PCR流程如下: 94℃下2 min;94℃下30 s, 58℃下30 s,68℃下90 s,共35个循环;68℃下8 min。PCR产物经1.5%的琼脂糖凝胶电泳后回收并纯化得到OmR40c1片段。并在T4连接酶的帮助下将其连接到PX2E-T入门载体中[23],然后热击转化到DH5α中[24],具体步骤如下:从-70℃冰箱中取出感受态细胞放在冰上融化10 min,加入10 μL连接产物后冰上放置30 min;42℃下热击90 s后立即冰上静置2 min;接着添加500 μL的SOC培养基,并在振荡摇床中培养1 h (37℃,225 r/min);吸取60 μL菌液涂于含有100 mg/L氨苄青霉素(Ampicillin, Amp)的LB固体培养基上,37℃下倒置培养过夜。从平板上挑取单克隆,并接种于含有100 mg/L Amp的LB液体培养基中,震荡培养过夜(37℃,225 r/min)。菌液PCR阳性检测后送至博尚生物测序公司进行序列检测。
1.2.3OmR40c1亚细胞定位载体的构建
以OmR40c1-PX2E-T为入门载体,分别与目的表达载体pGWB505和pGWB506通过LR反应构建OmR40c1-pGWB505与OmR40c1-pGWB506[25]。将重组产物导入到DH5a感受态细胞中,菌液PCR阳性检测后送至铂尚生物公司测序。将测序正确的质粒OmR40c1-pGWB505与OmR40c1- pGWB506分别电击到EHA105中,具体操作如下:从-70℃冰箱取出感受态细胞后置于冰上10 min,向管内添加2.5 μL质粒,混匀后冰上静置30 min;将混合液转移到已预冷的2 mm电击杯中,2300 V 电击转化完后向管内添加 500 μL YEP液体培养基并轻微混匀。将杯内溶液转移到另一无菌的离心管中,28℃、210 r/min下摇床、暗培养3 h;接着吸取60 μL菌液涂于含有50 mg/L大观霉素(Spectinomycin, Spe)和50 mg/L链霉素(Straptomycin, Str)双抗的YEP平板上,28℃下培养36 h。挑取单克隆于含有50 mg/L Spe和50 mg/L Str双抗的YEP液体培养基中28℃下培养过夜后用基因特异引物检测。挑取PCR阳性克隆并扩大培养,并于4000×g下离心5 min收集菌体;利用浸润液[含10 mmol/L MgCl2,10 mmol/L MES (pH 5.6),200 μmol/L乙酰丁香酮(As)]重悬细胞,并将菌液浓度调至OD600=0.8~1.0。利用2 mL注射器在烟草叶片背面将菌液缓慢渗透注射到叶片组织间隙中,25℃下培养3 d。参照莱卡(Leica) 激光共聚焦显微镜使用手册,在显微镜下观察并拍照记录细胞的定位情况。
1.2.4OmR40c1超表达载体的构建
将测序正确的PX2E-T-OmR40c1与P1300 pCAMBIA-1300UR-DEST进行重组反应[25]。将重组产物导入到DH5a细胞中,菌液PCR阳性检测后送至测序。将测序正确的P1300UR-OmR40c1质粒电击到EHA105,菌液检测阳性的将作为下一步遗传转化菌株。
1.2.5根癌农杆菌介导的OmR40c1水稻遗传转化
利用农杆菌介导的水稻愈伤遗传转化技术将OmR40c1导入到水稻基因组中[26],具体操作如下:将去壳的粳稻日本晴种子浸泡在含有70%无水乙醇中约2 min后,用20%次氯酸钠消毒30 min,接着使用无菌水冲洗6次,最后浸泡在无菌水中约30 min。将种子转移到粳稻诱导培养基中,置于28℃光照培养箱中诱导愈伤组织。14 d继代1次,共2次。选取结实、圆润、浅黄且长势良好的小愈伤组织用于侵染。将带有重组质粒的农杆菌接菌到YEP培养基中,28℃下振荡培养20 h。吸取1 mL菌液,5000 r/min下离心5 min,弃上清;菌体重悬于AAM培养基中,将OD600调至0.05~0.15。将愈伤组织置于培养液中浸泡15 min,晾干后置于共培养基上,28℃下暗培养36 h。然后置于选择培养基上;14 d选择1次,共2次。将抗性愈伤置于分化培养基上,直至小苗顶盖生长。向分化罐中添加少许超纯水,炼苗一周后移栽至智能温室的土槽中,获得T0代株系,繁育得到T1代株系后进行下一步实验。
1.2.6OmR40c1转基因植株的DNA检测
以碱性裂解法[27]快速提取的水稻基因组DNA为模板,具体步骤如下:剪取2 cm长的水稻叶片,液氮磨碎;向2 mL EP管内添加100 μL 0.1 mol/L NaOH,振荡混匀;接着向管内添加100 μL 0.1 mol/L Tris-HCl(pH=8.0),离心取上清进行PCR。依据潮霉素序列设计引物(Hyg: F_5′CGTCTGC TGCTCCATACAA3′;Hyg: R_ 5′TCAATACACTACATGGCGTGA3′)进行PCR检测。PCR程序程序如下:94℃下4 min;94℃下30 s,58℃下30 s,72℃下30 s,共35个循环;72℃下延伸8 min。通过PCR筛选出来的阳性株系进行进一步的RT-PCR验证。
1.2.7OmR40c1在转基因株系中的表达分析
利用TRIzol法提取转基因小苗5叶期叶片中的总RNA,参照Bio-Rad公司逆转录试剂盒逆转录成cDNA。以OsActin为内参基因,采用相对定量法确定OsR40c1在转录中的表达量。引物及qRT-PCR体系参照步骤1.2.1。
1.2.8OmR40c1转基因水稻的耐盐性分析
将去壳消毒的OmR40c1T1代种子置于含174 mmol/L NaCl的1/2 MS(50 mg/L HyG)培养基上,并置于智能光照培养箱中(光照12 h,温度30℃)培养10 d。野生型置于无抗的1/2 MS(174 mmol/L NaCl)中作为对照组。观察野生型和转基因水稻的成活率及其株高。每组实验每个株系种子30粒,3个技术重复,生物学重复2次。
1.2.9OmR40c1转基因水稻生理生化指标的测定
将去壳消毒的OmR40c1T1代种子置于1/2 MS(50 mg/L HyG)培养基上,野生型日本晴种子置于1/2 MS(174 mmol/L NaCl)中,然后置于智能光照培养箱中(光照12 h,温度30℃)培养10 d。将小苗转移到水稻水培营养液中继续培养约3周。将转基因和野生型水稻分成2组。一组在新鲜的水培营养液中继续培养,另一组则在含有174 mmol/L NaCl的水培营养液中进行盐胁迫处理。10 d后,分别记录两组水稻在盐处理前后的鲜质量、绿叶数及根长。120℃下杀青30 min,然后90℃下烘干并分别记录两组水稻在盐处理前后的恒重。每组实验每个株系8株。
1.2.10OmR40c1转基因水稻中Na+、K+离子浓度的测定
将烘干的水稻碾磨成粉末状,按质量体积比(v/m)1∶16加入浓硫酸,消煮3h;接着转移到容量瓶中定容。最后利用火焰分光光度计(FP6410,杭州汇尔)分别测量两组水稻在盐处理前后Na+、K+离子的含量。
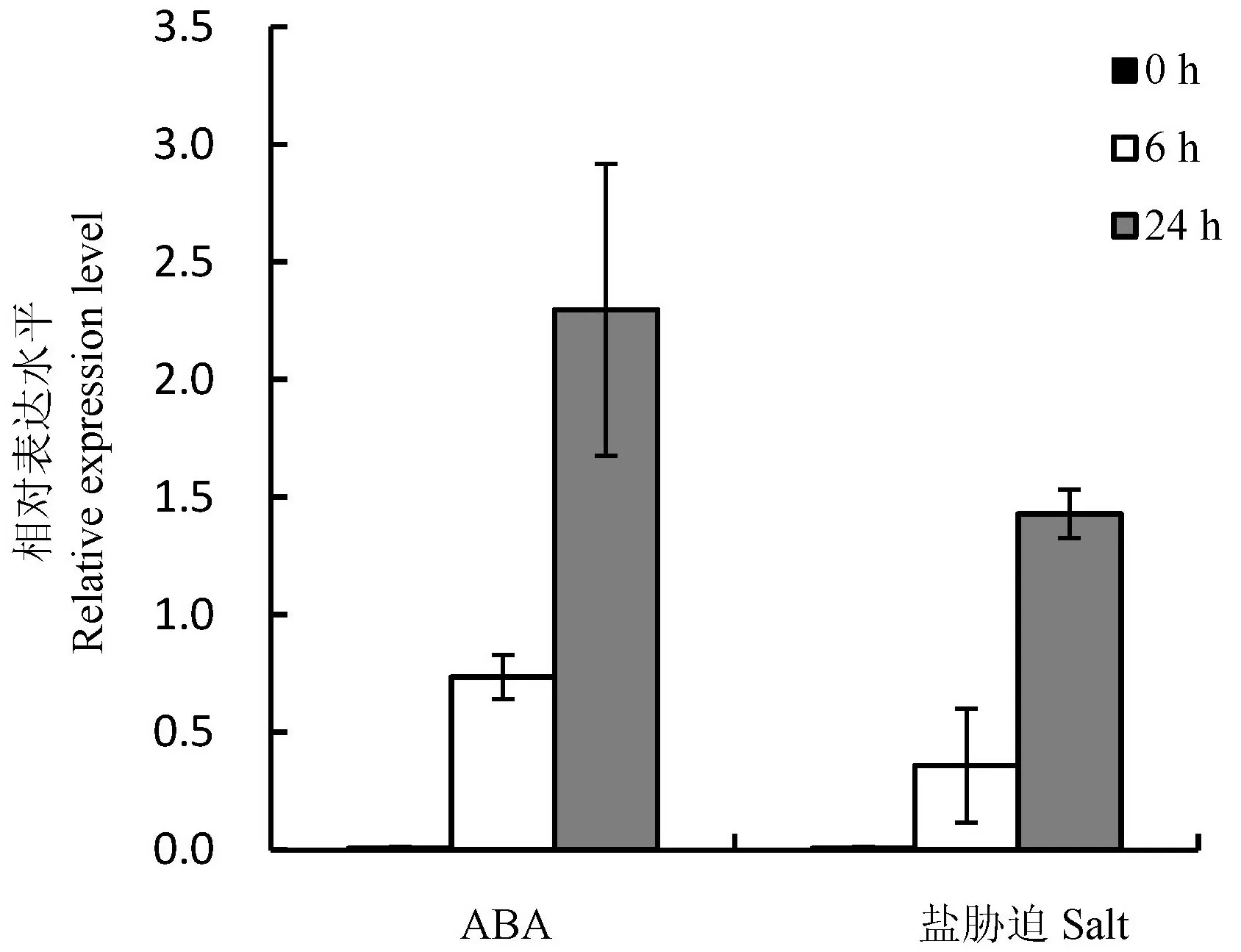
图1ABA和盐胁迫OmR40c1的诱导表达量分析
Fig.1. Expression of OmR40c1in response to ABA and salt stress.
2结果与分析
2.1OsR40c1的诱导表达
以OsActin为内参,利用RT-PCR技术分析OsR40c1在ABA和NaCl胁迫下苗期日本晴叶片中的表达情况。如图1所示,OsR40c1为一个诱导型表达基因,在处理0 h的叶片中几乎不表达。ABA处理6 h和24 h,OsR40c1的表达量均上调;盐胁迫6 h和24 h,OsR40c1的表达量也均上调。OsR40c1受ABA和盐胁迫诱导表达,其表达特征与之前的研究结果[21]一致。
2.2表达载体P1300UR-OmR40c1的构建
为了加快载体构建的速度,我们采用了Invitrogen公司的Gataway载体构建系统,实现了目的基因在不同载体之间的快速平衡转移,从而省去繁琐的目的片段酶切、纯化及连接过程。如图2所示,从疣粒野生稻中获得OmR40c1基因片段后,我们在这些基因片段的5′及3′端各加一个核苷酸A,然后通过T-A连接到入门载体pX2E-T中,获得OmR40c1-pX2E-T入门载体。通过重组的方式将入门载体中目的片段转移到表达载体p1300UR中,进而获得表达载体p1300UR-OmR40c1。
2.3OmR40c1蛋白的亚细胞定位
通过LR反应将入门载体PX2E-T上的目的基因OmR40c1平行转移到目的表达载体pGW505及pGW506中,进而获得融合表达载体。接着将融合表达载体电击到根癌农杆菌电击感受态细胞EHA105中。注射烟草叶片下表皮48~72 h后,在共聚焦显微镜下观察。如图3所示,OmR40c1基因在GFP的N末端时,融合蛋白定位在细胞膜和细胞核上;OmR40c1基因在GFP的C末端时,融合蛋白也是定位在细胞膜和细胞核上。该结果表明OmR40c1蛋白定位在细胞膜和细胞核上。
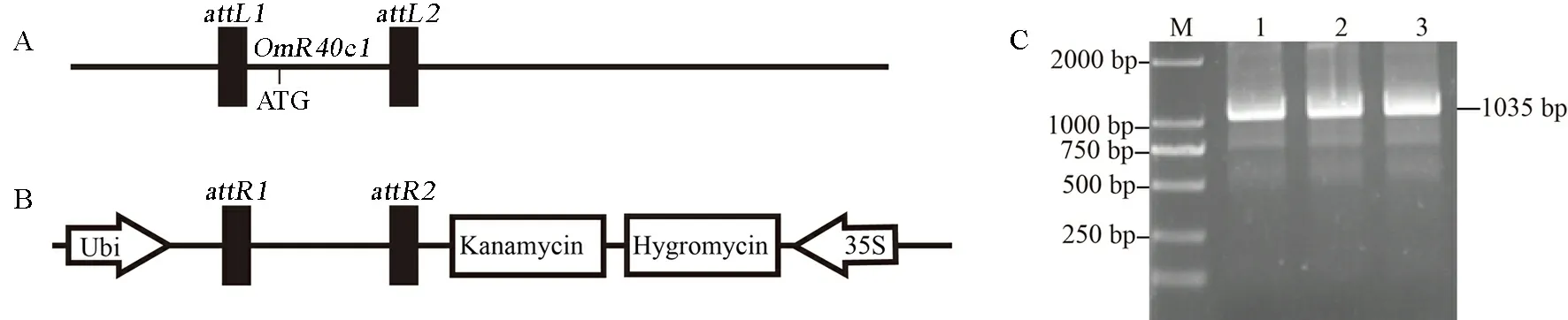
A-OmR40c1入门载体构建; B-OmR40c1转基因表达载体构建; C-OmR40c1表达载体扩增结果。M-分子量标记。
A, CDS ofOmR40c1in entry cloning T-vector pX2E-T; B, CDS ofOmR40c1betweenattR1 andattR2 in P1300UR-DEST analysis vector; C, Cloning ofOmR40c1gene coding sequence (CDS) by PCR. M-Marker.
图2p1300UR-OmR40c1表达载体的构建及其菌液PCR
Fig. 2. Construction of recombinant plasmid of p1300UR-OmR40c1.
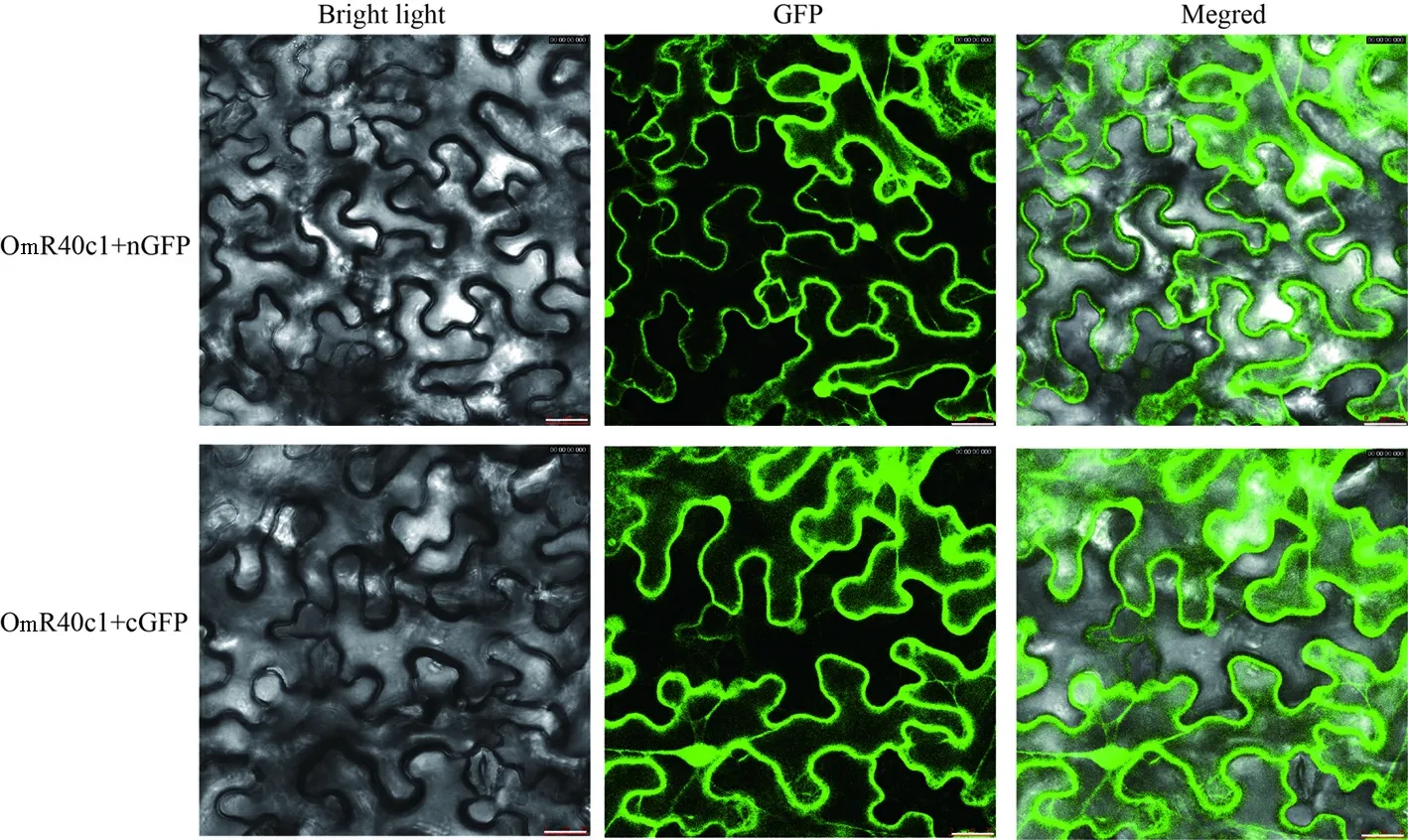
nGFP表示GFP蛋白N末端与目的蛋白C末端融合; cGFP表示GFP蛋白C末端与目的蛋白N末端融合。Bar = 10 μm。
NGFP, pGW505 (_505, 35S: GFP - Gene fusion); cGFP, pGW506 (_506, 35S: GFP- Gene fusion) vectors. Bar = 10 μm.
图3OmR40c1蛋白在烟草叶片表皮细胞中的亚细胞定位
Fig. 3. Subcellular location of OmR40c1 protein in tobacco leaf cells.
2.4转基因株系的DNA检测
我们将获得的OmR40c1片段连接到入门载体PX2E-T中,然后与目的载体P1300UR-DEST重组,最终获得OmR40c1-P1300UR超表达载体。然后,通过电击方式将其导入到EHA105感受态细胞中,并借助根癌农杆菌将目的基因OmR40c1整合到水稻愈伤细胞的基因组中,通过培养、筛选、分化、炼苗、水培及移栽等水稻转基因步骤获得了T0代植株。我们一共转化4×31组OmR40c1愈伤组织,并获得75株T0代转基因小苗,其中10株为白化苗,另有49组未分化出小苗;PCR鉴定除白化苗后的48株小苗,共获得14株阳性小苗(图4)。

A-泳道1~12分别表示12株转基因水稻; B-泳道1~8分别代表8株转基因水稻,9~10代表野生型日本晴,11~12代表超纯水。
A, Lanes 1-12 indicate transgenic rice plants; B, 1-8 indicate transgenic rice plants; 9-10 indicate wild type rice plants; 11-12 indicate water.
图4 转OmR40c1水稻的PCR鉴定结果
Fig. 4. PCR identification of OmR40c1 transgenic rice plants.
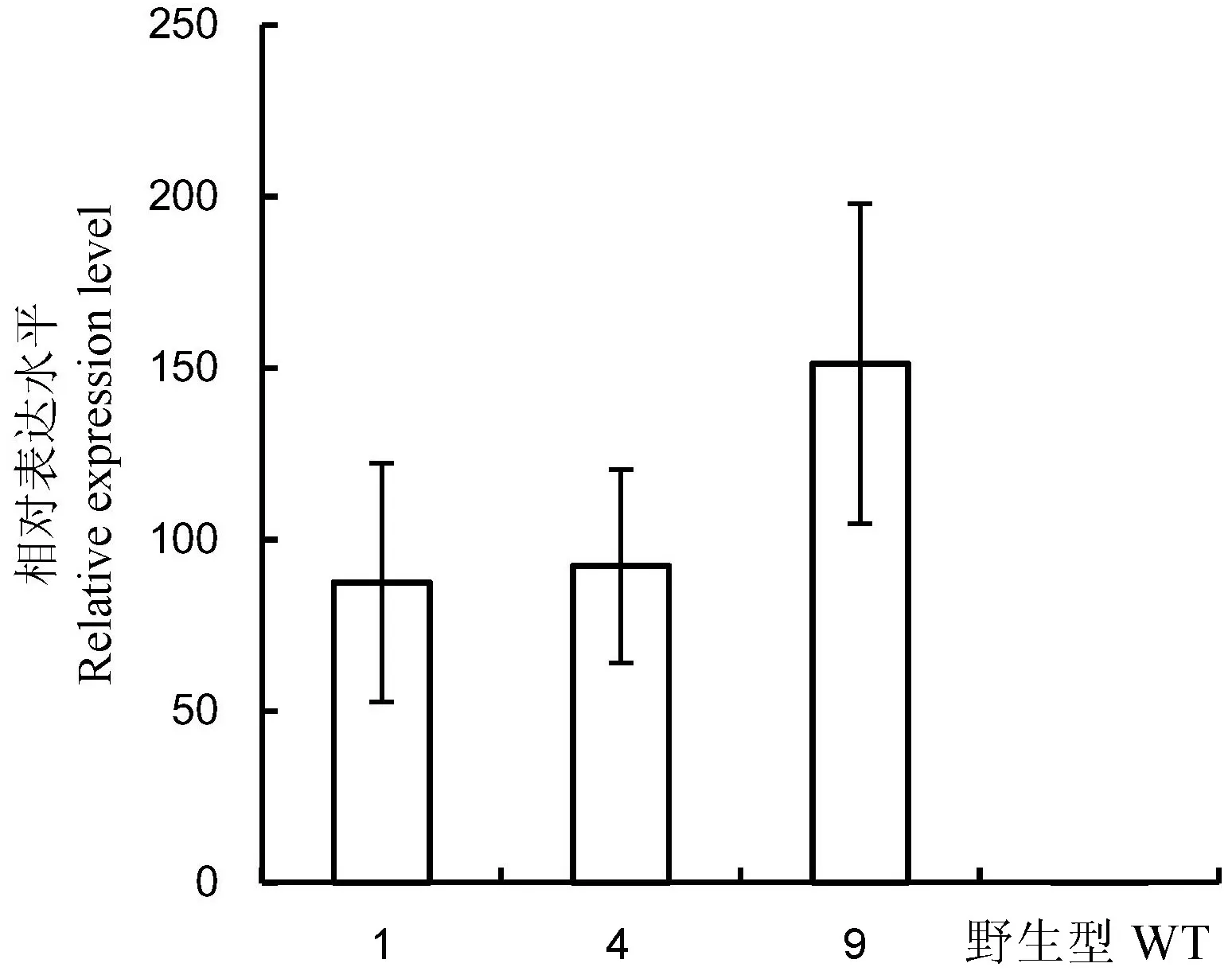
图5qRT-PCR分析OmR40c1在转基因水稻中的表达
Fig. 5. Real-time PCR analysis of OmR40c1 in transgenic rice plants.
2.5转基因株系的RT-PCR检测
分别提取OmR40c1T1代转基因苗期阳性苗的总RNA,逆转录成cDNA。以OsActin为内参基因,对上述转基因株系1、4、9及WT中OmR40c1的转录表达变化进行定量分析。如图5所示,OmR40c1在转基因株系1、4及9中均过量表达,其中,在转基因株系9中的表达量最高。该结果表明OmR40c1在转基因水稻中成功表达。
2.6转基因株系的耐盐性分析
盐胁迫会导致种子发芽时间推迟、发芽过程延长及发芽率降低等[4]。为了研究盐胁迫对转OmR40c1基因水稻的发芽率、表型及株高的影响,我们将去壳的转OmR40c1基因水稻和野生型日本晴水稻种子分别置于含有174 mmol/L NaCl+和50 mg/L Hyg及含174 mmol/L NaCl的1/2 MS培养基上。然后在智能光照培养箱中(光照12 h,温度30℃)培养10 d后,统计发芽率和株高。如图6-A所示,盐胁迫下的转OmR40c1基因水稻株高、根系都不同程度受抑,而野生型则更为严重。与正常条件相比(图6-B,表1),在盐胁迫下的OmR40c1转基因水稻的发芽率略有下降;而盐胁迫下的野生型发芽率仅为其正常情况下的一半左右。在株高方面(图6-C,表2),盐胁迫下的OmR40c1转基因水稻株高是其在正常条件下的2/5左右;而盐胁迫下的野生型株高仅为其正常情况下的1/6左右。野生型水稻在盐胁迫下的发芽率、株高等方面与郭望模[4]的研究结果十分相似。另外,盐胁迫下的OmR40c1转基因水稻和野生型植株发育都不同程度受到抑制,但野生型几乎无法在174 mmol/L NaCl的培养基上诱导生长。
表1盐胁迫下OmR40c1的发芽率

Table 1. Germination rate of OmR40c1 under salt stress. %
表2盐胁迫下转OmR40c1基因水稻的株高

Table 2. Plant height of OmR40c1 transgenic rice under salt stress. cm
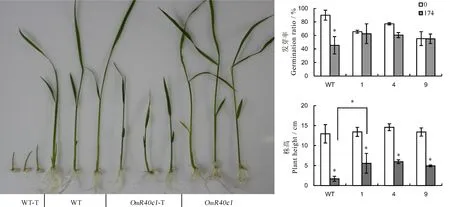
A-转OmR40c1水稻和野生型水稻秧苗在盐处理前后的表型; B-转OmR40c1水稻和野生水稻秧苗在盐处理前后的发芽率; C-转OmR40c1水稻和野生型水稻秧苗在盐处理前后的株高。WT-野生型日本晴; T, 174 mmol/L NaCl处理;*显著性差异(P<0.05)。
A, Phenotype ofOmR40c1 transgenic rice under salt stress; B, Germination ratio ofOmR40c1transgenic plants; C, Height ofOmR40c1transgenic plants. WT, Wild Type; T,Treated with 174 mmol/L NaCl;*Significant differences (P<0.05).
图6盐胁迫下OmR40c1转基因水稻幼苗的发芽率和株高
Fig. 6. Germination rate and plant height of OmR40c1 transgenic rice seedlings under salt stress.
2.7转基因株系的生理指标
为了研究盐胁迫对转OmR40c1基因水稻的叶片、根长、干质量及鲜质量的影响,我们对4周龄的转OmR40c1基因水稻进行了盐胁迫处理。如图7-A所示,盐胁迫下,水稻的叶片及根部的生长发育受阻,且叶片更为严重。无盐胁迫状态下,转基因水稻和野生型水稻的绿色叶片数量基本在10片左右;174 mmol/L NaCl盐胁迫下,转基因水稻和野生型水稻的绿色叶片数量基本在2.5片左右,且转基因水稻的叶片数略微高于野生型(图7-B,表3)。盐胁迫下水稻根部的生长受到抑制,两者的受抑制程度基本相当(图7-C)。盐胁迫下,野生型水稻的鲜质量下降更为明显。我们推测野生型水稻植株内的离子浓度含量相对较低,脱水更为严重(图7-D,表4)。盐胁迫下,转基因水稻的鲜质量是干质量的7.9倍左右;野生型植株的鲜质量是干质量的7.1倍左右(图7-D、E)。该结果暗示盐胁迫下转基因水稻体内积累的水分可能比野生型水稻多。
2.8转基因株系中的K+、Na+含量
对7周龄左右的OmR40c1转基因和野生型水稻174 mmol/L NaCl处理10 d,然后分别测定实验组和对照组中转基因水稻与野生型水稻植株内的K+、Na+含量。如图8-A所示,盐胁迫前后,转基因水稻与野生型水稻体内的K+含量没有显著的变化,但转基因水稻中的K+含量是野生型水稻植株内K+的1.25倍。无盐胁迫状态下,转基因水稻与野生型水稻植株内的Na+含量没有明显差异;盐胁迫下,转基因水稻植株内的Na+含量约是野生型体内Na+含量的1.38倍(图8-B)。该结果暗示OmR40c1可能通过细胞膜协助Na+的运输,以维持细胞内外离子渗透压的平衡。
表3盐胁迫下转OmR40c1基因水稻的绿叶数和根长
Table 3. Number of green leaves and length of roots of OmR40c1 trangenic rice under salt stress.

处理TreatmentNaCl浓度NaClconcentration/(mmol·L-1)绿叶数Numberofgreenleaves野生型WildtypeOmR40c1根长Rootlength/cm野生型WildtypeOmR40c1对照CK010.5±0.4310.03±0.4820.15±1.3618.77±0.93盐胁迫Saltstress1743.0±0.863.65±1.1511.86±0.6911.13±0.67
表4盐胁迫下转OmR40c1基因水稻植株的鲜质量和干质量
Table 4. Fresh and dry weight of OmR40c1 trangenic rice under salt stress.

处理TreatmentNaCl浓度NaClconcentration/(mmol·L-1)鲜质量Freshweight/g野生型WildtypeOmR40c1干质量Dryweight/g野生型WildtypeOmR40c1对照CK07.04±1.365.67±0.950.75±0.300.58±0.08盐胁迫Saltstress1743.66±0.412.85±0.510.52±0.090.37±0.08
3讨论
水稻是一种对盐中度敏感的作物,土壤盐渍化是限制盐碱稻区水稻稳产的主要限制因素。培育耐盐/碱水稻品种是发展盐/碱稻区生产最为经济有效的途径之一,而基因工程技术是培育耐盐/碱水稻品种的主要方法之一。近年来,水稻耐盐转基因的研究取得了一些进展。OsCPK7是一个钙离子激酶,该酶可能通过保护细胞膜被氧化而增强转基因株系的耐盐性[28]。AgNHX1是一个反盐转运体,转AgNHX1的水稻能在300 mmol/L的NaCl中存活3 d左右[29]。OsTZF1是一个锌指蛋白,该转录因子可通过调控盐胁迫基因的表达而增强水稻的耐盐性[30]。
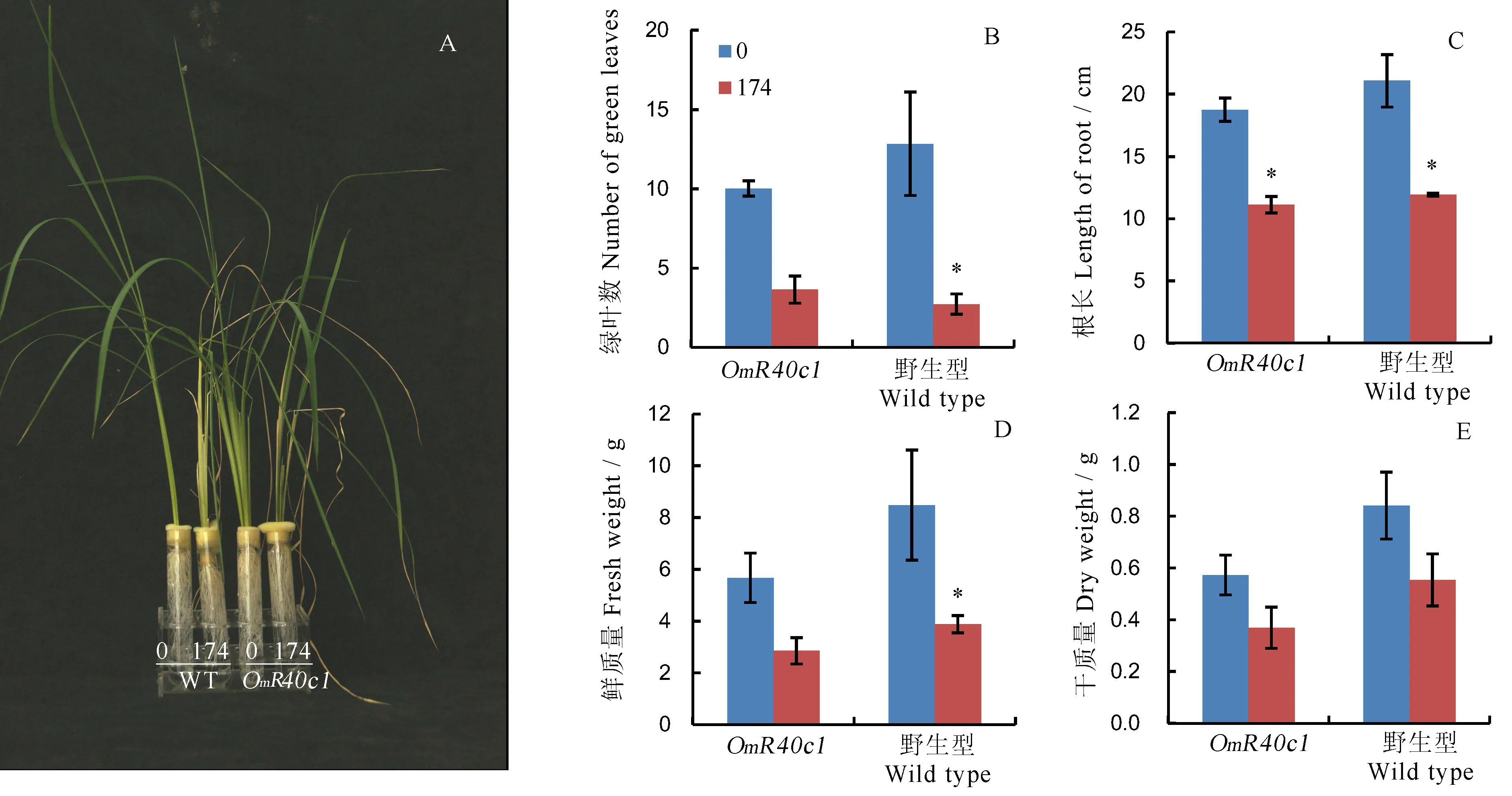
A-7周左右的转OmR40c1水稻和野生型日本晴在盐胁处理下的表型; B-盐胁迫下转OmR40c1水稻和野生型日本晴绿叶数; C-盐胁迫下转OmR40c1水稻和野生型日本晴根长; D-盐胁迫下后转OmR40c1水稻和野生型日本晴植株鲜质量; E-盐胁迫下转OmR40c1水稻和野生型日本晴干质量。WT-野生型日本晴; 0, 0 mmol/L NaCl; 174, 174 mmol/L NaCl;*显著性差异。
A, Phenotype ofOmR40c1transgenic rice under salt stress; B, Number of green leaves ofOmR40c1transgenic rice under salt stress; C, Length of root ofOmR40c1transgenic rice under salt stress; D, Fresh weight ofOmR40c1transgenic rice under salt stress; E, Dry weight ofOmR40c1transgenic rice under salt stress. WT, Wild type of Nipponbare. 0, 0 mmol/L NaCl; 174, 174 mmol/L NaCl.*Significant difference.
图7盐胁迫下OmR40c1转基因水稻的生理指标
Fig. 7. Physiological indexes of OmR40c1 trangenic rice under salt stress.

A-7周左右的转OmR40c1水稻型和野生水稻在盐胁处理下的K+浓度; B-7周左右的转OmR40c1水稻和野生型水稻在盐胁处理下的Na+浓度; 0, 0 mmol/L NaCl; 174, 174 mmol/L NaCl;*显著性差异。
A, Concentration of K+inOmR40c1transgenic rice under salt stress; B, Concentration of Na+inOmR40c1transgenic rice under salt stress. WT, Wild type of Nipponbare; 0, 0 mmol/L NaCl; 174, 174 mmol/L NaCl;*Significant difference.
图8盐胁迫下转OmR40c1基因水稻的K+、Na+浓度
Fig. 8. Concentrations of K+and Na+in OmR40c1 transgenic rice under salt stress.
本研究从疣粒野生稻克隆到的OmR40c1基因,其CDS区域与OsR40c1相同,而在UTR区域有差异。OsR40c1是一个受ABA和盐胁迫诱导表达的Ricin_B(蓖麻凝集素-β亚基)蛋白,且定位于细胞膜及细胞核上。OmR40c1能提高种子的发芽率,可能参与种子的萌发过程。该结果与郭望模[4]和李南羿[31]研究结果类似。盐胁迫下,转OmR40c1水稻小苗的株高仅为正常株高的一半左右,野生型株系的发育则受到严重的抑制。盐胁迫下,转OmR40c1水稻和野生型水稻的叶片褪绿,根部发育受到明显的抑制;转OmR40c1水稻和野生型水稻的鲜质量都干质量都显著下降。该结果与黑倩的研究结果类似[32]。
转OmR40c1水稻植株内K+富集能力是野生型的1.25倍。盐胁迫下,转OmR40c1水稻植株内的Na+富集能力是野生型的1.38倍。我们推测位于细胞膜上的OmR40c1蛋白,可能参与Na+的跨膜运输来维持细胞内外的离子渗透压,进而提高水稻的耐盐性。具体的耐盐性分子机理,有待进一步研究。
参考文献:
[1]Shi H, Xiong L, Stevenson B, et al. TheArabidopsissalt overly sensitive 4 mutants uncover a critical role for vitamin B6 in plant salt tolerance.PlantCell, 2002, 14(3): 575-588.
[2]祁栋灵, 韩龙植, 张三元. 水稻耐盐碱性鉴定评价方法. 植物遗传资源学报, 2005(2): 226-230.
Qi D L, Han L Z, Zhang S Y. Methods of characterization and evaluation of salt or alkaline tolerance in rice.JPlantGenetResour, 2005(2): 226-230.(in Chinese with English abstract)
[3]Maggio A, Barbieri G, Raimondi G, et al. Contrasting effects of GA3treatments on tomato plants exposed to increasing salinity.JPlantGrowthRegul, 2010, 29(1): 63-72.
[4]郭望模, 傅亚萍, 孙宗修. 水稻芽期和苗期耐盐指标的选择研究. 浙江农业科学, 2004(1): 30-33.
Guo W M, Fu Y P, Sun Z X. Salt tolerance evaluation indices of rice at its germinating and seedling stages.JZhejiangAgricSci, 2004(1): 30-33.(in Chinese with English abstract)
[5]孙健, 王敬国, 刘化龙,等. 盐胁迫下水稻苗高和分蘖数的发育动态QTL分析. 核农学报, 2015, 29(2): 235-243.
Sun J, Wang J G, Liu H L, et al. Dynamic QTL analysis of rice seedling height and tiller number under salt stress.JNuclAgicSci. 2015,29(2): 235-243.(in Chinese with English abstract)
[6]余为仆. 秸秆还田条件下盐胁迫对水稻产量与品质形成的影响. 扬州: 扬州大学, 2014: 30-39.
Yu W P. Effect of salt stress associated with straw returning on yield and quality of rice. Yangzhou: Yangzhou University, 2014: 30-39.(in Chinese with English abstract)
[7]Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures: Towards genetic engineering for stress tolerance.Planta, 2003, 218(1): 1-14.
[8]Yamane K, Rahman MS, Kawasaki M, et al. Pretreatment with antioxidants decreases the effects of salt stress on chloroplast ultrastructure in rice leaf segments (OryzasativaL.).PlantProdSci, 2004, 7(3): 292-300.
[9]王仁雷, 华春, 罗庆云, 等. 盐胁迫下水稻叶绿体中Na+、Cl-积累导致叶片净光合速率下降. 植物生理与分子生物学学报, 2002, 28(5): 385-390.
Wang R L, Hua Chun, Luo Q Y, et al. Na+and Cl-accumulation in chloroplasts results in a decrease in net photosynthetic rate in rice leaves under salt stress.JPlantPhysiolMolBiol, 2002, 28(5): 385-390.(in Chinese with English abstract)
[10]Lin J, Wang Y, Wang G. Salt stress-induced programmed cell death in tobacco protoplasts is mediated by reactive oxygen species and mitochondrial permeability transition pore status.JPlantPhysiol, 2006, 163(7): 731-739.
[11]苏芳莉, 李海福, 陈曦, 等. 盐胁迫对芦苇细胞超微结构的影响. 西北植物学报, 2012, 31(11): 2216-2221.
Su F L, Li H F, Chen X, et al. Effect of salt stress on the ultrastructure of reed cell.ActaBotBororealOccidentSin, 2012, 31(11): 2216-2221.(in Chinese with English abstract)
[12]张振华, 刘强, 宋海星, 等. K+,Ca2+和Mg2+对不同水稻(OryzasativaL.)基因型苗期耐盐性的影响. 中国农业科学, 2010, 43(15): 3088-3097.
Zhang Z H, Liu Q, Song H X, et al. The salinity tolerance of rice (OryzasativaL.) genotypes as affected by nutrients (K+, Ca2+and Mg2+) at seedling stage.ChinaAgricSci, 2010, 43(15): 3088-3097.(in Chinese with English abstract)
[13]Yuan H J, Ma Q, Wu G Q, et al. ZxNHX controls Na+and K+homeostasis at the whole-plant level inZygophyllumxanthoxylumthrough feedback regulation of the expression of genes involved in their transport.AnnalsBot, 2015,115(3): 495-507.
[14]Deinlein U, Stephan A B, Horie T, et al. Plant salt-tolerance mechanisms.TrendsPlantSci, 2014, 19(6): 371-379.
[15]Geng Y, Wu R, Wee CW, et al. A spatio-temporal understanding of growth regulation during the salt stress response inArabidopsis.PlantCell, 2013,25(6): 2132-2154.
[16]Jabeen N, Ahmad R. The activity of antioxidant enzymes in response to salt stress in safflower (CarthamustinctoriusL.) and sunflower (HelianthusannuusL.) seedlings raised from seed treated with chitosan.JSciFoodAgric, 2013, 93(7): 1699-1705.
[17]Xu G Y, Rocha P S, Wang M L, et al. A novel rice calmodulin-like gene, OsMSR2, enhances drought and salt tolerance and increases ABA sensitivity inArabidopsis.Planta, 2011, 234(1): 47-59.
[18]Kumari S, Joshi R, Singh K, et al. Expression of a cyclophilin OsCyp2-P isolated from a salt-tolerant landrace of rice in tobacco alleviates stress via ion homeostasis and limiting ROS accumulation.Funct&IntegrGenom, 2015,15(4): 395-412.
[19]Yang A, Dai X, Zhang WH. A R2R3-type MYB gene,OsMYB2, is involved in salt, cold, and dehydration tolerance in rice.JExpBot, 2012, 63(7): 2541-2556.
[20]Barrero J M, Rodriguez PL, Quesada V, et al. Both abscisic acid (ABA)-dependent and ABA-independent pathways govern the induction of NCED3,AAO3 andABA1 in response to salt stress.Plant,Cell&Environ, 2006, 29(10): 2000-2008.
[21]Moons A, Gielen J, Vandekerckhove J, et al. An abscisic-acid- and salt-stress-responsive rice cDNA from a novel plant gene family.Planta. 1997,202(4): 443-454.
[22]Rio D C, Ares M, Jr., Hannon G J, et al. Purification of RNA using TRIzol (TRI reagent).ColdSpringHarborProtoc, 2010, 2010(6): pdb.prot5439.
[23]周洁, 王栩鸣, 陈斌, 等. 基于Gateway技术的低成本植物双分子荧光互补分析系统. 浙江农业学报, 2013, 25(5): 1024-1030.
Zhou J, Wang X M, Chen B, et al. Low-cost gateway-compatible bimolecular fluorescence complementation assay system.ActaAgricZhejiangensis, 2013, 25(5): 1024-1030.(in Chinese with English abstract)
[24]Sambrook J, Russell D W. The inoue method for preparation and transformation of competentE.coli: “Ultra-competent”cells.CSHProtocols, 2006, 2006(1): 1-6.
[25]李茹, 周洁, 李冬月, 等. 水稻 OsWRKY7基因的表达研究. 中国水稻科学, 2015, 29(6): 559-570.
Li R, Zhou J, Li D Y, et al. Expression ofOsWRKY7 in rice.ChinJRiceSci, 2015, 29(6): 559-570.(in Chinese with English abstract)
[26]Gao C, Long D, Lenk I, et al. Comparative analysis of transgenic tall fescue (FestucaarundinaceaSchreb.) plants obtained byAgrobacterium-mediated transformation and particle bombardment.PlantCellRep, 2008, 27(10): 1601-1609.
[27]Wang H, Qi M, Cutler A J. A simple method of preparing plant samples for PCR.NucleicAcidsRes, 1993, 21(17): 4153-4154.
[28]Ye S, Wang L, Xie W, et al. Expression profile of calcium-dependent protein kinase (CDPKs) genes during the whole lifespan and under phytohormone treatment conditions in rice (OryzasativaL. ssp.indica).PlantMolBiol, 2009, 70(3): 311-325.
[29] Ohta M, Hayashi Y, Nakashima A, et al. Introduction of a Na+/H+antiporter gene from Atriplex gmelini confers salt tolerance to rice.FEBSLett. 2002, 532(3): 279-282.
[30]Jan A, Maruyama K, Todaka D, et al. OsTZF1, a CCCH-tandem zinc finger protein, confers delayed senescence and stress tolerance in rice by regulating stress-related genes.PlantPhysiol, 2013, 161(3): 1202-1216.
[31] 李南羿, 郭泽建. 转录因子OPBP1和OsiWRKY基因的超表达提高水稻的耐盐及抗病能力. 中国水稻科学, 2006, 20(1):13-18.
LI N Y, GUO Z J. Overexpression of two different transcription factors, OPBP1 and OsiWRKY, enhances resistance against pathogen attack and salt stress in rice.ChinJRiceSci, 2006, 20(1): 13-18.(in Chinese with English abstract)
[32]黑倩, 张辉, 黄继斌, 等. 过量表达AtNHXS1新基因显著提高水稻的耐盐性. 华中农业大学学报, 2012, 31(5): 529-535.
Hei Q,Zhang H, Huang J B, et al. Overexpress on a shuffled Na+/H+antiporter geneAtNHXS1 improving salt tolerance of rice(OryzasativeL.).JHuazhongAgricUniv, 2012, 31(5): 529-535.
收稿日期:2016-01-08; 修改稿收到日期: 2016-05-18。
基金项目:国家基础研究计划资助项目(2014CB1603090); 国家863计划资助项目(2014AA0A603-15); 浙江省自然科学基金资助项目(LZ14C140001, LZ2013C1109)。
中图分类号:Q755; Q945.78; S511.02
文献标识码:A
文章编号:1001-7216(2016)04-0335-10
Over-expression ofOmR40c1, a Ricin_B Lectin fromOryzameyerianaL. Enhances Salt Tolerance in Transgenic Plants
CHEN Xian1,2, DONG Yan2,3, ZHOU Jie2, WANG Xu-ming2, YAN Cheng-qi2,*, CHEN Jian-ping1,2,*
(1College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310029, China;2Institute of Virology and Biotechnology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;3College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China;*Corresponding author, E-mail: jpchen2001@126.com, yanchengqi@163.com)
Abstract:Salt stress is a major environmental factor limiting rice growth and productivity in saline soil. Planting tolerant line is still the most effective way in response to salt stress. OsR40c1is an abscisic acid (ABA) and salt stress-induced gene. However, the function of OmR40c1is poorly studied. Here, we cloned a gene from Oryza meyeriana which shared the same CDS with OmR40c1but differed in 5′&3′ UTR. Subcellular location analysis showed that OmR40c1was located in cytoplasmic membrane and nuclear. OmR40c1 overexpressing transgenic rice was obtained by using the Agrobacterium-mediated gene transfer system. OmR40c1might involve in seed germination. The germination rate of OmR40c1 transgenic rice was slightly affected by salt stress, while wild type decreased about 50% compared with their mocks. The seedlings of wild type hardly grown on the 1/2 MS medium with salt (174 mmol/L NaCl), the height of 10-day OmR40c1 transgenic rice seedling decreased more than a half. Green leaves and root of OmR40c1 and wild type rice were both seriously affected by salt stress. The concentration of Na+in OmR40c1 was about 1.38 times higher than that in wild type, together with a slight rise in the K+ concentration and the results suggest that OmR40c1 may act as a salt tolerance gene in enhancing rice salt tolerance especially at the adult stage.
Key words:Oryza meyeriana; OmR40c1; transgenic rice; salt tolerance

