基于PRLR-JAK-STAT5信号传导通路测定鹅催乳素的新方法
宋金委,李 辉,陈 哲,施振旦,王振勇*
(1.山东农业大学动物科技学院,泰安 271018; 2.江苏省农业科学院畜牧研究所,南京 210014)
基于PRLR-JAK-STAT5信号传导通路测定鹅催乳素的新方法
宋金委1,李辉2,陈哲2,施振旦2,王振勇1*
(1.山东农业大学动物科技学院,泰安 271018; 2.江苏省农业科学院畜牧研究所,南京 210014)
摘要:旨在建立鹅催乳素(Goose prolactin,gPRL)的高灵敏度的测定方法。本研究设计出基于PRLR-JAK-STAT5信号通路的荧光素酶报告基因系统。首先克隆鹅PRLR基因CDS区序列,合成信号转导和转录激活因子5 (Signal transducer and activator of transcription 5,STAT5) 信号应答序列,并分别插入真核表达载体pCMV6-Entry和荧光素酶报告载体pGL3-Enhancer中,构建成为信号接收载体和信号应答载体。然后将两载体同筛选基因载体pEZX-MR03及内参载体pRL-TK共转染到HEK293T细胞中,经嘌呤霉素筛选后获得稳定转染的转基因细胞株。分别用终浓度为0、30、60、90 ng·mL-1的PRL刺激转基因细胞,通过qRT-PCR和双荧光素酶检测系统测定在不同PRL浓度下转基因细胞株中荧光素酶(Luciferase, Luc)基因的相对表达量和相对活性的变化。筛选出10株成功整合有全部4个转基因载体的转基因细胞株,经过不同浓度PRL刺激后,筛选出一株细胞,其荧光素酶基因表达量和酶活性均表现出随PRL浓度升高而上调的趋势。结果表明,建立的基于PRLR-JAK-STAT5信号传导系统检测鹅PRL生物活性的新方法是可行的,为准确测定家禽PRL奠定基础。
关键词:鹅催乳素受体;信号转导;STAT5;荧光素酶报告基因;催乳素活性
催乳素(Prolactin,PRL)又名促乳素,因能促进鸽子嗉囊上皮增生,生成嗉囊乳而得名[1]。PRL的生理功能超过300多种,是名副其实的万能激素。PRL对禽类的繁殖活动具有重要的调控作用,对于季节性繁殖的禽类,PRL的季节性分泌可调节禽类对光照敏感性的变化,PRL分泌上升造成光钝化效应抑制繁殖活动,使禽类进入季节性非繁殖状态,反之则进入繁殖状态[2]。研究表明,雌禽产蛋可促进脑垂体分泌高浓度的PRL,从而促进和维持就巢行为[3],同时抑制垂体促性腺激素的分泌[4],使禽类的卵巢萎缩及功能下降,终止排卵和产蛋,最终引起繁殖力下降[5]。而中低浓度的PRL则表现出促进禽类的卵泡发育和产蛋性能[6-8]以及促进雄禽睾丸发育[9]的作用。因此PRL对禽类繁殖活动的调控表现出依分泌水平或血液浓度而异的复杂机制,在禽类繁殖调控中具有重要作用。尤其近年探索鹅反季节繁育技术取得较大进展,鹅PRL浓度水平在反季节繁育过程中对鹅不同繁殖阶段起到一定的指示作用[10-11],准确测定鹅PRL浓度可为鹅反季节繁育技术的深入研究提供帮助,因此,进行PRL的检测,在禽类繁育调控研究中具有重要意义。
PRL的检测方法主要包括免疫测定和生物学测定法两种。其中免疫测定法包括放射免疫法(RIA)、放射受体法(RRA)、酶联免疫法(ELISA)、化学免疫发光法(CIA)等。在当前多数检测禽类PRL的相关文献中均采用放免法,即利用天然PRL及其抗体或用重组PRL蛋白制备抗体进行放免分析。但是该方法缺点十分明显,主要表现在同位素衰变导致标记有效期短、损害试验人员健康和污染环境等方面[12],故目前应用有下降的趋势。而且放免法测定的是蛋白的免疫活性,而非生物活性,由于具有免疫活性的蛋白不一定具有生物活性,而在生物体内只有具有生物活性的蛋白才能发挥生理作用,因此放免法测定的蛋白浓度并不等同于生物体内有效蛋白浓度。本研究设计了基于PRLR-JAK-STAT5信号通路测定鹅PRL的方法,为开发针对鹅及禽类PRL蛋白的生物活性检测方法奠定基础。
1材料与方法
1.1试验材料
Trizol试剂、Lipo fectamine LTX、Opti-MEM购自Invitrogen公司。TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物技术有限公司。人胚肾细胞HEK293T购自凯基生物。pGL3-Enhancer、pRL-TK载体、双荧光素酶检测试剂盒购自Promega公司。鸡PRL标准品购自美国农业部。 筛选基因载体pEZX-MR03和pCMV6-Entry本实验室保存。PremixTaq酶、T4 DNA连接酶、pMD19-T、感受态细菌E.coliDH5α、内切酶、琼脂糖回收纯化试剂盒、质粒提取试剂盒均购自宝生物(大连)有限公司。中提去内毒素质粒试剂盒购自Axygen公司。基因组DNA提取试剂盒购自天根生化科技有限公司。嘌呤霉素购自MPbio公司。FastStart Universal SYBR Green Master(Rox)购自Roche公司。胎牛血清(FBS)、DMEM培养基、青链霉素混合液(100X) (Penicillin-Streptomycin Solution)双抗购自Gibco公司。
1.2方法
1.2.1鹅PRLR基因的克隆及表达载体的构建屠宰性成熟的健康扬州鹅,取卵巢组织,装入无菌冻存管液氮速冻后,于-70 ℃冰箱保存备用。根据GenBank收录的鹅PRLR基因序列(Gene ID:DQ209271.2),采用Oligo 6.0 软件设计鹅PRLR基因CDS区序列引物,并在上下游引物的5′端引入Hind III和XhoI酶切位点(表1)。Trizol法提取鹅卵巢总RNA,用1%的琼脂糖凝胶电泳验证RNA的完整性,并用Nanodrop2000(Thermo)紫外可见光分光光度计测定总RNA纯度和浓度。以提取的总RNA为模板,用全式金Trans Script One-Step gDNA Removal and cDNA Synthesis Super Mix反转录得到cDNA。 以cDNA为模板进行PCR扩增获得PRLR的CDS区,经测序验证后,双酶切凝胶纯化回收并定向克隆到真核表达载体pCMV6-Entry的Hind Ⅲ和XhoI位点,构建成pCMV6-PRLR-Entry表达载体,利用双酶切和测序验证所构建载体的准确性。
1.2.2重组STAT5双荧光素酶报告载体的构建根据已知的STAT5结合序列:AGATTTCTAGGAATTCAATCC,人工合成5个串联STAT5结合序列并定向克隆到pGL3-Enhancer的KpnⅠ和XhoⅠ位点中,构建成pGL3-(STAT5)5-Enhancer载体,利用双酶切和测序验证所构建载体的准确性。
1.2.3细胞转染,转基因细胞的筛选和验证将复苏并传代的293T细胞接种于6 孔板中,在含10%胎牛血清1%双抗的 DMEM中培养,当细胞生长至汇合率 60%~70%时,换培养基为DMEM,将去内毒素提取且线性化的pCMV6-PRLR-Entry、pGL3-(STAT5)5-Enhancer、pEZX-MR03和pRL-TK,采用脂质体Lipo fectamine LTX 转染细胞,6 h后换含10%胎牛血清1%双抗的DMEM继续培养。待细胞状态恢复后采用嘌呤霉素筛选,筛选过程:首先采用终浓度为1 μg·mL-1的嘌呤霉素进行高压筛选,6 d后,更换终浓度为0.5 μg·mL-1嘌呤霉素进行维持筛选。筛选16 d后,出现细胞克隆,待克隆长大后,在荧光显微镜下观察,然后采用滤纸胰酶消化方法挑取EGFP阳性克隆。将所挑取的细胞克隆扩大培养后冻存备用。根据Luc基因序列、人β-actin基因序列和克隆得到的鹅PRLR基因序列,设计检测引物(表1)。将得到的单克隆细胞株分别提基因组DNA,用基因组DNA为模板,用PRLR、Luc的引物分别进行PCR验证,筛选出稳定转染的单克隆细胞株。

表1 引物序列
1.2.4实时荧光定量PCR测定单克隆细胞株中鹅Luc基因的相对表达量复苏挑取的转基因细胞株于6孔板中,在含10%胎牛血清的 DMEM 中培养,当细胞生长至汇合率 70%~80%时,加入不同浓度的PRL,浓度梯度为0、30、60 ng·mL-1。继续培养6 h后,收集细胞提取总RNA并反转录为cDNA。以cDNA为模板,以β-actin为内参基因,以Luc和鹅PRLR引物用PremixTaq酶分别进行普通PCR检测鹅PRLR和Luc的表达。同时采用ABI7500进行实时荧光定量PCR测定Luc的相对表达量,采用2-△△Ct分析方法进行数据分析。
1.2.5荧光素酶的活性测定复苏挑取的转基因细胞株于 6 孔板中,在含10%胎牛血清的 DMEM 中培养,当细胞生长至汇合率 70%~80%时,加入不同浓度的PRL,浓度梯度为0、30、60和90 ng·mL-1。继续培养6 h后,收集细胞,每孔加入 20 μL收集细胞裂解缓冲液,室温摇晃 15 min 后,吹打细胞,收集裂解液至 96 孔白板,加入 100 μL荧光素酶分析剂(LARⅡ),放置发光检测仪Glomax(Promega)中,测定萤火虫(Firefly)荧光素酶活性。加入100 μL Stop &Glo Reagent,测定海肾(Renilla)荧光素酶活性。计算荧光素酶相对活性。发光仪程序设置:延迟 2 s,测定时间5 s。制定荧光素酶相对活性随PRL浓度变化量。
2结果
2.1pCMV6-PRLR-Entry和pGL3-(STAT5)5-Enhancer载体的构建
PCR获得了2 498 bp的鹅PRLR的CDS区(图1A)。经测序验证后,将该片段定向克隆到真核表达载体pCMV6-Entry中的HindⅢ和XhoⅠ位点,并进行双酶切和测序验证结果证明所构建的载体是正确的,表达载体示意图如图1B。将人工合成的(STAT5)5序列克隆到pGL3-Enhancer中的KpnⅠ和Xhod Ⅰ位点,载体示意图如图1C,并且通过测序验证证明所构建的载体是正确的。

M.DL5000 DNA marker;1,2.PRLR DNAA.PCR获得2 498 bp的鹅PRLR的CDS片段电泳图;B.利用Hind Ⅲ和Xho I酶切位点将PRLR定向克隆到真核表达载体pCMV6-Entry;C.利用KpnⅠ和Xho I酶切位点将(STAT5)5定向克隆到真核表达载体pGL3-EnhancerA.The sequence of CDS 2 498 bp region goose PRLR gene obtained by PCR;B.PRLR gene was eukaryotic expression cloned into the pCMV6-Entry vector by Hind III and Xho I restriction sites;C.(STAT5)5 was eukaryotic expression cloned into the pGL3-Enhancer vector by KpnⅠand Xho I restriction sites图1 pCMV6-PRLR-Entry和pGL3-(STAT5)5-Enhancer重组载体的示意图Fig.1 The schematic maps of the recombinant vectors pCMV6-PRLR-Entry and pGL3-(STAT5)5-Enhancer
2.2转基因细胞的制备与鉴定
将线性化的去内毒素pCMV6-PRLR-Entry Vector,pGL3-(STAT5)5-Enhancer,pEZX-MR03和pRL-TK转染细胞,经嘌呤霉素筛选后获得细胞单克隆,挑取后单克隆细胞株,在荧光显微镜488 nm波长激发下可观察到EGFP的表达(图2a),白光对照如图2b。
分别用PRLR和Luc的引物对单克隆细胞株基因组DNA进行PCR扩增,近200个单克隆细胞株中筛选获得10株PRLR和Luc都稳定转染的细胞株(图2c,2d)。
2.3转基因细胞对PRL应答的检测
对经PRL刺激后的转基因细胞株进行普通PCR,检测鹅PRLR和Luc的表达(图3a),可看出PRLR和Luc均有表达。同时采用ABI7500进行实时荧光定量PCR测定Luc的相对表达量(图3b),Luc相对表达量随着PRL浓度的上升而上升。
2.4Luc相对活性随PRL浓度变化的标准曲线
稳定转染基因的单克隆细胞株中,分别加PRL至终浓度分别为0、30、60、90 ng·mL-1,继续培养6 h后,测定Luc相对活性,制定Luc相对活性随PRL浓度变化的标准曲线(图4)。
3讨论
PRL是动物生殖过程中的重要调控激素,其功能的发挥同其它激素一样,只有通过其受体PRLR介导才能激活信号通路,并将信号传递至下游靶基因而发挥作用。PRLR是一种单链跨膜蛋白受体,属于细胞因子受体超家族,并且在多个组织中广泛表达。PRLR分子量介于34 000~37 000,由胞外域(Extracellular domain,ECD)、跨膜域(Transmembrane domain,TMD)和胞内域(Intracellular Domain,ICD)组成[13]。胞内域含有两个相当保守的区域box1和box2,近膜端的box1由脯氨酸和疏水氨基酸残基富集的8个氨基酸残基组成,由于脯氨酸特有的结构特征,box1内保守的P-x-P基序形成特异的结构而被转导分子所识别[14],box1主要参与与JAK2 ( Just another kinase 2 或janus kinase 2 )的结合以及JAK2的磷酸化。胞内域中存在着对信号传导至关重要的JAK ( Just another kinase 或janus kinase ) 家族。该家族是一种非受体型酪氨酸激酶,家族中不同成员参与不同类型的细胞因子信号传导;STAT(Signal transducers and activators of transcription,信号转导和转录激活因子) 家族是在研究干扰素对基因表达的调控中被认识的,是一种DNA 结合蛋白[15]。JAK-STAT途径是近年来新发现的一条细胞因子信号转导途径,广泛参与细胞的增殖、分化、凋亡、免疫调节等过程,是众多细胞因子信号转导的重要途径[16]。

M.DL500 DNA marker;1~23.不同单克隆细胞株基因组DNA;24.阳性对照。a.HEK 293T单克隆细胞株绿色荧光图片(10×20);b.HEK 293T单克隆细胞株白光图片(10×20);c.单克隆细胞株基因组DNA用PRLR验证引物进行PCR的结果电泳图;d.单克隆细胞株基因组DNA用Luc验证引物进行PCR的结果电泳图M.DL500 DNA marker;1-23.The genomic DNA of monoclonal cell lines;24.Positive control.a.The image of HEK 293T cell clones with green fluorescence (10×20);b.The image of HEK 293T cell clones with white light (10×20);c.The results of PCR of the genomic DNA of monoclonal cell lines with the PRLR gene verificating primer;d.The results of PCR of the genomic DNA of monoclonal cell lines with the luciferase gene verificating primer图2 转基因细胞鉴定Fig.2 The schematic diagram of identification of transgenic cell

M.DL500 DNA marker;1~3.0 ng·mL-1PRL时β-actin、PRLR和Luc表达;4~6.30 ng·mL-1PRL时β-actin、PRLR和Luc表达;7~9.60 ng·mL-1PRL时β-actin、PRLR和Luc表达。a.普通PCR检测鹅PRLR和Luc的表达电泳图;b.Luc相对表达量随PRL浓度变化图M.DL500 DNA marker;1-3.The expression of β-actin,PRLR and Luc when the PRL is 0 ng·mL-1;4-6.The expression of β-actin,PRLR and Luc when the PRL is 30 ng·mL-1;7-9.The expression of β-actin,PRLR and Luc when the PRL is 60 ng·mL-1.a.The electrophoresis chart of expression of luciferase and PRLR detected by common PCR;b.The graph of relative expression of Luc with the change of PRL concentration图3 转基因细胞Luc基因的表达检测Fig.3 The expression detection of luciferase gene in the transgenic cell
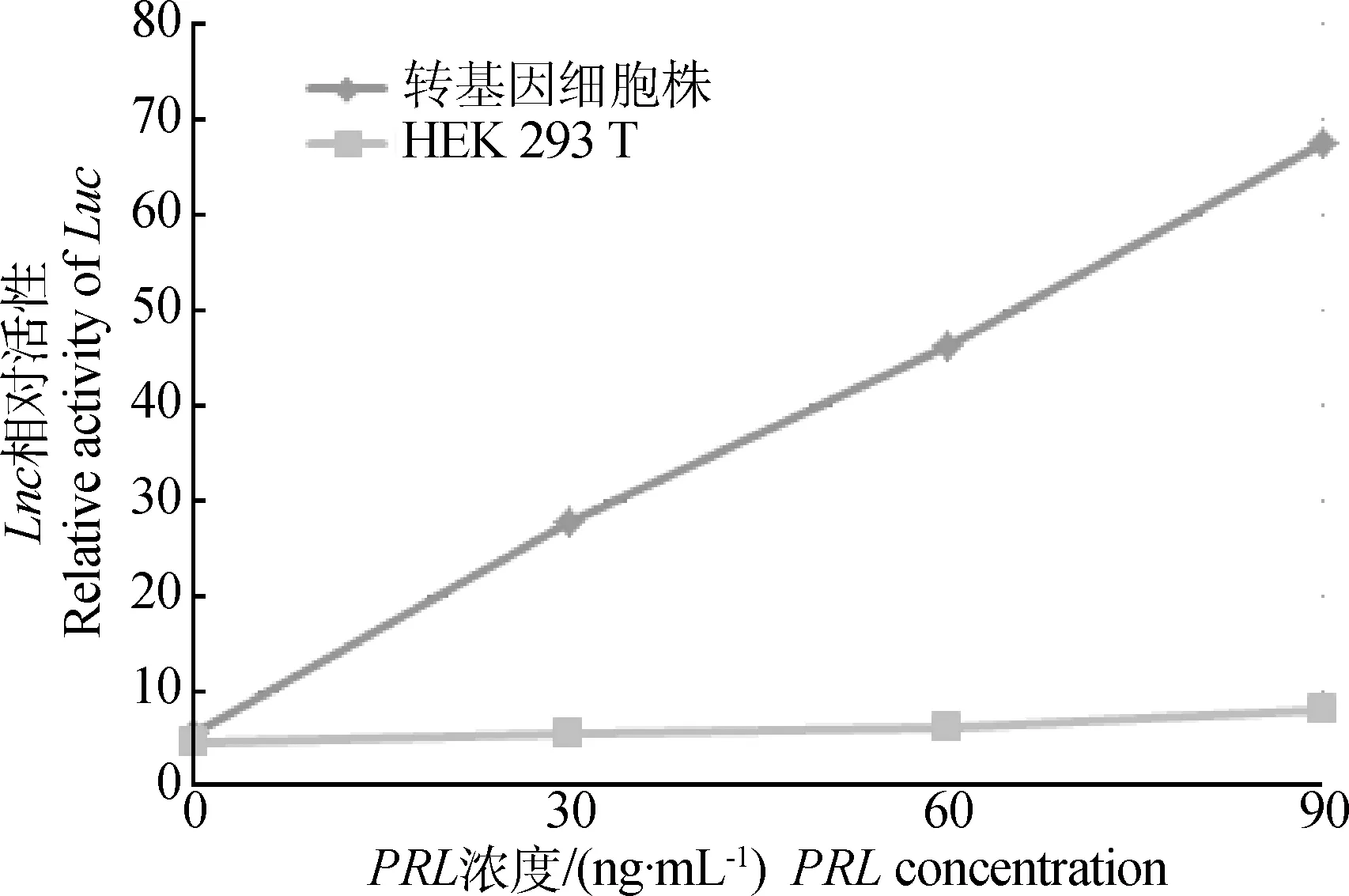
图4 Luc相对活性随PRL浓度变化的标准曲线Fig.4 The standard curve of relative activity of Luc with PRL concentration
PRL分子含有两个结合位点,PRL分子的结合位点1先与细胞表面受体的ECD结合后形成激素受体二聚体,激素受体二聚体的形成是结合位点2与第2个PRLR ECD结合的先决条件,最后形成一个激素结合两个受体分子的三聚体,三聚体激活受体胞内域的JAK2的活化,活化的JAK2募集并磷酸化STAT5 的特异性酪氨酸残基,随即磷酸化的STAT5形成二聚体,然后通过核孔进入细胞核内,结合到靶基因启动子的特异性的γ-干扰素激活位点序列(GAS)(TTCNNNGAA)并启动靶基因的转录[17]。
基于上述的PRL信号传导系统,开发成一种新型高灵敏度的检测鹅及禽类PRL生物活性的方法。目前有一些蛋白生物活性检测方法也是应用JAK-STAT途径产生并传导细胞内信号,可准确快速测定蛋白生物活性,特别是测定瘦素(Leptin)生物活性[18-22]。本试验首先克隆全长为2 498 bp的鹅PRL受体基因,将其插入真核表达载体pCMV6-Entry中,作为信号接受系统。然后根据GAS序列,人工合成STAT5的结合序列,为了提高应答效率,将STAT5序列连续重复5次后合成,并插入含有萤火虫荧光素酶基因的pGL3-Enchancer中,作为信号应答系统。STAT5广泛存在于各个组织和细胞中[17],故利用HEK293T细胞作为宿主构建检测模型。HEK293T 细胞自身含有Neo抗性基因,本研究选择含有EGFP标记基因和嘌呤霉素抗性基因的pEZX-MR03质粒与所构建的载体进行共转染,利用EGFP和嘌呤霉素筛选转基因细胞株。筛选出的转基因细胞经PRL刺激后,通过实时荧光定量PCR测定Luc基因的相对表达量。结果发现,本试验构建的测定方法确实使Luc基因的相对表达量随PRL浓度上升明显上调,而对照组荧光素酶活性随PRL浓度上升几乎无变化,证明基于PRLR-JAK-STAT5信号传导构建的检测系统能够用于灵敏的反映鹅PRL浓度变化。在目前试验的测定范围,荧光素酶相对活性随PRL浓度变化呈现线性相关的趋势,证明该检测系统能够用于定量的检测鹅PRL浓度水平,并且本系统检测的是具有生物活性的PRL蛋白,能够真实反映鹅体内PRL有效蛋白浓度。本检测系统在加入PRL 6 h后即可直接检测激素生物活性水平,与目前检测禽类PRL采用的放免法相比,节省了测定的前处理过程,更加快速,也更加安全环保。将进一步摸索扩大本测定方法的测定范围,完善测定标准曲线,进一步改进和改良测定方法,为实际的科研应用奠定基础。
4结论
本研究建立了测定鹅血清中催乳素浓度的蛋白生物活性检测方法,并筛选获得稳定转染成功的单克隆细胞株,为鹅PRL准确测定奠定基础,同时也为其他蛋白激素的测定提供参考。
参考文献(References):
[1]王锋.动物繁殖学[M].北京:中国农业大学出版社,2012:53-54.
WANG F.Animal reproduction science[M].Beijing:China Agricultural University Press,2012:53-54.(in Chinese)
[2]李静,滕卫平.催乳素的免疫调节作用[J].国外医学内分泌学分册,2000,20(2):99-101.
LI J,TENG W P.Immune regulation of prolactin[J].ForeignMedicalSciencesEndocrineSection,2000,20(2):99-101.(in Chinese)
[3]施振旦,陈峰,毕英佐.禽类就巢发生和调控研究进展[J].黑龙江动物繁殖,2000,8(3):37-41.
SHI Z D,CHEN F,BI Y Z.Research on regulation of poultry seasonal reproduction[J].HeilongjiangJournalofAnimalReproduction,2000,8(3):37-41.(in Chinese)
[4]刘颖,施振旦,黄运茂,等.鸡催乳素和抑制素-α亚基重组蛋白的构建及表达[J].中国兽医学报,2002,22(4):365-367.
LIU Y,SHI Z D,HUANG Y M,et al.Construction and expression of recombinant proteins based on chicken prolactin and inhibin α subunit fragment[J].ChineseJournalofVeterinaryScience,2002,22(4):365-367.(in Chinese)
[5]杨海明.扬州鹅繁殖的光照调控及下丘脑基因差异表达研究[D].扬州:扬州大学,2014.
YANG H M.Study on light regulation and differential expression of genes in hypothalamus during Yangzhou geese reproductive cycle[D].Yangzhou:Yangzhou University,2014.(in Chinese)
[6]黄运茂,施振旦.广东地方鹅产蛋—就巢周期调控模式的探讨[J].黑龙江畜牧兽医,2007(7):57-58.
HUANG Y M,SHI Z D.Study on the regulation pattern of Guangdong local goose seasonal reproduction[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2007(7):57-58.(in Chinese)
[7]施振旦,朱基美,黄运茂,等.调节马岗鹅繁殖特性的初步结果和结论[J].中国草食动物,2001,3(1):12-15.SHI Z D,ZHU J M,HUANG Y M,et al.Preliminary results and conclusions of the regulation of the reproductive characteristics of Magang goose[J].ChinaHerbivores,2001,3(1):12-15.(in Chinese)
[8]施振旦,黄祖汉.家鸡催乳素放射免疫测定法的建立[J].核农学报,2000,14(1):36-39.
SHI Z D,HUANG Z H.Using micro-quantity of chloraminet in chicken prolactin labelling and radioimmunoassay[J].ActaAgriculturaeNucleataeSinica,2000,14(1):36-39.(in Chinese)
[9]DAWSON A,SHARP P J.The role of prolactin in the development of reproductive photorefractoriness and postnuptial molt in the European starling (Sturnusvulgaris)[J].Endocrinology,1998,139(2):485-490.
[10]SHI Z D,HUANG Y M,LIU Z,et al.Seasonal and photoperiodic regulation of secretion of hormones associated with reproduction in Magang goose ganders[J].DomestAnimEndocrinol, 2007,32(3):190-200.
[11]HUANG Y M,SHI Z D,LIU Z,et al.Endocrine regulations of reproductive seasonality,follicular development and incubation in Magang geese[J].AnimReprodSci,2008,104(2-4):344-358.
[12]郭日红.鹅催乳素ELISA分析方法的建立[D].广州:华南农业大学,2013.
GUO R H.Devlopment of enzyme-linked immunoadsorbent assay (ELISA) for measuring goose prolactin[D].Guangzhou:South China Agriculture University,2013.(in Chinese)
[13]YAMASHITA S,TAKAYANAGI A,SHINIZU N.Temporal and cell-type specific expression of c-fos and c-jun protooncogenes in the mouse uterus after estrogen stimulation[J].Endocrinology,1996,137(12):5468-5475.
[14]GOFFIN V,FERRAG F,KELLY P A.Chapter 1 Molecular aspects of prolactin and growth hormone receptors[J].AdvMolCellEndocrinol,1998,2:1-33.[15]周永明,田胜利,周韶虹,等.骨髓增生异常综合征患者JAK2和STAT5基因表达的变化[J].临床血液学杂志,2007,20(2):70-72.
ZHOU Y M,TIAN S L,ZHOU S H,et al.The comparative study on JAK2/STAT5 signal transduction pathway in myelodysplastic syndrome[J].JournalofClinicalHematology,2007,20(2):70-72.(in Chinese)
[16]孙胜利.脑缺血和细胞缺氧/复氧过程中JAK-STAT信号转导相关基因的表达[D].上海:第二军医大学,2006.
SUN S L.JAK/STAT-related gene expression during transient focal cerebral ischemia/reperfusion and during cell hypoxia/reoxygenation[D].Shanghai:Second Military Medical University,2006.(in Chinese)
[17]SCHINDLER C,DARNELL J E.Transcriptional responses to polypeptide ligands:the JAK-STAT pathway[J].AnnuRevBiochem,1995,64:621-651.
[18]ADACHI H,TAKEMOTO Y,BUNGO T,et al.Chicken leptin receptor is functional in activating JAK-STAT pathwayinvitro[J].JEndocrinol,2008,197(2):335-342.
[19]ROSENBLUM C I,TOTA M,CULLY D,et al.Functional STAT 1 and 3 signaling by the leptin receptor (OB-R);reduced expression of the rat fatty leptin receptor in transfected cells[J].Endocrinology,1996,137(11):5178-5181.
[20]ROSENBLUM C I,VONGS A,TOTA M R,et al.A rapid,quantitative functional assay for measuring leptin[J].MolCellEndocrinol,1998,143(1-2):117-123.[21]HEN G,YOSEFI S,RONIN A,et al.Monitoring leptin activity using the chicken leptin receptor[J].JEndocrinol,2008,197(2):325-333.
[22]OHKUBO T,HIROTA K,MURASE D,et al.Avian blood induced intranuclear translocation of STAT3 via the chicken leptin receptor[J].CompBiochemPhysiolBBiochemMolBiol, 2014,174:9-14.
(编辑程金华)
doi:10.11843/j.issn.0366-6964.2016.07.011
收稿日期:2016-01-07
基金项目:国家自然科学基金项目(31372314);江苏省自然科学基金(BK20130718)
作者简介:宋金委(1989-),女,满族,河北青县人,硕士生,主要从事禽类品种改良和繁育研究,E-mail:915352256@qq.com *通信作者:王振勇,博士,副教授,E-mail: wzy@sdau.edu.cn
中图分类号:S835.2
文献标志码:A
文章编号:0366-6964(2016)07-1389-07
A Novel Method of Detecting Goose Prolactin Based on PRLR-JAK-STAT5 Signal Transduction Pathway
SONG Jin-wei1,LI Hui2,CHEN Zhe2,SHI Zhen-dan2,WANG Zhen-yong1*
(1.CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271018,China;2.InstituteofAnimalScience,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
Abstract:In order to develop a high sensitive method of detecting goose prolactin,luciferase detecting system based on PRLR-JAK-STAT5 signal transduction pathway was designed in the present study.Firstly the CDS region of goose PRLR gene was cloned,the signal transducer and activator of transcription 5(STAT5) was artificially synthesized and inserted into the eukaryotic expression vector pCMV6-Entry and luciferase reporter pGL3-Enhancer plasmid as signal receiver vector and signal responder vector respectively.Secondly,the two recombinant vectors along with puromycin screening vector pEZX-MR03 and internal control pRL-TK vector were transfected into HEK293T cells.After puromycin screening,stable transgenic cell lines were isolated and stimulated by a serial of different concentrations of chicken PRL (0,30,60,90 ng·mL-1).Finally the mRNA relative expression level and enzyme activity of luciferase enzyme were detected by qRT-PCR and dual-luciferase detection system.Results showed that 10 stable transgene cell lines carried the 4 vectors were isolated.After treated with different concentrations of chicken PRL,luciferase gene mRNA expression level was up regulated and luciferase enzyme activity also enhanced in dose dependent manner in one of these 10 cell lines.These results demonstrated that it was feasible of detecting PRL bioactivity using the constructed PRLR-JAK-STAT5 signal transduction system and could be further used in measuring poultry PRL concentrations.
Key words:goose prolactin receptor;signal transduction;signal transducer and activator of transcription 5;luciferase reporter gene;prolactin bioactivity

