金黄色葡萄球菌对奶牛乳腺成纤维细胞TGF-β1/Smad信号通路及其转分化的影响
杨 彬,徐丹丹,孙志鹏,赵佳琦,闫博巍,李晓婷,武 瑞
(黑龙江八一农垦大学动物科技学院,大庆 163319)
金黄色葡萄球菌对奶牛乳腺成纤维细胞TGF-β1/Smad信号通路及其转分化的影响
杨彬,徐丹丹,孙志鹏,赵佳琦,闫博巍,李晓婷,武瑞*
(黑龙江八一农垦大学动物科技学院,大庆 163319)
摘要:为探索金黄色葡萄球菌(S.aureus)对奶牛乳腺成纤维细胞(BMFB)TGF-β1/Smad信号通路及其转分化的影响,用热灭活金黄色葡萄球菌(0、104、105、106、107和108 CFU·mL-1)刺激BMFB,24 h后采用Real-time PCR 方法检测TGF-β1、α-SMA和collagen-Ⅰ mRNA的转录量,Western blot方法检测α-SMA、collagen-Ⅰ及p-Smad2/3蛋白的表达量。使用TGF-β1受体特异性抑制剂SB-431542预处理细胞,再用105 CFU·mL-1热灭活金黄色葡萄球菌刺激细胞,24 h后采用Real-time PCR方法检测α-SMA和collagen-Ⅰ mRNA的转录量,Western blot方法检测α-SMA、collagen-Ⅰ及p-Smad2/3蛋白的表达量,免疫荧光法检测collagen-Ⅰ蛋白的表达量。结果显示,不同浓度热灭活金黄色葡萄球菌处理细胞的TGF-β1 mRNA的转录量显著升高(P <0.05或P <0.01),其中以105 CFU·mL-1刺激组的TGF-β1 mRNA的转录量最高。不同浓度灭活的金黄色葡萄球菌处理细胞的α-SMA、collagen-Ⅰ及p-Smad2/3的表达量均能显著升高(P<0.05或P <0.01),其中以105 CFU·mL-1刺激组的α-SMA、collagen-Ⅰ及p-Smad2/3的表达量最高。抑制剂SB-431542能够极显著抑制α-SMA、collagen-Ⅰ及p-Smad2/3的表达量(P<0.01)。结果提示,金黄色葡萄球菌能够通过TGF-β1/Smad信号通路诱导奶牛乳腺成纤维细胞转分化为肌成纤维细胞,本研究为揭示金黄色葡萄球菌性乳腺炎发生硬化的机制奠定基础。
关键词:金黄色葡萄球菌;奶牛乳腺成纤维细胞;α-SMA;collagen-Ⅰ;p-Smad2/3
金黄色葡萄球菌是引起临床、亚临床及慢性乳腺炎的最主要致病菌之一[1]。金黄色葡萄球菌性乳腺炎能够导致乳腺成纤维细胞的异常增生,从而引起结缔组织的增生,增生的结缔组织向腺泡腔和导管腔内陷,引起乳腺导管的阻塞,最终受损的乳腺区域由于纤维变性而失去其泌乳功能[2]。器官纤维化的病理特征多表现为肌成纤维细胞的激活和细胞外基质的过度沉积,并最终导致器官正常结构的消失和功能永久性丧失[3-4]。细胞外基质是一种不可溶性蛋白质,包括各型胶原蛋白(collagen)、弹性蛋白、纤连蛋白、蛋白多糖等成分[5]。肌成纤维细胞是导致细胞外基质异常沉积的主要细胞,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是肌成纤维细胞特异的标志蛋白[6]。成纤维细胞并不是终末分化的细胞类型,而且保留了被激活后分化成纤维母细胞亚型的能力,肌成纤维细胞在正常组织器官中很少存在,当组织器官受到损伤后由其他类型细胞(主要是成纤维细胞)转分化而来[7]。
研究证明转化生长因子β1(TGF-β1)是促进组织器官纤维化最关键的细胞因子之一。在纤维变性疾病过程中,实质细胞和结缔组织细胞合成并分泌TGF-β1,TGF-β1能够诱导成纤维细胞等细胞转分化为肌成纤维细胞,促进成纤维细胞及肌成纤维细胞细胞外基质的合成与沉积[8]。TGF-β1是通过其Ⅰ型受体(TGF-βRⅠ)和Ⅱ型受体(TGF-βRⅡ)及其下游Smad信号分子发挥作用,TGF-β1/活动素连续激活TGF-βRⅡ、TGF-βRⅠ,TGF-βRⅠ使细胞内质-核信号分子Smad2/3磷酸化,Smad2/3与Smad4结合后转位到细胞核中参与基因调控[9-10]。
研究表明金黄色葡萄球菌诱导的慢性奶牛乳腺炎TGF-β1、受体TGF-βRⅠ及collagen-Ⅰ的表达显著升高[11]。本课题组前期证明热灭活的金黄色葡萄球菌能够诱导奶牛乳腺成纤维细胞α-SMA及collagen-Ⅰ表达的升高,表明金黄色葡萄球菌可以使奶牛乳腺成纤维细胞转分化为肌成纤维细胞,但是金黄色葡萄球菌诱导奶牛乳腺成纤维细胞发生转分化的机制仍不清楚。因此,本研究拟从TGF-β1/Smad信号通路的角度探讨其在奶牛乳腺纤维化中的作用,为防治金黄色葡萄球菌感染引起奶牛乳腺纤维化提供理论依据。
1材料与方法
1.1试验材料
BMFB由本实验室分离纯化鉴定并冻存;金黄色葡萄球菌由本实验室保存;DMEM/F12干粉培养基购自Gibco公司;胎牛血清购自Hyclone公司;RNA提取试剂盒、反转录试剂盒、荧光定量染料均购自TaKaRa公司;α-SMA抗体、GAPDH抗体均购自Abcam公司;collagen-Ⅰ抗体购自Novus公司;p-Smad2/3抗体购自Santa Cruz公司;山羊抗兔IgG-HRP、兔抗山羊IgG-HRP、FITC标记山羊抗兔IgG均购自北京中衫金桥公司;SB-431542购自Selleck公司;RIPA细胞裂解液购自康为世纪公司;蛋白酶抑制剂购自Sigma公司;预染蛋白质Marker购自Thermo公司;SDS-PAGE凝胶配制试剂盒、ECL化学超敏显色液均购自索莱宝公司。
1.2热灭活菌液的制备
将冻存的S.aureus进行复苏活化,采用平板计数法计算菌液浓度,用培养基将菌液稀释为104、105、106、107、108CFU·mL-1,将菌液70 ℃温育30 min灭活备用。
1.3热灭活菌液刺激细胞
将冻存的3~4代BMFB用胰酶消化悬浮,计数后按1×105·mL-1的浓度接种于细胞培养板中,待细胞生长汇合铺成单细胞层时,对照组以不加菌液的细胞培养基培养,处理组加入不同浓度灭活菌液共培养24 h,分别收集各组细胞总RNA进行TGF-β1、α-SMA、collagen-Ⅰ和GAPDHmRNA的荧光定量PCR检测,分别收集各组细胞总蛋白质进行α-SMA、collagen-Ⅰ 、p-Smad2/3和GAPDH蛋白的Western blot检测。在检测抑制剂SB-431542预处理细胞后灭活菌液对细胞中α-SMA和collagen-Ⅰ表达的影响试验中,将冻存的BMFB复苏培养接种在细胞培养板,阴性对照组只加细胞培养基培养及只加SB-431542(10 μmol·L-1),阳性对照组加入105CFU·mL-1灭活菌液,TGF-β1受体特异性抑制剂处理组加入SB-431542(10 μmol·L-1)孵育1 h,然后加入105CFU·mL-1灭活菌液共24 h,分别收集各组细胞总RNA进行α-SMA、collagen-Ⅰ和GAPDHmRNA的荧光定量PCR检测,分别收集各组细胞总蛋白质进行α-SMA、collagen-Ⅰ、p-Smad2/3和GAPDH蛋白的Western blot检测,并进行collagen-Ⅰ的免疫荧光检测。
1.4TGF-β1、α-SMA和collagen-Ⅰ mRNA的检测
根据GenBank中TGF-β1、α-SMA、collagen-Ⅰ和GAPDH的序列,设计并合成引物(表1),利用RNA提取试剂盒提取各组细胞总RNA,利用反转录试剂盒进行反转录制备cDNA,利用SYBR染料进行荧光定量PCR检测。反应程序:95 ℃ 3 min、95 ℃ 5 s、60 ℃ 30 s,40个循环,以GAPDHmRNA的转录水平为内参对TGF-β1、α-SMA和collagen-Ⅰ mRNA的相对转录水平进行计算。
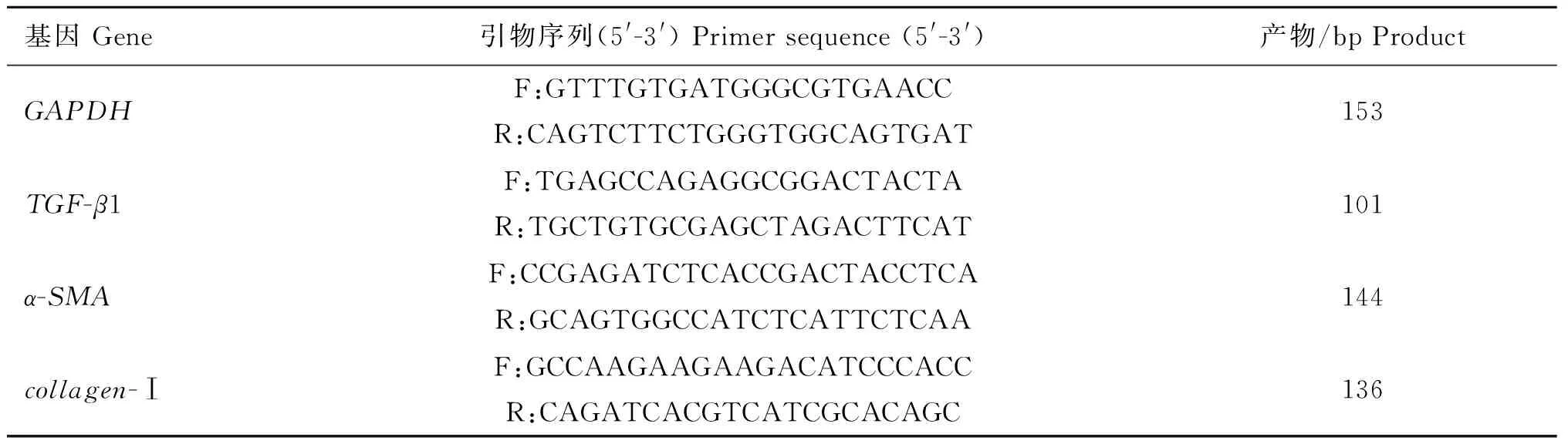
表1 荧光定量PCR用到的引物和序列
1.5Western blot检测p-Smad2/3、α-SMA和 collagen-Ⅰ 蛋白
待细胞培养至预定时间,弃培养基,用PBS清洗细胞。然后冰上用RIPA裂解细胞,细胞刮刀刮取细胞,吸取裂解液进行12 000 r·min-14 ℃离心10 min。吸取上清液,BCA法测定蛋白质浓度。加入上样缓冲液沸水煮10 min后进行SDS-PAGE胶电泳。采用BIO-RAD垂直电泳系统进行常规SDS-PAGE电泳。电泳后,采用BIO-RAD的转印仪将样品转移至PVDF膜,将膜置于封闭液(5%脱脂乳的PBST)室温封闭2 h,加一抗,4 ℃冰箱过夜。洗膜后将膜孵育在含二抗的PBST溶液中,室温下孵育1 h,用ECL试剂进行显色,于凝胶成像系统中进行检测,Western blot条带采用Quantity one软件进行灰度值分析计算,重复6次,取其平均值,计算标准偏差,以目的蛋白质灰度值/内参蛋白灰度值表示相对定量结果。
1.6免疫荧光方法检测collagen-Ⅰ的蛋白质表达
细胞爬片后,用4%多聚甲醛固定20 min,PBS缓冲液冲洗3次,0.5%Triton处理10 min,PBS冲洗3次,正常血清封闭液封闭30 min后,分别滴加一抗兔collagen-Ⅰ抗体(1∶100稀释),4 ℃过夜。洗涤后滴加荧光FITC标记山羊抗兔IgG二抗(1∶100稀释),室温下作用90 min,PBS冲洗3次,防淬灭剂封片、镜检、照相。
1.7统计分析
采用SPSS17.0统计软件进行单因素方差分析,P<0.05或P<0.01为具有统计学差异。
2结果
2.1金黄色葡萄球菌对BMFBα-SMA、collagen-Ⅰ和TGF-β1 mRNA转录的影响
用104、105、106、107、108CFU·mL-1的热灭活菌液刺激BMFB 24 h,荧光定量PCR方法检测α-SMA、collagen-Ⅰ和TGF-β1 mRNA结果显示,不同浓度的热灭活菌均可以使α-SMA、collagen-Ⅰ和TGF-β1的mRNA转录水平显著升高(P<0.05或P<0.01),其中以105CFU·mL-1刺激组的α-SMA、collagen-Ⅰ和TGF-β1的mRNA转录水平最高(图1)。

A.α-SMA;B. collagen-Ⅰ;C.TGF-β1;*.P<0.05;**.P<0.01图1 热灭活金黄色葡萄球菌刺激BMFB的α-SMA、collagen-I和TGF-β1荧光定量PCR分析Fig.1 Real-time PCR analysis of α-SMA,collagen-Ⅰ,TGF-β1 in BMFB stimulated with heat-killed S.aureus (HKSA)
2.2 金黄色葡萄球菌对BMFB α-SMA、collagen-Ⅰ和p-Smad2/3蛋白表达的影响
用104、105、106、107、108CFU·mL-1的灭活菌液刺激BMFB 24 h,Western blot方法检测结果显示,不同浓度的热灭活菌均可以使α-SMA、collagen-Ⅰ和p-Smad2/3的蛋白表达水平显著升高(P<0.05或P<0.01),其中以105CFU·mL-1刺激组的α-SMA、collagen-Ⅰ和p-Smad2/3的蛋白质表达水平最高(图2)。

A.Western blot图;B~D.Western blot平均灰度值;*.P<0.05;**.P<0.01A.Western blot image;B-D.The Western blot average grey value;*.P<0.05;**.P<0.01图2 热灭活金黄色葡萄球菌刺激BMFB的α-SMA、collagen-Ⅰ和p-Smad2/3免疫印迹分析Fig.2 Western blot analysis of α-SMA,collagen-Ⅰ and p-Smad2/3 in BMFB stimulated with heat-killed S.aureus (HKSA)
2.3SB-431542抑制金黄色葡萄球菌诱导BMFB α-SMA、collagen-Ⅰ和p-Smad2/3的表达
分别用105CFU·mL-1的灭活菌刺激BMFB 24 h,用SB-431542预处理细胞1 h后加入105CFU·mL-1灭活菌液,荧光定量PCR方法检测α-SMA和collagen-Ⅰ的mRNA转录水平,结果显示,与灭活菌刺激组比较,SB-431542预处理后加灭活菌刺激组的α-SMA和collagen-Ⅰ的mRNA转录水平极显著降低(P<0.01)(图3)。Western blot方法检测结果显示,与灭活菌刺激组比较,SB-431542预处理后加灭活菌刺激组的α-SMA、collagen-Ⅰ和p-Smad2/3的蛋白质表达水平极显著降低(P<0.01)(图4)。说明SB-431542能够显著抑制BMFB α-SMA和collagen-Ⅰ的表达。免疫荧光方法检测结果显示,SB-431542预处理后加灭活菌刺激组的collagen-Ⅰ荧光染色强度较灭活菌刺激组明显减弱(图5)。
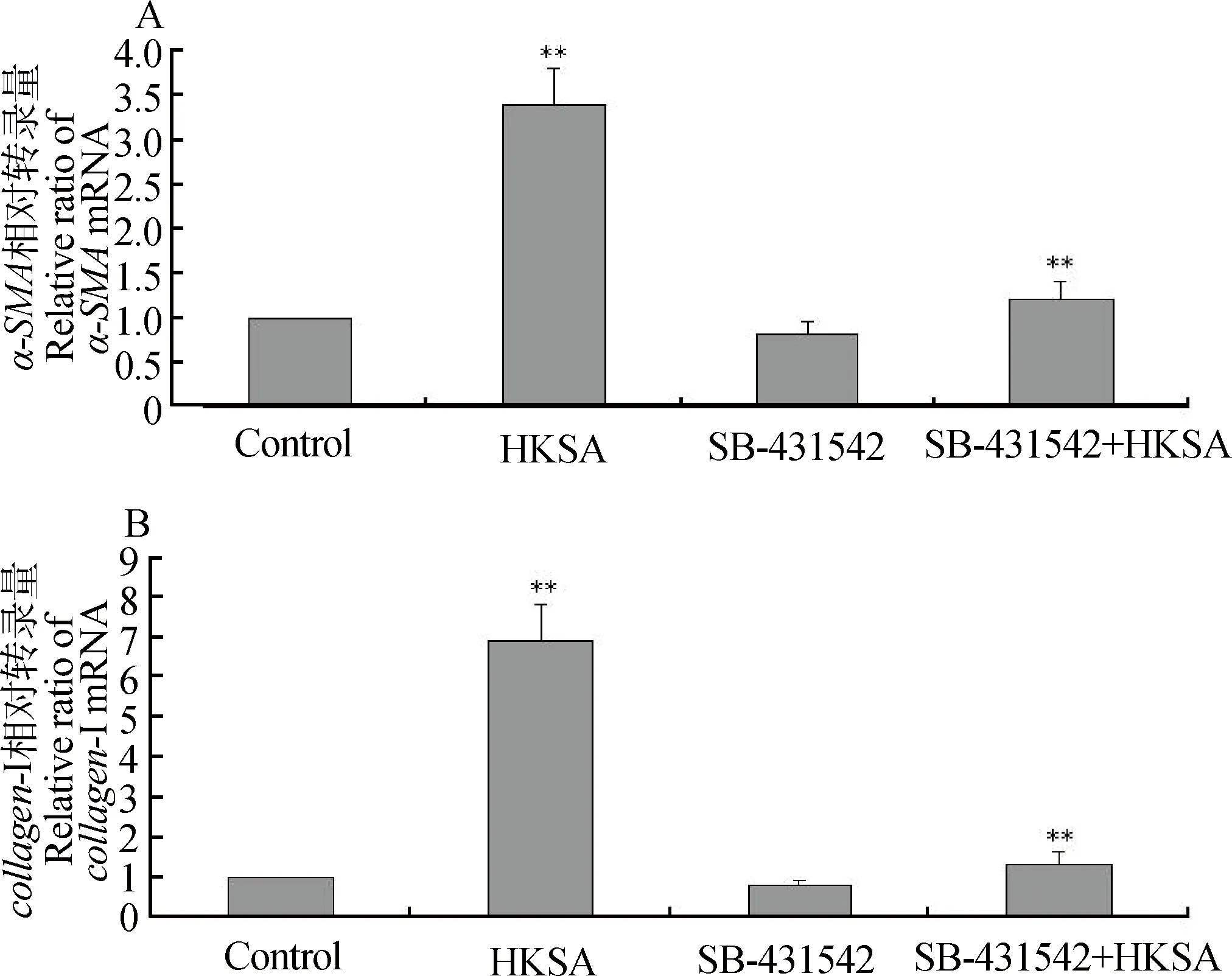
A.α-SMA的荧光定量PCR分析;B.collagen-Ⅰ的荧光定量PCR分析;*.P<0.05;**.P<0.01A.Real-time PCR analysis of α-SMA;B.Real-time PCR analysis of collagen-Ⅰ;*.P<0.05;**.P<0.01图3 SB-431542抑制金黄色葡萄球菌诱导BMFB α-SMA和collagen-Ⅰ mRNA的表达Fig.3 SB-431542 inhibits HKSA induced α-SMA and collagen-Ⅰ mRNA in BMFB

A.Western blot图;B~D.Western blot平均灰度值;*.P<0.05;**.P<0.01A.Western blot image;B-D.The Western blot average grey value;*.P<0.05;**.P<0.01图4 SB-431542抑制金黄色葡萄球菌诱导BMFB α-SMA、collagen-Ⅰ和p-Smad2/3蛋白表达的免疫印迹分析Fig.4 Western blot analysis of HKSA induced α-SMA,collagen-Ⅰ and p-Smad2/3 in BMFB and inhibition by SB-431542

A.未刺激对照组;B.灭活菌刺激组;C.SB-431542预处理后灭活菌刺激组A.BMFB without stimulation;B.BMFB stimulated with HKSA;c.BMFB treated with SB-431542 and HKSA图5 SB-431542抑制金黄色葡萄球菌诱导BMFB collagen-Ⅰ 蛋白表达的免疫荧光染色(200×)Fig.5 Immunofluorescence staining of HKSA induced collagen-Ⅰ in BMFB and inhibition by SB-431542 (200×)
3讨论
金黄色葡萄球菌感染能够诱导奶牛乳腺细胞TNF-α、IL-1、IL-6等促炎性细胞因子的免疫反应[12-13]。这些细胞因子参与了组织的损伤修复及肉芽组织的增生。在肉芽组织增生过程中,成纤维细胞被激活并表达α-SMA,成纤维细胞转分化为肌成纤维细胞,这些肌成纤维细胞合成细胞外基质并造成细胞外基质的沉积[14]。成纤维细胞能够产生炎性细胞因子并对多种炎性细胞因子(如TGF-β1、IL-1、IL-6等)产生应答反应,研究发现外源TGF-β1能够使奶牛乳腺成纤维细胞α-SMA和collagen-Ⅰ的表达水平显著增高[15],成纤维细胞在急慢性炎症及炎症消退中发挥重要作用[7]。活菌会导致细胞在几小时之内死亡,本研究用热灭活金黄色葡萄球菌刺激BMFB能显著促进TGF-β1、α-SMA、collagen-Ⅰ mRNA的升高,其原因可能是由于金黄色葡萄球菌刺激成纤维细胞分泌细胞因子诱导成纤维细胞发生表型转化,而TGF-β1是促进成纤维细胞转分化为肌成纤维细胞及细胞外基质合成的关键细胞因子。
TGF-β1/Smad信号通路在许多组织发生纤维化过程中起重要作用[8],Smads作为TGF-β细胞内信号传递分子调控细胞膜信号转导,Smad2/3是活化型Smad蛋白,为TGF-β1下游调节因子,肝、肾纤维化的形成与Smad2/3密切相关[16-17]。本研究用热灭活金黄色葡萄球菌刺激BMFB能够促进TGF-β1 mRNA、α-SMA、collagen-Ⅰ、p-Smad2/3的蛋白质表达水平显著升高,提示金黄色葡萄球菌可能通过TGF-β1/Smad信号通路诱导奶牛乳腺成纤维细胞转分化为肌成纤维细胞。106、107、和108CFU·mL-1浓度的灭活菌液刺激BMFB诱导TGF-β1 mRNA的转录水平没有105CFU·mL-1诱导的水平高,可能是由于高浓度菌液刺激BMFB产生的其他细胞因子(如TNF-α)抑制了TGF-β1的分泌所致[18]。
SB-431542可通过阻断TGF-β1与Ⅰ型受体的结合,改善TGF-β1/Smad信号通路介导产生的纤维化。研究表明乙醇能促进心肌成纤维细胞转分化为肌成纤维细胞,并且促进TGF-β和collagen-Ⅰ的升高,SB-431542能够减弱乙醇诱导的成纤维细胞的激活[19]。SB-431542通过抑制Smad2/3的磷酸化而抑制百草枯诱导Ⅱ型肺泡上皮细胞的转分化[20]。本研究发现SB-431542抑制热灭活金黄色葡萄球菌诱导BMFB α-SMA和collagen-Ⅰ的表达,提示SB-431542通过抑制TGF-β1/Smad信号通路从而抑制金黄色葡萄球菌诱导BMFB转分化为肌成纤维细胞。
4结论
金黄色葡萄球菌能够通过TGF-β1/Smad信号通路诱导奶牛乳腺成纤维细胞转分化为肌成纤维细胞。
参考文献(References):
[1]BAR-GAL G K,BLUM S E,HADAS L,et al.Host-specificity of Staphylococcus aureus causing intramammary infections in dairy animals assessed by genotyping and virulence genes[J].VetMicrobiol,2015,176(1-2):143-154.
[2]AKERS R M,NICKERSON S C.Mastitis and its impact on structure and function in the ruminant mammary gland[J].JMammaryGlandBiolNeoplasia,2011,16(4):275-289.
[3]MINTON K.Extracellular matrix:Preconditioning the ECM for fibrosis[J].NatRevMolCellBiol,2014,15(12):766-767.
[4]RITTIÉ L.Another dimension to the importance of the extracellular matrix in fibrosis[J].JCellCommunSignal,2015,9(1):99-100.
[5]BONNANS C,CHOU J,WERB Z.Remodelling the extracellular matrix in development and disease[J].NatRevMolCellBiol,2014,15(12):786-801.
[6]HINZ B.Myofibroblasts[J].ExpEyeRes,2016,142:56-70.
[7]KENDALL R T,FEGHALI-BOSTWICK C A.Fibroblasts in fibrosis:novel roles and mediators[J].FrontPharmacol,2014,5:123.
[8]BIERNACKA A,DOBACZEWSKI M,FRANGOGIANNIS N G.TGF-β signaling in fibrosis[J].GrowthFactors,2011,29(5):196-202.
[9]NAKERAKANTI S,TROJANOWSKA M.The role of TGF-β receptors in fibrosis[J].OpenRheumatolJ,2012,6:156-162.
[10]MENG X M,TANG P M,LI J,et al.TGF-β/Smad signaling in renal fibrosis[J].FrontPhysiol,2015,6:82.
[11]ANDREOTTI C S,PEREYRA E A,BARAVALLE C,et al.Staphylococcus aureus chronic intramammary infection modifies protein expression of transforming growth factor β (TGF-β) subfamily components during active involution[J].ResVetSci,2014,96(1):5-14.
[12]WANG X,XIU L,HU Q,et al.Deep sequencing-based transcriptional analysis of bovine mammary epithelial cells gene expression in response toinvitroinfection with Staphylococcus aureus stains[J].PLoSOne,2013,8(12):e82117.
[13]FU Y,ZHOU E,LIU Z,et al.Staphylococcus aureus andEscherichiacolielicit different innate immune responses from bovine mammary epithelial cells[J].VetImmunolImmunopathol,2013,155(4):245-252.
[14]DARBY I A,LAVERDET B,BONTÉ F,et al.Fibroblasts and myofibroblasts in wound healing[J].ClinCosmetInvestigDermatol,2014,7:301-311.
[15]丁旭娜.TGF-β1、bFGF和PDGF在奶牛乳腺纤维化中作用的研究[D].呼和浩特:内蒙古农业大学,2012.
DING X N.Studies on the effect of TGF-β1,bFGF and PDGF in bovine mammary fibrosis[D].Huhhot:Inner Mongolia Agricultural University,2012.(in Chinese)
[16]YOSHIDA K,MURATA M,YAMAGUCHI T,et al.TGF-β/Smad signaling during hepatic fibro-carcinogenesis (review)[J].IntJOncol,2014,45(4):1363-1371.
[17]LAN H Y.Diverse roles of TGF-β/Smads in renal fibrosis and inflammation[J].IntJBiolSci,2011,7(7):1056-1067.
[18]FUJITA M,SHANNON J M,MORIKAWA O,et al.Overexpression of tumor necrosis factor-alpha diminishes pulmonary fibrosis induced by bleomycin or transforming growth factor-beta[J].AmJRespirCellMolBiol,2003,29(6):669-676.
[19]LAW B A,CARVER W E.Activation of cardiac fibroblasts by ethanol is blocked by TGF-β inhibition[J].AlcoholClinExpRes,2013,37(8):1286-1294.
[20]XIE L,ZHOU D,XIONG J,et al.Paraquat induce pulmonary epithelial-mesenchymal transition through transforming growth factor-β1-dependent mechanism[J].ExpToxicolPathol,2016,68(1):69-76.
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.025
收稿日期:2016-01-12
基金项目:黑龙江八一农垦大学博士后启动基金
作者简介:杨彬(1982-),男,内蒙古呼和浩特人,讲师,博士,主要从事奶牛乳腺炎致病机制的研究,E-mail: yangbin_nm@126.com *通信作者:武瑞,教授,E-mail: fuhewu@126.com
中图分类号:S852.3
文献标志码:A
文章编号:0366-6964(2016)07-1495-07
The Effect ofStaphylococcusaureuson TGF-β1/Smad Signaling Pathway and Transdifferentiation in Bovine Mammary Fibroblasts
YANG Bin,XU Dan-dan,SUN Zhi-peng,ZHAO Jia-qi,YAN Bo-wei,LI Xiao-ting,WU Rui*
(CollegeofAnimalScienceandTechnology,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China)
Abstract:This study aimed to investigate the effect of Staphylococcus aureus (S.aureus) on TGF-β1/Smad signaling pathway and transdifferentiation in bovine mammary fibroblasts (BMFB).BMFB were stimulated with heat-killed S.aureus (HKSA) at 104,105,106,107,108 CFU·mL-1.The transcription of TGF-β1,α-SMA and collagen-Ⅰ mRNA were detected by Real-time PCR after 24 h.The expression of α-SMA,collagen-Ⅰ and p-Smad2/3 protein were detected by Western blot.BMFB were pretreated with TGF-β1 receptor-specific inhibitor SB-431542,BMFB were stimulated with heat-killed S.aureus (HKSA) at 105 CFU·mL-1.The transcription of α-SMA and collagen-Ⅰ mRNA were detected by Real-time PCR after 24 h.The expression of α-SMA,collagen-Ⅰ and p-Smad2/3 protein were detected by Western blot.Immunofluorescence was used to detect collagen-Ⅰ expression.The results showed that the transcription level of TGF-β1 mRNA,expression of α-SMA,collagen-Ⅰ and p-Smad2/3 increased significantly at different concentration after 24 h stimulation compared with unstimulated BMFB (P<0.05).The expression of TGF-β1,α-SMA,collagen-Ⅰ and p-Smad2/3 reached the maximal level at 105 CFU·mL-1.The expression of α-SMA,collagen-Ⅰ and p-Smad2/3 were significantly reduced by pretreating BMFB with SB-431542 (P<0.01).The results indicate that TGF-β1/Smad signaling pathway plays an important role in S.aureus induced BMFB transdifferentiation.
Key words:Staphylococcus aureus;bovine mammary fibroblasts;α-SMA;collagen-Ⅰ;p-Smad2/3

