雏鸡免疫器官中chMDA5的表达与定位
栾亚男,葛 铭,李广兴,谢婉秋,杨贵君,张瑞莉
(东北农业大学动物医学学院,哈尔滨 150030)
雏鸡免疫器官中chMDA5的表达与定位
栾亚男,葛铭,李广兴,谢婉秋,杨贵君,张瑞莉*
(东北农业大学动物医学学院,哈尔滨 150030)
摘要:为研究鸡模式识别受体MDA5(chMDA5)在雏鸡免疫器官中的表达与定位,分别于1、7、14、21、28、31、35、42、45、49日龄时从50只健康海兰白蛋鸡中随机选取5只,采取法氏囊、胸腺及脾,应用实时荧光定量PCR、Western blot及间接免疫荧光技术检测雏鸡免疫器官中chMDA5的表达情况。结果发现,在各日龄雏鸡法氏囊、胸腺及脾内均检测到chMDA5转录;在法氏囊淋巴滤泡的皮质、胸腺小叶的皮质和髓质及脾的白髓和红髓部位均检测到chMDA5阳性细胞;法氏囊和胸腺组织中chMDA5蛋白的表达规律较为一致,即在1~7日龄呈上升趋势并在7日龄达到峰值,随后下调,在14~35日龄时呈波动变化,之后逐渐上调并趋于稳定;脾中chMDA5蛋白表达以14 d左右为一个周期变化,随着日龄增大其表达量在总体上趋于上调。结果表明,chMDA5在雏鸡免疫器官中均有表达,且不同日龄之间的表达存在差异。本研究为进一步探究chMDA5与雏鸡免疫功能相关性提供了科学的试验依据。
关键词:chMDA5;雏鸡;免疫器官;表达;定位
先天免疫是动物机体针对病原体入侵的第一道防线,并参与适应性免疫的激活[1]。病原体相关分子模式(pathogen associated molecule patterns,PAMP)会被机体的模式识别受体(pattern recognition receptors,PRRs)识别,从而启动机体的先天免疫应答,如通过分泌Ⅰ型干扰素(IFN-Ⅰ)等细胞因子抵御病原体的入侵[2]。2005年RIG-Ⅰ样受体(RIG-Ⅰ like receptors,RLRs),即一条不依赖于Toll样受体(toll-like receptors,TLRs)的、能专一性识别细胞质中病毒核酸的新通路被发现[3]。目前已知的RLRs家族成员包括三个:视黄酸诱导基因-Ⅰ(retinoic acia-induced gene Ⅰ,RIG-Ⅰ)、黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)及LGP2(laboratory of genetics and physiology 2),它们均位于细胞质中[4]。RIG-Ⅰ识别相对较短的双链RNA(dsRNA)(<1 kb)和5′三磷酸的RNA;MDA5识别较长的dsRNA(>1 kb)[5];而对LGP2的配体了解较少,目前研究认为它对RLRs信号通路起到调节作用。
MDA5可识别病毒的双链RNA[6-8]。作者实验室曾对双链RNA病毒科的传染性法氏囊病病毒(infection bursal disease virus,IBDV)感染SPF雏鸡外周血液淋巴细胞chMDA5及其信号通路因子表达的动态变化进行研究,结果表明,IBDV能够激活雏鸡体内chMDA5信号通路,并且IBDV复制与chMDA5信号通路因子的表达有着密切关系[9]。MDA5的N端为2个CARD(caspase activation and recruitment domain)结构域串联而成,称为效应结构域;中间为DExD/H解旋酶区(DExD/H helicase),具有水解ATP及结合并解开RNA的能力,称为调节结构域;C端为RNA结合域(RD,抑制结构域)和与其交叠的C端结构域(CTD)[3]。当MDA5识别其配体后,该信号被传递到干扰素-β(IFN-β)启动子——刺激因子-1(IPS-1)[10],也称为MAVS/VISA/Cardif[11-13],它们通过CARD-CARD结构域相互作用锚定在线粒体膜上。IPS-1通过其C末端一边募集TRAF2/TRAF6活化IKK激酶复合物,从而激活NF-κB;另一边募集TRAF3和TBK1使IRF3和IRF7磷酸化,并形成二聚体形式,活化后的这些转录因子进入细胞核[14-15],调控相应的促炎症因子及Ⅰ型干扰素的表达。产生的IFN-β还可以与细胞表面的特异性受体结合,通过启动JAK-STAT信号通路引发抗病毒活性并激活适应性免疫[16]。因此,MDA5在识别病原体,激活抗病毒反应中起着重要作用。A.J.Karpala等通过研究提出鸡可能缺乏RIG-Ⅰ基因[17],这就使得MDA5在鸡体识别病原体入侵,激活抗病毒天然免疫方面显得尤为重要。而不同组织器官中MDA5的分布情况可能会影响该部位对入侵病原体的识别。目前,未见有MDA5在鸡体器官组织中表达及定位的报道。因此,本研究以在我国饲养较为普遍的海兰白雏鸡为研究对象,依据鸡场常规的免疫程序选定研究日龄,采用实时荧光定量PCR、Western blot以及间接免疫荧光方法,研究雏鸡在不同日龄时,其免疫器官(法氏囊、胸腺及脾)中chMDA5的转录及蛋白质表达水平的变化,为探究MDA5与鸡体免疫功能相关性奠定基础,也为禽类病毒性传染病的防治研究提供新的方向。
1材料与方法
1.1试验动物及处理
50只1日龄健康海兰白蛋鸡购自哈尔滨先锋种鸡场,分别于1、7、14、21、28、31、35、42、45、49日龄,随机抽取5只雏鸡进行安乐死,快速采取法氏囊、胸腺及脾,放入液氮速冻后转入-80 ℃保存备用。
1.2主要试剂及仪器
Power 2×SYBR Real-time PCR Premixture、RNApure 高纯度总RNA快速提取试剂盒(离心柱型)均购自北京百泰克生物技术有限公司;M-MLV反转录酶、RNA酶抑制剂均购自大连宝生物工程有限公司;高效RIPA组织/细胞裂解液购自北京索莱宝生物技术有限公司;小鼠抗鸡MDA5单克隆抗体由本实验室制备[18];山羊血清购自博士德生物工程有限公司;抗β-actin小鼠单克隆抗体购自碧云天生物技术有限公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG、异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG均购自北京中杉金桥生物技术有限公司;碘化丙啶(PI)购自Sigma公司;ECL超敏发光液购自北京普莱利基因技术有限公司;杭州博日Line Gene 9620荧光定量PCR仪为黑龙江省天力科技开发有限公司产品;冰冻切片机、正置荧光显微镜均为德国Leica公司产品。
1.3实时荧光定量PCR法检测雏鸡免疫器官chMDA5 mRNA的表达
1.3.1雏鸡免疫器官总RNA的提取及反转录按照高纯度总RNA提取试剂盒说明书的方法分别提取不同日龄雏鸡的法氏囊、胸腺及脾的总RNA,然后根据反转录酶说明书进行反转录,得到的cDNA -20 ℃保存备用。
1.3.2引物的设计与合成参考GenBank公布的chMDA5基因序列,使用Oligo软件进行分析设计特异性引物,用于实时荧光定量PCR检测chMDA5 mRNA的表达情况。同时,参考GenBank公布的chβ-actin基因序列设计特异性引物,作为参考基因,引物由金唯智生物科技有限公司合成。引物序列见表1。
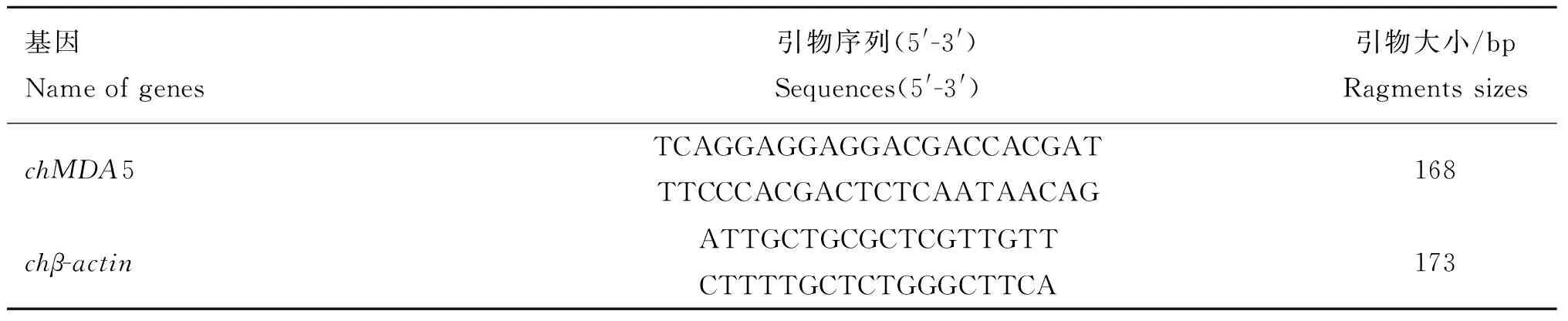
表1 chMDA5和参考基因目的片段扩增用引物
1.3.3雏鸡免疫器官chMDA5 mRNA表达的检测实时荧光定量反应在Line Gene 9620荧光定量PCR仪上进行,PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火34 s,共40个循环。退火延伸时检测荧光信号。PCR反应体系:2×Premix 10 μL、上游Primer(10 μmol·L-1)0.4 μL、下游Primer(10 μmol·L-1)0.4 μL、cDNA 1 μL、ROX 0.4 μL、PCR水补至20 μL。对PCR结果采用2-ΔΔCt法进行分析,试验中由PCR仪设定统一的荧光阈值,PCR扩增信号达到阈值后,仪器将计算出此反应所需的循环数为Ct值。以chβ-actin为参考基因,脑组织样品为对照,各组织相对于脑组织的ΔΔCt值根据以下公式计算:ΔΔCt值=(目的基因Ct值-参考基因Ct值)试验组-(目的基因Ct值-参考基因Ct值)对照组。利用公式计算出mRNA相对表达量为2-ΔΔCt。
1.4Western blot方法检测雏鸡免疫器官chMDA5蛋白的表达1.4.1雏鸡免疫器官总蛋白质的提取将雏鸡法氏囊、胸腺及脾组织分别剪成细小的碎块,加液氮进行研磨,按照每20 mg组织加入200 μL的比例加入裂解液,并按与裂解液1∶100的比例加入PMSF,充分研磨后将样品12 000 r·min-1离心5 min,取上清,与2×SDS上样buffer 1∶1混匀,煮沸10 min,得到的蛋白质样品-40 ℃保存备用。1.4.2雏鸡免疫器官chMDA5蛋白表达的检测选用浓度为8%的分离胶和5%的浓缩胶进行SDS-PAGE,电泳完毕后,将胶取下,切成适当大小,剪取相同大小的NC膜,分别浸泡在转印液TTB中20 min,使用半干式转印仪进行转印,按从阳极到阴极依次为滤纸、NC膜、凝胶、滤纸的顺序重叠起来。设置电压为15 V,转印2 h。NC膜用TTBS配制的5%脱脂乳,37 ℃条件下封闭2 h。封闭结束后,TTBS洗膜3次,每次5 min。一抗分别为1∶2 000稀释的小鼠抗鸡MDA5单克隆抗体和1∶1 000稀释的抗β-actin小鼠单克隆抗体,4 ℃孵育过夜,反应后TTBS洗膜3次,每次10 min。二抗为1∶5 000稀释的辣根过氧化物酶(HRP)标记山羊抗小鼠IgG,室温作用1 h,反应后TTBS洗膜3次,每次10 min,TBS洗膜2次,每次5 min。ECL超敏发光液进行化学曝光,利用Image软件分析Western blot结果。
1.5间接免疫荧光方法检测雏鸡免疫器官chMDA5蛋白的定位
使用冰冻切片机分别将雏鸡法氏囊、胸腺及脾制成7 μm的冰冻切片。切片于室温晾干1 h,置于丙酮中-20 ℃固定20 min,室温晾干。PBS洗涤3次,每次5 min。正常山羊血清用PBS按1∶100稀释,室温封闭20 min。PBS洗涤3次,每次5 min。小鼠抗鸡MDA5单克隆抗体按1∶100稀释,37 ℃孵育2 h。PBS洗涤3次,每次10 min。异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG按1∶300稀释,37 ℃避光孵育1.5 h。PBS洗涤3次,每次10 min。碘化丙啶(PI)复染细胞核,洗涤同前。封片后将切片置于正置荧光显微镜下观察chMDA5蛋白表达情况,阳性反应部位呈特异性绿色荧光。
1.6数据分析
采用Graph PadPrism软件绘制柱状图。
2结果
2.1雏鸡免疫器官chMDA5 mRNA转录的动态变化
雏鸡法氏囊中chMDA5 mRNA的转录量在1~14日龄时相近,之后其转录量有所下降,28日龄后呈上升趋势至31日龄达到峰值,之后转录量持续下调,直到49日龄时有所上调,如图1。

图1 雏鸡法氏囊中chMDA5 mRNA转录的动态变化Fig.1 Dynamic changes of the chMDA5 mRNA transcription in chick bursa of Fabricius
雏鸡胸腺中chMDA5 mRNA的转录量在1~14日龄时相近,之后呈下调趋势,21日龄后其转录量大幅上升,至31日龄达到峰值,随后又逐渐下调,至45日龄之后趋于稳定,如图2。
雏鸡脾中chMDA5 mRNA的转录量在1~21日龄时趋于一致,在28日龄时小幅上调,随后下调(31日龄),后又大幅上调,在35日龄时达到峰值,随后呈持续下调趋势,至49日龄达到最低值,如图3。

图2 雏鸡胸腺中chMDA5 mRNA转录的动态变化Fig.2 Dynamic changes of the chMDA5 mRNA transcription in chick thymus

图3 雏鸡脾中chMDA5 mRNA转录的动态变化Fig.3 Dynamic changes of the chMDA5 mRNA transcription in chick spleen
2.2雏鸡免疫器官chMDA5蛋白的表达变化
雏鸡法氏囊中chMDA5蛋白的表达量在1~7日龄呈上升趋势,且7日龄时达到所检测日龄中的最大值,随后其表达量下降,在14~35日龄之间呈先上升后下降的波动趋势,之后表达量上调并在42日龄后趋于稳定,如图4。

图4 雏鸡法氏囊中chMDA5蛋白的表达变化Fig.4 Changes of the chMDA5 protein expression in chick bursa of Fabricius
雏鸡胸腺中chMDA5蛋白的表达量在1~7日龄之间呈高表达水平,之后其表达量下降,在14~35日龄之间也呈现出小幅波动趋势,之后表达量大幅上调并在42日龄后其表达略趋于稳定,如图5。
雏鸡脾中chMDA5蛋白的表达量整体呈现出以14 d左右为一个周期的阶段式上调趋势,在一个周期内又呈现出先上升后下降的变化,并在42日龄后其表达趋于高水平且波动不大,如图6。

图5 雏鸡胸腺中chMDA5蛋白的表达变化Fig.5 Changes of the chMDA5 protein expression in chick thymus

图6 雏鸡脾中chMDA5蛋白的表达变化Fig.6 Changes of the chMDA5 protein expression in chick spleen
2.3雏鸡免疫器官chMDA5蛋白的定位
在雏鸡法氏囊、胸腺及脾的细胞质内均可检测到chMDA5蛋白的表达。其中,法氏囊的免疫阳性反应区域是在淋巴滤泡的皮质和髓质,尤其是皮质部分免疫阳性反应较强且阳性细胞排列紧密(如图7A);胸腺小叶的皮质、髓质内均可见较明显阳性反应细胞(如图7C);脾的白髓和红髓细胞内也可见到特异性绿色荧光(如图7E),图7B、D、F为阴性对照,且均无阳性反应信号。
3讨论
RIG-Ⅰ样受体在动物的绝大多数组织中都有表达,而且它们所介导的先天性免疫反应也在相应的细胞中发生[19]。MDA5是RLRs家族中的重要成员,它能够识别多种病毒的入侵,从而启动抗病毒天然免疫反应,诱导Ⅰ型干扰素的产生,是机体抵抗病原体入侵的重要途径之一[3,20-21]。因此,明确MDA5在机体免疫器官内的分布及表达情况,可为研究MDA5参与动物机体免疫调节及免疫发病机制提供依据。
本试验从mRNA和蛋白质水平对不同日龄健康雏鸡免疫器官法氏囊、胸腺及脾中chMDA5的表达进行研究,结果发现,在各日龄雏鸡法氏囊、胸腺及脾中均检测到chMDA5的转录和蛋白质的表达。法氏囊与胸腺中chMDA5 mRNA表达的动态变化较为一致,均在1~14日龄时相近,随后开始下调,21日龄后呈上调趋势并在31日龄时其表达量达到峰值,之后逐渐下调,而法氏囊在49日龄又呈上调趋势;脾在1~31日龄之间其表达量变化不大,随后开始上调并在35日龄时达到峰值,之后逐渐下调。脾35日龄时的表达峰值可能是由于中枢免疫器官在31日龄时的高转录所致。
mRNA的转录变化并不能代表蛋白质水平的表达情况,所以作者又采用Western blot方法对chMDA5蛋白的表达情况进行了研究。结果显示,法氏囊与胸腺中chMDA5蛋白的表达情况也趋于一致,均在7日龄达到峰值,随后下调,在14~35日龄时呈波动变化,之后逐渐上调并趋于稳定;脾中其表现出以14 d左右为一个周期的变化趋势,随着日龄增大其表达量在总体上趋于逐渐上调。
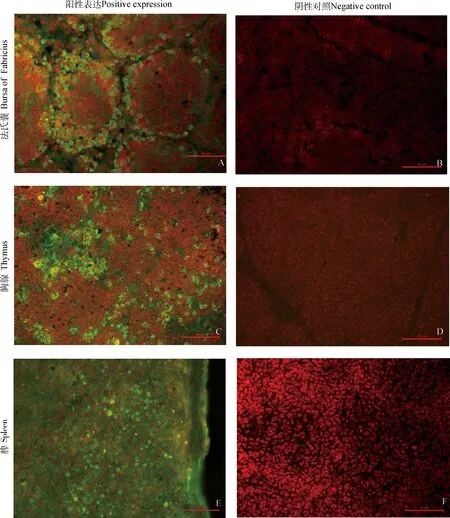
图7 雏鸡主要免疫器官中chMDA5蛋白的定位(bar=20 μm)Fig.7 Locations of the chMDA5 protein in main immune organs of chick (bar=20 μm)
本试验从mRNA及蛋白质水平共同揭示chMDA5在雏鸡免疫器官中的表达情况,发现在雏鸡免疫器官中chMDA5 mRNA与蛋白质表达水平的变化并不完全趋于一致,这可能与体内复杂的转录后水平的调控有关。
由于动物机体组织结构与其功能是密切相关的,可从各免疫器官的发育情况来分析chMDA5蛋白的表达变化。曙光等发现蛋鸡法氏囊在68日龄时其滤泡的长、宽、皮质及髓质厚度最大[22],本试验只检测到49日龄的雏鸡,所以可能未检测到其最大的表达量。王莹等发现1日龄雏鸡的胸腺组织结构发育已经较完善[23],作者也的确在1日龄胸腺组织检测到chMDA5蛋白较高水平的表达。张英楠等发现海兰白雏鸡的脾在7日龄时具备近似成熟的组织结构,但直至35日龄才趋于稳定[24]。作者发现脾在7日龄时chMDA5蛋白呈现出高表达,这一表达情况与其组织结构发育的趋势基本是相一致的,而作者在42日龄时观察到chMDA5蛋白的最大表达量,这可能与饲养环境等因素导致其发育情况稍有不同相关。
有研究报道,MDA5主要表达于非免疫细胞中[20]。作者采用间接免疫荧光方法对chMDA5蛋白的表达进行了定位,发现在雏鸡法氏囊的淋巴滤泡、胸腺小叶的皮质部和髓质部及脾的红髓和白髓均有表达,表明chMDA5蛋白在雏鸡免疫器官免疫细胞的细胞质中均有表达。
本研究发现,7日龄雏鸡法氏囊、胸腺及脾内chMDA5蛋白表达量均处于较高水平,而在14日龄后均呈现不同程度的下调以及波动状态,直到42日龄逐渐上调并趋于稳定,这提示我们考虑到chMDA5与其所识别的病毒种类及其易感日龄的相关性,如3~6周龄的雏鸡对IBDV最为易感,而最近有研究报道,IBD易感日龄已向两端延伸[25],这可能就与chMDA5蛋白的表达在2~6周龄之间均呈较低趋势相关;已有研究表明鸡TLR3也可识别IBDV[26-27],所以这一猜测还需要与鸡TLR3蛋白表达情况相结合而做进一步研究。42日龄以后,免疫器官发育日益成熟,三种免疫器官中MDA5蛋白均趋于高表达且相对稳定在一定水平,应该是雏鸡抗病毒能力增强的一个重要因素。另外,7日龄雏鸡免疫器官中chMDA5的高表达也提示在生产实际中可在此日龄对雏鸡进行相应的免疫,可能会产生更高的抗体水平。综上,通过研究chMDA5在雏鸡免疫器官中的表达与定位情况,对雏鸡相应疾病的预防、治疗及免疫发病机制的研究均具有指示作用。
4结论
chMDA5在雏鸡法氏囊、胸腺及脾中均有转录及蛋白质表达,且不同日龄之间的表达存在差异;chMDA5蛋白主要定位于法氏囊、胸腺及脾免疫细胞的细胞质内。
参考文献(References):
[1]KAWAI T,AKIRA S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].NatImmunol,2010,11(5):373-384.
[2]谭艳,陈政良.天然免疫模式识别途径:胞外识别与胞内识别[J].免疫学杂志,2004,20(3):28-30,34.
TAN Y,CHEN Z L.Innate immunity pattern recognition:intracellular and extracellular pathways[J].ImmunologicalJournal,2004,20(3):28-30,34.(in Chinese)
[3]刘欢欢,谢丽君,邵志勇,等.MDA5在先天性免疫抗病毒作用中的研究进展[J].中国畜牧兽医,2015,42(1):230-233.
LIU H H,XIE L J,SHAO Z Y,et al.Research progress on antiviral effect of MDA5 in innate immunity[J].ChinaAnimalHusbandry&VeterinaryMedicine,2015,42(1):230-233.(in Chinese)
[4]YONEYAMA M,FUJITA T.Recognition of viral nucleic acids in innate immunity[J].RevMedVirol,2010,20(1):4-22.
[5]LEE C C,WU C C,LIN T L.Characterization of chicken melanoma differentiation-associated gene 5 (MDA5) from alternative translation initiation[J].CompImmunolMicrobiolInfectDis,2012,35(4):335-343.
[6]KATO H,TAKEUCHI O,SATO S,et al.Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses[J].Nature,2006,441(7089):101-105.
[7]GITLIN L,BARCHET W,GILFILLAN S,et al.Essential role of mda-5 in type I IFN responses to polyriboinosinic:polyribocytidylic acid and encephalomyocarditis picornaviras[J].ProcNatlAcadSciUSA,2006,103(22):8459-8464.
[8]孙文香,蒋争凡.病毒感染引发天然免疫细胞信号转导研究进展[J].中国细胞生物学学报,2013,35(5):563-573.
SUN W X,JIANG Z F.Innate immune detection and activation to viral infection[J].ChineseJournalofCellBiology,2013,35(5):563-573.(in Chinese)
[9]王成成,葛铭,刘超男,等.IBDV感染雏鸡外周血液淋巴细胞chMDA5信号通路因子表达的动态变化[J].畜牧兽医学报,2015,46(5):830-835.
WANG C C,GE M,LIU C N,et al.Dynamic changing in the expression of chMDA5 signal pathway factors in peripheral blood lymphocytes of chicken infected with IBDV[J].ActaVeterinariaetZootechnicaSinica,2015,46(5):830-835.(in Chinese)
[10]KAWAI T,TAKAHASHI K,SATO S,et al.IPS-1,an adaptor triggering RIG-I- and Mda5-mediated typeⅠinterferon induction[J].NatImmunol,2005,6(10):981-988.
[11]MEYLAN E,CURRAN J,HOFMANN K,et al.Cardif is an adaptor protein in the RIG-I antiviral pathway and is targeted by hepatitis C virus[J].Nature,2005,437(7062):1167-1172.
[12]SETH R B,SUN L,EA C K,et al.Identification and characterization of MAVS,a mitochondrial antiviral signaling protein that activates NF-κB and IRF3[J].Cell,2005,122(5):669-682.
[13]XU L G,WANG Y Y,HAN K J,et al.VISA is an adapter protein required for virus-triggered IFN-β signaling[J].MolCell,2005,19(6):727-740.
[14]BARBALAT R,EWALD S E,MOUCHESS M L,et al.Nucleic acid recognition by the innate immune system[J].AnnuRevImmunol,2011,29:185-214.
[15]LOO Y M,GALE M JR.Immune signaling by RIG-I-like receptors[J].Immunity,2011,34(5):680-692.
[16]YONEYAMA M,KIKUCHI M,NATSUKAWA T,et al.The RNA helicase RIG-I has an essential function in double-stranded RNA-induced innate antiviral responses[J].NatImmunol,2004,5(7):730-737.
[17]KARPALA A J,STEWART C,MCKAY J,et al.Characterization of chicken Mda5 activity:regulation of IFN-β in the absence of RIG-I functionality[J].JImmunol,2011,186(9):5397-5405.
[18]王成成.鸡MDA5基因克隆表达及单克隆抗体的制备与应用[D].哈尔滨:东北农业大学,2015.
WANG C C.Cloning and expression of chicken melanoma differentiation-associated gene 5 and using of monoclonal antibodies against its recombinant protein[D].Harbin:Northeast Agricultural University,2015.(in Chinese)
[19]张煜,钟波,杨艳,等.TLRs与RLRs介导的细胞抗病毒反应信号转导及其调节机制[J].细胞生物学杂志,2009,31(4):453-468.
ZHANG Y,ZHONG B,YANG Y,et al.Mechanisms and regulations of TLRs- and RLRs-mediated cellular antiviral signaling[J].ChineseJournalofCellBiology,2009,31(4):453-468.(in Chinese)
[20]YONEYAMA M,KIKUCHI M,MATSUMOTO K,et al.Shared and unique functions of the DExD/H-box helicases RIG-I,MDA5,and LGP2 in antiviral innate immunity[J].JImmunol,2005,175(5):2851-2858.
[21]SUMPTER R JR,LOO Y M,FOY E,et al.Regulating intracellular antiviral defense and permissiveness to hepatitis C virus RNA replication through a cellular RNA helicase,RIG-I[J].JVirol,2005,79(5):2689-2699.
[22]曙光,张勇,王纯洁.肉雏鸡与蛋雏鸡法氏囊生长发育规律的探讨[J].中国畜牧兽医,2009,36(10):31-34.
SHU G,ZHANG Y,WANG C J.Contrasting research on the law of growth on broiler chicken and layer chicken[J].ChinaAnimalHusbandry&VeterinaryMedicine,2009,36(10):31-34.(in Chinese)
[23]王莹,刘伟强.鸡胚胸腺、法氏囊组织免疫功能发育研究[J].牡丹江师范学院学报(自然科学版),2012(3):14-17.
WANG Y,LIU W Q.Research on the immune function development in chicken embryo thymus and bursal tissue[J].JournalofMudanjiangNormalUniversity(NaturalSciencesEdition),2012(3):14-17.(in Chinese)
[24]张英楠,杨树宝,杨柳,等.鸡脾脏组织结构早期发育的动态观察[J].中国家禽,2010,32(3):13-15.
ZHANG Y N,YANG S B,YANG L,et al.Dynamic observation of histological development of spleen in chicken[J].ChinaPoultry,2010,32(3):13-15.(in Chinese)
[25]李潭清,宋勤叶,杨润德,等.鸡传染性法氏囊病的研究进展[J].安徽农业科学,2008,36(35):15481-15484.
LI T Q,SONG Q Y,YANG R D,et al.The research of infectious bursal disease[J].JournalofAnhuiAgriculturalSciences,2008,36(35):15481-15484.(in Chinese)
[26]RAUF A,KHATRI M,MURGIA M V,et al.Differential modulation of cytokine,chemokine and Toll like receptor expression in chickens infected with classical and variant infections bursal disease virus[J].VetRes,2011,42:85.
[27]王成成,王杲强,葛铭,等.感染传染性法氏囊病病毒的DF-1细胞中chTLR3表达的动态变化[J].中国兽医科学,2014,44(12):1304-1308.
WANG C C,WANG G Q,GE M,et al.Dynamic changes of the chTLR3 expression in DF-1 cells infected with infectious bursal disease virus[J].ChineseVeterinaryScience,2014,44(12):1304-1308.(in Chinese)
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.023
收稿日期:2016-02-01
基金项目:国家自然科学基金(31272533)
作者简介:栾亚男(1992-),女,吉林集安人,硕士生,主要从事动物病理学的研究,E-mail:1137072249@qq.com *通信作者:张瑞莉,教授,E-mail:zhangruili@neau.edu.cn
中图分类号:S852.4
文献标志码:A
文章编号:0366-6964(2016)07-1480-08
The Expression and Location of chMDA5 in Chick Immune Organs
LUAN Ya-nan,GE Ming,LI Guang-xing,XIE Wan-qiu,YANG Gui-jun,ZHANG Rui-li*
(CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin150030,China)
Abstract:The objective of the present study was to examine the expression and location of chick melanoma differentiation associated gene 5 (chMDA5) in chick immune organs.Fifty health Highland white chicks were euthanized to collect bursa of Fabricius,thymus and spleen at 1,7,14,21,28,31,35,42,45,49-day-old,separately.Then,real-time fluorescence quantitative PCR,Western blot and IFA techniques were used to detect the expression of chMDA5 in chick immune organs.The results showed that the chMDA5 mRNA were examined in bursa of Fabricius,thymus and spleen at each age,chMDA5+ cells were detected in the cortex of bursal lymphoid follicles,the cortex and medulla of thymus lobule,the white pulp and red pulp of spleen.The expression pattern of chMDA5 protein in bursa of Fabricius and thymus tissue was consistent,which showed an upward trend in 1 to 7-day-old chicks and reached peak at 7-day-old,and then went down in 14 to 35-day-old with a fluctuation trend,then gradually increase and stabilized.In spleen,the protein expression of chMDA5 was increased with the increasing age in a period of about 14 days.The results indicated that the chMDA5 were expressed in chick immune organs,and there were differences in expression of chMDA5 with different ages.This study provide a scientific test basis for further exploration about the correlation between chMDA5 and chick immune function.
Key words:chMDA5;chicks;immune organs;expression;location

