黄连素对NASH小鼠NE/α1-AT失衡的干预研究
陈颖基 马晓洁 王磊 金沛桦 瞿欢佳 施军平
黄连素对NASH小鼠NE/α1-AT失衡的干预研究
陈颖基马晓洁王磊金沛桦瞿欢佳施军平
310053 杭州,浙江中医药大学(陈颖基、王磊、金沛桦);杭州师范大学(瞿欢佳);杭州师范大学附属医院(马晓洁、施军平)
【摘要】目的探讨NE/α1-AT失衡在非酒精性脂肪性肝炎(NASH)发生发展中的作用及其意义以及黄连素对其影响。方法8周龄C57BL/6JApoE-/-雄性小鼠26只,按体重随机分为正常对照组(正常饮食,SC组,n=8)、高脂组(高脂高胆固醇饮食,HFHC组,n=8)、黄连素干预组(n=10)。黄连素干预组6周起予以20 mg/kg/d黄连素灌胃,喂养12周处死所有小鼠,称体重肝湿重,检测肝功能和血脂,肝组织油红O染色评估脂肪变,HE染色评估炎症改变。酶联免疫反应(ELISA)检测肝组织中NE、α1-AT浓度,免疫组化染色及蛋白免疫印迹(Western Blot)方法检测NE表达情况,RT-PCR法检测小鼠肝组织α1-AT的mRNA表达。结果高脂组和正常对照组相比,高脂组小鼠ALT、AST均有明显升高,TG明显高于对照组。高脂组小鼠HE染色可见明显脂肪变及炎症灶并伴有明显气球样变,造模终点其NAS积分5-8分,达到NASH诊断标准。高脂组NE浓度及活性明显升高,α1-AT水平降低,NE/α1-AT比值较正常组升高;黄连素干预组炎症气球样变较高脂组减少。黄连素干预组小鼠ALT、AST较对照组升高明显,且较高脂组AST明显下降,黄连素干预组小鼠NE/α1-AT较高脂组明显下降。结论高脂高胆固醇喂养ApoE-/-小鼠12周可成功建立NASH小鼠模型,NE与α1-AT在非酒精性脂肪性肝炎发生发展中有明显的变化,NE/α1-AT失衡在NASH中起到重要作用;黄连素可减轻NASH小鼠肝脏内脂质沉积和炎症程度,并可改善NE/α1-AT失衡,具有防治NASH作用。
【主题词】非酒精性脂肪性肝炎;黄连素;中性粒细胞弹性蛋白酶;α-1抗胰蛋白酶
Fundprograms:NationalNaturalScienceFoundationofChina(81570524);NaturalScienceFoundationofZhejiangProvinceofChina(LY15H070004)
近来有研究表明在肥胖人群和小鼠血清中的中性粒细胞弹性蛋白酶(Neutrophilelastase,NE)活性升高,而在小鼠血清和肝脏中其抑制剂α1-抗胰蛋白酶(α1-antitrypsin,A1AT)水平明显下降,这可能是介导系统性低度慢性炎症和胰岛素抵抗的主要机制[1,2];黄连素(berberine,[C20H8NO4]+,又称小檗碱)临床长期用于清热解毒,具有抗炎活性,它可通过抑制细菌脂多糖(Lipopolysaccharides,LPS)诱导的PMN浸润,在急性肺损伤模型中黄连素可通过抑制NE表达减轻内毒素所致的肺损伤,且有研究显示黄连素可改善非酒精性脂肪性肝病(NAFLD)大鼠的脂质代谢紊乱、空腹血糖水平及炎症等现象[3-4],但其具体作用机制仍不明确。故本研究采用高脂高胆固醇饮食建立非酒精性脂肪性肝炎(NASH)小鼠,研究黄连素对NASH小鼠NE/α1-AT失衡的影响,阐明黄连素治疗NASH的可能作用机制。
1材料与方法
1.1动物分组及给药SPF级8周龄C57BL/6JApoE-/-雄性小鼠26只(购于南京动物模式研究所),按体重随机分为正常对照组(8只)摄食普通食料和普通饮水、高脂组(18只)摄食改良西方饮食(高脂饲料:20%蛋白质、50%碳水化合物、21%脂肪和0.21%胆固醇)。6周后将高脂组按体重分为高脂组8只和黄连素干预组10只,黄连素干预组小鼠每只每天予以200mg/kg的黄连素(购于Sigma公司,溶于蒸馏水中制备黄连素混悬液)灌胃,其余两组小鼠喂养同前,每天予以同体积蒸馏水灌胃。造模开始后每周观察并记录各组ApoE-/-雄性小鼠的体重,观察动物的食欲、行为习惯和二便等改变。
1.2试剂和仪器抗NE兔多克隆抗体购于英国Biorbyt公司,山羊抗兔IgG购于麦约尔生物公司,免疫组化试剂盒购于北京中杉金桥公司。PCR引物由上海生工生物工程有限公司合成,PCR试剂盒及逆转录试剂盒均购于上海Invitrogen公司,ELISA试剂盒购于美国R&D公司,SDS-PAGE凝胶快速配制试剂盒购于碧云天公司。
1.3标本采集造模12周处死所有小鼠,隔夜空腹称重,无痛处死实验动物,常规制备血清标本,称重肝脏湿重、肝指数(肝脏湿重/体重),取材于肝左叶固定部位以用于制备肝脏石蜡切片和冰冻切片标本,其他部分装入冻存管投入液氮中冻存以用于mRNA检测。
1.4指标与方法
1.4.1肝脏普通病理学检查:冰冻切片行油红O染色观察肝细胞脂肪变,对石蜡切片进行HE染色,观察肝组织纤维化及炎症情况,肝脏HE染色评分参照美国国立卫生研究院NASH临床研究网络病理工作组指南进行NAFLD活动度评分(NAFLDacticityscore,NAS)。
1.4.2血液学指标:12周检测ALT、AST等肝肾功能指标;甘油三酯、脂蛋白及总胆固醇等脂代谢指标。
1.4.3PCR检测:Trizol法提取RNA并保存,后按照逆转录试剂盒说明书进行第一链cDNA的合成。PCR反应条件为95 ℃预变性10min,95 ℃15s,60 ℃1min, 95 ℃15s,60 ℃15s,95 ℃15s, 共40个循环。凝胶电泳法对扩增产物进行检测,后用UVP凝胶成像系统进行图像采集及分析。
1.4.4NE的免疫组化检测:对切片常规脱蜡及水化,内源性过氧化物酶封闭采用3%H2O2并通过高压蒸汽修复抗原,加封闭液后滴加鼠多克隆抗体NE、浓度为1∶200,4 ℃孵育过夜,次日加山羊抗兔IgG,37 ℃孵育30min,DAB显色,苏木素复染,中性树胶封片,光镜下观察。
1.4.5NE的WesternBlot检测:肝组织总蛋白经SDS-PAGE电泳后,通过半干法将蛋白质分子转移到PVDF膜上,后浸泡于封闭液(5%BSA)中室温下封闭1.5h,TBST洗膜3次,然后将PVDF膜与一抗稀释液(抗NE的比例为1∶500,抗β-actin比例为1∶1 000)4 ℃摇床振荡孵育过夜,第2天取出用TBST洗膜3次,PVDF膜与二抗稀释液(1∶1 000)在室温摇床振荡反应1h,回收二抗并用TBST洗膜3次后加入显影剂3~4min显色,最后通过化学发光成像系统采集图像进行分析。
1.4.6ELISA检测:NE、α1-AT:分别设空白孔、标准孔及待测试样品孔加样,摇匀后置于37 ℃恒温箱中温育30min。洗后每孔加入50μl酶标试剂,空白板除外,后置于37 ℃恒温箱中孵育30min。洗后每孔加入底物显色液A、B各50μl,室温避光显色。显色后每孔加入50μl终止液。将酶标板置于酶标仪上读取450nm波长时各孔吸光度。

2结果
2.112周高脂组、黄连素干预组与对照组小鼠肝肾功能及脂代谢指标12周时高脂组小鼠较对照组体重增加(P <0.05),黄连素干预组小鼠体重较对照组升高,但无统计学意义(P >0.05);与对照组相比,高脂组小鼠ALT、AST、TG、TC均明显升高(P <0.05);黄连素干预组小鼠ALT、AST较对照组升高明显,且较高脂组AST明显下降,差异有统计学意义(P <0.05)。(详见表1)
2.2肝脏组织病理学检查肉眼观察示对照组小鼠肝脏颜色鲜红、质软,肝脏边缘锐利,表面光滑;HFHC组肝脏颜色呈黄褐色、质韧,肝脏边缘变钝,外观呈弥漫性肿大;BBR组小鼠肝脏颜色、质地、外观接近对照组。油红O染色显示:对照组小鼠肝脏未见明显脂肪变,HFHC组可见大面积油红O染色,BBR组油红O染色面积、密度均较高脂组明显减少。光镜下HE染色示:正常对照组小鼠肝脏病理无明显异常发现;高脂组小鼠肝脏可见弥漫性脂肪变性及少量气球样变,小叶内及汇管区可见明显炎症细胞浸润,计算NAS为4~7分,其中88%>4分已达到NASH诊断标准,63% NAS积分达5分,与对照组存在统计学差异;BBR组小鼠肝脏脂肪变及气球样变较高脂组明显减轻,NAS积分均低于4分,90%低于3分。

表1造模12周小鼠体重、肝指数及生化指标比较±s)
注:SC组:正常饮食组;HFHC组:高脂高胆固醇组;BBR组:黄连素组;与对照组比较*P<0.05,**P<0.01;与高脂组比较△P<0.05,△△P<0.01
Note: SC group: normal diet group;HFHC group: high fat high cholesterol group;group BBR: Berberine group;compared with the control group*P<0.05,**P<0.01;compared with high fat group△P<0.05,△△P<0.01
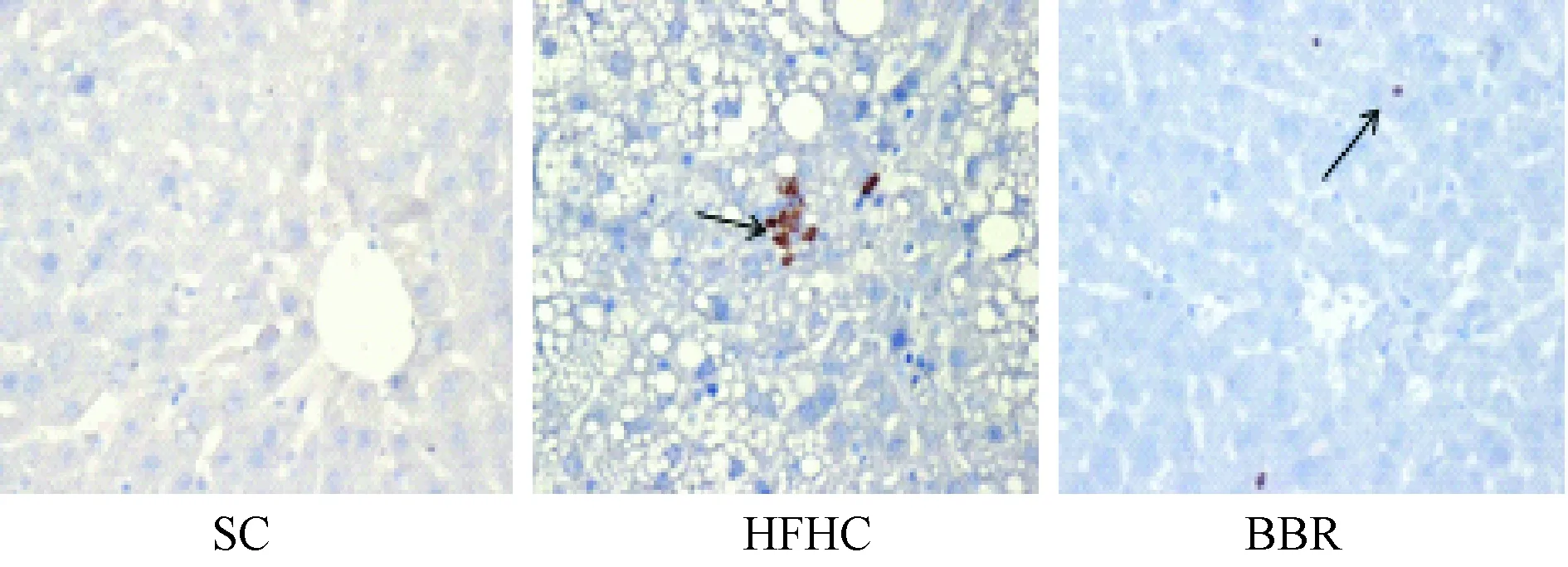
图1 12周各组NE免疫组化染色(40×10倍镜)Fig.1 Representative immunostainings for NE in lives from SC,HFHC and BBR(Magnification is×400)
2.3肝脏组织中NE的免疫组化免疫组化结果显示,12周时,HFHC组小鼠肝脏NE阳性表达较正常饮食组明显增多;BBR干预组较高脂组NE阳性表达明显减少(见图1)。
2.4肝脏组织中NE的Western Blot结果Western Blot显示:12周时HFHC组和黄连素干预组小鼠肝脏NE蛋白阳性表达均较正常饮食组明显增高,且BBR干预组NE蛋白表达较高脂组明显下降。
2.5肝组织中α1-AT的PCR结果RT-PCR结果显示:HFHC组小鼠肝脏α1-AT mRNA的表达较正常饮食组明显降低;BBR干预组小鼠肝脏α1-AT mRNA的表达较较高脂组明显增多。
2.6肝组织中α1-AT、NE及NE/α1-AT的ELISA结果ELISA法检测结果显示:HFHC组较对照组小鼠肝组织NE存在明显过表达,且存在NE/α1-AT失衡;BBR组较高脂组NE表达降低,NE/α1-AT失衡明显改善。
3讨论
有研究表明模式识别受体Toll样受体(TLRs)和库普弗细胞(Kupffer cell)为主介导的天然免疫异常在NASH的发病过程中起到重要的作用,但NASH仍缺乏完整的发病机制[5]。中性粒细胞是人体内数量最多的白细胞,它在非特异性细胞免疫系统中起着十分重要的作用。NE是炎症刺激下中性粒细胞激活并发生脱颗粒作用而分泌的蛋白溶酶,NE反过来可调节中性粒细胞的生成、游走和浸润。在炎症过程中,NE的作用主要可归纳为两方面:一方面NE可诱导上皮细胞释放多种促炎因子(GM-CSF、IL8等),放大炎症反应;另一方面它可通过降解前炎症介质如TNFα、IL-1β下调炎症反应,从而抑制炎症反应。即生理条件下,NE激活后吞噬并杀灭有害病菌参与炎症调节,但NE过度激活会导致胶原蛋白、层粘连蛋白及其他内皮细胞外基质降解引起内皮细胞损伤而导致炎症反应发生[6]。有研究发现在NASH肝脏肝小叶早期存在中性粒细胞浸润这一特征性病理改变[7-8]。此外,国外研究发现中性粒细胞释放的NE与多种肥胖及脂肪组织慢性炎症相关,并且在高脂喂养10周的NE基因敲除小鼠模型中可以发现对胰岛素敏感性增强[1]。NE的活性受多种蛋白酶抑制剂调控,且NE抑制剂包括内源性和人工合成类两种。α1-AT为肝脏合成的内源性弹性蛋白酶抑制剂,它不仅有效抑制NE活性,还可通过调节细胞因子及趋化因子的释放从而发挥多层次抗炎作用,是机体先天免疫反应中的抗炎蛋白,其缺失或不足与肺部疾病密切相关[9-10]。国外最新研究结果显示,NE及其抑制剂之间的失衡与肥胖、胰岛素抵抗和脂肪肝有密切关系[2]。本研究结果显示:高脂高胆固醇喂养12周的ApoE-/-小鼠其肝组织内炎性细胞明显增多并出现明显脂肪变,多种方法检测其肝组织中NE活性明显增高,α1-AT活性降低从而导致NE/α1-AT失衡;黄连素干预组小鼠肝脏内NE活性明显低于高脂组,NE/α1-AT失衡较高脂组亦有明显改善;结合病理结果,黄连素干预组小鼠肝脏脂肪变及炎症浸润程度较高脂高胆固醇组有明显改善,进一步提示黄连素可能通过抑制NE活性调节NE/α1-AT失衡从而改善NASH小鼠肝脏脂肪变及炎症情况,这可为今后治疗NASH提供新的治疗方法。
4参考文献
[1]Talukdar S,Oh da Y,Bandyopadhyay G,et al. Neutrophils mediate insulin resistance in mice fed a high-fat diet through secreted elastase[J]. Nat Med, 2012,18(9):1407-1412. doi: 10.1038/nm.2885.
[2]Mansuy-Aubert V, Zhou QL, Xie X,et al. Imbalance between neutrophil elastase and its inhibitor α1-antitrypsin in obesity alters insulin sensitivity, inflammation, and energy expenditure. Cell MeTab, 2013,17(4):534-548.doi: 10.1016/j.cmet.2013.03.005.
[3]Yang QH, Hu SP, Zhang YP,et al. Effect of berberine on expressions of uncoupling protein-2 mRNA and protein in hepatic tissue of non-alcoholic fatty liver disease in rats. Chin J Integr Med, 2011,17(3):205-211. doi: 10.1007/s11655-011-0668-4.
[4]Xing LJ, Zhang L, Liu T,et al. Berberine reducing insulin resistance by up-regulating IRS-2 mRNA expression in nonalcoholic fatty liver disease (NAFLD) rat liver. Eur J Pharmacol, 2011,668(3):467-471. doi: 10.1016/j.ejphar.2011.07.036.
[5]Rivera CA, Adegboyega P, van Rooijen N,et al. Toll-like receptor-4 signaling and Kupffer cells play pivotal roles in the pathogenesis of non-alcoholic steatohepatitis. J Hepatol, 2007,47:571-579.doi: 10.1016/j.jhep.2007.04.019.
[6]Heutinck K M,ten Bere I J,Hack C E,et al.Serine proteases of the human immue system in health and disease,Mol Immunol,2010,47(11-12):1943-1955.doi: 10.1016/j.molimm.2010.04.020.
[7]LIU J,Zhuang ZJ,Bian DX, et al.Toll-like receptor-4 signalling in the progression of non-alcoholic fatty liver disease induced by high-fat and high-fructose diet in mice. Clin Exp Pharmacol Physiol, 2014,41(7):482-488.doi: 10.1111/1440-1681.12241.
[8]Farrell GC,van Rooyen D,Gan L,et al. NASH is an Inflammatory Disorder: Pathogenic, Prognostic and Therapeutic Implications. Gut Liver, 2012,6(2):149-171. doi: 10.5009/gnl.2012.6.2.149.
[9]Chalmers JD, Hill AT. Mechanisms of immune dysfunction and bacterial persistence in non-cystic fibrosis bronchiectasis. Mol Immunol, 2013,55(1):27-34. doi: 10.1016/j.molimm.2012.09.011.
[10]Okubo K, Yoshizawa K, Okiyama W,et al. Severe alcoholic hepatitis with extremely high neutrophil count successfully treated by granulocytapheresis. Intern Med, 2006,45(3):155-158. doi: 10.2169/internalmedicine.45.1456.
通信作者:施军平,Email:13957121199@126.com
DOI:10.3760/cma.j.issn.1003-9279.2016.03.013
基金项目:国家自然科学基金(81570524);浙江省自然科学基金(LY15H070004)
(收稿日期:2016-04-12)
The intervention study of berberine about the imbalance of NE/α1-AT in mice with NASH
ChenYingji,MaXiaojie,WangLei,JinPeihua,QuHuanjia,ShiJunping
ZhejiangUniversityofTraditionalChineseMedicine,Hangzhou310053,China(ChenYJ,WangL,JinPH)HangzhouNormalUniversity,Hangzhou310053,China(QuHJ).TheAffiliatedHospitalofHangzhouNormalUniversity,Hangzhou310053,China(MaXJ,ShiJP)Correspondingauthor:ShiJunping,Email:13957121199@126.com
【Abstract】ObjectiveTo explore the effect of NE/α1-AT on the pathogenesis of NASH and the adjustment function of berberine to the imbalance of NE/α1-A and the therapeutic action of berberine to NAFLD. Methods8-week-old male C57BL/6JApoE-/-mice (26),according to the weight assigned to the high-fat-high-cholesterol group (18) and standard chow group (8).HFHC group fed with high fat high cholesterol diet and normal water;the SC group fed with normal diet and drank normal water.After 8 weeks, the HFHC group divided into HFHC group and BBR group according to the weight,Berberine group with 200mg/kg/d berberine,the other two groups fed with the same volume of distilled water.12 weeks all mice were sacrificed.We detected body weight,live weight,live function and lipid metabolism.HE and oil red O staining were used to evaluate pathological changes.ELISA method was used to detect NE and α1-AT expression in mice live tissue;RT-PCR method was used to detect protein α1-AT mRNA expression in live tissue;Immunohistochemistry and Western Blotting were applied to determine expression of NE.ResultsCompared with the SC group at the end of 12 weeks,ALT,AST were significantly increased in HFHC group,TG was significantly higher than the SC group.Body weight and live weight of ApoE-/-mice fed with HFHC diet significantly higher than the SC group.HE staining showed obvious steatosis and inflammatory foci in HFHC group. The NAS score at the end of model establishment was 5-8 points,which reached the diagnostic criterion for NASH. The concentration and activity of NE in the SC group were significantly increased,and the level of α1-AT was decreased,which lead to ratio NE/α1-AT was significantly higher than the SC group. BBR in mice treated with HE staining showed inflammation ballooning lower than HFHC group.At week 12,ALT,AST of BBR group increased compared with the SC group,and significantly lower compared with the HFHC group. NE/α1-AT was significantly higher than the HFHC group.Conclusions12 weeks of high fat and high cholesterol feeding, ApoE-/- mice can successfully establish the NASH mouse model;a marked change and contact exist between NE and α1-AT in the process of development of NASH;Berberine can reduce liver lipid deposition and the degree of inflammation in NASH mice,and can improve the NE/ alpha 1-AT imbalance.
【Key words】Non-alcoholic steatohepatitis;berberine;neutrophil elastase;alphal antitypsin
·病毒病诊断与治疗·

