核桃凋落叶分解对3种作物生长、光合及抗性生理特性的影响
张如义,胡红玲,胡庭兴,杨丽妹,舒 兰,阮若玉
(1. 四川农业大学林学院,四川 成都 611130;2.内江市农业科学研究院,四川 内江 641000)
核桃凋落叶分解对3种作物生长、光合及抗性生理特性的影响
张如义1,2,胡红玲1①,胡庭兴1,杨丽妹1,舒兰1,阮若玉1
(1. 四川农业大学林学院,四川 成都611130;2.内江市农业科学研究院,四川 内江641000)
摘要:采用盆栽试验,研究了核桃(Juglans regia)凋落叶在土壤中分解对3种受体作物萝卜(Raphanus sativus)、芥菜(Brassica juncea)和白菜(Brasicca pekinensis)生长、光合及抗性生理特性的影响,并比较不同受体作物对核桃凋落叶化感作用的敏感性,筛选可能与核桃套作的作物。试验设置4.5(T1)、9.0(T2)和18.0 g·盆-1(T3)3个凋落叶添加水平,对照(CK)不添加凋落叶。结果表明:(1)核桃凋落叶在其分解过程中对3种受体作物各项生长指标均表现出抑制作用,随着凋落叶量的增加抑制效应逐渐增强,而随着分解时间的延长抑制效应呈减弱趋势;(2)凋落叶分解80 d时,各处理3种受体作物叶片中的叶绿素和类胡萝卜素含量明显低于CK。各植物叶片净光合速率、气孔导度和蒸腾速率均显著低于CK;(3)与CK相比,各凋落叶处理3种受体作物叶片丙二醛含量增加,过氧化物酶和过氧化氢酶活性表现为受抑制作用,而超氧化物歧化酶活性表现为促进作用,可溶性糖含量增加,可溶性蛋白含量降低;(4)3种受体作物对核桃凋落叶化感综合抑制作用的敏感程度由大到小依次为白菜、萝卜和芥菜。综合各项指标可见,核桃凋落叶在分解初期(约80 d时)对3种受体作物产生了强烈的化感作用,主要通过氧化损伤、抑制叶绿素合成和降低其光合能力来阻碍其生长,之后随着凋落叶的进一步分解,释放的化感物质越来越少,对3种受体作物生长的抑制作用减弱。
关键词:核桃;凋落叶;化感;受体作物;光合特性;抗性生理
农林复合系统对于植被恢复和持续发挥土地生产力具有极为重要的生态经济价值,尤其是在我国人口较多而资源匮乏的地区[1]。而农林复合生态系统中套作或间作植物之间关系如何将影响经营效益的高低乃至农林复合种植的成败,化感作用就是其中不可忽视的一个方面。化感作用是由特定化学物质(化感物质)介导的植物(或微生物)之间直接或间接的相互作用而影响植物生长发育,如种子的萌发、幼苗的生长和成株的开花结实等[2]2-4。
近十多年来,随着退耕还林工程的推进和农业产业结构的调整,我国长江上游地区发展了大面积的核桃(Juglansregia)人工林。由于土地资源的不足,核桃农林复合种植因具有经济和生态的双重效益而受到广泛重视,但核桃及其同属植物被认为具有强烈化感作用,其化感作用所带来的生态负效应也受到国内外广泛关注。目前多数研究者主要通过浸提核桃枝或叶的方式证明其对作物种子萌发及幼苗生长有影响[3-4],这种试验方法产生的化感作用与自然状态下的化感形式存在较大差异。因此,近年来将核桃凋落物添加到土壤中模拟残体分解这一化感途径的研究不断增多[5-6],这种方法充分考虑了土壤生化过程对化感作用的介导作用,大多数化感物质经过土壤而作用于受体植物的形式,更加接近自然状态,对生产实践更具有指导意义。但是,鲜有研究涉及不同受体对核桃化感作用的响应差异。
研究表明,巨桉凋落叶分解过程中释放的化感物质显著抑制植物叶片的净光合速率、气孔导度和蒸腾速率以及光合色素的积累[7-8]。黄溦溦等[9]研究银木凋落叶腐解过程中的化感作用时,发现小白菜抗氧化酶系统中各项活性氧清除酶均表现为低促高抑现象,陈洪等[10]关于巨桉凋落叶对老芒麦幼苗生长和抗性生理的影响研究也证实这一点。长期以来,核桃及其同属植物被认为具有强烈化感作用[11],其凋落叶是化感物质释放的主要来源之一,而在开展核桃农林复合种植时,通常将核桃凋落叶翻耕于土壤中,套种在林间的农作物可能因此而受到影响,有研究表明核桃凋落叶分解物质对小麦、莴笋光合特性和抗性生理均有化感作用[5-6]。为此,笔者采用核桃凋落叶作为供体材料,选用秋末冬初时节核桃叶凋落后常种植于核桃林下的常见蔬菜作物萝卜(Raphanussativus)、芥菜(Brassicajuncea)和白菜(Brasiccapekinensis)作为受体植物,通过盆栽试验,探讨在更加接近自然状态下核桃凋落叶分解对3种作物生长和生理参数的影响,通过比较不同受体对核桃凋落叶化感作用的敏感性,一方面了解核桃凋落叶在土壤中分解对受体作物的化感作用程度和作用机理,为核桃-农作物复合系统的经营管理提供理论依据和参考,另一方面尝试筛选出冬季可能更适宜在核桃林套作的作物。
1材料与方法
1.1试验地概况
试验地设在四川农业大学科研园区,位于四川省雅安市雨城区(29°58′21″ N,102°59′57″ E),海拔为600 m。年平均气温为16.2 ℃,积温为5 231 ℃,月平均最高温为29.9 ℃(7月),月平均最低温为3.7 ℃(1月),年均日照时数为1 039.6 h,无霜期为298 d,多年平均降水量为1 774.3 mm,空气平均湿度为79%,属于亚热带湿润气候区。
1.2试验材料
供试核桃凋落叶取自四川甘孜州8年生核桃林,选择自然凋落到地表的干净、未分解的当年叶片,取回晾干后粉碎为面积约1~2 mm2的碎屑,备用。
受体植物选择秋末冬初时节核桃凋落叶凋落后种植于核桃林下的3种常见蔬菜萝卜、芥菜和白菜,萝卜品种为“板叶满身红”,芥菜品种为“白皮棒菜”,白菜为适宜当地种植的飘儿菜品种“雪白一号”,种子由四川种都种业有限公司提供。播种前,选择饱满、大小均一的种粒,用温水浸泡24 h,待用。
采用统一规格的白色聚乙烯塑料盆(口径14 cm,底径10 cm,高16 cm)作为栽植容器。土壤选择当地农田砂壤土,其基本理化性质如下:pH值为7.84,w(有机质)为24.282 g·kg-1,w(全氮)为0.672 g·kg-1,w(全磷)为6.720 g·kg-1,w(全钾)为5.708 g·kg-1,w(速效磷)为12.631 mg·kg-1,w(速效钾)为15.269 mg·kg-1。预先过筛,混匀,平铺晾置2 d自然风干后定量装盆,每盆用土1 kg,具体参照丁伟等[5]处理方法。播种前将土壤与一定量凋落叶碎末均匀混合,装入栽植容器。
1.3试验设计
采用单因子随机试验设计,根据野外调查,每年1 hm2核桃林地面凋落叶量为8 000~9 000 kg,折算到试验所用盆钵盆口面积上约为9.0 g,故以9.0 g·盆-1作为基本施入量。由于不同林分条件(林龄、林分密度等)存在差异,且受人畜活动以及风等外力因素的影响,不同林地上凋落的核桃叶量不一致,因此设置4.5(T1)、9.0(T2)和18.0 g·盆-1(T3)3种凋落叶量处理,并设对照(CK,不施入凋落叶),各处理均设5个重复,共计60盆。材料准备就绪后,将各剂量核桃凋落叶碎末与等量土壤(1 kg)充分混合,装入盆中,分别播种3种受体作物。播种时,将种子均匀点播于各盆中(20 粒·盆-1),覆土2 cm厚,浇透水。待种子萌发后,采用HH2土壤水分测定仪(ML2x,GBR)监测土壤水分情况,使土壤体积含水量保持在18%左右(即供试土壤田间持水量的70%~80%)。
播种后待各处理种子全部出芽后间苗1次,在播种后80、100和120 d分别取样测定3种受体作物的生长形态指标,并在80 d时测定其光合参数和抗性生理指标。
1.4指标测定方法
1.4.1生长指标的测定
随机选取各处理植株,用直尺测量株高,即从茎盘到最长叶尖的距离。用电子游标卡尺测定植株地面直径。取样洗净后用吸水纸吸干,用电子天平称鲜重(每处理设3个重复,每个重复6株)。
1.4.2光合参数的测定
光合参数测定选择晴朗无风的天气,采用Li-6400便携式光合测定仪(Li-Cor Inc.,USA),人工控制CO2浓度为400 μmol·mol-1,温度为25 ℃,光照强度为1 200 μmol·m-2·s-1,测定净光合速率(Pn)、蒸腾速率(Rt)、气孔导度(Gs)和胞间CO2浓度(Ci),每个处理设5个重复,每个重复记录10个数据。
叶绿体色素含量的测定:将叶片带回实验室,用丙酮-乙醇混合液提取法提取叶绿体色素,用723PC型分光光度计测定叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量[12]。
1.4.3抗性生理指标的测定
抗氧化酶活性:超氧化物歧化酶(SOD)活性采用氮蓝四唑法[13]测定,以抑制NBT光化还原的50%为1个酶活单位(U1)。过氧化物酶(POD)活性采用愈创木酚法[14]72测定,将每1 min 470 nm 处的D470值增加0.01定义为1个酶活单位(U2)。过氧化氢酶(CAT)活性采用紫外分光光度法[15]测定,以1 min内240 nm处的D240值减少0.1为1个酶活单位(U3)。丙二醛(MDA)含量采用硫代巴比妥酸加热显色法[14]126-127测定。渗透调节物质含量的测定:可溶性糖(SS)含量采用硫代巴比妥酸加热显色法[14]81-82测定,与MDA含量同时测定;可溶性蛋白(SP)含量采用考马斯亮蓝G250法[14]85测定。
1.5数据处理
采用WILLIAMSON等[16]提出的敏感指数(Ir)来度量核桃凋落叶对3种受体作物的化感效应,计算方法为:T≥C时,Ir=1-C/T;T
采用SPSS 17.0软件对数据进行单因素方差分析(one-way ANOVA),用最小显著差数法(LSD法)进行多重比较,显著性水平设为α=0.05。
2结果与分析
2.1核桃凋落叶分解对3种受体作物生长指标的影响
由表1可知,播种后80 d,随着核桃凋落叶的分解,3种受体作物的地径、株高和鲜重均随凋落叶量的增加而呈下降趋势,表现为显著受抑制作用(P<0.05)。100~120 d时,受体植物地径、株高和鲜重仍受到抑制作用,同时各凋落叶添加量处理3种受体作物在各个时段的生长均表现出不同的抑制效应,总体上较80 d时有所减弱。
幼苗鲜重是根生长和苗生长的综合反映,以萝卜为例,当核桃凋落叶分解80 d时,T3处理萝卜幼苗鲜重Ir值为-0.756,抑制效应达到最大,随凋落叶添加量的减少,Ir绝对值逐渐减小,表现出明显的剂量效应;而随着凋落叶分解时间的延长,T3处理萝卜幼苗鲜重受抑制效应逐渐减弱,120 d时Ir值为-0.171,表现出明显的时间动态效应。相似地,芥菜和白菜的幼苗鲜重也受到显著抑制(P<0.05),同样表现出明显的剂量效应和时间效应。就同一时段来看,3种作物受到的抑制作用有差异,以凋落叶分解80 d时为例,各剂量凋落叶处理白菜幼苗鲜重(Ir平均值为-0.626)受抑制最强,其次是芥菜(-0.537),萝卜最弱(-0.476)。
2.2核桃凋落叶分解对3种受体作物叶绿体色素含量的影响
随凋落叶量的增加,3种受体作物叶片各种叶绿体色素含量均显著降低(P<0.05,表2)。以萝卜为例,与CK相比,T1处理叶片叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量分别降低16.1%、12.2%和12.1%;T3处理叶片Chl a、Chl b和Car含量分别下降72.1%、70.1%和61.0%。对3种受体作物叶绿体色素含量的比较发现,随凋落叶量的增加,3种作物叶片各种叶绿体色素含量受抑制作用逐渐加强,且3种作物表现出不同的受抑制效应。
2.3核桃凋落叶分解对3种受体作物净光合速率及气体交换参数的影响
由表3可知,随着土壤中核桃凋落叶量的增加,3种受体作物叶片Pn均呈现下降趋势,且各处理与对照之间差异显著(P<0.05),均表现出负效应(Ir<0),其中,芥菜和白菜均以T3处理负效应为最强。各凋落叶处理3种作物Gs和Rt均显著低于CK(P<0.05),且随着凋落叶量的增加,Pn、Gs和Rt受抑制程度增加;而Ci随凋落叶量和受体种类的变化而发生改变,仅T1处理3种作物Ci低于CK,T2处理萝卜和T3处理芥菜Ci高于CK,且芥菜和白菜各处理Ci与CK之间差异均达显著水平(P<0.05)。
表1不同添加量核桃凋落叶对3种受体作物地径、株高和鲜重的影响
Table 1Effects of application rate of walnut leaf litter on ground diameter, plant height, and fresh weight of three different recipient crops
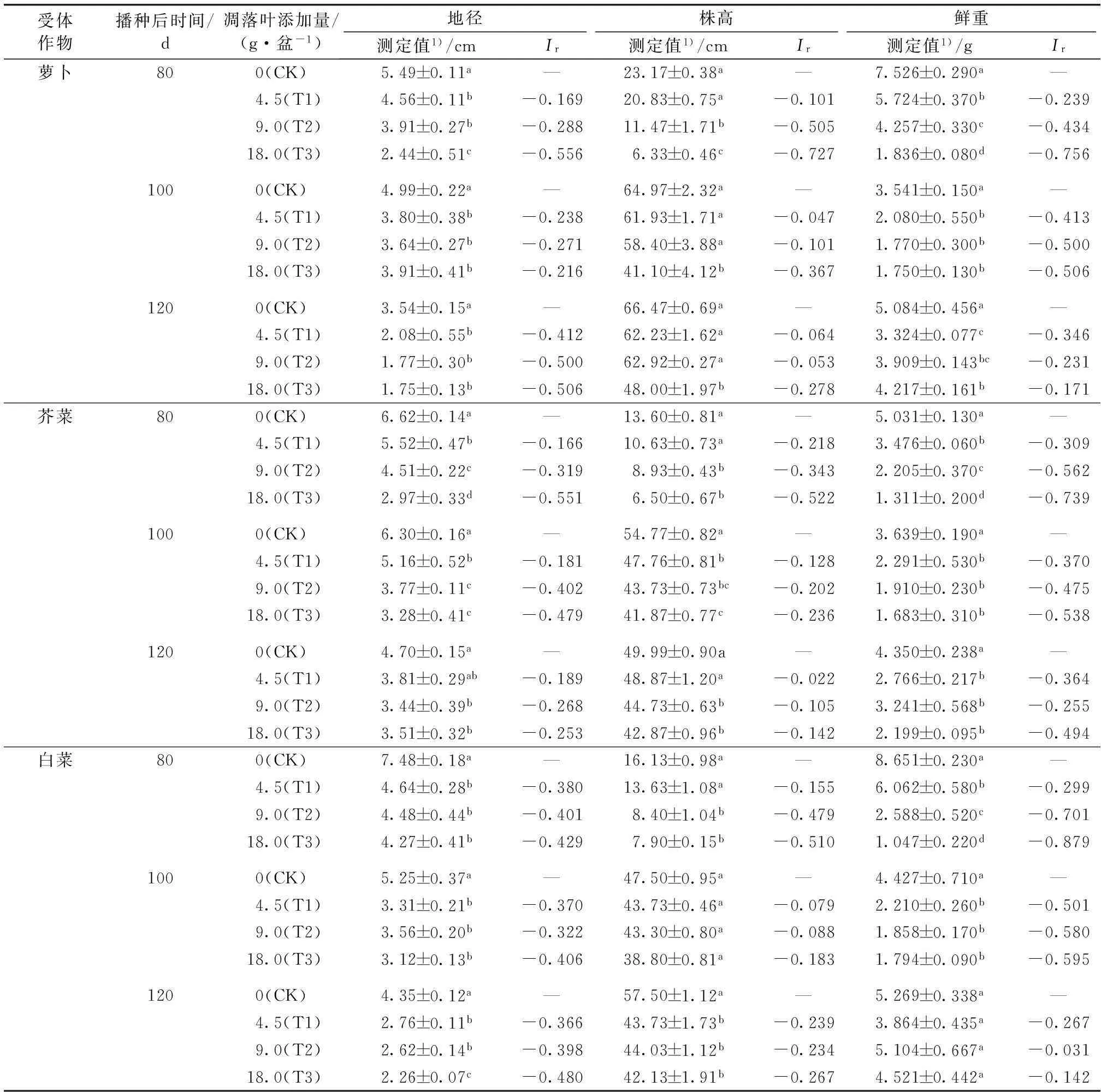
受体作物播种后时间/d凋落叶添加量/(g·盆-1)地径株高鲜重测定值1)/cmIr测定值1)/cmIr测定值1)/gIr萝卜800(CK)5.49±0.11a—23.17±0.38a—7.526±0.290a—4.5(T1)4.56±0.11b-0.16920.83±0.75a-0.1015.724±0.370b-0.2399.0(T2)3.91±0.27b-0.28811.47±1.71b-0.5054.257±0.330c-0.43418.0(T3)2.44±0.51c-0.5566.33±0.46c-0.7271.836±0.080d-0.7561000(CK)4.99±0.22a—64.97±2.32a—3.541±0.150a—4.5(T1)3.80±0.38b-0.23861.93±1.71a-0.0472.080±0.550b-0.4139.0(T2)3.64±0.27b-0.27158.40±3.88a-0.1011.770±0.300b-0.50018.0(T3)3.91±0.41b-0.21641.10±4.12b-0.3671.750±0.130b-0.5061200(CK)3.54±0.15a—66.47±0.69a—5.084±0.456a—4.5(T1)2.08±0.55b-0.41262.23±1.62a-0.0643.324±0.077c-0.3469.0(T2)1.77±0.30b-0.50062.92±0.27a-0.0533.909±0.143bc-0.23118.0(T3)1.75±0.13b-0.50648.00±1.97b-0.2784.217±0.161b-0.171芥菜800(CK)6.62±0.14a—13.60±0.81a—5.031±0.130a—4.5(T1)5.52±0.47b-0.16610.63±0.73a-0.2183.476±0.060b-0.3099.0(T2)4.51±0.22c-0.3198.93±0.43b-0.3432.205±0.370c-0.56218.0(T3)2.97±0.33d-0.5516.50±0.67b-0.5221.311±0.200d-0.7391000(CK)6.30±0.16a—54.77±0.82a—3.639±0.190a—4.5(T1)5.16±0.52b-0.18147.76±0.81b-0.1282.291±0.530b-0.3709.0(T2)3.77±0.11c-0.40243.73±0.73bc-0.2021.910±0.230b-0.47518.0(T3)3.28±0.41c-0.47941.87±0.77c-0.2361.683±0.310b-0.5381200(CK)4.70±0.15a—49.99±0.90a—4.350±0.238a—4.5(T1)3.81±0.29ab-0.18948.87±1.20a-0.0222.766±0.217b-0.3649.0(T2)3.44±0.39b-0.26844.73±0.63b-0.1053.241±0.568b-0.25518.0(T3)3.51±0.32b-0.25342.87±0.96b-0.1422.199±0.095b-0.494白菜800(CK)7.48±0.18a—16.13±0.98a—8.651±0.230a—4.5(T1)4.64±0.28b-0.38013.63±1.08a-0.1556.062±0.580b-0.2999.0(T2)4.48±0.44b-0.4018.40±1.04b-0.4792.588±0.520c-0.70118.0(T3)4.27±0.41b-0.4297.90±0.15b-0.5101.047±0.220d-0.8791000(CK)5.25±0.37a—47.50±0.95a—4.427±0.710a—4.5(T1)3.31±0.21b-0.37043.73±0.46a-0.0792.210±0.260b-0.5019.0(T2)3.56±0.20b-0.32243.30±0.80a-0.0881.858±0.170b-0.58018.0(T3)3.12±0.13b-0.40638.80±0.81a-0.1831.794±0.090b-0.5951200(CK)4.35±0.12a—57.50±1.12a—5.269±0.338a—4.5(T1)2.76±0.11b-0.36643.73±1.73b-0.2393.864±0.435a-0.2679.0(T2)2.62±0.14b-0.39844.03±1.12b-0.2345.104±0.667a-0.03118.0(T3)2.26±0.07c-0.48042.13±1.91b-0.2674.521±0.442a-0.142
Ir为化感指数。 “—”表示无数据。就同种受体作物同一测定时间而言,同列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)数据为平均值±标准差。
表2不同添加量核桃凋落叶对3种受体作物叶绿体色素含量的影响
Table 2Effects of application rate of walnut leaf litter on content of chlorophyll in the three different recipient crops
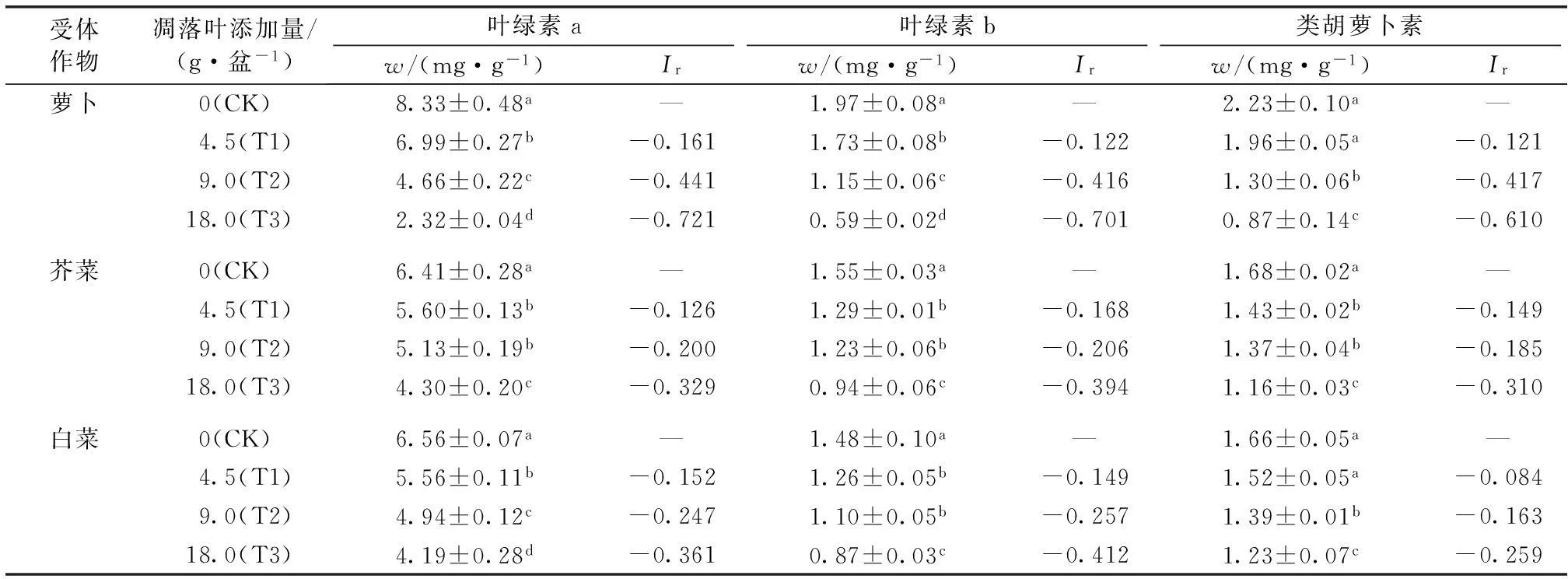
受体作物凋落叶添加量/(g·盆-1)叶绿素a叶绿素b类胡萝卜素w/(mg·g-1)Irw/(mg·g-1)Irw/(mg·g-1)Ir萝卜0(CK)8.33±0.48a—1.97±0.08a—2.23±0.10a—4.5(T1)6.99±0.27b-0.1611.73±0.08b-0.1221.96±0.05a-0.1219.0(T2)4.66±0.22c-0.4411.15±0.06c-0.4161.30±0.06b-0.41718.0(T3)2.32±0.04d-0.7210.59±0.02d-0.7010.87±0.14c-0.610芥菜0(CK)6.41±0.28a—1.55±0.03a—1.68±0.02a—4.5(T1)5.60±0.13b-0.1261.29±0.01b-0.1681.43±0.02b-0.1499.0(T2)5.13±0.19b-0.2001.23±0.06b-0.2061.37±0.04b-0.18518.0(T3)4.30±0.20c-0.3290.94±0.06c-0.3941.16±0.03c-0.310白菜0(CK)6.56±0.07a—1.48±0.10a—1.66±0.05a—4.5(T1)5.56±0.11b-0.1521.26±0.05b-0.1491.52±0.05a-0.0849.0(T2)4.94±0.12c-0.2471.10±0.05b-0.2571.39±0.01b-0.16318.0(T3)4.19±0.28d-0.3610.87±0.03c-0.4121.23±0.07c-0.259
Ir为化感指数。“—”表示无数据。就同种受体作物而言,同列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)数据为平均值±标准差。
表3不同添加量核桃凋落叶对3种受体作物净光合速率和气体交换参数的影响
Table 3Effects of application rate of walnut leaf litter on photosynthetic rate and gas exchange parameters of the three different recipient crops

受体作物凋落叶添加量/(g·盆-1)净光合速率Pn1)气孔导度Gs2)胞间CO2浓度Ci1)蒸腾速率Rt2)测定值3)/(μmol·m-2·s-1)Ir测定值3)/(mol·m-2·s-1)Ir测定值3)/(mmol·mol-1)Ir测定值3)/(mmol·m-2·s-1)Ir萝卜0(CK)9.07±0.12a—0.07±0.00a—172.60±7.46a—1.81±0.08a—4.5(T1)5.90±0.02b-0.3500.04±0.00b-0.429107.70±11.33b-0.3760.91±0.04b-0.4979.0(T2)4.65±0.02c-0.4870.04±0.00b-0.429190.80±2.01a0.0951.00±0.01b-0.44818.0(T3)4.75±0.05c-0.4760.03±0.00c-0.57177.95±6.37c-0.5480.63±0.02c-0.652芥菜0(CK)9.17±0.14a—0.07±0.00a—157.70±4.47b—1.58±0.05a—4.5(T1)6.04±0.02b-0.3410.04±0.00b-0.429141.60±4.78c-0.1021.00±0.02b-0.3679.0(T2)4.55±0.21c-0.5040.03±0.00c-0.571143.30±1.26c-0.0910.75±0.04c-0.52518.0(T3)2.39±0.06d-0.7390.02±0.00d-0.714191.60±5.68a0.1770.48±0.00d-0.696白菜0(CK)12.61±0.55a—0.12±0.03a—196.00±0.24a—2.58±0.91a—4.5(T1)9.02±0.17b-0.2850.05±0.00b-0.583110.30±0.82d-0.4371.32±0.02b-0.4889.0(T2)4.09±0.11c-0.6760.03±0.00c-0.750136.20±0.68b-0.3050.64±0.02c-0.75218.0(T3)3.36±0.04c-0.7340.02±0.00c-0.833126.90±4.10c-0.3530.53±0.01c-0.795
Ir为化感指数。“—”表示无数据。就同种受体作物而言,同列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)以CO2计;2)以H2O计;3)数据为平均值±标准差。
2.4核桃凋落叶分解对3种受体作物叶片抗氧化酶活性和MDA含量的影响
由图1可知,各处理受体作物SOD活性随土壤中凋落叶量的增加而升高,表现出促进作用(Ir>0)。而3种受体作物叶片中POD活性和CAT活性均多表现出显著受抑制作用(P<0.05),且呈现出随凋落叶量增加受抑制作用逐渐加强的趋势(Ir<0)。以POD活性为例,受体作物各处理与CK相比,萝卜的T1、T2和T3处理分别下降30.0%、50.5%和70.6%;白菜T1、T2和T3处理分别下降29.2%、31.7%和51.0%;芥菜的T1处理上升3.6%,T2和T3处理分别下降10.9%和4.6%。随着3种抗氧化酶活性的变化,各处理受体作物叶片MDA含量均高于CK,且呈随凋落叶添加量增加而增大的趋势。从受体作物抗氧化酶活性和膜脂过氧化产物来看,随凋落叶添加量和受体作物种类的不同,SOD、POD和CAT活性以及MDA含量变化规律并不一致,但总体上表现为核桃凋落叶可使受体作物叶片膜脂过氧化明显加重。
2.5核桃凋落叶分解对3种受体作物叶片渗透调节物质的影响
各处理3种受体作物叶片SS含量均显著高于CK(P<0.05),且随凋落叶量的增加而呈现上升趋势。各作物化感效应均以T3处理为最强,萝卜(Ir=0.457)、芥菜(Ir=0.357)和白菜(Ir=0.633)化感效应随凋落叶量的增加而增强。SP含量的变化趋势与SS含量的变化趋势恰好相反,各处理受体作物叶片SP含量均低于CK,T2、T3处理与CK相比差异均达显著水平(P<0.05),且随凋落叶量的增加而减少,表现出受抑制作用(Ir<0)(图2)。

CK、T1、T2和T3指凋落叶添加量分别为0、4.5、9.0和18.0 g·盆-1。叶片质量以鲜重计。同一幅图中同一组直方柱上方英文小写字母不同表示处理间某指标差异显著(P<0.05)。
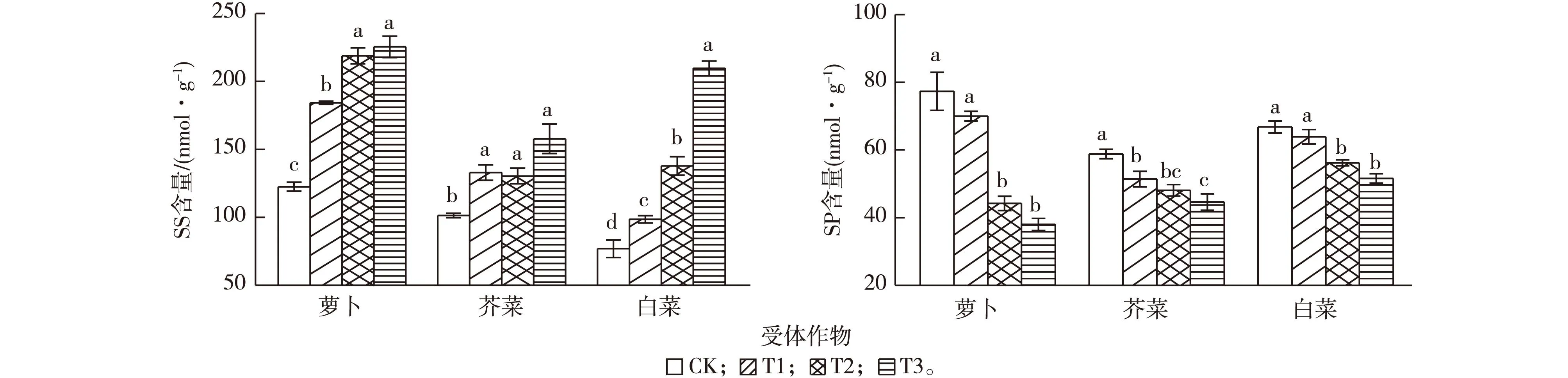
CK、T1、T2和T3指凋落叶添加量分别为0、4.5、9.0和18.0 g·盆-1。叶片质量以鲜重计。同一幅图中同一组直方柱上方英文小写字母不同表示处理间某指标差异显著(P<0.05)。
2.6核桃凋落叶分解对3种受体作物的化感综合效应
由表4可知,对3种受体作物的观测结果均显示,核桃凋落叶分解的化感综合效应随凋落叶添加量的增大而增大,这与3种受体作物在形态生长上表现出的剂量效应是一致的(表1)。总体上来看,不同作物对核桃凋落叶的敏感程度不同,3个水平的核桃凋落叶处理的化感综合效应由大到小依次为白菜、萝卜和芥菜,表明芥菜对核桃凋落叶分解产生的化感作用具有更强的耐受性。
3讨论
3.1核桃凋落叶分解对3种受体作物生长的影响
核桃凋落叶在其分解过程中对3种受体作物各项生长指标均表现出抑制作用,播种后80、100和120 d,随凋落叶量的增加抑制效应逐渐增强,而随分解时间的延长抑制效应呈减弱趋势,这与黄溦溦等[9]和陈洪等[17]以银木凋落叶和巨桉凋落叶为供体的研究结果一致。前期的抑制作用比较明显,可能是因为核桃凋落叶在分解初期释放大量化感物质,而后期抑制作用逐渐减弱可能是因为凋落叶释放的化感物质已经减少,同时土壤中微生物作用也加快化感物质在土壤中的降解,另一方面凋落叶在分解后期释放的营养物质在一定程度上弥补了受体作物初期生长受到的抑制。黄建贝等[6]研究核桃凋落叶分解对小麦的影响也得到类似结论。
表4不同添加量核桃凋落叶对3种受体作物生长的化感综合效应
Table 4Effects of application rate of walnut leaf litter on allolepathic effect (AE) of the litter on growth of the three different recipient crops
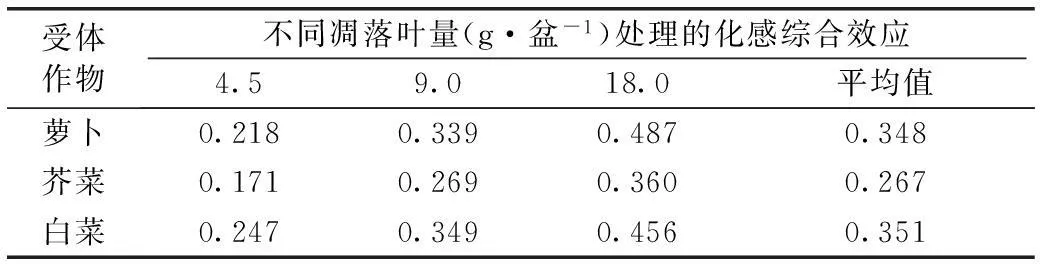
受体作物不同凋落叶量(g·盆-1)处理的化感综合效应4.59.018.0平均值萝卜0.2180.3390.4870.348芥菜0.1710.2690.3600.267白菜0.2470.3490.4560.351
3.2核桃凋落叶分解对3种受体作物光合特性的影响
笔者研究发现,随着凋落叶添加量的增加,3种受体作物各处理叶片叶绿素含量均呈明显下降趋势,表明核桃凋落叶分解释放的化感物质对受体作物叶片中Chl a、Chl b和Car的合成有明显抑制作用,且抑制效应随凋落叶量的增加而增强。丁伟等[5]对核桃凋落叶分解对莴笋抗氧化系统及光合特性的影响研究也发现了这种现象。经凋落叶处理后各受体作物Pn、Gs和Rt均呈下降趋势,综合分析其光合速率降低的原因主要是化感物质抑制了叶绿体色素的合成,造成氧化胁迫,从而限制作物营养生长,最终影响生物量积累。陈刚等[18]在研究天竺桂对凤仙花的化感作用时也得到相似结论。
3.3核桃凋落叶分解对3种受体作物抗性生理特性的影响
现代植物生理学认为,植物抗氧化能力的提高和渗透调节物质的积累是植物在逆境条件下得以生存的2种不同的重要机制[19]。逆境条件下,植物细胞内的自由基平衡被打破,自由基积累导致膜脂过氧化,对植物造成损害,并伴有MDA的产生[20]。同时也诱导以SOD、POD和CAT为主的保护酶系统活性升高,但当胁迫超过一定范围时,保护酶系统会受到破坏,使得植物体内的活性氧代谢失调[21-22]。笔者试验结果表明,随着核桃凋落叶添加量的增加,3种受体作物叶片中POD和CAT活性均呈减弱的变化规律,且各处理多表现为受抑制作用(Ir<0),而SOD活性则随凋落叶量的升高而升高,表现为显著促进作用(Ir>0),伴随着3种抗氧化酶的变化,与CK相比各处理MDA含量呈现显著升高趋势。说明受体作物在化感物质胁迫下抗氧化酶系统产生积极的响应,但其调节能力有限,当胁迫压力超出一定范围时,酶结构遭受破坏导致体内积累过量的活性氧自由基,这些自由基又引起膜脂过氧化,产生大量MDA,进而导致植物代谢及生理功能出现紊乱,生长受到显著抑制。而SOD、POD和CAT作为细胞保护酶,在相同处理方式下表现出的变化趋势却不相同,说明核桃凋落叶中化感物质对受体作物不同酶活性的影响不同,杨延杰等[23]的研究中也得出了类似结论。
逆境条件下,植物体内作为有机渗透保护物质的SP和SS会被大量诱导合成[24]。笔者研究中3种受体作物各处理SS含量随凋落叶量增加均呈现显著增长趋势,而SP含量却呈现下降趋势。这与陈洪等[17]以巨桉凋落叶为供体的研究结果相同。可能的原因有:一是核桃凋落叶中释放的化感物质妨碍了植物根系对水分的吸收,造成一定程度的水分胁迫,从而使其SS大量积累[10];二是大量化感物质妨碍了受体植物根系对矿质离子的吸收,蛋白质合成缺少所需的P、S和Fe元素;三是化感物质进入细胞后,直接与之作用,使其变性沉淀,如生物碱、有机酸等破坏了蛋白质结构[25]。
3.4综合评价
有研究表明,化感物质具有多种生理作用,可以影响受体植物多种生理代谢活动[26],受体植物光合特性、抗性生理特性的变化,以及形态生长受到抑制,应该是化感物质对植物体内多种生理代谢活动综合作用的结果。核桃凋落叶分解80 d时,其释放的化感物质通过影响受体作物抗氧化保护酶系统平衡和渗透调节物质的积累,对其细胞造成过氧化伤害,致使其叶绿素合成受到抑制,光合能力降低,最终导致受体作物生长受到抑制。100~120 d时,随着时间的延长,受体作物受抑制程度逐渐减弱,凋落叶分解产生的化感作用强度在时间上呈先增强后减弱的趋势,这可能是凋落叶在土壤中逐步释放的化感物质在一定时间内逐步积累至最多,效应最强,随着时间的延长,其释放的化感物质转而逐步减少,其作用也随之减弱。
化感物质有选择性和专一性,同一种化感物质对不同受体植物的作用效果也不相同[2]55-56。总体上来看,3种受体作物对核桃凋落叶的敏感程度不同,芥菜受到的化感综合抑制效应最弱,表明其更适合在核桃林下套作,而白菜受综合抑制效应最大,最为敏感,不宜在核桃林下套作。3种受体作物生长受到的抑制作用呈随凋落叶量的增大而增大、随分解时间的延长而逐渐减弱的趋势。因此,在核桃-农作物复合种植的生产实践中,减少单位面积地表核桃凋落叶的堆积量,可以有效减弱其对受体作物生长的抑制作用,最好在凋落叶分解一段时间后再种植作物。
4结论
综上所述,核桃凋落叶在分解过程中可能通过释放化感物质影响了受体作物抗氧化保护酶系统平衡和渗透调节物质的积累,对细胞造成过氧化伤害,致使其叶绿素含量和光合能力降低,最终影响了作物的形态生长和生物量积累。就笔者研究而言,3种作物对核桃凋落叶的敏感程度不同,芥菜受到的综合抑制效应最弱,表明其更适合在核桃林下套作。因此,在核桃-农作物复合种植的生产实践中,通过农作物品种的选择和合理的水肥管理,开展核桃-农作物复合种植是可行的。当然,盆栽试验条件与田间状况尚存在一定差异,有必要进一步开展田间试验加以验证。
参考文献:
[1]张明如,翟明普,尹昌君,等.农林复合生态系统的生态学原理及生态经济功能研究进展[J].中国水土保持科学,2003,1(4):66-71.
[2]孔垂华,胡飞.植物化感相生相克作用及其应用[M].北京:中国农业出版社,2001.
[3]翟梅枝,高小红,赵彩霞,等.核桃枝叶水溶物的化感作用研究[J].西北农业学报,2006,15(3):179-182.
[4]彭晓邦,程飞,张硕新.核桃叶水浸液对不同产地黄苓的化感效应[J].草地学报,2011,19(5):839-845.
[5]丁伟,胡庭兴,李仲彬,等.核桃凋落叶分解对莴笋抗氧化系统及光合特性的影响[J].西北植物学报,2014,34(4):769-777.
[6]黄建贝,胡庭兴,吴张磊,等.核桃凋落叶分解对小麦生长及生理特性的影响[J].生态学报,2014,34(23):6855-6863.
[7]吴秀华,李羿桥,胡庭兴,等.巨桉凋落叶分解初期对菊苣生长和光合特性的影响[J].应用生态学报,2013,24(7):1817-1825.
[8]陈良华,弓平,杨万琴,等.巨桉凋落叶分解初期对小白菜光合生理特性的影响[J].四川农业大学学报,2012,30(2):174-180.
[9]黄溦溦,胡庭兴,张念念,等.银木凋落叶腐解过程对小白菜生长和抗性生理的影响[J].生态学报,2012,32(12):3883-3891.
[10]陈洪,胡庭兴,杨万勤,等.巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响[J].草业学报,2011,20(5):57-65.
[11]李茜.渭北黄土区农林复合系统核桃化感作用研究[D].杨凌:西北农林科技大学,2011.
[12]杨敏文.快速测定植物叶片叶绿素含量方法的探讨[J].光谱实验室,2002,19(4):478-481.
[13]GIANNOPOLITIS C N,ROES S K.Superoxide Dismutases:I.Occurrence in Higher Plants[J].Plant Physiology,1977,59(2):309-314.
[14]熊庆娥.植物生理学实验教程[M].成都:四川科技出版社,2003.
[15]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002:84-85.
[16]WILLIAMSON G B,RICHARDSON D.Bioassays for Allelopathy:Measuring Treatment Responses With Independent Controls[J].Journal of Chemical Ecology,1998,14(1):181-187.
[17]陈洪,米小华,胡庭兴,等.巨桉凋落叶分解对牧草生长和光合特性及土壤酶活性的影响[J].西北植物学报,2014,34(4):810-819.
[18]陈刚,彭勇,涂利华,等.天竺桂凋落叶对凤仙花生长和光合特性的影响[J].西北植物学报,2014,34(5):1015-1024.
[19]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[20]李坤,郭修武,郭印山,等.葡萄根系浸提液的化感作用[J].应用生态学报,2010,21(7):1779-1784.
[21]李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[22]POLITYCK A B.Peroxidase Activity and Lidid Peroxidation in Roots of Cucumber Seedlings Influenced by Derivatives of Cinnamic and Benzoic Acids[J].Acta Physiologiae Plantarum,1996,18(4):365-370.
[23]杨延杰,王晓伟,赵康,等.邻苯二甲酸对萝卜种子萌发、幼苗叶片膜脂过氧化及渗透调节物质的影响[J].生态学报,2013,33(19):6074-6080.
[24]高英志,王艳华,王静婷,等.草原植物碳水化合物对环境胁迫响应研究进展[J].应用生态学报,2009,20(11):2827-2831.
[25]郭蔼光.基础生物化学[M].北京:高等教育出版社,2001:59-60.
[26]李寿田,周健民,王火焰,等.植物化感作用研究概况[J].中国生态农业学报,2002,10(4):68-70.
(责任编辑: 李祥敏)
收稿日期:2015-06-25
基金项目:“十二五”国家科技支撑计划(2011BAC09B05);四川省教育厅重点项目(13ZA0246)
通信作者①E-mail: 15039081@qq.com
中图分类号:X176; Q143
文献标志码:A
文章编号:1673-4831(2016)04-0595-08
DOI:10.11934/j.issn.1673-4831.2016.04.013
作者简介:张如义(1989—),男,四川广元人,硕士生,主要从事森林生态方面的研究。E-mail: 847408099@qq.com
Effects of Decomposing Walnut (Juglans regia) Leaf Litter on Growth, Photosynthesis and Resistance Physiology of Three Recipient Plants.
ZHANG Ru-yi1,2, HU Hong-ling1, HU Ting-xing1, YANG Li-mei1, SHU Lan1, RUAN Ruo-yu1
(1. College of Forestry, Sichuan Agricultural University, Chengdu 611130, China; 2. Neijiang City Academy of Agricultural Sciences, Neijiang 641000, China)
Abstract:A pot experiment was conducted to study effects of decomposing walnut leaf litter on growth, photosynthesis and resistant physiology of three recipient crops, i.e. radish (Raphanus sativus), mustard (Brassica juncea) and Chinese cabbage (Brasicca pekinensis), and to compare the three crops in sensibility to allelopathy of the litter, with a view to choosing a crop suitable for interplantation with walnut trees so that ideal income can be obtained. The experiment was designed to have four litter application rates, i. e. Treatment T1 (4.5 g·pot-1), Treatment T2 (9.0 g·pot-1), Treatment T3 (18.0 g·pot-1) and CK (0 g·pot-1). Results show that: (1) The litter during its decomposing process displayed inhibiting effect on all the growth-related indices of the three recipient plants, and the effect increased with rising litter application rate, but declined with the decomposition process going on; (2) On D80 (80 days after application of the litter), it was found that the contents of chlorophyll and carotenoid of the recipient crops in the treatments were significantly lower than their respective ones in CK, and so were the net photosynthetic rates (Pn), stomatal conductances (Gs) and transpiration rates (Rt) of the recipient plants; (3) The content of MDA in leaves of the recipient plants were higher in the treatments than in CK (P<0.05). The activities of peroxidase (POD) and catalase (CAT) were inhibited in all the treatments, while the activity of superoxide dismutase (SOD) was promoted. The content of soluble sugar (SS) increased, but the content of soluble protein (SP) decreased; and (4) The three recipient plants displayed an order of cabbage > radish > mustard in terms of sensitivity to the allelopathic inhibition of decomposing walnut leaf litter. Comprehensive analysis of all the indices shows that during the initial period of decomposition (about 80 days), the litter displayed strong allelopathic effects on all the three recipient plants. Growth of the recipient crops was inhibited by the litter through oxidative damage, and hinderance of synthesis and photosynthesis of chlorophyll, but with the decomposition going on, the litter released less allelopathic substances and as a result, the inhibitive effect of the litter weakened.
Key words:walnut; leaf litter; allelopathy; recipient plant; photosynthetic characteristic; resistant physiology

