两种硫酸鱼精蛋白效价测定方法的比较与分析
刘萍,顾建琴,孙杰,胡,姜珠慧,郑钊铖,唐黎明
(上海市食品药品检验所,上海 201203)
两种硫酸鱼精蛋白效价测定方法的比较与分析
(上海市食品药品检验所,上海 201203)
目的 分析并比较两种硫酸鱼精蛋白的效价测定方法。方法 分别采用肝素-结合力滴定法和生物测定法对5批硫酸鱼精蛋白进行效价测定,滴定法依据国外药典,生物测定法依据《中国药典》施行。结果 肝素结合力-滴定法的滴定终点吸光度值在中(0.10 mg/mL)、高浓度(0.15 mg/mL)相对稳定,效价数据的相对标准偏差(RSD)小于5%。三种待测液浓度与肝素标准品滴加量呈良好的线性关系,相关系数R2为1.000。将滴定法与生物测定法效价结果进行比较,两种方法的相关性显著(P=0.013),误差水平一致(P>0.05),但滴定法测得的效价数值略低于生物测定法结果(P=0.045)。结论 肝素结合力-滴定法的方法可行、操作简便,国内应积极推广。
硫酸鱼精蛋白;生物测定法;肝素-结合力滴定法
硫酸鱼精蛋白(protamine sulphate)系适宜的鱼类新鲜成熟精子中提取的一种碱性蛋白质硫酸盐[1]。本品为强碱性蛋白质,带强阳电荷,能与肝素分子中维持抗凝活性所必需的酸性基团迅速结合,形成稳定的复合物,从而使肝素失去抗凝能力,在心血管外科、肝脏外科等领域发挥着不可替代的重要作用[2-3]。《中国药典》[4]中现行收载的标准中效价测定方法为兔全血法和猪/兔血浆法。该法需制备新鲜全血或血浆,操作繁琐,实验周期长,费时费力,特异性较差[5],且受到生物差异和主观终点判定的影响。相比之下,国外药典均已采用肝素结合力-滴定法替代原有的生物测定法。该法利用硫酸鱼精蛋白与肝素的结合活性,在硫酸鱼精蛋白溶液中逐步滴加肝素。当溶液在可见光区的吸光度出现显著增大时,将该吸光度突跃点记为滴定终点,并用该点的肝素加入量计算硫酸鱼精蛋白的效价。
目前,肝素结合力-滴定法已为美国[6]、日本[7]、英国[8]、欧洲药典[9]所接受,成为国外药典硫酸鱼精蛋白效价测定的常规方法之一。各国药典的共通部分是均要求配制硫酸鱼精蛋白(原料)的三种浓度待测液(0.15 mg/mL、0.10 mg/mL和0.05 mg/mL),并在适宜波长下测定三种待测溶液的吸光度,基于吸光度突跃点计算其效价。美国、英国及欧洲药典对测定波长并未规定,日本药方局推荐500 nm。各国药典对肝素标准品溶液的配制规定也有所不同。美国药典规定肝素标准品浓度为80~120 U/mL,而日本药典则规定为20 U/mL。
在我国,硫酸鱼精蛋白注射液是临床外科手术中用于中和肝素的手术必备药品,然而由于生产企业少,药品价格较低等原因,国内曾出现市场短缺现象。《中国药典》要求采用生物测定法检测硫酸鱼精蛋白及其注射液效价,使生产企业面临试验条件匮乏、操作困难的难题。因此,为顺应药典简化和减少生物测定法的趋势[10],并与国际接轨推行肝素结合力-滴定法,本研究致力于比较滴定法与生物测定法的异同,并对两种方法结果的一致性进行讨论,为《中国药典》中硫酸鱼精蛋白效价测定的方法修订提供有效的数据支持。
1 材料与方法
1.1 肝素结合力-滴定法
1.1.1 仪器及试剂:Sartorius CP225D型电子天平(德国赛多利斯有限公司),UV2550型紫外可见分光光度计(日本岛津公司)。肝素钠标准品由中国药品生物制品检定所提供(批号:150509-200912),每毫克相当于197 IU。水为灭菌注射用水,5批硫酸鱼精蛋白及注射液由国内相关生产企业提供,其中原料3批,注射液2批。
1.1.2 测定方法:根据国外药典USP38、EP8.0、JP16等,每批原料(Y)精密称取3份硫酸鱼精蛋白粉末样品,每份样品用灭菌注射用水配制0.15、0.10和0.05 mg/mL 3个浓度的待测液,各浓度平行测定两次。制剂(Z)按标示量配制三份0.15 mg/mL的待测溶液,每份样品同样平行测定两次。取2.0 mL(Vs)待测液,置于比色杯内并滴加肝素钠标准品溶液,在500 nm处测定吸光度值,记录加入肝素钠标准品溶液体积和待测液的吸光度值。连续滴加,直至待测液吸光度值出现显著升高。将每次滴定前后的吸光度值跃变差值ΔA的最大值点记为突跃点,并将该点作为滴定终点。记录滴定终点处累计加入肝素钠标准品溶液体积(VT),并按下式计算硫酸鱼精蛋白效价:
测得效价=(VT×CT)/(VS×CS),其中VT:加入肝素钠标准品的体积(mL);CT:肝素钠标准品的浓度(U);VS:待测样品的体积(mL);CS:待测样品的浓度(mg/mL)
原料应计算三种浓度待测液和各份样品测定结果的平均值和标准差,所有效价测定结果的平均值即为硫酸鱼精蛋白供试品(干燥品)1 mg中和肝素的效价(单位)。制剂应计算0.15 mg/mL浓度测定结果的平均值和标准差,全部效价结果的平均值即为制剂的效价(单位)。
1.2 生物测定法
1.2.1 实验动物:新西兰家兔,体质量约2.0~2.5 kg,雌雄均可,雌者需无孕,由上海奉贤辉煌养殖场提供。试验前在实验动物室适应性饲养至少3天。
1.2.2 测定方法:根据《中国药典》(2015年版)和《中国药品检验标准操作规范(2010年版)》[11]中的硫酸鱼精蛋白生物测定法,取新鲜兔全血,并配制肝素标准品溶液(系滴定法同批标准品)和硫酸鱼精蛋白供试品溶液(1 mg/mL)。测定法及结果判断严格按照《中国药典》执行,观察并记录各管凝结时间。每批样品重复5次。5次结果的平均值即为硫酸鱼精蛋白供试品(干燥品)1 mg中和肝素的效价(单位)。
1.3 统计学方法 所有统计方法运用SPSS 19.0进行操作。2种测定方法的相关性检验采用Pearson相关分析,同批样品两种方法测得的数据的差异运用配对样本t检验进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 肝素结合力-滴定法结果
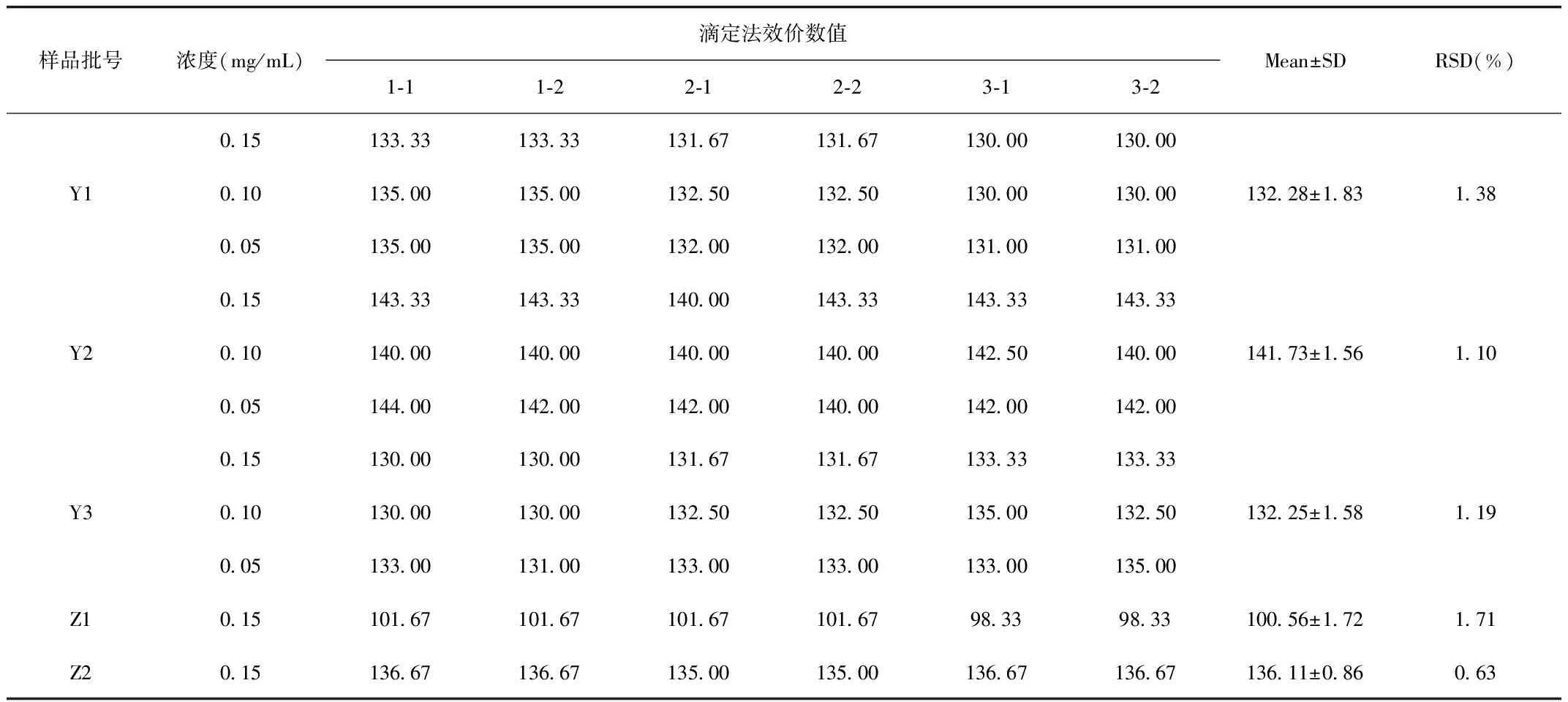
2.1.1 3批原料样品与2批制剂样品效价结果:肝素结合力-滴定法测得的硫酸鱼精蛋白效价结果如表1所示。3批原料样品的效价平均值分别为132.28、141.73和132.25 U/mL,相对标准偏差(RSD)分别为1.38%、1.10%和1.19%。2批制剂样品的效价平均值分别为100.56和136.11 U/mL,RSD分别为1.71%和0.63%。5批样品的RSD均在5%以下。
表1 肝素结合力-滴定法测得的硫酸鱼精蛋白效价结果Tab.1 The potency results of heparin titration method
2.1.2 3批原料样品滴定终点吸光度结果:三种浓度硫酸鱼精蛋白待测液的滴定终点吸光度有所不同。如表2所示,当待测液浓度为0.15 mg/mL,滴定终点的吸光度值多在0.5~0.8之间,且3批原料供试品(0.15 mg/mL)滴定终点的RSD分别为6.87%、17.63%和7.53%;当待测液浓度为0.10 mg/mL时,滴定终点的吸光度值在0.2~0.5之间,三份样品的RSD分别为3.31%、25.36%和22.32%;当待测液浓度为0.05 mg/mL时,终点吸光度值始终在0.2以下,且RSD较高,有两份样品的RSD达24.21%和28.21%。根据以上数据计算,0.15 mg/mL、0.10 mg/mL和0.05 mg/mL待测液的平均RSD分别为10.68%、16.99%和22.25%。由此可知0.05 mg/mL待测液的滴定终点吸光度值的稳定性低于其他两种浓度待测液。
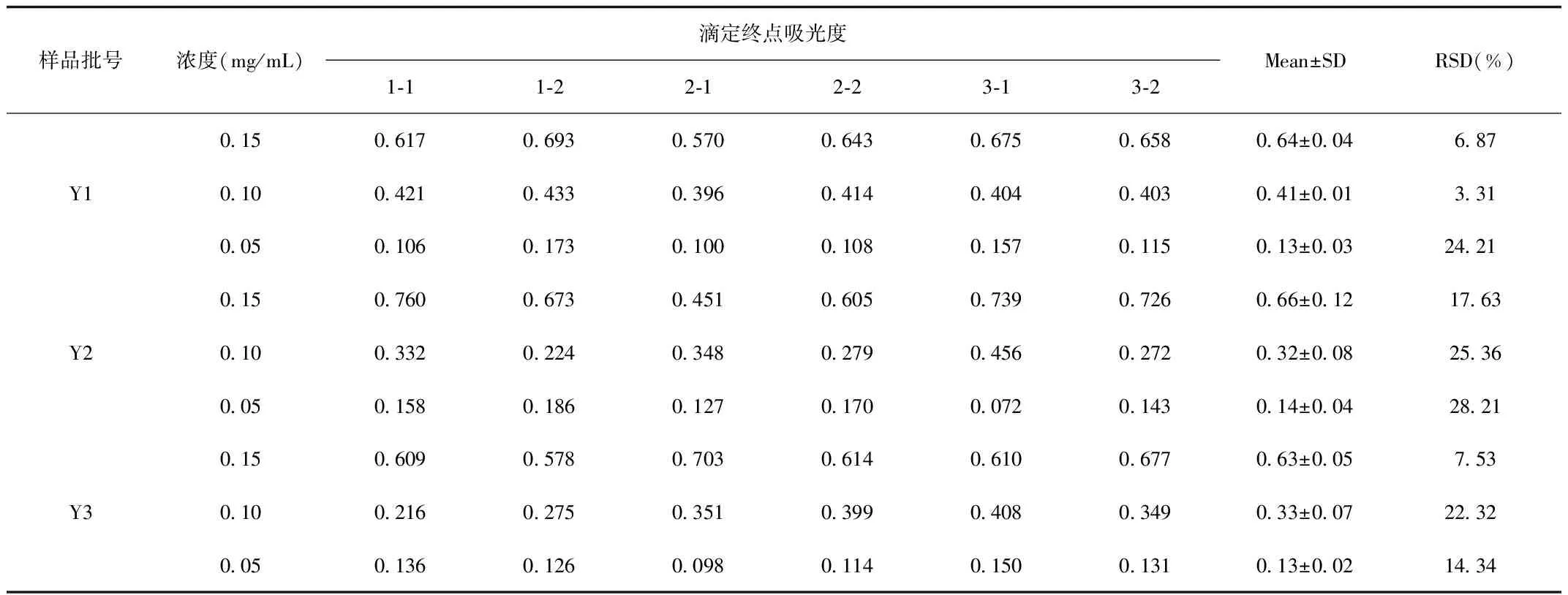
表2 硫酸鱼精蛋白不同浓度待测液滴定终点吸光度值Tab.2 The absorbance at the end-point of different test solutions
2.2 回归分析
2.2.1 各浓度滴定终点吸光度和肝素加入体积回归分析:根据各浓度滴定吸光度和肝素加入体积绘制吸光度变化曲线图。如图1所示,各浓度滴定终点前4个点的吸光度值均在0.2以下,且吸光度值十分接近。当跃变发生时,待测液浓度越大,其吸光度的变化越显著,肉眼也能观察到比色杯中白色浑浊出现。对三种浓度的滴定终点吸光度-肝素加入体积进行回归分析,可见良好的线性关系,相关系数R2为0.991,说明加入肝素标准品的体积与硫酸鱼精蛋白待测液的滴定终点吸光度成正比,因此滴定终点吸光度值可以作为指示硫酸鱼精蛋白中和肝素的敏感指标。
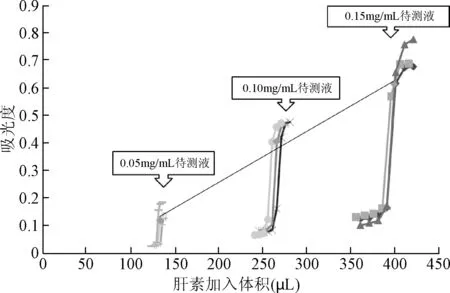
图1 三种浓度硫酸鱼精蛋白待测液的滴定曲线图Fig.1 The relationship of the absorbance with volumes oftitrant at three test solutions
2.2.2 供试品待测液浓度和肝素加入体积的回归分析:对供试品待测液浓度和肝素加入体积进行回归分析,结果见图2。相关系数R2为1.000,回归方程为y=2640x+0.5。该结果表明肝素结合力-滴定法在待测液不同浓度有良好的线性关系,适于多种浓度硫酸鱼精蛋白的效价分析。
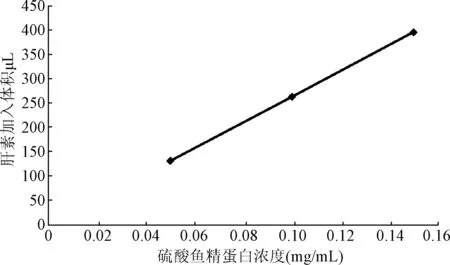
图2 三种浓度硫酸鱼精蛋白与肝素加入体积线性关系图Fig.2 The Linear relationship of three test solutions with volumes of heparin titrant(±s,n=6)
2.3 肝素结合力-滴定法与生物测定法结果比较 为比较滴定法与生物测定法测得结果的一致性,同批样品分别采用两种方法进行效价测定。生物测定法每批样品重复5次,共5个结果。结果见表3,3批原料样品的效价平均值分别为144.00、146.00和146.00 U/mL,RSD分别为2.91%、1.53%和2.87%。2批制剂样品的效价平均值分别为105.00和137.00 U/mL,RSD分别为0.00%和2.00%。生物测定法的RSD水平与滴定法(表1)水平没有统计学差异(P>0.05),两者误差大小一致。
运用Pearson相关分析进一步检验两种方法的相关性,结果显示Pearson相关系数为0.951,两种方法的相关性显著(P=0.013)。运用配对样本t检验比较同批样品两种方法测得的数据是否存在差异。检验结果显示,滴定法测得的硫酸鱼精蛋白效价水平显著低于生物测定法结果(P=0.045)。
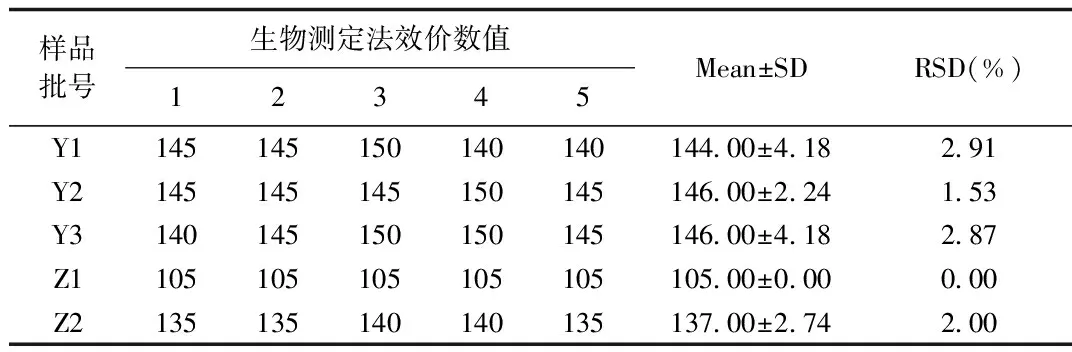
表3 硫酸鱼精蛋白生物测定法效价结果Tab.3 The potency results of biological assay
3 讨论
本研究采用肝素结合力-滴定法和生物测定法检测并比较了5批硫酸鱼精蛋白原料及制剂的效价。结果显示,肝素结合力-滴定法虽然在低浓度时的滴定终点吸光度值误差较大,但中、高浓度的滴定终点吸光度值相对稳定;高中低三种浓度测得的效价数据相对标准偏差小,待测液浓度与肝素标准品滴加量呈显著的线性关系,提示该方法线性与专属性良好。与生物测定法进行结果比对后发现,两种方法的误差水平一致,且数据呈显著相关性。
肝素结合力-滴定法和生物测定法都建立在硫酸鱼精蛋白与肝素分子具有结合活性的基础上。但是两种方法的原理和性质却大相径庭。首先,生物测定法的试验体系是新鲜兔全血或猪/兔血浆,一定量的鱼精蛋白和不同肝素剂量混合后,再加入新鲜血液与之作用。生物测定法的优点是提供了与临床疗效一致的药品的生物活性信息,可监测不曾预料、不易发现的构象变化,在生化药品的鉴别、纯度、安全、活性、效价和稳定性等方面发挥重要作用[12]。但是其缺点是存在生物变异带来的实验误差,例如本试验采用的动物和基底血液的差异会直接导致测定结果不同。另一方面,鱼精蛋白还能与生物体内的粘多糖、核酸以及纤维蛋白原等物质结合。如果基底血液中已经存在肝素或非正常水平的粘多糖就会造成实验结果偏差[13]。
相比之下,肝素结合力-滴定法不使用血液或血浆,利用鱼精蛋白和肝素结合后产生复合物的特点,将吸光度跃变值最大的一点定为滴定终点。该法避免了生物变异带来的偏差,且用仪器测定代替了肉眼观察终点,方法相对客观,操作简便。但是由于分光光度计测定值的最佳范围在0.3~0.7之间,故滴定终点吸光度值如果低于0.3或高于0.7就会引入一定误差。在本研究中可见0.05 mg/mL待测液的滴定终点吸光度值相对偏差较大。另一方面,当吸光度值发生跃变时,由于吸光度值改变速度较快,因此肝素标准品加入至吸光度测定之间的等待时间如有不同,也会对滴定终点吸光度值的判定带来影响。除此之外,肝素滴定液加入体积大则试验误差大,在小浓度待测液中如果一次滴加过量肝素,会造成跃变点被掩盖的现象,导致吸光度值改变不明显。基于以上情况,本研究在滴定0.15、0.10及0.05 mg/mL待测液时,分别采用不同的肝素滴加体积(10、5和2 μL),并且严格规定肝素标准品加入至吸光度测定之间的等待时间为30 s,据此得出精密度较高的滴定法效价结果。
本研究发现滴定法和生物测定法的数据呈显著相关性,相关系数为0.951,该结果说明滴定法和生物测定法数据呈线性相关性,即用生物测定法得出的效价水平越高,用滴定法也能得出较高水平。然而另一方面,本研究发现滴定法测得的效价水平低于生物测定法的数值。造成该差异的原因除了方法原理和性质不同外,还可能受到了终点判定方式的影响。生物测定法要求在试验前进行鱼精蛋白效价预测。当鱼精蛋白和肝素混合后,应立即摇匀并放置1 min后观察。如全部管均出现不透明浑浊,则肝素剂量应加大,直到出现半透明浑浊管[14]。生物测定法的终点管往往介于不透明浑浊管和半透明浑浊管之间。相比之下,滴定法依据的是鱼精蛋白和肝素结合后浑浊出现的跃变点,且需在短时间内尽快测定吸光度值。因此,滴定法的判定终点可能出现在生物测定法之前。另外,本研究的硫酸鱼精蛋白比对样品仅为5批,结果可能受限于样本量较小带来的误差,其统计学差异P值也仅为0.045,差异判定的强度较弱。因此,滴定法和生物测定法是否真正存在差异,还需未来进一步研究。
综上,肝素结合力-滴定法的精密度、线性与专属性均良好,采用的试剂和仪器在我国实验室内普遍,操作省时省力,易于推广。虽然测得的效价结果低于生物测定法,但两种方法的相关性显著,相对标准偏差大小一致,且滴定法的实验误差易于控制,实用性优秀。现今,随着全球对动物保护意识的提高和3R原则[15]的广泛施行,用理化方法取代生物测定法已经是生产、技术、环境等多方面的共同要求。在未来的生化药品检测中,生物测定法可以逐步转化为辅助理化方法的定性或半定量测定,使两种方法共同在生化药品的效价检测中发挥积极作用。
[1] 傅红霞,杜荣茂,应铁进,等.鱼精蛋白的研究现状及其发展前景[J].食品科技,2003(4):25-27.
[2] 肖祥胜,张跃民.鱼精蛋白用于中和肝素时的副反应[J].医学信息:医学与计算机应用,2001,14(8):517-519.
[3] 谢安,魏蔚.鱼精蛋白的应用现状及存在的问题[J].中国胸心血管外科临床杂志,2016,23(1):78-82.
[4] 中华人民共和国卫生部药典委员会.中华人民共和国药典(2015年版四部)[S].北京:中国医药科技出版社,2015.
[5] Snycerski A,Dudkiewicz-Wilczynska J, et al.Determination of protamine sulphate in drug formulations using high performance liquid chromatography[J].J Pharm Biomed Anal,1998,18(4-5):907-910.[6] The United Stateds Pharmacopeial Convention.The United States Pharmacopeia(USP 38)[S].Baltimore:United Book Press,2015.
[7] Society of Japanese Pharmacopeia.Japanese Pharmacopoeia XVI[S].Tokyo:YAKUJINIPPO,2011.
[8] British Pharmacopeia Commission Office.British Pharmacopoeia[S].London:The Stationery Office,2014.
[9] Council of Europe.European Pharmacopoeia 8.0[S].Nördlingen:Druckerei C.H.Beck,2014.
[10] 李湛军,范慧红,徐康森.2010版药典生化药品的生物测定和安全性检查的剖析[J].药物分析杂志,2010(11):2241-2245.
[11] 中国药品生物制品检定所.中国药品检验标准操作规范(2010年版)[M].北京:中国医药科技出版社,2010.
[12] 王亚敏.生物检定在药品质量标准中的作用[J].中国生化药物杂志,2007,28(2):133-136.
[13] Jaques LB.Protamine-antagonist to heparin[J].Canadian Medical Association Journal,1973,108(10):1291-1297.
[14] 冷炜.药品的生物检定[M].北京:气象出版社,1995.
[15] Balls M.3R和仁慈准则[M].北京:科学出版社,2014.
(编校:王俨俨)
Comparison and analysis of two potency assay methods of protamine sulfate
LIU Ping, GU Jian-qin, SUN Jie, HU Yue, JIANG Zhu-hui, ZHENG Zhao-cheng, TANG Li-mingΔ
(Shanghai Institute for Drug and Food Control,Shanghai 201203, China)
ObjectiveTo analyze and compare two potency assay methods of protamine sulfate.MethodsHeparin titration method was according to foreign pharmacopoeia,while biological assay method was according to China pharmacopoeia(2015).ResultsThe absorbance at the end-point was stable at 0.10 mg/mL and 0.15 mg/mL test solutions.The relative standard deviations(RSDs)of potency results were all less than 5%.Three test solutions and volumes of the titrant had a good linear relationship(R2=1.000).The results of titration method were significantly related to those of biological assay(P=0.013),with similar RSD(P>0.05).However,the potency of titration method were significantly lower than those of biological assay(P=0.045).ConclusionHeparin titration method is good-using,convenient,and need to be applied widely at home.
protamine sulfate;biological assay;heparin titration method
10.3969/j.issn.1005-1678.2016.08.041
刘萍,女,博士,检验员,研究方向:药理毒理,E-mail:liuping19876@163.com;唐黎明,通信作者,男,硕士生导师,主任药师,研究方向:药理毒理,E-mail:tangliming@smda.gov.cn。
R927.11;R973.2
A

