杧果FPPS基因的鉴定和序列分析
盖江涛,朱 敏,党志国,陈华蕊,陈振玺,王 鹏
(中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
杧果FPPS基因的鉴定和序列分析
盖江涛,朱 敏,党志国,陈华蕊,陈振玺,王 鹏
(中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
法尼基焦磷酸合成酶(Farnesyl Pyrophosphate Synthase,FPPS,EC∶2.5.1.1)是倍半萜合成中的一个关键酶,在植物萜类合成过程中有关键作用。以杧果FPPS基因为研究对象,以拟南芥FPPS基因为参考,通过BLAST方法从番木瓜、金钱橘、甜橙、苹果、小果野蕉、桃子、白梨、葡萄、中华猕猴桃、无油樟基因组数据中获得了FPPS基因,共19条FPPS基因序列,对其进行了系统进化分析和生物信息学分析。系统进化结果显示:双子叶植物纲果树与单子叶植物纲果树关系较远,同是双子叶植物纲的果树关系较近,同科果树亲缘关系更近。生物信息学分析结果显示:氨基酸序列中,酸性蛋白占94.7%,稳定性蛋白占84.2%,有信号肽的蛋白占5.3%,有导肽的蛋白占10.5%,所有蛋白均为有明显跨膜现象的亲水性蛋白;所有FPPS基因亚细胞定位于线粒体中,均有蛋白活性位点。
杧果;萜类;法尼基焦磷酸合成酶;系统进化;生物信息学
盖江涛,朱敏,党志国,等.杧果FPPS基因的鉴定和序列分析[J].广东农业科学,2016,43(6):69-75.
植物萜类是植物挥发物的主要组成成分,主要由半萜、单萜、倍半萜、二萜、四萜等组成,这类物质在植物花果香气组成、昆虫诱导、植物防御、生长调控等方面具有重要作用。法尼基焦磷酸合成酶(Farnesyl Pyrophosphate Synthase,FPPS,EC∶2.5.1.1)是倍半萜合成中的一个关键酶,在植物萜类合成中催化牻牛儿基焦磷酸(Geranyl Diphosphate,GPP)与异戊烯基焦磷酸(Isopentenyl Pyrophosphate,IPP)或二甲基烯丙基焦磷酸(Dimethylallyl Diphosphate,DMAPP)以1,4头尾缩合的方式形成15碳的法尼基焦磷酸(Farnesyl Diphosphate,FPP)[1]。FPP不仅是许多植物重要初生代谢物(如甾体、多萜醇等)的前体,而且在倍半萜环化酶的作用下还可以生成倍半萜衍生物(如植保素),与其他萜类化合物及其衍生物的生物合成密切相关[2]。因此,FPPS是类异戊二烯代谢途径重要的酶之一,对植物的抗病性、抗逆性以及生长发育有重要的调节作用[3]。
人们已通过不同方法从拟南芥[4]、茶树[5]、陆地棉[6]、橡胶树[7]、杜仲[8]、洋常春藤[9]等植物中克隆出FPPS基因。王冰莹将薄荷的FPPS基因在烟草中过量表达,转基因烟草中类胡萝卜素及其各组分的含量在叶片不同发育期均高于非转基因植株,说明外源FPPS基因在烟草中过表达,对类胡萝卜素合成具有促进作用[10]。Xiang等[11]从腊梅花中克隆到FPPS基因的全长cDNA序列,并通过FPPS基因组织特异性表达,说明FPPS基因可以促进花香萜类化合物的合成。Han等[12]将FPPS基因转入青篙中,发现转基因植株中的倍半萜青篙素大幅增加,可见,FPPSS基因在植物倍半萜烯产生的过程中至关重要。诸多实例表明FPPS基因在植物基因工程中具有应用价值,因此,研究FPPS基因的表达及其功能具有重要意义。
在模式植物拟南芥中,FPPS基因家族有2个,分别为FPPS1(AT5G47770)和FPPS2 (AT4G17190)[13]。研究发现,过量表达FPPS1基因的转基因植株中未成熟叶片衰老,而过量表达FPPS2基因的转基因植株生长发育过程中没有明显不利效应,说明FPPS1和FPPS2基因在生长发育过程中影响着不同的代谢途径[14]。如果将拟南芥中的FPPS1和FPPS2基因同时敲除,会使拟南芥致死;如果只敲除其中一个基因,都不会有致死效应,但FPPS2基因的缺失会引起幼苗阶段植株下胚轴和子叶短小[15]。也有研究表明,在细胞质中过量表达FPPS2基因,翻译产物会转移到叶绿体中,导致一些新的倍半萜(包括驱虫剂外激素E-β-法尼烯)产生,从而增加对桃蚜的应激反应,增强转基因植株对蚜虫的抗性[16]。
杧果(Mangifera indica Linnaeus)属于漆树科(Anacardiaceae)杧果属(Mangifera Linnaeus),是著名的热带果树之一。本试验以杧果FPPS基因为研究对象,以已知FPPS基因功能的十字花科拟南芥﹝Arabidopsis thaliana(Linnaeus)Heynhold〕的FPPS基因为参考,依托全基因组数据库,通过BLAST方法获得双子叶植物纲(Dicotyledoneae)番木瓜科(Caricaceae)番木瓜(Carica papaya Linnaeus),芸香科(Rutaceae)金钱橘(Citrus clementina Hortulanorum ex Tanaka)、甜橙﹝C.sinensis = C.×sinensis(Linnaeus)Osbeck〕,蔷薇科(Rosaceae)苹果(Malus domestica Borkhausen = Malus pumila Miller)、桃子﹝Prunus persica (Linnaeus)Batsch = Amygdalus persica Linnaeus〕、白梨(Pyrus bretschneideri Rehder),葡萄科(Vitaceae)葡萄(Vitis vinifera Linnaeus),猕猴桃科(Actinidiaceae)中华猕猴桃(Actinidia chinensis Planchon),漆树科杧果,无油樟科(Amborellaceae)无油樟(Amborella trichopoda Baillon),单子叶植物纲(Monocotyledoneae)芭蕉科(Musaceae)小果野蕉(Musa acuminata Colla)的FPPS基因家族的全部序列,通过系统发育分析、理化性质分析、结构分析等方法分析12种植物的FPPS基因家族,比较果树中FPPS基因的特性,为分析FPPS基因在杧果中的表达特性及其在萜类合成途径中的作用机制奠定基础,为推动杧果FPPS基因功能研究提供理论支持。
1 材料与方法
1.1 数据库搜索
从Phytozome V9.1(http://www.phytozome.net)[17]中搜索到拟南芥、番木瓜、金钱橘、甜橙、苹果、小果野蕉、桃子、葡萄的FPPS基因信息;从GigaDB(http://gigadb.org/dataset/view/id/100083/sort/size)[18]中得到白梨的基因组信息,并从中搜索到FPPS基因序列;从Kiwifruit Genome Database (http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/download.cgi)[19]中搜索到中华猕猴桃的FPPS基因信息;从Amborella Genome Database(http://amborella.huck.psu.edu/data)[20]中搜索到无油樟的FPPS基因信息;从NCBI(http://www.ncbi.nlm.nih.gov/)中搜索到杧果FPPS基因信息。
1.2 多序列比对、系统发育分析及物种进化分析
通过MEAG 6.0软件[21]中的MUSCLE工具[22]进行蛋白质的多序列比对,参数设置为默认值。将比对结果导入Gblocks[23-24]在线服务器中,选择保守区域进行后续研究,为了获得更多保守区域位点,选中3个较为宽松的选项(option for a less stringent selection)。调整后的序列使用Mrbayes 3.2.2[25]进行基于贝叶斯法的系统发育分析,共进行2次独立运算,每次运行设置2 000 000代,且每次运算使用4条蒙特卡洛-马尔科夫链(Markov Chain Monte Carlo,MCMC)进行随机取样,冷链温度设置为0.1,在取样中每1 000代保存一棵树,共保存2 000棵树。前20%的树作为burn-in舍弃,其余80%的树用来构建贝叶斯一致树和后验概率。生成的贝叶斯一致树保存为nexus格式,并在Figtree V1.4.0软件中进行编辑。物种进化分析通过在线工具(http://www.ncbi.nlm.nih.gov/Taxonomy/CommonTree/wwwcmt.cgi)完成。
1.3 蛋白质生物信息学分析
采用ProtParam tool(http://web.expasy.org/protparam/)[26]在线工具预测分析蛋白质的理化性质,应用TMpred程序(http://www.ch.embnet.org/software/TMpred-form.html)[27]在线分析预测蛋白质跨膜区和跨膜方向。用TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)[28]在线预测氨基酸序列导肽,应用SignalP 4.1 server(http://www.cbs.dtu.dk/services/SignalP/)[29]完成蛋白质信号肽的预测。活性位点运用在线分析软件Expasy (http://prosite.expasy.org/)[30]进行。二级结构的预测和分析用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)完成。
1.4 拟南芥FPPS基因生育期芯片数据表达模式的分析
从 Plant Expression Database[31]网站的拟南芥数据库(http://www.plexdb.org/plex.php?database=Arabidopsis)中下载RMA文件,提取拟南芥的2条FPPS基因AT4G17190、AT5G47770分别在各生育期组织〔(下胚轴(7 d)、芽(7 d)、叶柄(>17 d)、子叶(7 d)、幼叶(10 d)、成熟叶(17 d)、老叶(35 d)、根(7 d)、根(15 d)、根(21 d)、萼片(>21 d)、花瓣(>21 d)、雄蕊(>21 d)、雌蕊(>21 d)、花粉(6周)〕的表达情况,结果用Gplots软件包中的Heatmap.2软件绘制热图。
2 结果与分析
2.1 杧果与其他11种植物FPPS基因家族的系统进化分析
通过BLASTP方法去掉冗余序列,得到19条氨基酸序列,其中拟南芥2条、番木瓜1条、金钱橘1条、甜橙1条、苹果4条、桃子2条、葡萄1条、小果野蕉2条、中华猕猴桃1条、杧果1条、白梨2条、无油樟1条。对19条编码FPPS的氨基酸序列进行系统发育分析,结果(图1)显示,双子叶植物纲的金钱橘、甜橙、苹果、白梨、桃子、中华猕猴桃、杧果、葡萄、番木瓜、拟南芥聚为一支,单子叶植物纲的芭蕉科香蕉为一支,被选为外类群的双子叶植物纲无油樟科无油樟为一支。说明在进化过程中,FPPS基因的分化在单子叶植物和双子叶植物分化前形成,且双子叶植物纲的果树与单子叶植物纲的果树关系较远,同是双子叶植物纲的果树关系较近,同是蔷薇科的苹果、白梨、桃子之间以及同是芸香科的金钱橘、甜橙之间的亲缘关系更近。
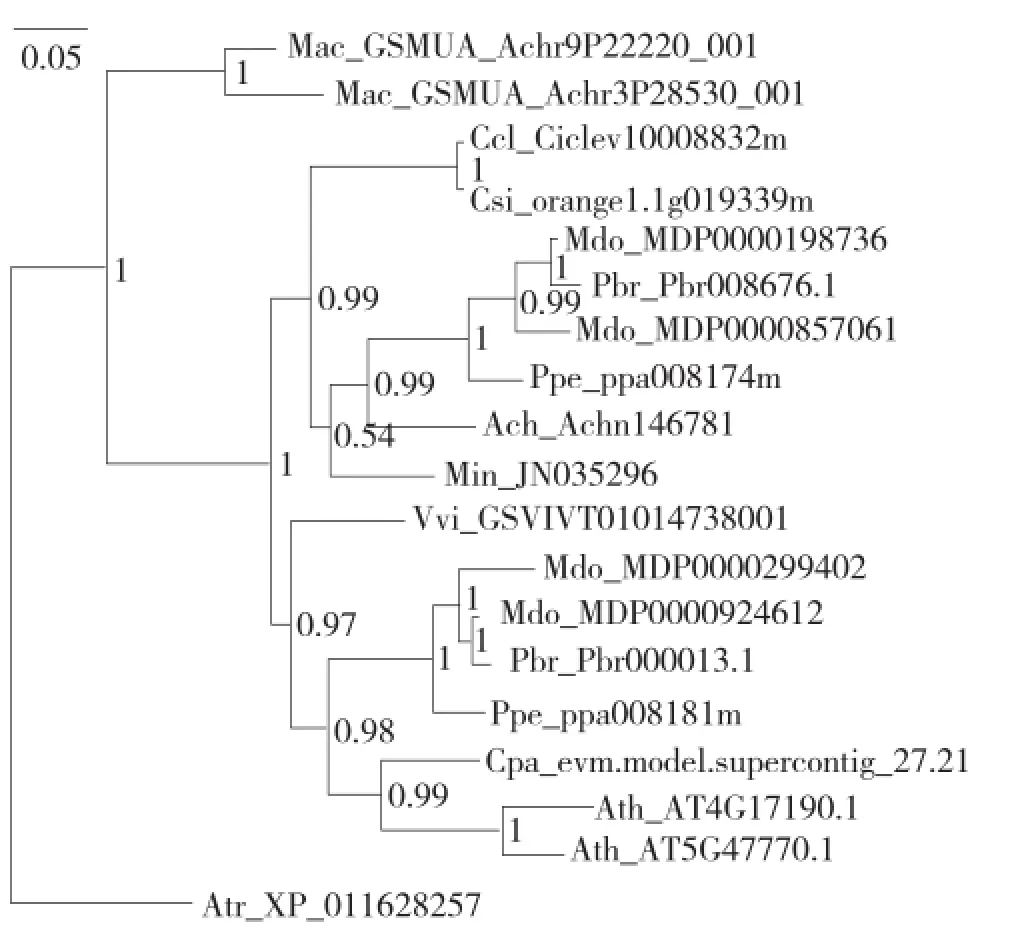
图1 杧果与其他11种植物FPPS基因家族氨基酸序列系统发育树
2.2 杧果与其他11种植物FPPS基因的物种进化分析
从图2可以看出,双子叶植物纲的植物聚为一大分支,单子叶植物纲的植物为一支,外类群植物为一支。在本研究选取的10种果树中,同是蔷薇科的苹果、白梨、桃子聚为一支,同是芸香科的金钱橘和甜橙聚为一支,说明在物种进化过程中,同纲植物亲缘关系更近,不同纲的植物亲缘关系较远。同时,杧果与金钱橘、甜橙聚为一支,说明在物种进化过程中,杧果与金钱橘、甜橙的亲缘关系更近,其次是番木瓜,而与苹果、白梨、桃子、葡萄、中华猕猴桃的亲缘关系相对较远,与小果野蕉的亲缘关系最远。
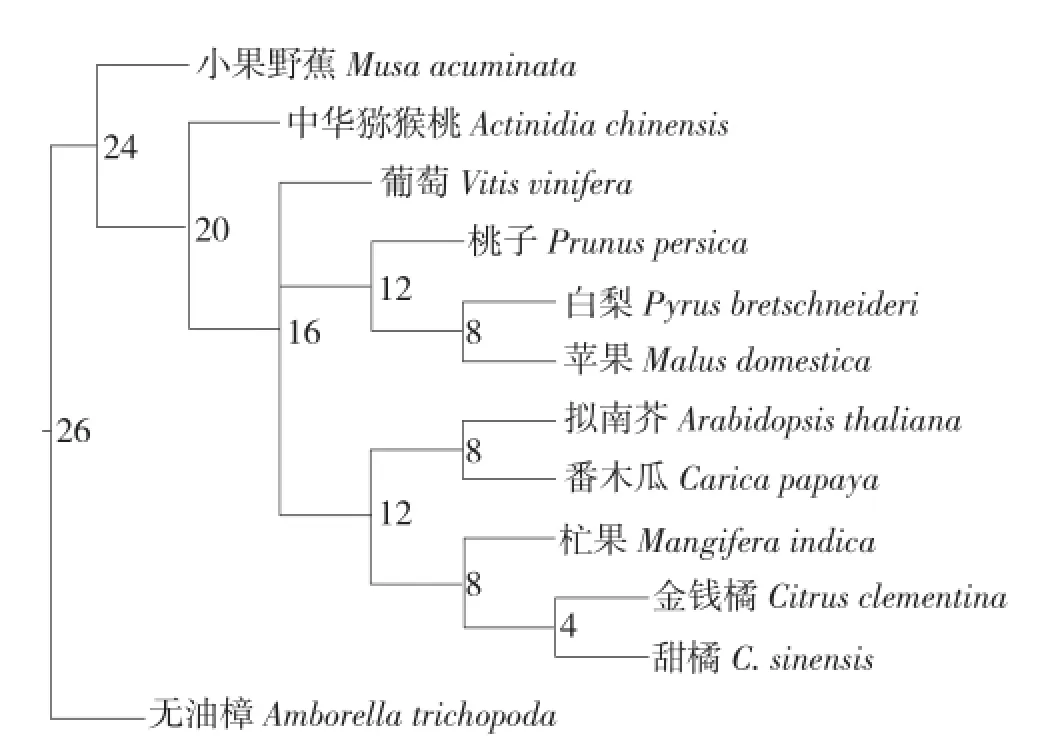
图2 杧果与其他11种植物的FPPS基因的系统发育树

表1 杧果与其他11种植物FPPS氨基酸序列的组成成分及理化性质分析比较
2.3 杧果与其他11种植物FPPS蛋白的理化性质分析
对19条FPPS氨基酸序列进行理化性质分析,结果显示,除Mdo_MDP0000198736为碱性蛋白(理论pI>7)外,其余蛋白均为酸性蛋白质(理论pI<7);根据Guruprasad方法[32]表明,除Ath_AT5G47770.1、Min_JN035296、Atr_XP_011628257为不稳定性蛋白(不稳定系数>40)外,其余蛋白均为稳定性蛋白(不稳定系数<40);相对分子量除Mdo_MDP0000198736为59.06 ku、Mdo_MDP0000857061为17.54 ku外,其余位于39.06~49.09 ku(表1),所有蛋白均有明显跨膜现象;除Mdo_MDP0000857061有信号肽外,其余蛋白均无信号肽(图3,封二));仅拟南芥基因Ath_AT5G47770.1具有线粒体靶向肽M (mitochondrial targeting peptide,mTP)、苹果基因Mdo_MDP0000857061具有分泌通路信号肽S (secretory pathway signal peptide,SP),其余氨基酸序列均没有导肽。
所有蛋白均为亲水性蛋白(GRAVY<0),半衰期一致表现为:序列的N-端为甲硫氨酸(Met),在哺乳动物活体中半衰期为30 h,在酵母活体中半衰期大于20 h,在大肠杆菌活体中半衰期大于10 h。
2.4 杧果与其他11种植物FPPS基因的结构分析
活性位点分析结果表明,所有基因都有活性位点,除Mdo_MDP0000857061只具有活性位点MGtyFQVqDDYlD、Ach_Achn146781只具有活性位点LVlDDim..DnsqtRRG外,其余基因都具有2个活性位点。其中Ath_AT4G17190.1、Ath_AT5G47770.1的活性位点一致,都具有LVlDDim..DnsvtRRG、MGiyFQVqDDYlD活性位点;Cle_Ciclev10008832m、Csi_orange1.1g019339m的活性位点一致,都具有LVlDDim..DgshtRRG、MGiyFQVqDDFlD活性位点;Pbr_Pbr008676.1、Atr_XP_011628257的活性位点一致,都具有LVlDDim..DgshtRRG、MGtyFQVqDDYlD活性位点;Cpa_evm.model.supercontig_27.210、Mdo_MDP0000299402、Ppe_ppa008181m、M i n_J N 0 3 5 2 9 6的活性位点一致,都具有LVlDDim..DgshtRRG、MGiyFQVqDDYlD活性位点;Mdo_MDP0000924612具有LVhDDlm..DgshtRRG、MGiyFQVqDDYlD活性位点,Mdo_MDP0000198736具有LVlDDim..DgshtRRG、MGtyFQVqDDYlD活性位点,Ppe_ppa008174m具有LVlDDim..DsshtRRG、MGtyFQVqDDYlD活性位点,Vvi_GSVIVT01014738001具有LVlDDim..DnshtRRG、MGiyFQVqDDYlD活性位点,Mac_GSMUA_Achr9P22220_001具有LVlDDim..DnshtRRG、MGtyFQVqDDFlD活性位点,Mac_GSMUA_Achr3P28530_001具有LVlDDim..DnshtRRG、MGtyFQVqDDYlD活性位点,Pbr_Pbr000013.1具有LVhDDlm..DgshtRRG、MGiyFQVqDDYlD活性位点。具有活性位点的蛋白均属于聚丙烯合成酶(Polyprenyl synthases),属于FPPS基因家族的特征序列。
2.5 杧果FPPS蛋白二级结构分析
应用在线工具SOPMA预测杧果FPPS氨基酸序列的二级结构,结果(图4,封二)显示,α-螺旋占58.19%,是杧果FPPS最大量的结构元件,其余由23.68%的无规则卷曲、10.82%的延伸链、7.31%的β-转角组成。其他11种植物的FPPS氨基酸序列的二级结构表现出一致性(表2),α-螺旋是FPPS最大量的结构元件,其次是无规则卷曲,以上两种构象之和均大于75%。
2.6 拟南芥FPPS基因生育期芯片中的表达模式
根据拟南芥各生育期芯片可以得出其两条FPPS基因的表达模式如图5(封二)所示。AT5G47770、AT4G17190基因在各组织中的表达差异显著,AT5G47770基因除在老叶(35 d)中表达不明显外,在其余组织中均有较强表达,在幼叶(10 d)、成熟叶(17 d)中表达最强;而AT4G17190基因除在花瓣(>21 d)、雌蕊(>21 d)、根(7 d)、雄蕊(>21 d)中有较弱表达外,在其余组织中均无明显表达,其中在花瓣(>21 d)中表达相对较强。

表2 杧果与其他11种植物的FPPS氨基酸序列的二级结构分析
3 结论与讨论
FPPS基因作为倍半萜合成途径中的关键酶基因,广泛应用于植物基因工程研究。本研究以杧果FPPS基因为重点研究对象,对拟南芥、番木瓜、金钱橘、甜橙、苹果、桃子、白梨、葡萄、中华猕猴桃、杧果、小果野蕉和无油樟12种植物共19条FPPS基因家族蛋白进行了系统发育分析、理化性质分析、结构分析等。系统发育分析结果显示,双子叶植物纲的金钱橘、甜橙、苹果、白梨、桃子、中华猕猴桃、杧果、葡萄、番木瓜、拟南芥聚为一支,单子叶植物纲芭蕉科小果野蕉聚为一支,外类群的无油樟为一支,说明:(1)在进化过程中,同纲同科的植物亲缘关系更近,与植物分类学理论一致;(2)以FPPS基因家族构建系统进化树,能准确反映植物物种之间的亲缘关系和进化关系;(3)FPPS基因的分化在单子叶植物和双子叶植物分化前形成;(4)植物在长期的分子进化过程中,生物种属间的基因序列存在一定的同源性,而同源性的高低与植物亲缘关系密切相关。
理化性质分析及结构分析结果显示,杧果与其他氨基酸序列均有蛋白活性位点,具有FPPS基因家族的特征序列。所有蛋白中,酸性蛋白占94.7%、稳定性蛋白占84.2%,有信号肽的蛋白占5.3%,有导肽的蛋白占10.5%,所有蛋白均为有明显跨膜现象的亲水性蛋白。通过蛋白质信号肽和导肽分析可知,除苹果基因Mdo_MDP0000857061具有分泌通路信号肽S(SP)、拟南芥基因Ath_AT5G47770.1具有线粒体靶向肽M(mTP)外,其余氨基酸序列均没有信号肽或导肽,说明杧果FPPS基因编码的蛋白与其他蛋白为非分泌性蛋白,它们由游离核糖体合成,参与细胞内生化反应,在细胞内代谢过程中发挥重要作用。
拟南芥FPPS基因生育期芯片表达模式分析结果表明,AT5G47770、AT4G17190基因在各组织中的表达差异显著,AT5G47770基因除在老叶(35 d)中表达不明显外,在其余组织中均有较强表达,推测AT5G47770基因具有看家功能;而AT4G17190基因除在花瓣(>21 d)、雌蕊(>21 d)、根(7 d)、雄蕊(>21 d)中有较弱表达外,在其余组织中均无明显表达,说明AT4G17190基因在植株发育过程的特定器官中行使功能,这与之前的报道结果[15]一致。
目前,虽然有关于杧果中FPPS基因的研究,但是对单个基因的克隆及生化特性的研究[33]尚未发现有从FPPS基因家族层面的报道。本文以不同植物FPPS基因具有较高的同源性为依据,选取12个物种(包括10种果树、1种模式植物、1种系统发育树选为外类群的植物),比较了杧果与其他植物中FPPS基因的特性,具有更强的针对性和借鉴性。结果发现,除杧果FPPS蛋白的稳定性与其他植物FPPS蛋白不一致外,其他性质均表现出一致性,杧果FPPS基因具有FPPS基因家族特征,推测杧果FPPS基因与其他植物具有相同或相似的生物学功能,但还需进一步的验证。本试验对进一步研究杧果FPPS基因的时空表达特性及在萜类合成途径中的作用机制研究提供了理论支持。
[1]Lange B M,Rujan T,Martin W,et al.Isoprenoid biosynthesis:the evolution of two ancient and distinct pathways across genomes[J].Proceedings of the National Academy of Sciences,2000,97(24):13172-13177.
[2]陈大华,叶和春,李国凤,等.植物类异戊二烯代谢途径的分子生物学研究进展[J].植物学报,2000,42(6):551-558.
[3]陈新,李玲玲,吕慧贞,等.法呢基焦磷酸(FPP)的生物合成及其分子调控[J].生物技术通报,2007 (2):67-71.
[4]Delourme D,Lacroute F,Karst F.Cloning of an Arabidopsis thaliana cDNA coding for farnesyl diphosphate synthase by functional complementation in yeast[J].Plant Molecular Biology,1994,26(6):1867-1873.
[5]徐燕.茶树萜类合成途径关键基因克隆及表达研究[J].杭州:浙江大学,2013.
[6]李继刚,陈永利,夏洁函.陆地棉法尼基焦磷酸合酶基因的克隆及表达分析[J].基因组学与应用生物学,2014,33(1):100-104.
[7]郭冬,李辉亮,杨子平,等.巴西橡胶树一个新的法尼基焦磷酸合酶基因的克隆及表达分析[J].热带作物学报,2015,36(3):441-447.
[8]杜次,李菁,彭清忠,等.杜仲法尼烯基焦磷酸合酶基因cDNA全长的克隆与序列分析[J].生命科学研究,2015,19(2):100-105.
[9]阮琴妹,曹雄军,孙化鹏,等.洋常春藤法呢基焦磷酸合酶基因的克隆与序列分析[J].湖南农业大学学报(自然科学版),2016,42(2):136-141.
[10]王冰莹,杨永霞,闫鼎,等.fps基因过量表达对烟叶类胡萝卜素生物合成的影响[J].中国烟草学报,2012,18(2):44-48.
[11]Xiang L,Zhao K,Chen L.Molecular cloning andexpression of Chimonanthus praecox farnesyl pyrophosphate synthase gene and its possible involvement in the biosynthesis of floral volatile sesquiterpenoids[J].Plant Physiology and Biochemistry,2010,48(10):845-850.
[12]Han J L,Liu B Y,Ye H C,et al.Effects of overexpression of the endogenous farnesyl diphosphate synthase on the artemisinin content in Artemisia annua L[J].Journal of Integrative Plant Biology,2006,48 (4):482-487.
[13]Keim V,Manzano D,Fernández F J,et al.Characterization of Arabidopsis FPS isozymes and FPS gene expression analysis provide insight into the biosynthesis of isoprenoid precursors in seeds[J].PLoS One,2012,7(11):e49109.
[14]Masferrer A,Arró M,Manzano D,et al.Overexpression of Arabidopsis thaliana farnesyl diphosphate synthase(FPS1S) in transgenic Arabidopsis induces a cell death/senescence-like response and reduced cytokinin levels[J].The Plant Journal,2002,30(2):123-132.
[15]Closa M,Vranová E,Bortolotti C,et al.The Arabidopsis thaliana FPP synthase isozymes have overlapping and specific functions in isoprenoid biosynthesis,and complete loss of FPP synthase activity causes early developmental arrest[J].The Plant Journal,2010,63(3):512-525.
[16]Bhatia V,Maisnam J,Jain A,et al.Aphid-repellent pheromone E-β-farnesene is generated in transgenic Arabidopsis thaliana over-expressing farnesyl diphosphate synthase2[J].Annals of Botany,2014,115(4):581-591.
[17]Goodstein D M,Shu S,Howson R,et al.Phytozome:a comparative platform for green plant genomics [J].Nucleic Acids Research,2012,40(D1):D1178-D1186.
[18]Wu J,Wang Z,Shi Z,et al.The genome of the pear(Pyrus bretschneideri Rehd.)[J].Genome Research,2013,23(2):396-408.
[19]Huang S,Ding J,Deng D,et al.Draft genome of the kiwifruit Actinidia chinensis[J].Nature Communications,2013,4:2460.
[20]Chamala S,Chanderbali A S,Der J P,et al.Assembly and validation of the genome of the nonmodel basal angiosperm Amborella[J].Science,2013,342 (6165):1516-1517.
[21]Tamura K,Stecher G,Peterson D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0 [J].Molecular Biology and Evolution,2013,30 (12):2725-2729.
[22]Edgar RC.MUSCLE:multiple sequence alignment with high accuracy and high throughput[J].Nucleic Acids Research,2004,32(5):1792-1797.
[23]Castresana J.Selection of conserved blocks from multiple alignments for their use in phylogenetic analysis[J].Molecular Biology & Evolution,2000,17 (4):540-552.
[24]Talavera G,Castresana J.Improvement of phylogenies after removing divergent and ambiguously aligned blocks from protein sequence alignments[J].Systematic Biology,2007,56(4):564-577.
[25]Ronquist F,Teslenko M,van der Mark P,et al.MrBayes 3.2:efficient Bayesian phylogenetic inference and model choice across a large model space[J].Systematic Biology,2012,61(3):539-542.
[26]Gasteiger E,Hoogland C,Gattiker A,et al.Protein identification and analysis tools on the ExPASy server.In:Walker J M.The Proteomics Protocols Handbook [M].Totowa:New Jersey:Humana Press,2005:571-607.
[27]Hofmann K,Stoffel W.TMbase-A database of membrane spanning protein segments[J].Biological Chemistry Hoppe-Seyler,1993,374:166.
[28]Emanuelsson O,Brunak S,von Heijne G,et al.Locating proteins in the cell using TargetP,SignalP and related tools[J].Nature Protocols,2007,2(4):953-971.
[29]Petersen T N,Brunak S,von Heijne G,et al.SignalP 4.0:discriminating signal peptides from transmembrane regions[J].Nature Methods,2011,8(10):785-786.
[30]Sigrist C J,Cerutti L,Hulo N,et al.PROSITE:a documented database using patterns and profiles as motif descriptors[J].Briefings in Bioinformatics,2002,3(3):265-274.
[31]Dash S,Van Hemert J,Hong L,et al.PLEXdb:gene expression resources for plants and plant pathogens [J].Nucleic Acids Research,2012,40(D1):D1194-D1201.
[32]Guruprasad K,Reddy B B,Pandit M W.Correlation between stability of a protein and its dipeptide composition:a novel approach for predicting in vivo stability of a protein from its primary sequence[J].Protein Engineering,1990,4(2):155-161.
[33]Kulkarni R,Pandit S,Chidley H,et al.Characterization of three novel isoprenyl diphosphate synthases from the terpenoid rich mango fruit[J].Plant Physiology and Biochemistry,2013,71(2):121-131.
(责任编辑 张辉玲)
Identification and sequence analysis of FPPS gene family in Mangifera indica
GAI Jiang-tao,ZHU Min,DANG Zhi-guo,CHEN Hua-rui,CHEN Zhen-xi,WANG Peng
(Tropical Crops Genetic Resources Institute,Chinese Academy of Tropical Agricultural Sciences,Danzhou 571737,China)
Farnesyl pyrophosphate synthase gene (FPPS,EC∶2.5.1.1) is a critical enzyme of sesquiterpene synthesis,paly a key role in the process of terpenoid biosynthesis.In this study,focusing on mango FPPS gene,taking Arabidopsis FPPS gene as reference,homologous peptide sequences of FPPS genes were screened from Carica papaya,Citrus clementina,C.sinensis,Malus domestica,Musa acuminata,Prunus persica,Pyrus bretschneideri,Vitis vinifera,Actinidia chinensis,Amborella trichopoda genome data by BLASTP.Total 19 FPPS gene sequences were obtained,then phylogenetic tree was constructed and bioinformatics analysis was carried out.Phylogenetic tree indicated a farther relationship between monocots and dicots plants,and dicots fruit trees had a close relationship in evolution.Moreover,the plants in the same family had higher degree of homology.Bioinformatics analysis showed that,in all proteins above mentioned,acidic protein was 94.7%,stable protein was 84.2%,signal protein was 5.3%,and leader peptide was 10.5%.Meanwhile,all FPPS proteins were hydrophilic proteins with striking transmembrane domain, all located in mitochondrion and had active site.
mango;terpenoid;farnesyl pyrophosphate synthase (FPPS);phylogenetic;bioinformatics
S667.7;Q37
A
1004-874X(2016)06-0069-07
10.16768/j.issn.1004-874X.2016.06.013
2015-10-16
中央级公益性科研院所基本科研业务费专项资金(1630032015026,1630032014013)
盖江涛(1983-),女,硕士,助理研究员,E-mail:gjt006616@163.com
王鹏(1980-),男,博士,副研究员,E-mail:pwang521@163.com

