花绒寄甲HSP70基因的特征与表达1)
郝春凤 王化鹏 张正青 常勇 李孟楼
(西北农林科技大学,杨凌,712100)
花绒寄甲HSP70基因的特征与表达1)
郝春凤王化鹏张正青常勇李孟楼
(西北农林科技大学,杨凌,712100)
摘要为阐明热休克蛋白70(HSP70)在花绒寄甲(Dastarcus helophoroides)发育及雌雄成虫抵抗环境胁迫中的作用,利用实时荧光定量PCR技术分析了其在发育阶段和环境胁迫时的表达情况。从花绒寄甲转录组中获得3条HSP70基因,分别命名为D.hHSP69.09、D.hHSP70.11和D.hHSP71.88。发育阶段定量结果显示,3条HSP70在所有发育阶段均有表达,D.hHSP69.09在1龄幼虫期表达量最高;D.hHSP70.11和D.hHSP71.88在雄虫中表达量最高。在检测的成虫组织中,D.hHSP69.09和D.hHSP70.11在卵巢表达量最高;D.hHSP71.88在脂肪体中表达量最高。HSP70基因随温度升高(23 ℃升至44 ℃)、41 ℃下处理时间(0~270 min)延长、氧化剂浓度(0~70 mmol·L-1)的升高表达量先增加后减少,雌雄表达量差异较大。饥饿试验显示,雌雄虫表达模式不同;随饥饿时间延长,雄虫HSP70基因表达量有所降低,雌虫一定时间内有所上升。因此,花绒寄甲HSP70可能与不同发育期的转换、幼虫的蜕皮行为相关; HSP70对温度、氧化和饥饿胁迫的应激敏感程度和表达水平不同,能够有效应对高温、氧化、饥饿等环境胁迫。
关键词花绒寄甲;逆境胁迫;HSP70;实时荧光定量 PCR
花绒寄甲(Dastarcus helophoroides)是多种林木蛀干害虫如栗山天牛(Massicus raddei)、云斑天牛(Batocera horsfieldi)、松褐天牛(Monochamus alternatus)、光肩星天牛(Anoplophora glabripennis)、锈色粒肩天牛(Apriona swainsoni)等最为有效的天敌昆虫[1],其幼虫寄生在天牛末龄幼虫和蛹上[2]。有报道指出,高温等环境胁迫能够显著影响昆虫的存活、发育和生殖[3-4]。花绒寄甲成虫有着相对较长的寿命,人工饲养8 a以上,在自然环境中,由于各种不利环境因素的影响,比如气候变化、生态环境恶化、病原微生物的入侵等,花绒寄甲的寿命往往达不到人工饲养条件下的寿命。由自然界中的逆境伤害所引起的细胞内蛋白质聚集对细胞的生存造成重要的威胁[5]。然而,昆虫已进化出一系列生理方面的策略来避免逆境造成的伤害,如昆虫通过调节热休克蛋白的合成来维持细胞蛋白平衡。热休克蛋白作为分子伴侣,与其他保护蛋白和辅助蛋白一致,在蛋白质转运、折叠、定位和降解等必要的生理活动中发挥重要作用[6-7]。
热激反应是生物体自我保护的重要机制之一,首次发现于黑腹果蝇(Drosophila melanogaster)的短暂热应激过程[8]。热休克蛋白家族作为一个大家族,依据分子质量大小及其序列相似性,将HSP分为5个家族:HSP100、HSP90、HSP70、HSP60、HSP40和small HSPs(sHSPs)[9]。其中,HSP70被认为是最重要、最保守的热休克蛋白家族,具有最高温度敏感性。一般通过分子伴侣作用、抗氧化作用、协同免疫作用和抗细胞凋亡作用对出现的应激有保护耐受作用[10]。
目前,热休克蛋白在抵抗热胁迫方面的重要作用已经得到了人们的广泛认识[11-12]。当环境温度高于正常水平时,诱导性热休克蛋白就会合成,从而能够增加生物体对高温的耐受力,保护机体免受热损伤[13]。虽然热休克反应在果蝇中首次被发现,人们对昆虫热休克蛋白的认识远远不如细菌、植物和哺乳类动物。除了分子伴侣的基本功能外,最近研究表明,HSP70还可能与昆虫的发育有关,特别是幼虫到蛹的转变过程。在斑潜蝇(Liriomyza sativae)的研究中蛹期3条sHSPs的表达量最高,3条sHSPs的表达量随着发育不断上升[14]。在小菜蛾(Mamestra brassicae)的研究中也表现出相似的结果[15]。
随着对热休克蛋白认识的不断深入,热休克蛋白应对高温、低温胁迫的响应机制已经得到广泛研究,虽然人们已经明确知道热休克蛋白的功能还有很多,如抗氧化、饥饿等,但对于其他抗性的研究并不多见。近年来,抗逆性研究是科学研究的热点之一,分子生物学技术的快速发展与成熟使研究基因表达不再局限于模式物种[16-17]。
利用释放花绒寄甲防治天牛类害虫,高效、对环境友好。花绒寄甲具有耐高温、耐饥饿等特性,对不利环境的适应性较强。在中国,花绒寄甲作为防治天牛类害虫的重要天敌昆虫,在生物的防治中具有重要的地位,而对于花绒寄甲热休克蛋白方面的研究尚未开展。不同种类的热休克蛋白在抵抗环境胁迫过程中发挥的作用及表达模式尚不明确。因此,研究花绒寄甲热休克蛋白70家族是十分必要的。
从花绒寄甲转录组中获得3条HSP70基因,通过RT-qPCR分析其在不同发育阶段与组织中的表达模式。检测花绒寄甲对不同环境胁迫的应激反应。应用RT-qPCR的方法探究HSP基因在非生物应激(如高温、氧化、饥饿处理)中的表达特性,分析HSP70在非生物应激中的作用。
1材料与方法
1.1供试昆虫和处理方式
花绒寄甲幼虫、蛹和成虫由西北农林科技大学林学院森林害虫生物防治实验室提供。花绒寄甲成虫用主要成分为蚕蛹粉的人工饲料饲养在人工气候箱内。饲养条件为,温度(23±1)℃、相对湿度70%~80%、光照周期16 h光照8 h黑暗。
温度处理:用干式恒温器对雌雄成虫进行温度处理,包括不同温度(26、29、35、38、41、44 ℃)刺激2 h后保存;41 ℃处理不同时间(0、30、60、90、120、150、180、210、240、270 min)后保存。
饥饿处理:将待试雌雄成虫分为对照组和试验组,饲养在相同条件下,对照组正常喂食,试验组不进行喂食,按照时间梯度(2 d)收集后保存。
氧化处理:用百草枯作为氧化剂。成虫用0、10、20、30、40、50、60、70 mmol·L-1的百草枯处理2 h,选取HSP表达敏感的浓度进行不同时间(0、1、2、3、4、5、6 h)处理。
饥饿处理:由于雌雄成虫在饥饿条件下存活时间不同,选取雌虫饥饿条件下(0、2、4、6、8、10、12、14、16、18、20、22 d)的样品,雄虫饥饿条件下(0、2、4、6、8、10、12、14、16 d)的样品。
成虫组织分离:将活的成虫置于冰上解剖,迅速分离头、胸、中肠、后肠、脂肪体、精巢、卵巢及残体,用生理盐水冲洗后立即保存。
所有试验样本选取后立即放入液氮中冷冻,并于冰箱中-80 ℃保存。每个处理均进行3个生物重复。
1.2花绒寄甲HSP70序列检索
花绒寄甲转录组中所有序列已经通过NCBI中的Blastx工具在Nr数据库中得到注释,注释截点E值为10-5。通过在转录组中的注释文件中检索关键词(HSP或者heat shock protein)筛选出花绒寄甲的HSP70序列。
1.3序列分析及进化树构建
采用NCBI中的ORF finder工具,分析HSP70其可能的开放阅读框并翻译为氨基酸。对所有的HSP70氨基酸序列进行氨基酸组成分析;获得的氨基酸序列通过ExPASy的compute pI/Mw工具预测蛋白的分子质量和等电点。通过Blast将cDNA和氨基酸序列与GeneBank数据库中已登录的其他物种序列进行比较。同时对其进行系统发育分析,从NCBI蛋白数据库下载鞘翅目的赤拟谷盗(Tribolium castaneum)、异色瓢虫(Harmonia axyridis)、马铃薯叶甲(Leptinotarsa decemlineata)、大猿叶甲(Colaphellus bowringi),鳞翅目的八字地老虎(Xestia cnigrum)、二化螟(Chilo suppressalis),半翅目的扶桑绵粉(Phenacoccus solenopsis)、褐飞虱(Nilaparvata lugens),以及双翅目的致倦库蚊(Culex quinquefasciatus)的HSP70氨基酸序列,利用ClastalW软件对所有下载的HSP70和花绒寄甲的HSP70进行序列比对,比对后用Mega 5.02分析其演化关系,采用Neighbor-joining算法构建进化树,置信度设置为1 000[16]。
1.4生物信息学分析
保守区域检测:NCBI http://www.ncbi.nlm.nih.gov/。
等电点及分子质量预测:http://us.expasy.org/tools/peptidemass.html。
蛋白质功能位点预测:PROSITE数据库http://cn.expasy.org/prosite。
DNAman 5.5.2软件用于氨基酸或者核苷酸的多序列比对;MEGA 5.2软件用于系统进化树构建及分析;Photoshop 10软件用于图像处理。
1.5总RNA提取和第1链cDNA合成
花绒寄甲样品均用Trizol reagent试剂盒(Sangon,上海)提取其总RNA。总RNA的质量和浓度在Maestro-NANO UV spectrophotometer上用分光光度法测定。每个重复各取1 μg的总RNA构建20 μL的反应体系,使用oligo(dT)18引物和Moloney Murine Leukemia virus(M-MLV)反转录酶(Sangon,上海)进行第1链cDNA的合成。
1.6实时荧光定量(RT-qPCR)表达分析
完成每个样第1链cDNA的合成后,用RT-qPCR技术在Bio-rad IQ5仪器上测定HSP70 mRNA的表达量。染料选用SYBR Green Mix(CWBIO,北京)。根据前面的试验结果,内参基因用EF-1α和α-Tubulin。每对定量引物通过10倍稀释的模板建立标准曲线验证,引物见表1。

表1 实时荧光定量试验中所用引物
RT-qPCR试验采用20 μL的反应体系进行,循环条件如下:95 ℃ 3 min;95 ℃ 30 s;58 ℃ 30 s;72 ℃ 30 s,45个循环。
1.7数据处理
试验所得的数据用相对定量法(2-ΔΔCt)计算分析[18]。数据显著差异性分析采用SPSS中的Tukey方法。用Origin 8.5进行作图。
2结果与分析
2.1花绒寄甲HSP70基因的检索和序列分析
通过搜索花绒寄甲成虫转录组数据库得到3条HSP70基因,经NCBI的Blastp工具在线比对,发现其同源性与其他昆虫的HSP70基因同源性最高,根据相对分子质量大小分别命名为D.hHSP69.09、D.hHSP70.11和D.hHSP71.88。
D.hHSP69.09、D.hHSP70.11和D.hHSP71.88基因的ORF大小分别为1 980、1 967、1 910 bp,编码626、636和655个氨基酸。利用在线软件对HSP70进行基本理化性质分析,D.hHSP69.09、D.hHSP70.11和D.hHSP71.88的理论等电点分别为5.57、6.01和5.93,相对分子质量约为69 092、70 112、71 881。
编码的氨基酸组成中,D.hHSP69.09、D.hHSP70.11和D.hHSP71.88分别含有73、70、73个谷氨酰胺(Gln)和谷氨酸(Glu),占总氨基酸的比例分别为11.7%、11.0%和11.2%。
多序列比对结果显示,D.hHSP69.09、D.hHSP70.11和D.hHSP71.88与其他昆虫(T.castaneum、H.axyridis、L.decemlineata、X.cnigrum、C.suppressalis、P.solenopsis、N.Culex quinquefasciatus)的HSP基因的同源性在65%~100%(图1)。
暖风器入口风温是暖风器设计的一个重要参数,按照《GB 50660—2011大中型火力发电厂设计规范》:“选择暖风器所用的环境温度,对采暖地区宜取用冬季采暖室外计算温度,对非采暖区宜取用冬季最冷月平均温度,并适当留有加热器面积”[1],但是在实际运行中发现有严寒地区暖风器出口风温不满足空预器入口温度的要求。
利用PROSITE数据库对氨基酸序列进行功能位点预测(表2),3条HSP70基因中均具有3个HSP70签名序列,位置大致相同。3条HSP70基因的签名序列1均相同,D.hHSP69.09与D.hHSP70.11的签名序列2相同,3条HSP70的签名序列3均有所不同。

表2 花绒寄甲HSP70基因氨基酸序列功能位点预测
在D.hHSP69.09和D.hHSP70.11的C-末端存在V/IEEVD基序。有研究表明,C-末端保守的V/IEEVD基序与分子伴侣辅助因子的识别有关,能够使HSP70绑定到其他协同伴侣上[19],表明D.hHSP69.09和D.hHSP70.11是一种细胞质型HSP。D.hHSP71.88的C-末端为IDEAD,目前尚未找到关于该序列的研究。
从NCBI上通过比对下载氨基酸序列进行系统发育分析。图2表明,3条序列分为3个独立进化支,其中,D.hHSP69.09和D.hHSP70.11所在分支亲缘关系更近,D.hHSP71.88单独在另一分支。从进化树上可见,D.hHSP69.09和同属鞘翅目的大猿叶甲、马铃薯叶甲的HSP70基因遗传距离较近;D.hHSP70.11与同属鞘翅目的赤拟谷盗的HSP70基因遗传距离最近。

黑色背景.一致性为100%;灰色背景.一致性大于等于75%。

图2 花绒寄甲HSP70基因与GeneBank已登录的其他物种的HSP70基因的系统发育分析
2.2定量PCR
2.2.1HSP70在花绒寄甲不同发育阶段的表达
以EF-1α作为内参基因,进行RT-qPCR试验,分析HSP70 mRNA在不同发育阶段中的表达模式。表3所示,3条基因的表达水平在花绒寄甲整个发育过程中波动很大。D.hHSP69.09在1龄幼虫期表达量最高;D.hHSP70.11和D.hHSP71.88在雄虫中表达水平最高。3条HSP70在蛹期的相对表达量均较高。表明,3条HSP70基因表达的增强总是与不同发育期的转换密切相关,包括幼虫-蛹、蛹-成虫的转换。通过SPSS分析,老熟幼虫、蛹、成虫之间HSP70的表达量在生物学统计上差异显著。
幼虫阶段HSP70基因随龄期的增加,mRNA的表达量逐渐减小,因此,推测HSP70基因可能和花绒寄甲幼虫的发育存在某种关系。

表3 花绒寄甲不同发育阶段HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
2.2.2HSP70在花绒寄甲不同组织中的表达
为探究花绒寄甲HSP70基因组织分布特性,以EF-1α作为内参基因,对HSP70基因在头、胸、精巢、卵巢、中肠、后肠和脂肪体中表达量进行分析。HSP70基因在不同组织中表达量的异同可能反映在一个特定的组织对热休克蛋白的需要。
表4所示,D.hHSP69.09和D.hHSP70.11 mRNA的相对表达量在卵巢中最高,其次在中肠。D.hHSP71.88基因在脂肪体中相对表达量最高,其次在精巢。HSP70基因相对表达量在脂肪体和中肠中相对较高。
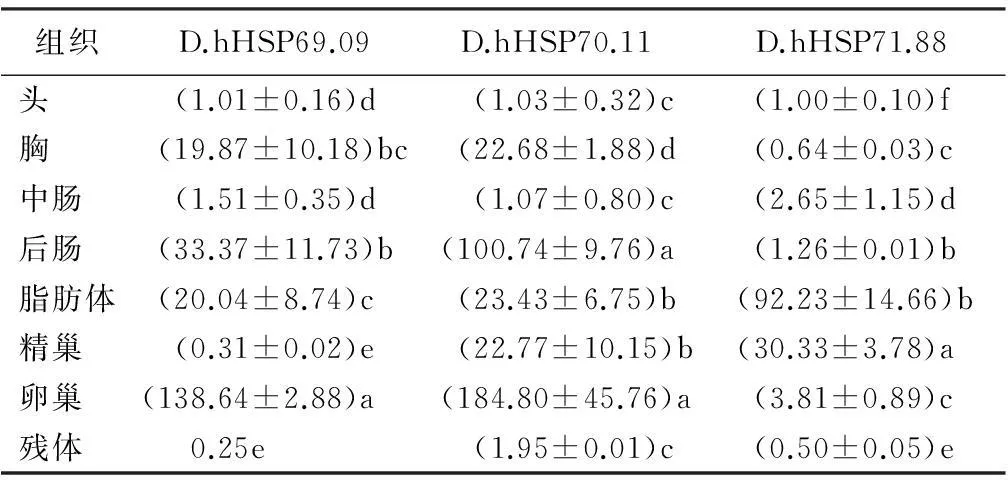
表4 花绒寄甲不同组织中HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
2.2.3高温应激反应下花绒寄甲HSP70的表达
以α-Tubulin作为内参基因,分析HSP70基因在高温应激下的表达模式。表5显示,雌雄成虫HSP70 mRNA的表达量存在明显差异。在23 ℃时,D.hHSP69.09雌虫mRNA的表达量显著高于雄虫,雌虫的表达量约为雄虫的2倍;与D.hHSP69.09不同,D.hHSP70.11和D.hHSP71.88雄虫mRNA的表达量显著高于雌虫,D.hHSP70.11雄虫的表达量约为雌虫的5倍;D.hHSP70.11雄虫的表达量约为雌虫的150倍。
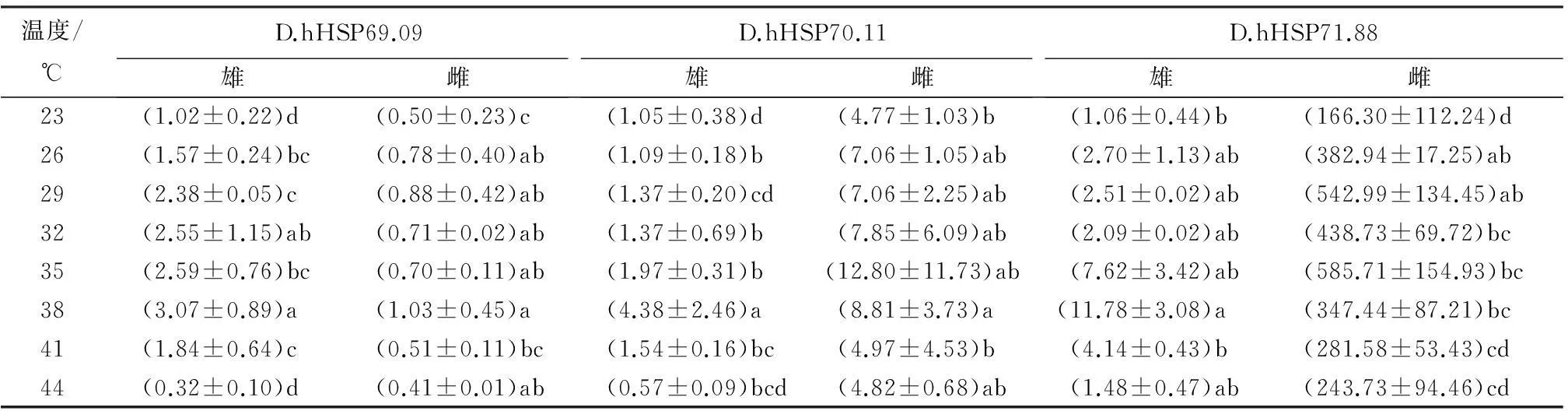
表5 不同温度(处理2 h)下花绒寄甲HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
高温刺激下HSP70基因均被诱导,表达趋势相似。随温度上升,表达量逐渐升高,至一定温度后下降。但是,不同基因表达程度存在巨大差异,表达量最高点所对应的温度不同。雌雄成虫中D.hHSP69.09在38 ℃高温刺激时相对表达量最高,其中,雌虫的mRNA表达量约为雄虫的3倍。D.hHSP70.11雌虫在38 ℃高温刺激时相对表达量最高,雌虫的mRNA表达量约为雄虫的2倍,雄虫在35 ℃高温刺激时mRNA表达量最高,雄虫的mRNA表达量约为雄虫的12倍。D.hHSP71.88雌虫在38 ℃高温刺激时表达量最高,雄虫的mRNA表达量约为雌虫的3倍;雄虫在38 ℃高温刺激时表达量最高,雄虫的mRNA表达量约为雌虫的77倍。
为更好地分析HSP70基因在高温刺激下的生理作用,对应激反应较为敏感的温度41 ℃做不同时间热激处理。由表6可见,3条基因均出现随处理时间的延长而诱导增加的趋势。41 ℃高温刺激后短时间内雌虫HSP70基因表达量明显高于雄虫,随着时间延长雄虫的表达量高于雌虫。
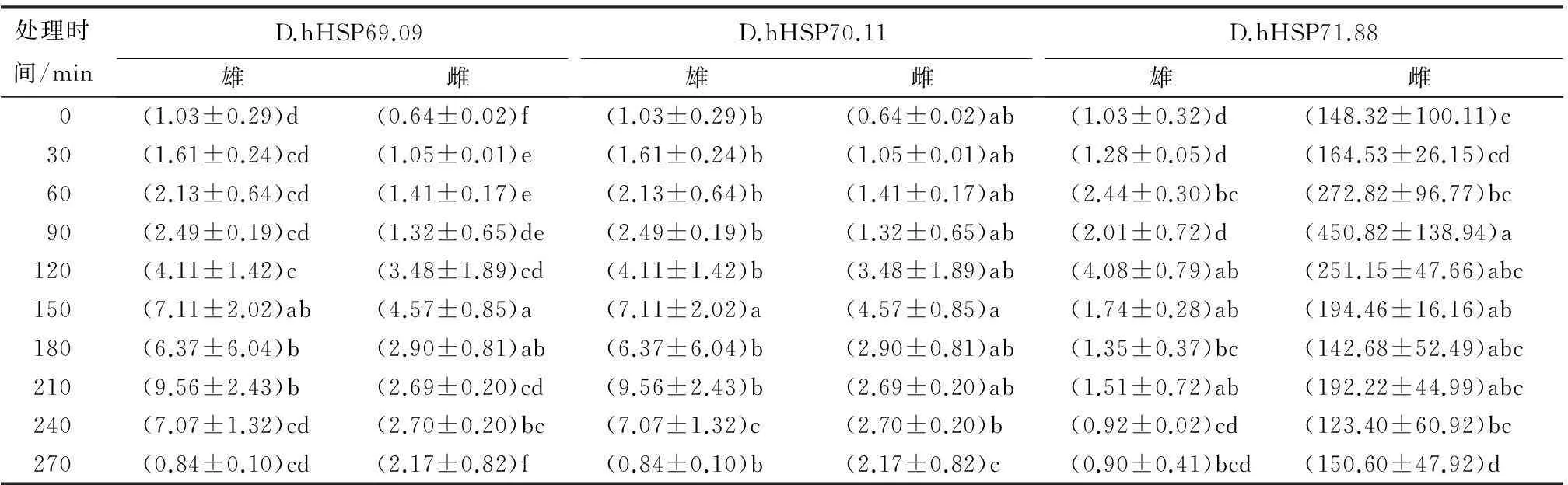
表6 41 ℃处理不同时间时花绒寄甲HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
2.2.4氧化胁迫下花绒寄甲HSP的表达
由表7可见,以α-Tubulin作为内参基因,在不同浓度氧化处理下HSP70表现出被诱导,表达量先升高后下降;雌雄成虫HSP70 mRNA的表达量存在显著差异。D.hHSP69.09雌虫mRNA的表达量显著高于雄虫,雌虫在20 mmol·L-1时表达量达到最高,约为雄虫的3.8倍;雄虫在30 mmol·L-1时最高,雌虫的表达量约为雄虫的1.8倍;D.hHSP70.11和D.hHSP71.88雄虫mRNA的表达量显著高于雌虫。D.hHSP70.11和D.hHSP71.88雌虫在20 mmol·L-1时表达量达到最高,其中,D.hHSP70.11雌虫的表达量约为雄虫的3.8倍,D.hHSP71.88雌虫的表达量约为雄虫的100倍,D.hHSP70.11雄虫在30 mmol·L-1时最高,雌虫的表达量约为雄虫的2.3倍;D.hHSP71.88雄虫在20 mmol·L-1时最高,雌虫的表达量约为雄虫的19倍。
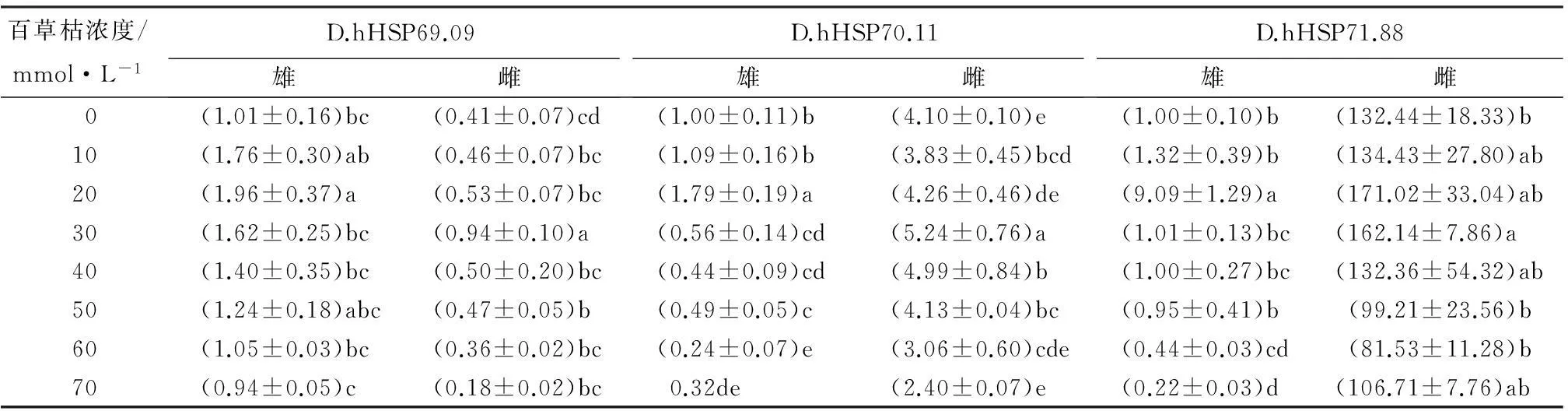
表7 氧化胁迫下花绒寄甲HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
2.2.5饥饿处理下花绒寄甲HSP的表达
在相同的饥饿条件处理下,花绒寄甲雌虫耐饥饿能力高于雄虫,雌性成虫可存活超过一月,但是雄成虫只能存活半月。
以α-Tubulin作为内参基因,由表8所示,在饥饿刺激下雌雄虫表达水平不同。随饥饿处理时间延长,雄虫中HSP70基因mRNA的表达量降低,表现出被抑制。
3讨论
昆虫产生热休克蛋白来抵御环境中的各种压力,如极端高温、种群密集、干燥缺水和低氧等不利生活条件。热休克蛋白可以保护机体蛋白在压力胁迫下发生不可逆变性,而且促进在胁迫刺激后蛋白的折叠和降解。HSP70被认为通过形成分子网络在蛋白合成、抗压能力和滞育方面等发挥着非常重要的作用。大量表达的热休克蛋白是昆虫生存的重要调节器,参与昆虫的正常发育和滞育行为。热休克蛋白在面对诸多非生物刺激时如高温和寒冷、紫外辐射、重金属、化学杀虫剂等不良环境时,其表达量显著被诱导和调节。
3.1花绒寄甲HSP70基因的结构
对D.hHSP69.09、D.hHSP70.11和D.hHSP71.88氨基酸序列分析显示,花绒寄甲HSP70与其他昆虫HSP70具有较高的同源性。结构与功能有着密切联系,利用PROSITE数据库对蛋白质氨基酸序列进行功能位点预测,3条HSP70基因中均具有3条HSP70家族的签名序列,位置大致相同。此外,在D.hHSP69.09和D.hHSP70.11的C-末端存在的V/IEEVD基序,表明D.hHSP69.09和D.hHSP70.11是一种细胞质型HSP70。而D.hHSP71.88的C-末端为IDEAD,目前尚未找到关于该序列的文献。
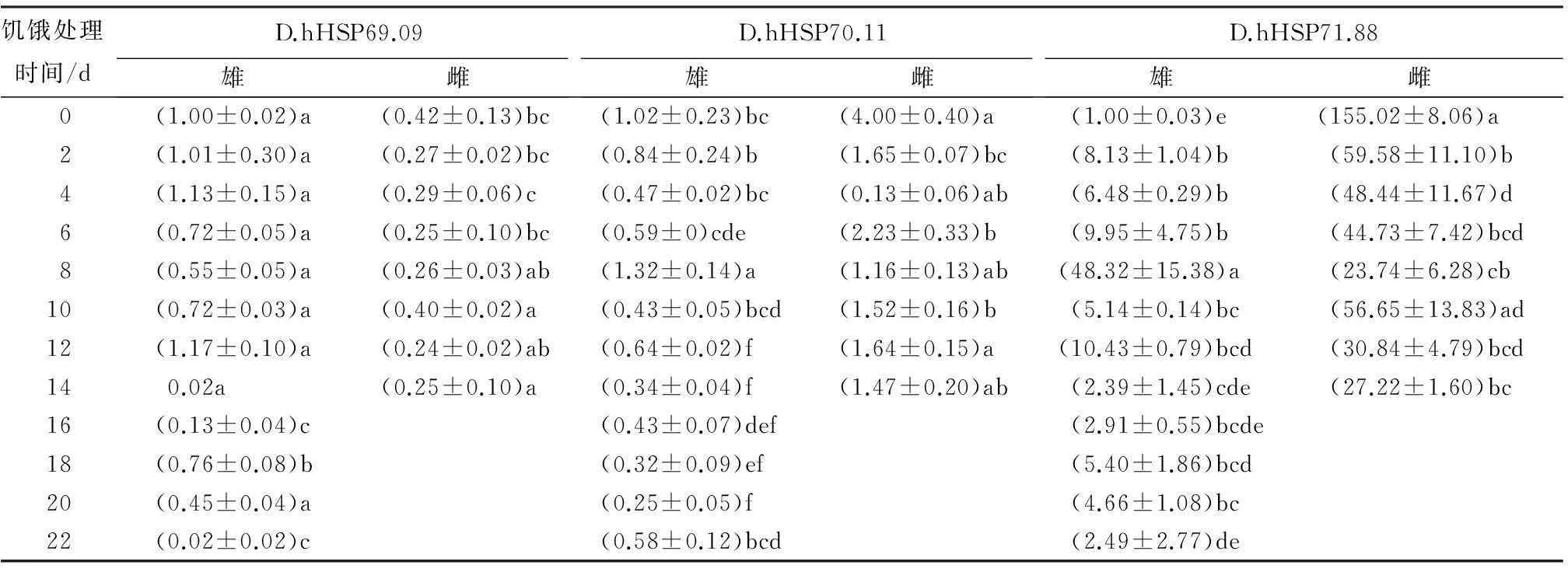
表8 饥饿胁迫下花绒寄甲HSP70的表达模式
注:表中数据为平均值±标准差;同列数据后不同字母表示差异显著(p<0.05)。
花绒寄甲HSP70基因编码的氨基酸组成中,Gln和Glu在总氨基酸中的比例较高。据文献报道,蛋白质在遭受高温胁迫时,Gln和Glu可能通过提供额外的静电作用力维持蛋白质的稳定[20]。
3.2花绒寄甲HSP70基因的时间和空间特异性
昆虫的发育阶段是决定一个昆虫的耐热性和耐寒性的一个重要的因素[21]。花绒寄甲HSP70基因mRNA表达在花绒寄甲整个发育过程中波动很大,波动总与不同发育期的转换密切相关,包括幼虫-蛹、蛹-成虫。在完全变态昆虫中,不同发育时期的转换总是伴随相关基因表达水平的剧烈波动[22]。在意大利蜜蜂(Apis mellifera)中,卵-幼虫的转换改变了65种蛋白和34种磷蛋白的表达水平,新孵化幼虫增强了蛋白质折叠、细胞骨架及代谢相关蛋白的表达,以确保意大利工蜂的快速生长[23]。因此,花绒寄甲HSP70基因在不同发育时期转换时的高水平表达暗示着其可能通过调控蛋白质折叠来参与花绒寄甲的发育过程。幼虫阶段HSP70基因随着龄期的增加,mRNA的表达量逐渐减小,推测HSP70基因可能和花绒寄甲幼虫的蜕皮存在某种关系。
昆虫中HSP70的表达模式显示出明显的组织特异性。HSP70基因相对表达量在脂肪体和中肠中较高,推测其可能参与对外源毒物的解毒和氧化应激的保护作用,说明热休克蛋白可能在保护昆虫机体免受外源毒物损害存在潜在作用[23]。
D.hHSP69.09和D.hHSP70.11 mRNA在精巢中相对表达量最高,表明其可能与雄性生殖系统存在某种关系。精子发育对高温极其敏感。果蝇的初级精母细胞在导入HSP70后对高温迟钝[24]。对中国樟木天蚕蛾(Antheraea pernyi)的研究中发现,Ap-sHSP21在高温诱导后,在精巢中的表达水平明显高于其他组织[25]。在黑腹果蝇的雄配子发育过程中观察到热休克蛋白。HSP26在精子和卵子的发育中表达水平需要被调整[26]。HSP27在精子细胞减数分裂后期也被检测到[27]。由组织特异性分析结果推测,D.hHSP69.09和D.hHSP70.11可能参与花绒寄甲雄性生育调节过程。
3.3花绒寄甲HSP70基因在不同非生物应激中的表达特性
温度是重要的环境因素,它能诱导生物体发生相关生理变化而产生氧化应激[28]。在高温胁迫下,昆虫会出现各种热害反应。高温会加快昆虫体内水分的散失,影响昆虫正常的生理代谢;高温还会改变昆虫体内代谢途径,诱发细胞中的活性氧簇(ROS)大量增加,从而对虫体造成伤害。同时,昆虫具有一定程度的环境适应性。热休克蛋白在昆虫耐温度胁迫中发挥着重要作用,可提高昆虫对不良环境的耐受性,保护昆虫免受或少受胁迫伤害[29]。花绒寄甲作为变温动物,它的分布及生存深受环境温度的限制,花绒寄甲具有较高的耐高温特性,最高生存温度能达到47 ℃;雌雄成虫HSP70 mRNA的表达量存在明显差异,在高温刺激下,HSP70基因均被诱导,表达模式相同,随温度上升,表达量逐渐升高至一定温度后下降。但不同基因表达程度存在巨大差异,表达量最高点所对应的温度不同。因此,花绒寄甲HSP70基因被高温诱导表达下过表达,意味着HSP70基因可能在花绒寄甲热应激反应中,通过分子伴侣活性发挥重要的保护作用。
以往研究已经揭示高浓度的活性氧会对机体生物大分子产生严重危害,如蛋白、核苷酸和其他细胞组件等[30]。为减轻过氧化物的损伤,机体产生了相应的防御系统。许多研究已经证实,氧化损伤可被多种环境条件诱导产生,包括温度、杀虫剂、紫外辐射和重金属等[31]。
热休克蛋白被认为是响应氧化损伤时细胞中重要的调节器[32]。采用百草枯作为氧化刺激源,结果表明,根据花绒寄甲在百草枯氧化应激后热休克蛋白表达量的变化模式推测,热休克蛋白在花绒寄甲抗氧化胁迫中发挥着重要作用。本结果为热休克蛋白的抗氧化功能提供了又一理论依据。
饥饿刺激会对昆虫产生一系列的复杂影响,包括营养缺乏、离子平衡被打破以及水平衡失调等[14]。大量研究报导表明,饥饿可诱导热休克蛋白基因的表达[33]。在对蝶蛹金小峰(Pteromalus puparum)的研究中发现,饥饿处理24 h后,4条热休克蛋白基因的表达水平发生明显变化[34]。花绒寄甲雌虫的耐饥饿能力高于雄虫。在相同的饥饿条件下,雌性成虫可存活超过一月,但雄成虫只能存活半月。饥饿胁迫环境下花绒寄甲雌雄虫HSP70 mRNA的表达水平不同,雄虫中3条HSP70基因均被抑制;短时间的饥饿处理,雌成虫中HSP70基因出现上调趋势。推测HSP70基因在雌雄成虫中的不同表达模式可能与花绒寄甲耐饥能力以及饥饿寿命相关。有研究指出,HSP70与昆虫衰老有重要关系[24],这也为下一步的研究提供了方向。
4结论
从花绒寄甲转录组中获得3条热休克蛋白70基因,分析序列的基本结构特征以及与其他昆虫HSP70之间的进化关系,发现花绒寄甲具有HSP70多样性,在结构上具有高度保守性。利用Real-time PCR技术对花绒寄甲HSP70在不同发育阶段以及在高温、氧化、饥饿刺激下的表达模式研究,HSP70在花绒寄甲生长发育、繁殖过程中和抗氧化、抗饥饿等不良环境刺激下发挥重要作用。研究结果将有助于在分子水平上来评估花绒寄甲的抗逆性能力,而花绒寄甲作为生物防治中重要的天敌昆虫,在天牛类害虫生物防治中具有更广阔的应用前景。
参考文献
[1]魏建荣,杨忠岐,牛艳玲,等.花绒寄甲的分布与生态学习性补充调查[J].中国森林病虫,2009,28(1):16-18.
[2]李孟楼,王培新,马峰,等.花绒坚甲对光肩星天牛的寄生效果研究[J].西北农林科技大学学报(自然科学版),2007,35(6):152-156.DOI:doi:10.3321/j.issn:1671-9387.2007.06.031.
[3]MIRONIDIS G K, SAVOPOULOU-SOULTANI M.Effects of heat shock on survival and reproduction of Helicoverpa armigera (Lepidoptera: Noctuidae) adults[J].Journal of Thermal Biology,2010,35(2):59-69.
[4]CHEN H, XU X L, LI Y P, et al.Characterization of heat shock protein 90, 70 and their transcriptional expression patterns on high temperature in adult of Grapholita molesta (Busck)[J].Insect Science,2014,21(4):439-448.
[5]BASHA E, O’NEILL H, VIERLING E.Small heat shock proteins and α-crystallins: dynamic proteins with flexible functions[J].Trends in Biochemical Sciences,2012,37(3):106-117.
[6]SONNA L A, FUJITA J, GAFFIN S L, et al.Invited review: Effects of heat and cold stress on mammalian gene expression[J].Journal of Applied Physiology,2002,92(4):1725-1742.
[7]SØRENSEN J G, KRISTENSEN T N, LOESCHCKE V.The evolutionary and ecological role of heat shock proteins[J].Ecology Letters,2003,6(11):1025-1037.
[8]RITOSSA F.A new puffing pattern induced by temperature shock and DNP in drosophila[J].Experientia,1962,18(12):571-573.
[9]GARRIDO C, PAUL C, SEIGNEURIC R, et al.The small heat shock proteins family: the long forgotten chaperones[J].International Journal of Biochemistry & Cell Biology,2012,44(10):1588-1592.
[10]黄文聪.热休克蛋白70热耐受性获得与运动应答的反应[J].中国组织工程研究与临床康复,2008,12(24):4735-4739.doi:10.3321/j.issn:1673-8225.2008.24.017.
[11]HOFFMANN A A, PARSONS P A.Evolutionary genetics and environmental stress[J].New York: Oxford University Press,1991.
[12]FEDER M E, HOFMANN G E.Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J].Annual Review of Physiology,1999,61(1):243-282.
[13]GEHRING W J, WEHNER R.Heat shock protein synthesis and thermotolerance in Cataglyphis, an ant from the Sahara desert[J].Proceedings of the National Academy of Sciences,1995,92(7):2994-2998.
[14]HUANG L H, WANG C Z, KANG L.Cloning and expression of five heat shock protein genes in relation to cold hardening and development in the leafminer, Liriomyza sativae[J].Journal of Insect Physiology,2009,55(3):279-285.
[15]SHOJI S, MUHAMMAD A, HISAAKI T.A comparison of heat shock protein genes from cultured cells of the cabbage armyworm, Mamestra brassicae, in response to heavy metals[J].Archives of Insect Biochemistry & Physiology,2007,65(4):210-222.
[16]LI Z W, LI X, YU Q Y, et al.The small heat shock protein (sHSP) genes in the silkworm, Bombyx mori, and comparative analysis with other insect sHSP genes[J].BMC Evol Biol,2009,9:215.
[17]LIU Z H, XI D M, KANG M J, et al.Molecular cloning and characterization of Hsp27.6: the first reported small heat shock protein from Apis cerana cerana[J].Cell Stress & Chaperones,2012,17(5):539-551.
[18]LIVAK K J, SCHMITTGEN T D.Analysis or relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25:402-408.
[19]DAUGAARD M, ROHDE M, JTTELM.The heat shock protein 70 family: Highly homologous proteins with overlapping and distinct functions[J].FEBS Letters,2007,581(19):3702-3710.
[20]JACOBSEN J V, SHAW D C.Heat-Stable proteins and abscisic acid action in barley aleurone cells[J].Plant Physiology,1989,91(4):1520-1526.
[21]FIELDS P G.The control of stored-product insects and mites with extreme temperatures[J].J Stored Prod Res,1992,28(2):89-118.
[22]GALA A, YU F, WOLTEDJI D, et al.Changes of proteome and phosphoproteome trigger embryo-larva transition of honeybee worker (Apis mellifera ligustica)[J].Journal of Proteomics, 2013, 78(1):428-446.
[23]ENAYATI A A, RANSON H, HEMINGWAY J.Insect glutathione S-transferases and insecticide resistance[J].Insect Molecular Biology,2005,14(1):3-8.
[24]王海鸿,雷仲仁.昆虫热休克蛋白的研究进展[J].中国农业科学,2005,38(10):2023-2034.
[25]LIU Q N, ZHU B J, DAI L S, et al.Overexpression of small heat shock protein 21 protects the Chinese oak silkworm Antheraea pernyi, against thermal stress[J].Journal of Insect Physiology,2013,59(8):848-854.
[26]GLASER R L, LIS J T.Multiple, compensatory regulatory elements specify spermatocyte-specific expression of the Drosophila melanogaster hsp26 gene[J].Molecular & Cellular Biology,1990,10(1):131-137.
[27]PAULI D, TONKA C H, TISSIERES A, et al.Tissue-specific expression of the heat shock protein HSP27 during Drosophila melanogaster development[J].Journal of Cell Biology,1990,111(3):817-828.
[28]AN M I, CHOI C Y.Activity of antioxidant enzymes and physiological responses in ark shell, Scapharca broughtonii, exposed to thermal and osmotic stress: Effects on hemolymph and biochemical parameters[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2010,155(1):34-42.
[29]段小凤,王晓庆,李品武,等.几种环境因子对昆虫适应性影响的研究进展[J].中国农学通报,2015,31(14):79-82.
[30]FINKEL T, HOLBROOK N J.Oxidants, oxidative stress and biology of ageing[J].Nature,2000,408:239-247.
[31]KOTTUPARAMBIL S, SHIN W, BROWN M T, et al.UV-B affects photosynthesis, ROS production and motility of the freshwater flagellate, Euglena agilis Carter[J].Aquatic Toxicology,2012,122(3):206-213.
[32]CHRISTIANS E S, ISHIWATA T, BENJAMIN I J.Small heat shock proteins in redox metabolism: Implications for cardiovascular diseases[J].International Journal of Biochemistry & Cell Biology,2012,44(10):1632-1645.
[33]BENOIT J B, LOPEZ-MARTINEZ G, TEETS N M, et al.Responses of the bed bug, Cimex lectularius, to temperature extremes and dehydration: levels of tolerance, rapid cold hardening and expression of heat shock proteins[J].Medical & Veterinary Entomology,2009,23(4):418-425.
[34]WANG H, LI K, ZHU J Y, et al.Cloning and expression pattern of heat shock protein genes from the endoparasitoid wasp, Pteromalus puparum in response to environmental stresses[J].Archives of Insect Biochemistry & Physiology,2012,79(4/5):247-263.
第一作者简介:郝春凤,女,1989年4月生,西北农林科技大学林学院,硕士研究生。E-mail:hlzsdau2009@163.com。 通信作者:李孟楼,西北农林科技大学林学院,教授。E-mail:limenglou@hotmail.com。
收稿日期:2015年12月21日。
分类号S763.3 Q786
Characterization and Expression Analysis of HSP70 Gene in Dastarcus helophoroides//
Hao Chunfeng, Wang Huapeng, Zhang Zhengqing, Chang Yong, Li Menglou(Northwest A&F University, Yangling 712100, P.R.China)//
Journal of Northeast Forestry University,2016,44(7):108-115,124.
Three full-length HSP70 genes, D.hHSP69.09, D.hHSP70.11 and D.hHSP71.88, were obtained from Dastarcus helophoroides.The development stage expression analysis by real-time qPCR displayed that three HSP70 genes were expressed in all development stage.The highest expression level of D.hHSP69.09 was detected in the first instar larva.The highest expression level of D.hHSP70.11 and D.hHSP71.88 were in the adult of male.The same condition of three HSP70 genes were the relative expression were high at the stage of pupal.By the tissue distribution analysis, the highest expression level of D.hHSP69.09 and D.hHSP70.11 was in the spermary.The relatively highest level of D.hHSP71.88 appeared in the corpus adiposum.The three HSPs of female and male adults were both up-regulated with the rise of temperature, time duration for 41 ℃ and concentration of oxidizing agent, then decreased.When treated with starvation stress, the expression patterns of male and female were different.When the processing time was prolonged, for male, the expression of three HSP70 genes were declined.However, in female adult, they were up-regulated.Therefore, HSP70 genes were correlated with the transition of different development stages and molting of larva in D.helophoroide.Moreover, HSP70 genes have direct relationship with resistibility to environmental stress including high temperature, oxidative stress, and starvation.
KeywordsDastarcus helophoroides; Environmental stress; HSP70; Real-time qPCR
1)国家自然科学基金项目(31170608)。
责任编辑:程红。

