核桃枝枯病病原菌生物学特性及药剂防治1)
尹万瑞 朱天辉
(四川农业大学,成都,611130)
核桃枝枯病病原菌生物学特性及药剂防治1)
尹万瑞朱天辉
(四川农业大学,成都,611130)
摘要对核桃枝枯病的新病菌新壳梭孢(Neofusicoccum parvum)研究发现,菌落生长初期颜色为白色,逐渐成灰黑色,培养3周后变成黑色。最佳培养条件为:PDA培养基、温度25~30 ℃、pH=7~8、全光照、100%湿度、碳源为葡萄糖,氮源为谷氨酸。选取9种化学药剂对病菌进行了室内药剂的筛选,通过菌丝生长抑制试验,筛选出70%甲基托布津可湿性粉剂、50%多菌灵可湿性粉剂和75%百菌清可湿性粉剂3种高效药剂,其抑制率依次为66.67%、64.44%、44.44%。
关键词核桃;核桃枝枯病;核桃枝枯病生物学特性;核桃枝枯病化学防治
核桃枝枯病在世界各地均有发生,不同的地域其病原也并非全相似。我国的核桃枝枯病也尤其严重,多分布在辽宁、山东、四川等地[1-3]。作为核桃(Juglans regia)主要常见的病害,大量的专家学者也对引起核桃枝枯病的病原进行了大量的调查研究并取得了一定的成就[4],研究认为核桃枝枯病的病原有胡桃楸拟茎点霉(Phomopsis juglandina),半知菌亚门黑盘孢[5-7],葡萄座腔菌属的Botryosphaeria dothidea、B.fabicercianum[8-10]、B.obtusa[11-14]等。笔者对四川地区核桃枝枯病的病害调查表明,引起四川地区核桃枝枯病的病原为新壳梭孢(Neofusicoccum parvum),在国内关于该病害的相关资料文献较少,但是这一病原菌在国外先后引起过核桃、柑橘(Citrus reticulata)、葡萄(Vitis vinifera)等的枝枯病,引起国外植物保护专家学者的重视[13,15-16]。笔者研究该病害的发病规律,并进行相应的药剂试验,为生产实践中防治该核桃枝枯病提供一些理论和实践依据。
1材料与方法
1.1试验材料
2014年3月—12月,对四川雅安、绵阳等核桃种植区域采样,进行组织分离培养,经过病原菌形态、培养形状、及致病性等方面的研究,确定该病原菌为新壳梭孢(Neofusicoccum parvum)。本菌株由四川农业大学森林保护实验室鉴定并提供菌株。
1.2病原菌的生物学特性
培养基对菌丝生长的影响:用直径为5 mm的灭菌打孔器打取在PDA平板上培养5 d的核桃枝枯病病菌菌饼,分别接种到PDA、PDA+维生素B6、燕麦、玉米、查氏、淀粉6种培养基上,并设置对照,于恒温箱中25 ℃培养3 d,重复3次,3 d后用十字交叉法[17]测量菌落直径,每个处理5次重复。
温度对菌丝生长的影响:将菌株用无菌打孔器取直径5 mm的菌饼接种于PDA平板中央,分别置于5~40 ℃,每5 ℃为一梯度,共9种温度下培养,于48 h后分别用十字交叉法检测菌落直径及萌发状况,每个处理5次重复。
光照条件对菌丝生长的影响:用无菌打孔器取直径5 mm的菌饼接种于PDA平板中央,分别置于24 h全光照、12 h光暗交替、24 h全黑暗3种光照条件下,培养箱中25 ℃培养,十字交叉法测量菌落直径,每个处理5次重复。
pH值对菌丝生长的影响:将灭菌后的PDA用1 mol·L-1的HCL和1 mol·L-1的NaOH调配成pH值5~11,以1为1个梯度,共7种。用无菌打孔器取5 mm的菌饼接种于上述7种不同pH值的PDA中,置于人工气候箱中25 ℃培养,分别于2、3 d后测量菌落直径,每个处理5次重复。
碳源、氮源对菌丝生长的影响:以查氏培养基为基础培养基,用果糖、淀粉、乳糖、葡萄糖、蔗糖等量替代基础培养基内的碳源,用磷酸铵、硝酸钾、硝酸铵、硫酸铵、尿素、蛋白胨等量替代基础培养基内的氮源,以不加碳源和不加氮源的查氏培养基为空白对照(CK)。取直径5 mm的菌饼接种于上述培养基平板中央,置于培养箱中25 ℃培养3 d,按十字交叉法测量菌落直径,每个处理5重复。
湿度对菌丝生长的影响:利用气候培养箱设置相对湿度为100%、95%、90%、85%、80%、75%的6个层次,取直径5 mm的菌饼接种于PDA培养基平板中央,置于培养箱中25 ℃培养2 d,按照上述方法每隔1 d测量菌落直径,每个处理5次重复。
致死温度的测定:将待测菌放入试管中,在水浴锅内处理10 min,水浴锅的温度设置为40、45、50、55、60、65 ℃。每个处理重复5次。将处理后的菌丝块和菌核接种于PDA培养基上,确定其致死温度。
1.3药剂防治
选用9种杀菌剂(表1)用于室内毒力测定。将杀菌剂用无菌水配制成1.25、2.50、5.00、10.00、20.00、40.00 mg·L-1的药液,取1 mL药液加入到温度降至50 ℃左右的灭菌培养基(9 mL)中,摇匀后倒入直径9 cm的培养皿中,制成PDA含药平板培养基。取培养3 d的病菌菌落,用无菌的打孔器打取5 mm的菌饼,移入加药的PDA平板中央,每皿一个菌饼,另设不含药培养基为对照,每个处理5次重复,7 d后用十字交叉法测量菌落直径大小,计算出抑制率。将对菌丝的抑制率换算成机率值,以各处理的杀菌剂的质量浓度对数值为自变量(x),以相应处理对病原菌菌丝机率值为因变量(y),应用统计回归方法,拟合出质量浓度对数-抑制百分率机率值毒力曲线(y=ax+b)。并且把抑制率为50%时的机率值代入毒力方程求出x,再转化成抑菌中浓度EC50[18]。EC50越小,即浓度越小,说明该药剂对病菌菌丝的抑制作用越好。抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
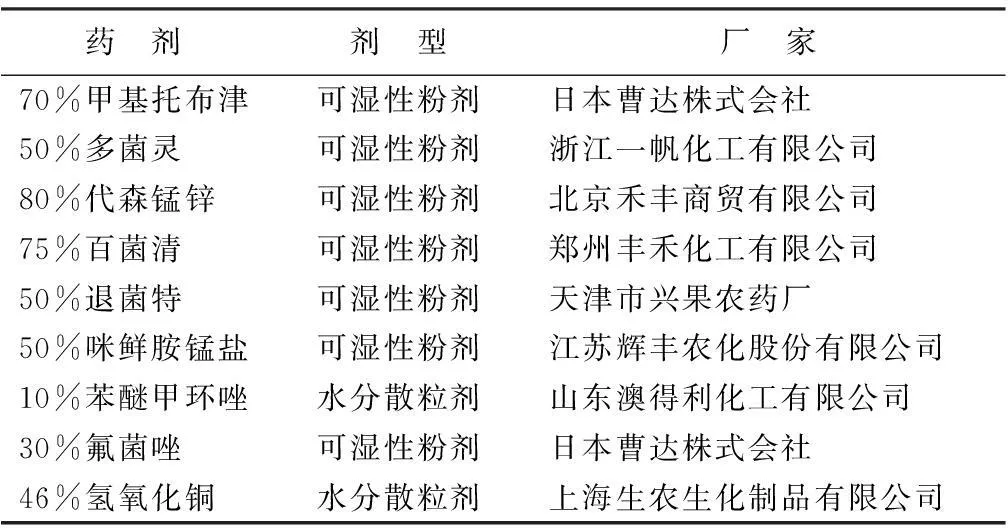
表1 供试菌剂
2结果与分析
2.1病原菌培养性状
该菌在PDA培养基平板长势较快,形成圆形或者近似圆形的菌落。菌落的气生菌丝发达,菌丝有隔,边缘整齐,菌落初期颜色由白色转变成灰黑色,3周后变成黑色。该菌在PDA培养基中培养25 d左右开始产生分生孢子器,经过紫外线照射10 min左右再培养3 d,产孢子较快。分生孢子器近似圆形或者不规则的形状。分生孢子近似椭圆形,单孢子,壁薄,颜色透明,无隔,大小相当,为(15.2~17.2)μm×(4.6~6.4)μm(图1)。
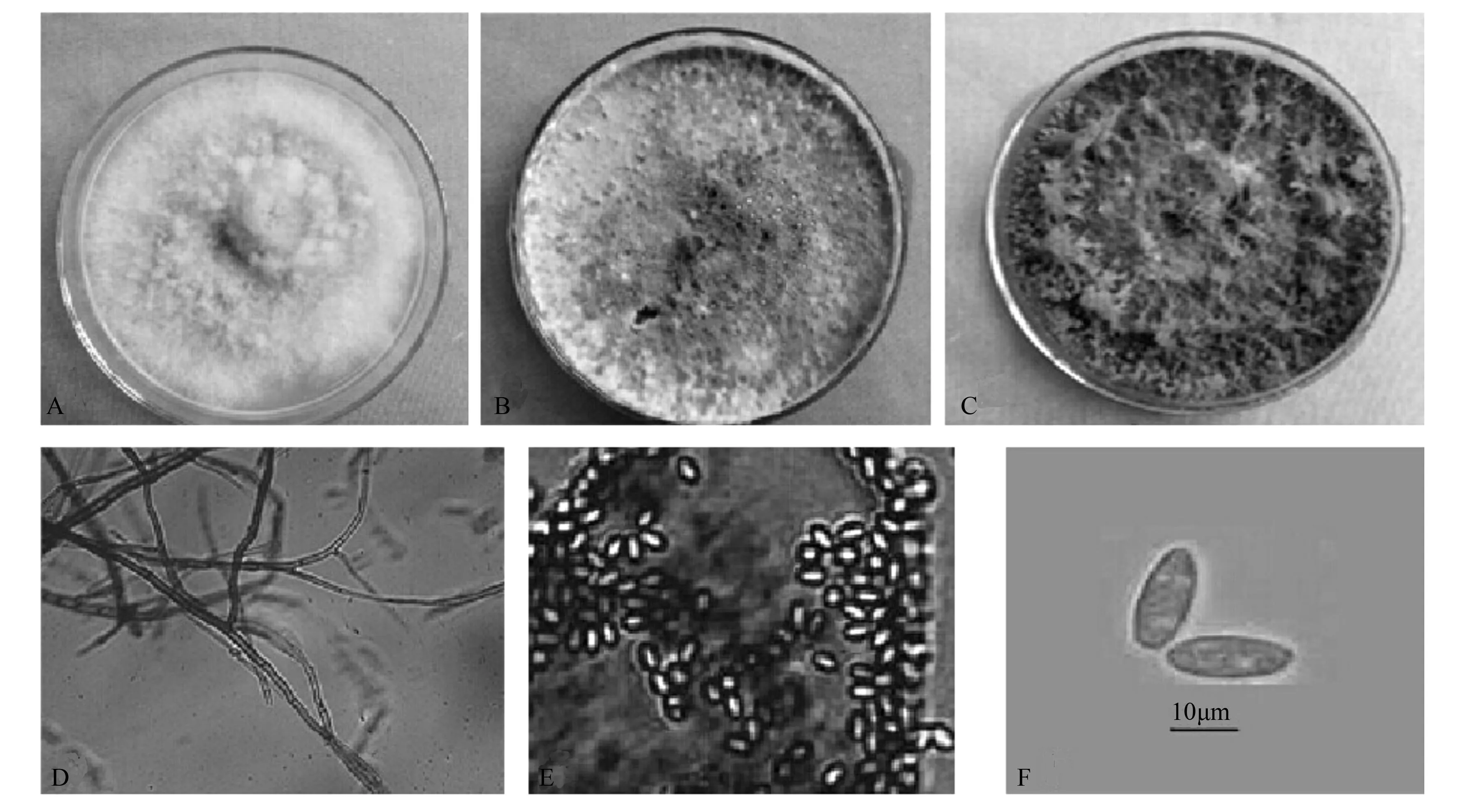
A-C.在PDA培养基中的颜色变化;D.菌丝形态;E-F.分生孢子。
2.2病原菌的生物学特性
2.2.1不同培养基对菌丝生长的影响
通过试验发现,病原菌在不同培养基上均能够生长,接种于维生素B2、PSA、查氏培养基、燕麦培养基、淀粉培养基、PDA分别培养3 d后,其菌落平均直径分别为4.35、5.30、4.70、4.05、3.30、5.50 cm,其中对照培养基(水+琼脂)平均菌落直径为2.70 cm。结果表明,选择PDA培养基最有利于菌丝生长发育、其次是PSA培养基、查氏培养基和维生素B2培养基。
2.2.2不同温度对菌丝生长的影响
病原菌在5~45 ℃不同梯度(每5 ℃为一梯度)培养2 d后,其菌落平均直径分别为0.52、0.52、1.28、2.33、4.92、4.58、3.87、3.67、3.33 cm。结果表明,菌丝生长趋势随着温度递增由低到高再降低,整体上适合高温生长。其中,在25~30 ℃下菌丝生长活力最旺盛,而在10 ℃以下生长极度缓慢或者不生长。
2.2.3不同光照条件对菌丝生长的影响
在全光照、24 h光黑暗交替、全黑暗条件下培养该菌2 d后,其菌落平均直径分别为2.21、2.07、1.82 cm。结果表明,该菌在全光照条件生长较快、其次为光暗交替,而在黑暗条件下生长速度最慢。
2.2.4不同pH值对菌丝生长的影响
由表2可见,病原菌在酸性条件下能生长,在中性(pH=7~8)条件下生长快且稳定,而当碱性增强时,其生长逐渐受到抑制。

表2 pH值对核桃枝枯病病原菌菌丝生长的影响
2.2.5不同碳源、氮源对菌丝生长的影响
在以甘露醇、蔗糖、葡萄糖、麦芽糖、淀粉为碳源的生长试验中,培养3 d后,病原菌的平均菌落直径分别为2.88、3.87、4.38、3.31、2.97 cm。结果表明,葡萄糖是最利于病原菌生长的碳源,其次为蔗糖和麦芽糖。
在以谷氨酸、尿素、硫酸铵、氯化铵、硝酸钾为氮源的生长的试验中,培养3 d后,病原菌的平均菌落直径分别为5.22、1.72、4.51、3.81、4.32 cm。结果表明,谷氨酸是最有利于菌丝生长的氮源,其次为硫酸铵、硝酸钾、氯化铵,尿素对菌丝生长有一定的抑制。
2.2.6不同湿度对菌丝生长的影响
相对湿度在60%~100%时,对菌丝生长影响不明显(表3)。相对湿度较高时,菌丝生长较快,在相对湿度为100%时,菌丝生长最旺盛,菌丝体发达。
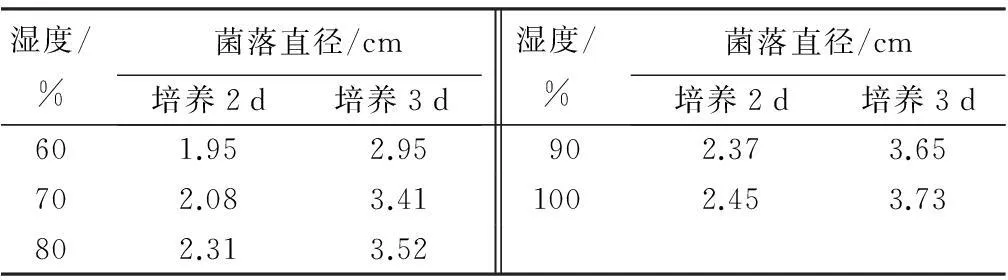
表3 湿度对核桃枝枯病病原菌菌丝生长的影响
2.2.7致死温度
病原菌在40~65 ℃不同梯度(每5 ℃为一梯度)处理后,培养3 d,测得菌落平均直径分别为3.33、3.06、2.31、1.68、0、0 cm。结果表明,经水浴锅60 ℃高温10 min后,放入培养箱中培养3 d,其菌丝也未生长。因此,确定60 ℃为其致死温度。
2.3药剂防治
将病原菌接种在含药剂制成的培养皿中,于培养箱中25 ℃培养7 d,计算出菌丝在不同药剂中的生长情况。由表4可知,不同质量浓度的不同药剂对菌丝抑制的情况差异较大。9种药剂在1.25~40.00 mg·L-1时,随着药剂质量浓度的增大菌落开始变小,在40 mg·L-1的时候,抑制率高于40%的有75%百菌清可湿性粉剂、70%甲基托布津可湿性粉剂、50%多菌灵可湿性粉剂;其中80%代森锰锌可湿性粉剂、50%咪鲜胺锰盐可湿性粉剂、10%苯醚甲环唑水分散粒剂、30%氟菌唑可湿性粉剂、40%氢氧化铜水分散粒剂对菌丝有一定的抑制作用,但抑制率很低;而50%退菌特可湿性粉剂对菌丝未见抑制作用。
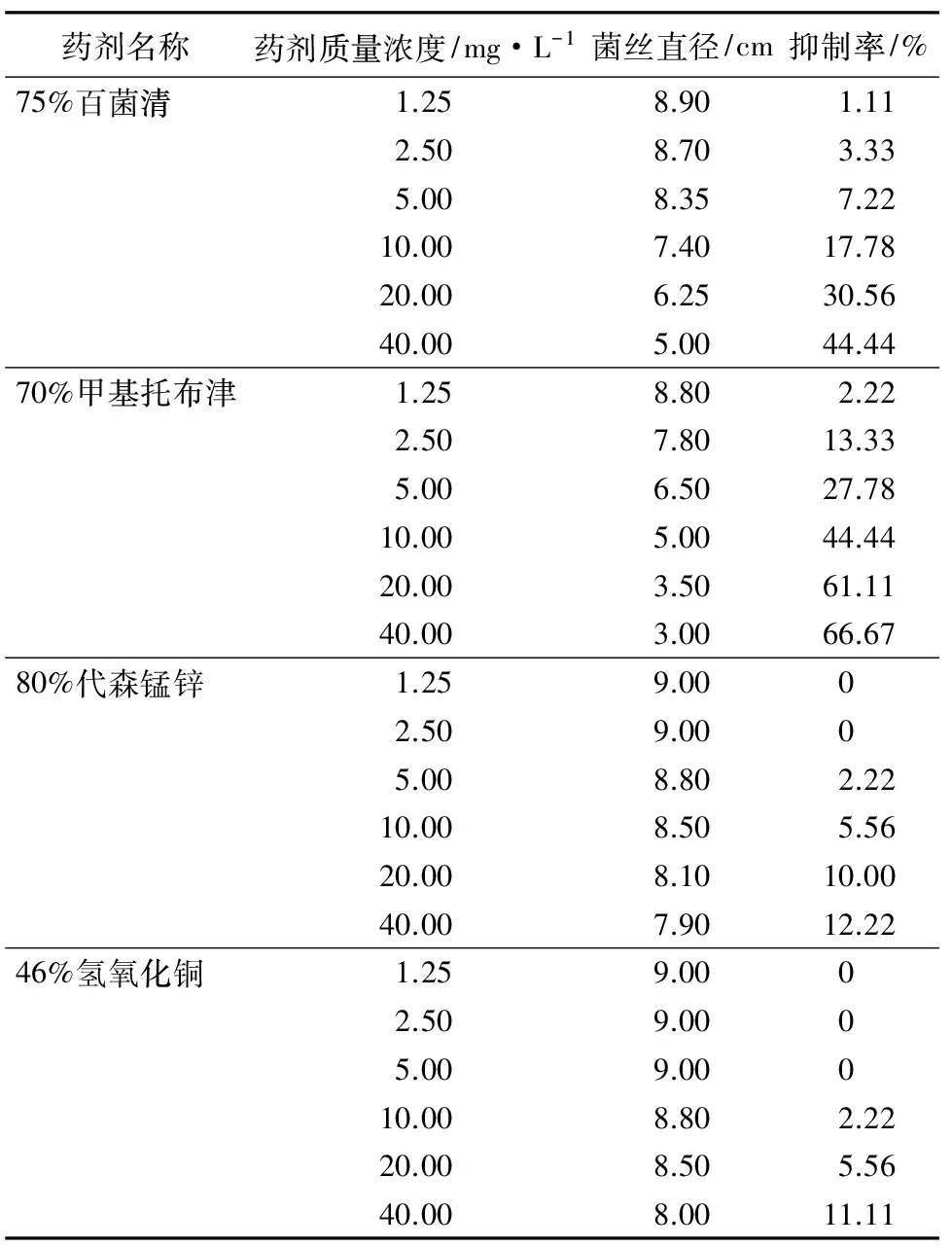
表4 杀菌剂对核桃枝枯病病原菌的抑制情况

续(表4)
由筛选出的防治该菌效果较好的3种化学药剂各处理质量浓度对数值为自变量(x),以相应处理对病原菌菌丝机率值为因变量(y),应用统计回归方法,拟合出质量浓度对数-抑制百分率机率值毒力曲线(y=ax+b),求出抑菌中浓度EC50(表5)。结果表明,70%甲基托布津对核桃病原的EC50值最小,表明该药剂对病原菌的抑制作用最好,其次为50%多菌灵和75%百菌清。
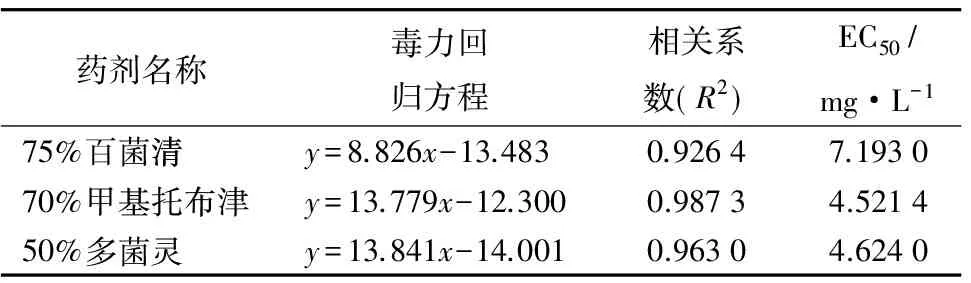
表5 有效杀菌剂对病原菌生长的回归方程及EC50
3结论
本研究就核桃枝枯病菌新病原新壳梭孢进行生物学特性研究及防治试验,结果表明,该菌在PDA培养基、25~30 ℃、pH=7~8、光照条件下适合生长,该菌的致死温度为60 ℃。在药剂防治试验中,70%甲基托布津可湿性粉剂对核桃病原菌抑制的EC50值最小,为4.521 4 mg·L-1,抑制效果最好,较差的50%多菌灵可湿性粉剂和75%百菌清可湿性粉剂EC50值依次为4.624 0、7.193 0 mg·L-1,对菌丝抑制有一定的防效。
不同的营养、温度、pH值、光暗条件等对菌丝的生长有较大地影响。生长的最佳条件与核桃枝枯病发病高峰期相吻合(7—8月份)。7—8月份,当地温度较高、光照充足、雨水天气较多,湿度大,加剧了病原传播速度,导致核桃枝枯病的大量发生。因此,应该在病发初期进行预防,生产上进行施肥除草、修剪整形。当发病时,应做到及时施药,减少病菌在核桃枝条的残留,使核桃保持健康生长。
参考文献
[1]郗荣庭,张毅萍.中国果树志:核桃卷[M].北京:中国林业出版社,1996.
[2]吴国良,刘群龙,郑先波,等.核桃种质资源研究进展[J].果树学报,2009,26(4):539-545.
[3]王红霞,张志华,玄立春.我国核桃种质资源及育种研究进展[J].河北林果研究,2007,22(4):387-392.
[4]董玉芝,朱小虎,陈虹,等.新疆巩留野核桃林调查及其分析[J].植物遗传资源学报,2012,13(2):386-392.
[5]曲文文,杨克强,刘会香,等.山东省核桃主要病害及其综合防治[J].植物保护,2011,37(2):136-140.
[6]孙俊.辽宁新病害核桃枝枯病病原鉴定[J].果树学报,2013,30(4):669-671.
[7]曲文文.山东省核桃(Juglans regia)主要病害病原鉴定[D].泰安:山东农业大学,2011.
[8]王璇,马良进,吕全,等.山核桃干腐病病原菌的鉴定[J].浙江农林大学学报,2014,31(2):238-245.
[9]张传清,章祖平,孙品雷,等.山核桃干腐病菌对7种杀菌剂的敏感性比较及其对苯醚甲环唑敏感基线的建立[J].农药学学报,2011,13(1):84-86.
[10]田甜,沈振明,徐秋芳,等.土壤中山核桃干腐病抑制菌的筛选和鉴定[J].浙江农林大学学报,2012,29(1):58-64.
[11]THOMIDIS T, MICHAILIDES T J, EXADAKTYLOU E.Neofusicoccum parvum associated with fruit rot and shoot blight of peaches in Greece[J].Eur J Plant Pathol,2011,131(4):661-668.
[12]PHILLIPS A J L, ALVES A, ABDOLLAHZADEH J, et al.The Botryosphaeriaceae: genera and species known from culture[J].Studies in Mycology,2013,76(1):51-167.
[13]CHEON W, KIM Y S, LEE S G, et al.First report of branch dieback of walnut caused by Neofusicoccum parvum in Korea[J].Plant Disease,2013,27(8):1114.
[14]CHEN S F, MORGAN D P, HASEY J K, et al.Phylogeny, morphology, distribution, and pathogenicity of Botryosphaeriaceae and Diaporthaceae from English Walnut in California[J].Plant Disease,2014,98(5):636-652.
[15]ADESEMOYE A O, ESKALEN A.First report of Spencermartinsia viticola, Neofusicoccum australe, and N.parvum causing branch canker of citrus in California[J].Plant Disease,2011,95(6):770.
[16]BASKARATHEVAN J, JASPERS M V, JONES E E, et al.Genetic and pathogenic diversity of Neofusicoccum parvum in New Zealand vineyards[J].Fungal Biology,2012,116(2):276-288.
[17]李元,廖颖,严伟,等.四川土荆芥精油对植物病原真菌的抗菌活性[J].生态环境学报,2010,19(5):1176-1181.
[18]张金林,庞民好,刘颖超,等.不同杀菌剂对草坪草病原菌毒力的作用测定[J].草业学报,2006,15(1):58-61.
第一作者简介:尹万瑞,男,1990年7月生,四川农业大学林学院,硕士研究生。E-mail:ywrui668@126.com。 通信作者:朱天辉,四川农业大学林学院,教授。E-mail:zhuth1227@tom.com。
收稿日期:2015年6月28日。
分类号S664.1;S763.1
Biological Characteristics of Walnut Branch Rot Pathogen and Its Chemical Prevention//
Yin Wanrui, Zhu Tianhui(Sichuan Agricultural University, Chengdu 611130, P.R.China)//
Journal of Northeast Forestry University,2016,44(7):98-101.
We studied the walnut branch rot, a new pathogen called Neofusicoccum parvum, and found that the initial growth color of colony was white, ash black gradually, then black after it was cultured after three weeks.The optimum culture conditions for walnut branch pathogen were under the PDA medium, 25 ℃-30 ℃, full illumination, 100% of humidity, the carbon source of glucose, and a nitrogen source.We selected nine kinds of chemicals which were screened for bacteria pharmacy test chamber, then three kinds of effective pharmacy screened by using the mycelial growth inhibition test.The best control effect successively were 70% thiophanate-methyl wettable powder, 50% carbendazim WP and 75% chlorothalonil WP with inhibition ratios of 66.67%, 64.44% and 44.44%, respectively.
KeywordsWalnut; Walnut branch rot; Biological characteristics of walnut branch rot; Chemical prevention of walnut branch rot
1)四川农业大学林学院基础应用研究专项课题。
责任编辑:程红。

