外源水杨酸对西洋杜鹃耐热性的影响1)
申惠翡 赵冰 徐静静 黄文梅 李厚华
(西北农林科技大学,杨凌,712100)
外源水杨酸对西洋杜鹃耐热性的影响1)
申惠翡赵冰徐静静黄文梅李厚华
(西北农林科技大学,杨凌,712100)
摘要以西洋杜鹃中‘粉珍珠’为试验材料,采用人工气候模拟热胁迫(38 ℃/30 ℃,昼/夜)并结合叶面喷施不同浓度水杨酸(0.05、0.10、0.15、0.20 μmol·L-1,SA)的处理方法,从形态表现、膜脂过氧化、渗透调节物质和抗氧化酶活性及叶片解剖结构等角度,研究外源水杨酸在植物抵抗高温胁迫过程中的生理功能及其作用机理。结果表明:高温胁迫(38 ℃/30 ℃)下,水杨酸预处理能够缓解高温胁迫对西洋杜鹃植株的伤害,经0.15~0.20 μmol·L-1SA处理可有效抑制叶绿素质量分数的降低,并利于植株后期恢复;经0.05 μmol·L-1SA处理可有效抑制丙二醛(MDA)、过氧化氢(H2O2)质量摩尔浓度的累积,并提高可溶性蛋白质量分数,增强超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,且不同处理间差异显著;经0.05、0.10 μmol·L-1SA处理有利于增加气孔密度、减小气孔张开度和气孔面积。经适宜浓度水杨酸处理能提高西洋杜鹃幼苗的耐热性,并以0.05 μmol·L-1浓度处理效果最佳。
关键词西洋杜鹃;水杨酸;高温胁迫;耐热性
杜鹃花是杜鹃花科(Ericaceae)杜鹃花属(Rhododendron)植物的总称,世界著名的观赏植物之一,特别是西洋杜鹃,花品超乎群花之上,更是花卉中的珍品,素有“木本花卉之王”的美誉[1]。但是西洋杜鹃生长发育对温度的要求较高,高温胁迫是影响杜鹃花代谢和观赏价值的关键非生物胁迫因子。有研究表明,热胁迫导致植物质膜透性加大,同时,活性氧大量累积引起膜脂过氧化、丙二醛质量摩尔浓度增加,电解质外渗,叶片解剖结构发生变化,进而影响植物的生长发育[2-3]。寻找提高植物耐热性的方法以及探讨其内在机理对调节植物的生长发育具有重要的意义,并为节约植物温室化栽培所耗能源提供有利措施。
水杨酸(SA)是植物体内一种酚类物质,被认为是一种内源信号分子,可通过调节多种生理代谢来响应各种非生物胁迫,从而改善植物的抗逆性[4]。近年来,外源SA在作物[5]、果树[6]、蔬菜[7]、草坪[8]等方面抵御非生物胁迫已经有相关报道。有研究表明,外源SA可减小膜脂过氧化程度,抑制MDA、H2O2质量摩尔浓度的积累;此外,外源SA还可以促进脯氨酸的积累,提高叶片中可溶性蛋白的质量分数等调节渗透系统,维持细胞膜稳定性;同时,SA可以通过调控抗氧化系统来影响植物对逆境胁迫的响应,诱导抗氧化酶(SOD、POD等)的活性增强,从而降低对质膜的损害,提高植物对高温、高盐、干旱等环境的抗性。高温胁迫下,细胞结构被破坏,水杨酸预处理可大大降低其受损程度,比较好地维持细胞原有结构,在一定程度上增强了植株抗热性。
目前,关于杜鹃花的研究主要集中于遗传多样性分析[9]、亲缘关系等方面[10],对杜鹃抗热性研究较少,利用外源SA提高其抗热性的研究几乎没有。因此,本研究拟在前人研究的基础上,以西洋杜鹃中‘粉珍珠’为试验材料,采用人工气候模拟热胁迫并结合叶面喷施不同浓度SA的处理方法,从形态表现、膜脂过氧化、叶绿素质量分数、渗透调节物质质量分数和抗氧化酶活性及叶片解剖结构等角度,研究外源SA在植物抵抗高温胁迫过程中的生理功能及其作用机理,为提高杜鹃花耐热性提供一定的栽培措施,并进一步为SA作为抗热诱导剂在观赏植物上的推广应用提供理论依据,同时节省温室栽培观赏植物能源消耗。
1材料与方法
供试西洋杜鹃品种为‘粉珍珠’,购自辽宁丹东市,均为生长健壮、长势一致的3年生优良盆栽苗,苗高28~30 cm、冠幅18~21 cm,塑料盆上口径23 cm、下口径20 cm、高17 cm,栽培基质为V(泥炭)∶V(松针)=1∶2。
试验采用人工模拟气候鉴定法,于2015年7—8月份在西北农林科技大学园林实验室连续进行。
将苗圃中的西洋杜鹃‘粉珍珠’品种移到人工气候箱(BIC-400)25 ℃/17 ℃(14 h/10 h,昼/夜)的条件下预处理7 d,第8天进行SA喷施处理,SA溶液浓度分别为0.05、0.10、0.15、0.20 μmol·L-1,连续喷施3 d后进行38 ℃/30 ℃(14 h/10 h,昼/夜)高温胁迫6 d。以清水作对照,喷施程度以叶片上液体欲滴为标准,共5个处理,每个处理8株,3次重复。试验组与对照组除温度不同外,光照和水分状况一致。气候箱光照度为150 μmol·m2·s-1,湿度为80%,为减轻高温引起的水分胁迫伤害,高温处理期间不定时地进行补水保湿。在高温胁迫处理0 d和6 d后,从不同方位取植株叶片观察其受害表现、测定生理生化指标和叶片解剖结构的变化,同时将试验组植株转入对照组条件下进行恢复生长。恢复生长20 d后,取材进行生理生化指标的测定。
形态学表现:试验期间每天对植株生长状况进行观察,并对幼苗的高温伤害程度进行分级记录。参考汪蓉[11]的分级标准制定以下评定标准(表1)。

表1 高温胁迫下西洋杜鹃植株表型热害等级
生理学指标测定:叶绿素质量分数测定采用80%丙酮提取法[12];MDA质量摩尔浓度测定采用硫代巴比妥酸法[13]。H2O2质量摩尔浓度和可溶性蛋白质量分数测定利用试剂盒(南京,建成生物工程研究所)进行提取。SOD活性测定采用氮蓝四唑(NBT)还原法[14]。POD活性测定采用愈创木酚法[15]。
解剖结构观察:在高温胁迫前和胁迫6 d之后,采样进行叶片超微结构观察。08:00—10:00,选取处理和对照植株从茎段开始数的第3片叶,将其迅速切成3 mm×3 mm,用4%的戊二醛固定,4 ℃条件下过夜,磷酸缓冲液(0.10 mol·L-1,pH=6.8)漂洗4次,30%、50%、70%、80%、90%、100%乙醇依次脱水,乙酸异戊酯置换后,用CO2临界点干燥仪(K-850)进行干燥,离子溅射仪(E-1045)喷金,再用JSM-6360LV扫描电镜进行观察。在放大300倍电镜下随机寻找8个视野统计气孔张开个数和总个数,并测量20个张开气孔的长和宽,计算孔径。同时,观察叶柄维管束排列情况。
数据处理:用Microsoft Excel 2010软件对试验数据进行处理,进一步用SPSS 22.0软件进行方差分析,采用Duncan’s进行多重比较(α=0.05)。
2结果与分析
2.1SA对热胁迫下植株形态学的影响
植物在高温胁迫下,其生长形态会发生一系列的变化,叶片黄化,逐渐变褐、枯萎、脱落,继而出现整株萎蔫,甚至死亡等现象。由图1和表2可知,高温胁迫下,植株生长状况受到一定的抑制,表现出不同程度的受害症状。并且,随着胁迫时间的延长,植株受害程度逐渐加深,但在恢复生长20 d后,植株生长有些改善。不同浓度水杨酸处理植株受害程度存在差异。但经水杨酸预处理后,植株受损程度明显低于未经水杨酸预处理的植株,尤以0.05 μmol·L-1SA处理植株受损程度最小,不仅在胁迫期间受损程度仅为II级,且恢复生长20 d后植株的伤害率也最低,仅为12.5%。而未经水杨酸处理的植株在高温胁迫6 d后,整体植株近80%叶片褐化,并有脱落现象,整体植株萎蔫,受损等级达V级,经20 d恢复后,植株伤害率仍最高,达25.0%。经0.10 μmol·L-1SA和0.15 μmol·L-1SA处理的表现相近,20 d恢复生长后,伤害率为16.7%,经0.20 μmol·L-1SA处理的伤害率为20.8%。

图1 高温胁迫下西洋杜鹃不同等级热害表现
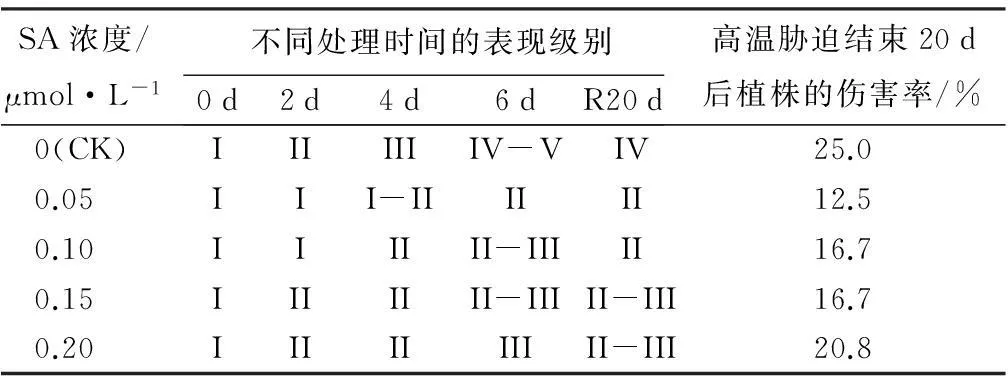
SA浓度/μmol·L-1不同处理时间的表现级别0d2d4d6dR20d高温胁迫结束20d后植株的伤害率/%0(CK)IIIIIIIV-VIV25.00.05III-IIIIII12.50.10IIIIII-IIIII16.70.15IIIIIII-IIIII-III16.70.20IIIIIIIIII-III20.8
注:R20 d表示恢复生长20 d后。
2.2SA对热胁迫下植株叶片生理特性的影响
2.2.1SA对热胁迫下叶片叶绿素质量分数的影响
从表3可知,未经SA处理的西洋杜鹃叶片中的叶绿素a、总叶绿素、类胡萝卜素质量分数呈现逐渐下降的趋势,叶绿素b质量分数则在高温胁迫2 d后和恢复生长20 d后较前一次测定有小幅度的上升。经SA预处理后的植株,其色素质量分数均高于未经处理的植株,但不同浓度的SA对色素质量分数的影响存在差异。由表3叶绿素a质量分数变化可知,在胁迫期或者恢复生长后,经0.20 μmol·L-1SA预处理的植株叶绿素a质量分数均显著高于对照的(P<0.05),分别比同时期对照的叶绿素质量分数高出13.3%、19.9%、20.0%、16.4%和20.6%,而经0.05 μmol·L-1SA处理的叶绿素a质量分数仅在恢复生长后显著高于对照(P<0.05)。此外,经0.15 μmol·L-1SA处理的植株在恢复生长20 d后叶绿素a质量分数显著增加。从叶绿素b质量分数变化中可以看出,高温胁迫前,经不同浓度的SA处理均显著提高叶绿素b的质量分数,以0.20 μmol·L-1SA处理对叶绿素b质量分数增加幅度最高,达53.1%。高温胁迫6 d后及恢复生长20 d后,不同浓度SA处理对叶绿素b质量分数的影响无显著差异,但显著高于对照。在总叶绿素质量分数中,较高浓度的水杨酸处理更有利于抑制叶绿素质量分数的降低。从类胡萝卜素质量分数可看出,高温胁迫后,经0.10 μmol·L-1SA处理的植株类胡萝卜素质量分数下降的最多,为32.7%,但其质量分数仍高于对照。
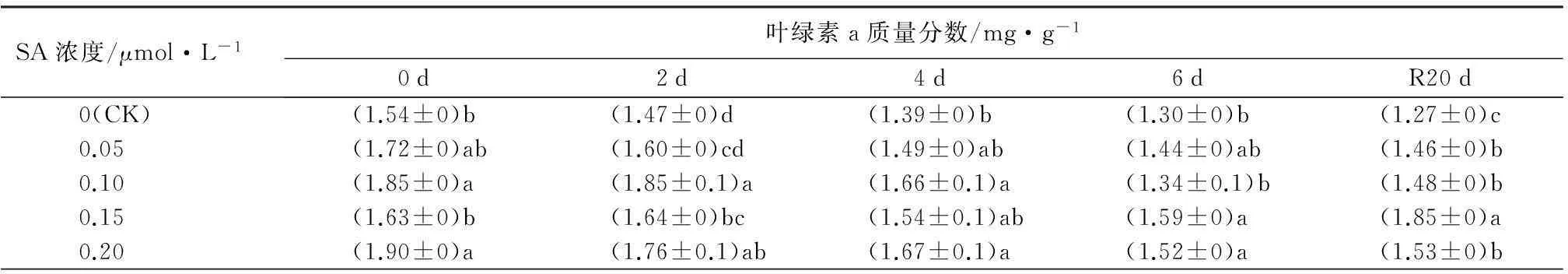
表3 SA对高温胁迫下西洋杜鹃叶片生理指标的影响
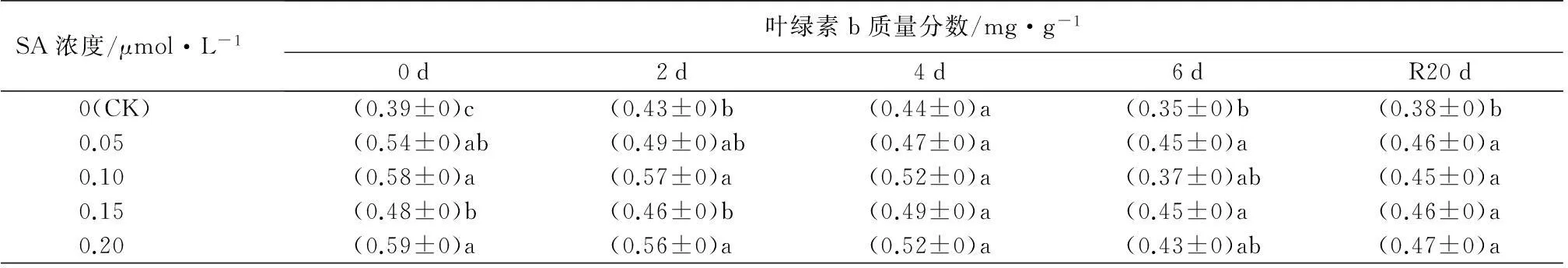
SA浓度/μmol·L-1叶绿素b质量分数/mg·g-10d2d4d6dR20d0(CK)(0.39±0)c(0.43±0)b(0.44±0)a(0.35±0)b(0.38±0)b0.05(0.54±0)ab(0.49±0)ab(0.47±0)a(0.45±0)a(0.46±0)a0.10(0.58±0)a(0.57±0)a(0.52±0)a(0.37±0)ab(0.45±0)a0.15(0.48±0)b(0.46±0)b(0.49±0)a(0.45±0)a(0.46±0)a0.20(0.59±0)a(0.56±0)a(0.52±0)a(0.43±0)ab(0.47±0)a

SA浓度/μmol·L-1总叶绿素质量分数/mg·g-10d2d4d6dR20d0(CK)(1.93±0)c (1.90±0)b(1.83±0)b (1.65±0)c (1.65±0.1)c0.05(2.25±0)ab(2.09±0)b(1.96±0)ab(1.89±0)ab(1.91±0)b0.10(2.43±0)a(2.41±0.1)a(2.18±0.1)a(1.71±0.1)bc(1.93±0)b0.15(2.11±0.2)bc(2.10±0)b(2.03±0.1)ab(2.04±0)a(2.31±0)a0.20(2.49±0)a(2.32±0.1)a(2.19±0.1)a(1.94±0)a(2.00±0)b
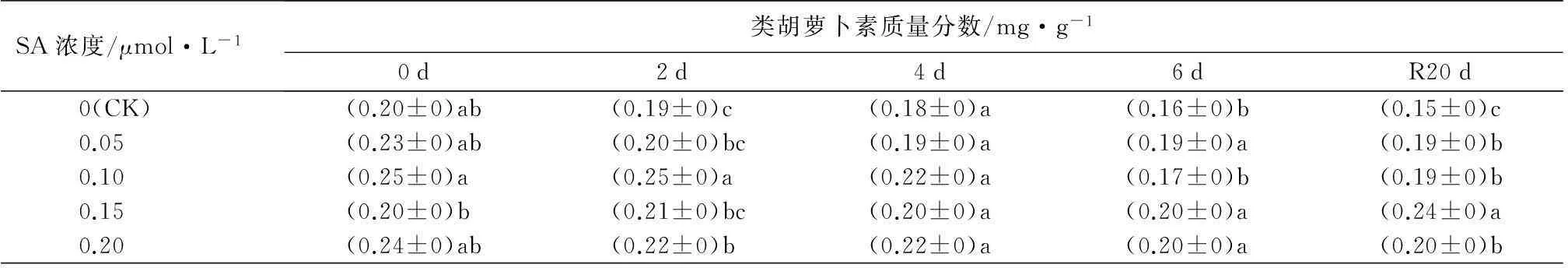
SA浓度/μmol·L-1类胡萝卜素质量分数/mg·g-10d2d4d6dR20d0(CK)(0.20±0)ab(0.19±0)c(0.18±0)a(0.16±0)b(0.15±0)c0.05(0.23±0)ab(0.20±0)bc(0.19±0)a(0.19±0)a(0.19±0)b0.10(0.25±0)a(0.25±0)a(0.22±0)a(0.17±0)b(0.19±0)b0.15(0.20±0)b(0.21±0)bc(0.20±0)a(0.20±0)a(0.24±0)a0.20(0.24±0)ab(0.22±0)b(0.22±0)a(0.20±0)a(0.20±0)b
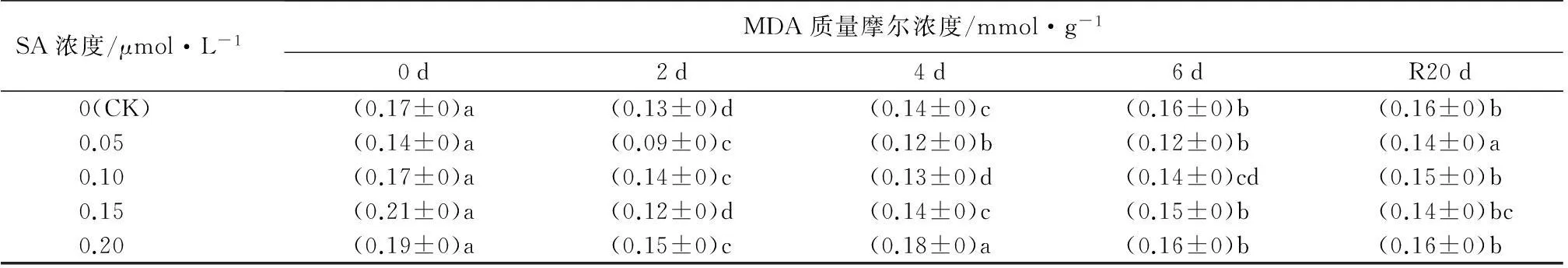
SA浓度/μmol·L-1MDA质量摩尔浓度/mmol·g-10d2d4d6dR20d0(CK)(0.17±0)a(0.13±0)d(0.14±0)c(0.16±0)b(0.16±0)b0.05(0.14±0)a(0.09±0)c(0.12±0)b(0.12±0)b(0.14±0)a0.10(0.17±0)a(0.14±0)c(0.13±0)d(0.14±0)cd(0.15±0)b0.15(0.21±0)a(0.12±0)d(0.14±0)c(0.15±0)b(0.14±0)bc0.20(0.19±0)a(0.15±0)c(0.18±0)a(0.16±0)b(0.16±0)b

续(表3)

SA浓度/μmol·L-1SOD活性/U·g-10d2d4d6dR20d0(CK)(331.90±4.6)b(344.90±0.8)a(320.29±1.6)c(305.09±8.8)b(314.22±1.7)c0.05(340.65±3.8)ab(353.18±2.7)a(343.81±2.7)a(330.43±3.7)a(343.58±4.0)ab0.10(347.26±0.5)a(352.71±4.2)a(342.70±1.4)a(328.15±3.6)a(335.30±6.1)ab0.15(348.61±4.5)a(343.54±2.4)a(332.17±1.4)b(330.51±3.3)a(350.91±5.5)a0.20(342.15±2.9)ab(350.13±2.8)a(327.86±1.3)b(324.32±0.6)a(334.33±5.6)b
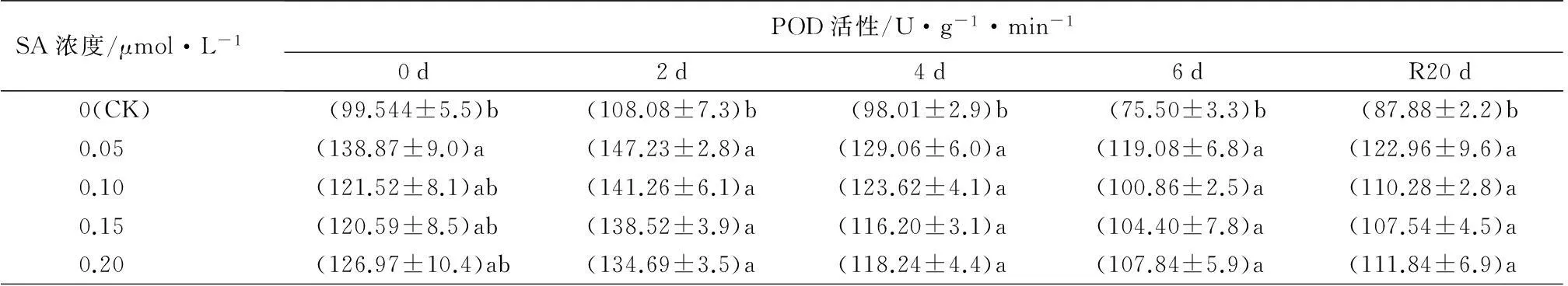
SA浓度/μmol·L-1POD活性/U·g-1·min-10d2d4d6dR20d0(CK)(99.544±5.5)b(108.08±7.3)b(98.01±2.9)b(75.50±3.3)b(87.88±2.2)b0.05(138.87±9.0)a(147.23±2.8)a(129.06±6.0)a(119.08±6.8)a(122.96±9.6)a0.10(121.52±8.1)ab(141.26±6.1)a(123.62±4.1)a(100.86±2.5)a(110.28±2.8)a0.15(120.59±8.5)ab(138.52±3.9)a(116.20±3.1)a(104.40±7.8)a(107.54±4.5)a0.20(126.97±10.4)ab(134.69±3.5)a(118.24±4.4)a(107.84±5.9)a(111.84±6.9)a
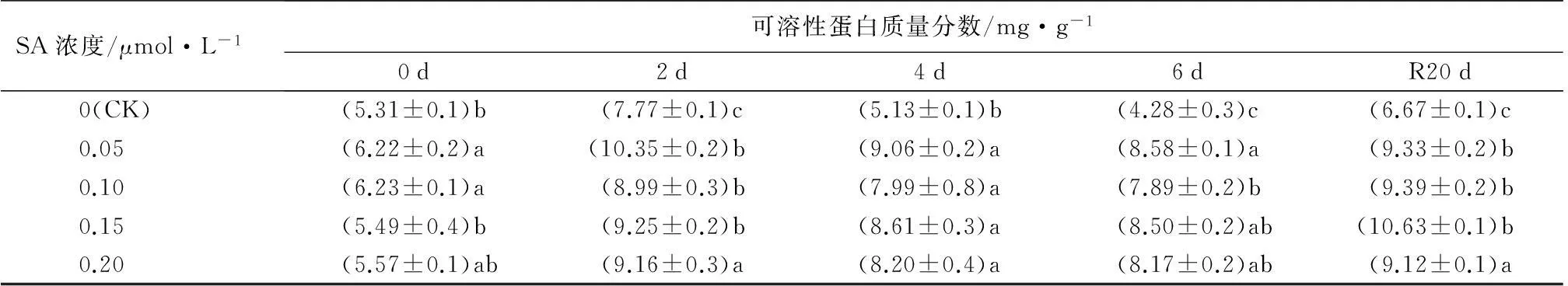
SA浓度/μmol·L-1可溶性蛋白质量分数/mg·g-10d2d4d6dR20d0(CK)(5.31±0.1)b(7.77±0.1)c(5.13±0.1)b(4.28±0.3)c(6.67±0.1)c0.05(6.22±0.2)a(10.35±0.2)b(9.06±0.2)a(8.58±0.1)a(9.33±0.2)b0.10(6.23±0.1)a(8.99±0.3)b(7.99±0.8)a(7.89±0.2)b(9.39±0.2)b0.15(5.49±0.4)b(9.25±0.2)b(8.61±0.3)a(8.50±0.2)ab(10.63±0.1)b0.20(5.57±0.1)ab(9.16±0.3)a(8.20±0.4)a(8.17±0.2)ab(9.12±0.1)a
注:表中数据根据叶片鲜质量测得;表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05);R20 d表示恢复生长20 d后。
2.2.2SA对热胁迫下叶片丙二醛和过氧化氢质量摩尔浓度的影响
从表3可以看出,未经SA处理的植株高温胁迫期间,MDA和H2O2质量摩尔浓度总体呈现先下降后上升的趋势,且均在胁迫2 d后MDA质量摩尔浓度下降到最低水平。恢复生长20 d后,两者较胁迫前均有所下降,但仍高于对照。表明热胁迫下西洋杜鹃叶片中活性氧物质积累。经不同浓度SA处理后的植株两者质量摩尔浓度均显著低于未经SA处理的植株(P<0.05),尤以0.05 μmol·L-1SA处理最为显著,高温胁迫前较对照下降幅度分别为24.9%和25.7%,胁迫6 d后分别低于对照44.8%和31.7%。
2.2.3SA对热胁迫下叶片可溶性蛋白质量分数的影响
从表3可以看出,各处理条件下,西洋杜鹃叶片中可溶性蛋白质量分数在高温胁迫下呈现先上升后下降的趋势,高温胁迫2 d后均大幅增加,随着胁迫时间延长而下降,恢复20 d后有所升高。经SA处理的植株可溶性蛋白质量分数在高温胁迫后均显著高于未经SA处理的植株(P<0.05)。高温胁迫期间,0.05 μmol·L-1SA表现最佳,其处理下的可溶性蛋白质量分数均高于其他处理。恢复生长20 d后,经0.15 μmol·L-1SA处理的植株中可溶性蛋白质量分数达到最高,为10.63 mg·g-1,显著高于对照59.20%(P<0.05)。
2.2.4SA对热胁迫下叶片抗氧化酶活性的影响
SOD和POD是生物有机体抵御活性氧伤害的重要保护酶。由表3可知,西洋杜鹃叶片的SOD和POD活性随胁迫时间的延长呈先增加后降低的趋势,SOD和POD活性均在热胁迫2 d后达到最高,且经0.05 μmol·L-1SA处理的最好,较未经SA处理的植株分别高2.4%和36.2%,高温胁迫6 d后,SOD活性较胁迫前下降8.0%,经20 d恢复生长,SOD活性上升到胁迫前的1.0%。POD活性在高温胁迫后,经SA处理的植株POD活性均显著高于对照(P<0.05),但不同浓度处理间无显著差异。
2.3SA对热胁迫下植株叶片解剖结构的影响
叶片作为植物的功能器官,其下表皮气孔大小、密度及开度可一定程度反映其对生态环境变化的情况。由表4可知,高温胁迫前,气孔的密度、宽度和面积在不同处理条件下无显著差异(P>0.05),而经0.15 μmol·L-1SA处理的植株气孔张开度显著高于经0、0.10、0.20 μmol·L-1SA处理的植株(P<0.05),经0.10 μmol·L-1SA处理的植株在气孔长度上显著高于其他处理的。高温胁迫后,气孔大小、气孔张开度和气孔密度在不同处理条件下变化结果不一致。从表4和图2可看出,未经SA处理的植株气孔密度、气孔张开度和气孔面积均有不同的变化,以0.10 μmol·L-1SA处理气孔密度上升幅度最大,为21.20%,气孔面积下降幅度最大,为27.20%,且气孔张开度在胁迫前和胁迫后都为处理间变化最小的;经0.05 μmol·L-1SA处理在高温胁迫后气孔密度最大,为106.57个·mm-2;经0.20 μmol·L-1SA预处理的植株气孔密度最小,显著低于经0.05和0.10 μmol·L-1SA处理的植株(P<0.05);经0.20 μmol·L-1SA处理对气孔张开度、气孔大小和气孔的面积均呈现出不同程度的影响水平。另外,高温胁迫使得叶柄横断面维管束中导管细胞直径变小(图2C、F)。

表4 水杨酸对高温胁迫下西洋杜鹃叶片气孔的影响
注:表中数据为平均值±标准差;同列不同小写字母表示处理间差异显著(P<0.05)。

A、B、C.25 ℃/17 ℃(昼/夜)条件下叶片气孔和维管束状态;D、E、F.38 ℃/30 ℃(昼/夜)条件下叶片气孔和维管束状态。
图2高温胁迫对西洋杜鹃叶片气孔和叶柄维管束形态的影响
3结论与讨论
外源SA可有效减轻高温胁迫对植株造成的危害,如抑制MDA和H2O2质量摩尔浓度的增加,诱导抗氧化酶活性增强,使得渗透调节物质质量分数增加,维持细胞膜稳定性等。本研究表明,随着高温胁迫时间的延长,植株叶片出现褐化、萎蔫等热害症状,叶绿素质量分数逐渐降低,MDA和H2O2质量摩尔浓度呈现先下降后上升的趋势,可溶性蛋白质量分数及抗氧化酶活性变化趋势则相反。此外,高温胁迫影响了叶片气孔的密度、张开度等,这与前人对铁皮石斛的研究结论一致[16]。通过SA诱导西洋杜鹃耐热性的效应分析表明,喷施SA浓度不同,其作用效果存在差异。本研究中,通过统计不同SA浓度对热胁迫下西洋杜鹃的热害等级,发现外源SA喷施浓度为0.05~0.20 μmol·L-1时均能提高热胁迫下植株的耐热性,尤以SA低浓度0.05 μmol·L-1处理效果最好,这与向地英等[17]对菊花耐热性的研究和何亚丽等[8]对高羊茅耐热性研究结论一致,即较低浓度的水杨酸更有利于提高植株的耐热性,且更有利于植株热胁迫后的恢复。
高温胁迫可能会引起植物膜脂过氧化,叶绿体结构受损,进而使得叶绿素质量分数降低。本试验发现,叶绿素a、总叶绿素和类胡萝卜素质量分数随着胁迫时间的延长,其质量分数随之降低;而叶绿素b质量分数在热胁迫0~4 d时逐渐上升,处理6 d后下降。但所有色素质量分数经20 d恢复后,下降程度降低或者略有回升。这与郑宇等[18]对西洋杜鹃其他品种热胁迫处理时结论一致。高温胁迫下叶绿素质量分数降低主要原因有两个,一是热胁迫使得活性氧物质累积,损害生物膜,破坏叶绿体等结构,导致叶绿素质量分数降低;二是高温使得植物叶绿素生物合成的中间产物氨基酮戊酸和原卟啉IX的生物合成受到影响,进而使得叶绿素生成量减少[19]。不同浓度SA处理一定程度上延缓叶绿素质量分数的降低甚至增加叶绿素的质量分数,这可能是因为SA作为信号分子,参与或调控了叶绿素生物合成的过程,但相关调控过程还有待进一步研究和论证。也可能是外源SA抑制了活性氧类物质MDA和H2O2质量摩尔浓度的增加。本试验研究结果发现,经不同浓度SA处理后,西洋杜鹃叶片中的MDA和H2O2质量摩尔浓度随着胁迫时间的延长呈现先下降后缓慢上升的趋势,在热胁迫2 d后,两者质量摩尔浓度均达到最小值且显著低于对照,这与Deya[20]研究结果一致。其中经0.05 μmol·L-1SA处理的MDA和H2O2质量摩尔浓度最低,可以有效降低高温胁迫下西洋杜鹃叶片中MDA和H2O2的累积,降低膜脂过氧化水平,维持细胞膜稳定性,提高植物的耐热能力。同时,植物体内存在自身抗氧化酶系统清除逆境条件下形成的过量活性氧,降低脂质过氧化水平,改善细胞代谢,以保护细胞膜免受氧化伤害。SA作为信号分子,可激活多种与胁迫相关的基因启动子[4],通过调节相关的活性氧、抗氧化体系而提高植物的抗逆性,抵御非生物胁迫。本研究中,外源SA在高温胁迫前增加了SOD和POD的活性,且抑制了SOD和POD活性随高温胁迫时间的延长而降低的程度,尤以0.05 μmol·L-1SA处理组的抗氧化酶活性最强。这可能是高温胁迫下西洋杜鹃植株的质膜化氧化程度降低,增强植株抗热性的原因。大量的有关SA增强热胁迫下植物抗氧化能力的研究证实了这一点。例如,经SA预处理可以有效激活油麦幼苗盐胁迫下SOD的活性,减小膜脂过氧化程度[21];孙军利等[22]利用外源水杨酸对高温胁迫下葡萄幼苗膜脂过氧化及抗氧化酶活性进行研究,发现外源SA促进抗氧化酶SOD、POD、CAT等的活性,显著降低了MDA的质量摩尔浓度,缓解了高温胁迫。
可溶性蛋白作为植物细胞内一种重要的渗透调节物质,对植株的代谢及生长发育有重要的作用,且植物的抗热性与蛋白质的合成和降解速率有关。由于其具有较强的亲水性,高温胁迫下可溶性蛋白增加有利于保持胞内水分平衡。本研究结果发现,可溶性蛋白质量分数随高温胁迫时间的延长呈现先升高后降低的趋势,并在高温胁迫2 d后达到最高,这可能与植物突然处于高温环境中诱导抗氧化系统抵御逆境胁迫有关。这与郑宇等[18]对西洋杜鹃其他品种高温胁迫表现一致。但关于高温胁迫下植物叶片中可溶性蛋白质量分数的变化存在争议。有结果表明,高温胁迫下可溶性蛋白质量分数下降[23],也有结果发现其质量分数增加[24]。经不同浓度SA处理后,可溶性蛋白质量分数显著高于对照,尤以0.05 μmol·L-1处理最高,但在恢复20 d生长后,以0.15 μmol·L-1处理可溶性蛋白质量分数最高,显著高于其他处理。这也与易小林等[25]研究结果一致。
高温胁迫除影响植物形态和生理生化水平变化外,还会引起植物细胞解剖结构的变化。叶片作为植物进行光合作用和呼吸作用的主要器官,与周围环境联系紧密,其中气孔密度、大小和张开度等可以一定程度反映该植物抵御逆境胁迫的能力[26]。本试验研究发现,未用SA处理的植株,高温胁迫使得气孔密度、气孔张开度、气孔宽度和面积均下降,这说明植株会通过调节气孔开合等来响应热胁迫。因此,气孔密度、气孔张开度及气孔长宽等可作为杜鹃耐热性叶叶片结构鉴定指标,这与容丽等[27]研究结果一致。高温胁迫后,除经高浓度0.20 μmol·L-1SA处理的植株气孔密度降低、气孔张开度升高;0.15 μmol·L-1SA处理使得气孔密度小幅度增高外,其他处理则呈现相反的变化。由此说明,0.05、0.01 μmol·L-1SA预处理植株对提高植株耐热性有一定的积极效应,通过增加气孔密度、减小气孔开度和面积,可有效地保持吸收和保持水分,并组织水分过度蒸发,保证叶片在高温胁迫下进行光合作用的水分供给,防止脱水对植物造成伤害。但是,植物自身抵御热胁迫和SA预处理提高植株耐热性的机制还有待进一步研究。
综上所述,随着高温胁迫时间延长,植株在形态学、生理特性和解剖学方面会发生一系列变化,受到一定程度的损害。低浓度SA预处理可以抑制叶片中叶绿素和可溶性蛋白质量分数降低,缓解MDA和H2O2摩尔质量浓度累积,诱导SOD和POD抗氧化酶活性增强,并通过调节气孔密度、张开度和面积进一步提高西洋杜鹃的耐热性。外源SA(0.05 μmol·L-1)对西洋杜鹃缓解热胁迫具有实践应用价值,其机理还有待进一步研究。
参考文献
[1]王守中.西洋杜鹃[M].上海:上海文化出版社,1984.
[2]CHEN W L, YANG W J, LO H F, et al.Physiology, anatomy, and cell membrane thermostability selection ofleafy radish (Raphanus sativus var.oleiformis Pers.) with different tolerance under heat stress[J].Scientia Horticulturae,2014,179:367-375.
[3]IQBALM,HUSSAINI,LIAQATH,etal.Exogenouslyappliedseleniumreducesoxidativestressandinducesheattoleranceinspringwheat[J].PlantPhysiologyandBiochemistry,2015,94:95-103.
[4]BORSANI O, VALPUESTA V, BOTELLA M A.Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress in Arabidopsis seedlings[J].Plant Physiology,2001,126(3):1024-1030.
[5]RANJEET R K, SUSHIL K S, SUNEHA G, et al.Salicylic acid alleviates the heat stress-induced oxidative damage of starch biosynthesis pathway by modulating the expression of heat-stable genes and proteins in wheat (Triticum aestivum)[J].Acta Physiology Plant,2015,37 (8):143.
[6]王桂林,范伟国,彭福田.桃树淹水及不同时间喷布水杨酸的生理响应[J].果树学报,2015,32(5):872-878.
[7]MANAA A, GHARBI E, MIMOUNI H, et al.Simultaneous application of salicylic acid and calcium improves salt tolerance in two contrasting tomato (Solanum lycopersicum) cultivars[J].South African Journal of Botany,2014,95:32-39.
[8]何亚丽,刘友良,陈权,等.水杨酸和热锻炼诱导的高羊茅幼苗的耐热性与抗氧化的关系[J].植物生理与分子生物学学报,2002,28(2):89-95.
[9]ZHAO B, YIN Z F, XU M, et al.AFLP analysis of genetic variation in wild populations of five Rhododendron species in Qinling Mountain in China[J].Biochemical Systematics and Ecology,2012,45:198-205.
[10]耿兴敏,祝遵凌,李敏,等.杜鹃花属植物扦插繁殖研究进展[J].中国野生植物资源,2011,30(6):1-6.
[11]汪蓉.抗热剂对马缨杜鹃抗热性的影响研究[D].广州: 仲恺农业工程学院,2014.
[12]LICHTENTHALER H K.Chlorophylls and carotenoids: pigments of photosynthetic biomembranes[J].Methods in Enzymology,1987,148:350-382.
[13]MADHAVA R K V, SRESTY T V S.Antioxidative parameters in the seedlings of pigeonpea (Cajanus cajan (L.) Millspaugh) in response to Zn and Ni stresses[J].Plant Science,2000,157(1):113-128.
[14]GIANNOPOLITIS C N, RIES S K.Superoxide dismutases: I.Occurrence in higher plants[J].Plant Physiology,1977,59:309-314.
[15]CHANCE B, MAEHLY A C.Assay of catalase and peroxidases[J].Methods Enzymol,1955,11:764-775.
[16]杨岚,师帅,王红娟,等.水杨酸对高温胁迫下铁皮石斛幼苗耐热性的影响[J].西北植物学报,2013,33(3):534- 540.
[17]向地英,李云,杨会苗,等.水杨酸对菊花耐热性的影响[J].江苏农业科学,2015,43(9):222-224.
[18]郑宇,何天友,陈凌艳,等.高温胁迫下西洋杜鹃的生理响应及耐热性[J].福建林学院学报,2012,32(4):326-335.
[19]赵冰,付玉梅,丁惠惠,等.Ca2+处理对秦岭高山杜鹃耐热性的影响[J].西北林学院学报,2010,25(6):29-32.
[20]DEYA E M R.Salicylic acid induced alleviation of oxidative stress caused by clethodim in maize (Zea mays L.) leaves[J].Pesticide Biochemistry and Physiology,2012,102(2):182-188.
[21]XU Q, XU X, ZHAO Y, et al.Salicylic acid, hydrogen peroxide and calcium-induced saline tolerance associated with endogenous hydrogen peroxide homeostasis in naked oat seedlings[J].Plant Growth Regulation,2008,54(3):249-259.
[22]孙军利,赵宝龙,郁松林.外源水杨酸对高温胁迫下葡萄幼苗膜脂过氧化及抗氧化酶活性的影响[J].石河子大学学报(自然科学版),2015,33(3):275-280.
[23]GULEN H, ERIS A.Effects of heat stress on peroxidase activity and total protein content in strawberry plants[J].Plant Science,2004,166(3):739-744.
[24]张乐华,周广,孙宝腾,等.高温胁迫对两种常绿杜鹃亚属植物幼苗生理生化特性的影响[J].植物科学学报,2011,29(3):362-369.
[25]易小林,李名扬,池浩,等.水杨酸缓解干旱、高温及双重胁迫下对紫御谷内源激素及渗透调节物质的影响[J].西南大学学报(自然科学版),2014,36(2):62-67.
[26]MAELI M, WILLIAM U, JESSICA K, et al.Plant stomata function in innate immunity against bacterial invasion[J].Cell,2006,126(5):969-980.
[27]容丽,陈训,汪小春.百里杜鹃杜鹃属13种植物叶片解剖结构的生态适应性[J].安徽农业科学,2009,37(3):1084-1088.
第一作者简介:申惠翡,女,1991年10月生,西北农林科技大学风景园林艺术学院, 硕士研究生。E-mail:shenhf1113@163.com。 通信作者:赵冰,西北农林科技大学风景园林艺术学院,副教授。E-mail:bingbing2003915@163.com。
收稿日期:2016年1月7日。
分类号S685.21;Q945.78
Effects of Exogenous Salicylic Acid on Heat-resistance of Rhododendron hybridum//
Shen Huifei, Zhao Bing, Xu Jingjing, Huang Wenmei, Li Houhua(Northwest Agriculture & Forestry University, Yangling 712100, P.R.China)//
Journal of Northeast Forestry University,2016,44(7):40-45,50.
We discussed the effects of different concentrations of salicylic acid (SA) on heat resistance of Rhododendron ‘Fen Zhen Zhu’ under high temperature stress from performance in morphology, the level of membrane lipid peroxidation, osmotic regulation substances and antioxidant enzyme activity, and the change of leaf anatomical structure with 3-year old R.‘Fen Zhen Zhu’, and sprayed 0 (CK), 0.05, 0.1, 0.15, 0.2 μmol·L-1salicylic acid solution on the leaves and combined with the thermal stress (38 ℃/30 ℃, day/night) by using plant growth chamber.The treated plants can effectively alleviate the high temperature damage along with the increase of heat stress time, alleviate effectively the decrease of chlorophyll by 0.15-0.20 μmol·L-1SA, improve significantly SOD and POD activities and inhibit the increase of MDA and H2O2in leaves treated by 0.05 μmol·L-1SA pretreatment, increase the accumulation of total soluble protein, and show significant difference between the different concentrations.Treated leaves of 0.05-0.10 μmol·L-1SA have a positive effect on the increase of stomata density, the decrease of stomata open percentage and aperture.Therefore, the plants treated by suitable concentrations of SA can effectively alleviate the high temperature damage with the heat stress treatment time, and improve heat resistance of R.‘Fen Zhen Zhu’, especially 0.05 μmol·L-1SA has the best treatment effect.
KeywordsRhododendron hybridum; Salicylic acid; High temperature; Heat resistance
1)国际科技合作基金项目(A213021501)。
责任编辑:任俐。

