桑树花青素合成相关MYB类转录因子的鉴定与功能分析
李 军,赵爱春,刘长英,吕蕊花,刘晓清,余茂德*
(1 贵阳中医学院 贵阳 550025;2 西南大学 生物技术学院,重庆 400715)
桑树花青素合成相关MYB类转录因子的鉴定与功能分析
李军1,赵爱春2,刘长英2,吕蕊花2,刘晓清1,余茂德2*
(1 贵阳中医学院 贵阳 550025;2 西南大学 生物技术学院,重庆 400715)
摘要:该研究通过生物信息学方法,从桑树基因组中获得了8个花青素生物合成调控关键转录因子(MYB)候选基因,利用转录组数据及实时荧光定量PCR技术,分析了各基因在不同组织及果实发育过程中的表达。聚类分析结果显示,4个MYB基因与葡萄、水稻和玉米花青素调控相关MYB基因聚为一类,仅1个MYB基因与拟南芥、苹果花青素调控相关MYB基因聚为一类。转录组数据显示多数基因在雄花中高水平表达。实时荧光定量PCR结果表明,2个MYB基因(MnMYBJ和MnMYB4)在果实发育过程中持续下调,1个MYB基因(MnMYB330)在果实发育过程中显著上调,分别与花青素在桑椹中的积累成负相关和正相关关系。因此,桑树MYB基因家族对花青素的积累可能存在正调控与负调控两种机制。
关键词:桑树;花青素;转录因子;调控;表达分析
花青素是一类广泛存在于植物中的水溶性色素,属于酚类化合物中的类黄酮[1]。花青素的结构母核由2个苯环和1个含氧芳香环构成,2-苯基苯并吡喃阳离子环上各碳位的-OH或-OCH3取代基的数量和位置决定了花青素的类型[2]。花青素含量较高的水果主要有蓝莓、桑椹、葡萄等,其中桑椹中花青素含量为鲜重5.768 mg/g[3],比葡萄鲜果(0.059 mg/g)[4]、蓝莓鲜果(0.25~4.38 mg/g)[5]高出许多。Hassimotto等[6]与Kang等[7]先后证明了桑椹花青素提取物对于卡拉胶引起的急性炎症反应具有较好的抑制作用。桑椹花青素能够抑制糖尿病小鼠的胰岛退化及膀胱功能紊乱[8]。桑椹花青素提取物可抑制肥胖小鼠不饱和脂肪酸诱导的脂肪合成、增强肝脏中脂肪氧化相关基因的表达并增加脂肪清除能力,从而抑制脂肪在肝脏中的积累[9-10]。
花青素在桑椹中的积累依赖于其生物合成途径及调控机制。 植物花青素生物合成途径是目前研究较多且最清楚的次生代谢途径之一,属于是类黄酮代谢途径的一个重要分支,以苯丙氨酸为起始底物,经花青素合成酶(ANS)等关键酶的作用下生成花色苷,最后经过糖基化修饰形成花青素[1]。目前本研究小组已经完成桑树花青素生物合成的关键酶基因的鉴定和功能分析[11],对调控机制的研究尚处于起步阶段。花青素生物合成及色素积累受到植物内部因子(如营养水平、生长发育等)以及环境因子(如光、温度以及病原感染等)的协同作用,其中光和温度是主要的调控因素[12]。研究表明MYB类转录因子(尤其是R2R3-MYB)是多种信号传导的末端响应蛋白,直接参与调控花青素生物合成关键酶的表达水平。MYB10和MYBA是蔷薇目植物苹果、梨及草莓花青素合成的调控因子[13]。玉米中MYB基因C1调控花青素的合成,是草本植物研究花青素生物合成的经典模型[14]。本研究通过生物信息学方法从桑树基因组中鉴定花青素合成相关的MYB基因家族成员,通过转录组数据及实时荧光定量PCR技术研究MYB基因的表达模式,分析这些基因与桑椹花青素积累关系,为探索桑树花青素生物合成的调控机理奠定基础。
1材料和方法
1.1材料
2014年3~5月份于西南大学桑树资源圃摘取桑品种(‘嘉陵30号’)6个时期(盛花后0、1、2、3、4和5周)的果实,分别标示为时期S0~S5,用液氮速冻后保存于-80 ℃冰箱中备用。质粒载体pMD19-T、TaKaRa ExTaq酶、反转录酶M-MLV、RNAiso Plus试剂盒、DNase Ⅰ、DL 2000 DNA Marker等购自宝生物工程(大连)有限公司,大肠杆菌(Escherichiacoli)菌株DH5α购自天根生化科技(北京)有限公司。引物由南京金斯瑞公司合成。
1.2方法
1.2.1桑树MYB基因家族成员的鉴定从NCBI下载花青素合成相关MYB基因(苹果MdMYB10、MdMYB110a和MdMYBA,葡萄VvMYBA,拟南芥PAP1、PAP2,玉米ZmC1)的氨基酸序列,通过BlastP程序检索桑树基因组中的预测蛋白序列,期望值为e-10。将获得的期望值较低的氨基酸序列作为query序列,检索苹果、葡萄、草莓的基因组及预测基因序列,如2次结果一致,则视为直系同源基因。
1.2.2桑树MYB基因家族的生物信息学分析及氨基酸序列比对蛋白质结构域预测在SMART (http: //smart. Embl-heidelberg.De/smart/set_mode. cgiNORMA)上进行,蛋白质基本性质分析采用ExPasy (http: // web.Expasy.Org/)。用ClustalW进行多序列比对,最后用GeneDoc对比对结果进行编辑。采用MEGA4.0软件中的邻接法(Neighbor-Joining,NJ)构建系统进化树。
1.2.3桑树花青素调控MYB基因家族的转录组表达分析转录表达数据来源于家蚕国家基因组重点实验室完成的桑树转录组测序结果,具有根、皮、冬芽、雄花和叶5个组织,根据转录组基因表达丰度RPKM值[Reads/(Fragments) Per Kilobase of exon model per Million mapped reads]衡量MYB基因在各组织中的表达水平。
1.2.4花青素总量的检测桑椹花青素提取与测量参考Rabino等[15]的方法。将-80 ℃保存的桑椹在液氮中研磨成粉,称取0.1 g粉末到2 mL离心管中,加入600 μL预冷的酸性甲醇(含1% HCl),4 ℃下提取12 h后,加入400 μL ddH2O和400 μL氯仿,充分混匀后12 000 r/min离心10 min,取上清分别检测液体在530和570 nm波长下的吸光值,花青素相对含量=A530-0.25A570。
1.2.5桑树总RNA提取及cDNA合成各取0.1 g新鲜样品于预冷的研钵中加液氮迅速研磨成粉末状,参照RNAiso抽提试剂盒(TaKaRa)操作说明提取总RNA,经DNA酶消化后用50 μL DEPC水溶解,采用1%琼脂糖凝胶电泳检测并利用紫外分光光度计测定总RNA浓度。以总RNA为模板,以Oligo(dT)15为引物,利用M-MLV反转录酶(TaKaRa)合成cDNA第1链,置-80 ℃保存备用。
1.2.6引物设计与实时荧光定量PCR检测由于花青素相关MYB基因的表达与花青素积累具有很强的相关性,且在果实发育后期有几百倍的变化,因此选取了‘嘉陵30号’4个时期(S0、S3、S4和S5)的果实来研究MYB基因家族成员表达水平,筛选与花青素合成相关的MYB基因。根据MYB基因核苷酸特异序列采用Primer 5.0分别设计8个候选基因的实时荧光定量PCR引物(表1),结果采用2-ΔCt表示。实时荧光定量PCR所用SYBR®Premix Ex TaqTM(Tli RNaseH Plus)购自TaKaRa公司,所涉及到的其余化学试剂均为国产分析纯。
2结果与分析
2.1桑树类黄酮生物合成相关MYB基因的鉴定
下载已经报道的调控花青素生物合成的MYB基因氨基酸序列,通过BlastP程序检索同源MYB基因。从桑树基因组中鉴定出8个与类黄酮生物合成相关的MYB候选基因(表2),分布于不同的scaffold上,2个基因仅1个内含子,5个基因存在2个内含子,MnMYBB有11个内含子,可能存在较复杂的剪切方式。这些基因编码261~478 个氨基酸,相对分子量大小从29.2~54.0 kD。3个MYB蛋白(MnMYB86、MnMYB11和MnMYB21)属于弱酸性蛋白质,MnMYB330等5个蛋白属于碱性蛋白质。多序列比对显示6个MYB蛋白(MnMYB308、MnMYB330、MnMYB86、MnMYB4、MnMYB11、MnMYB21)的氨基酸序列中含有保守的R2R3结构域(图1),MnMYBB与MnMYBJ与其他基因差异较大。MYB蛋白中含有5个保守的色氨酸(W)残基,MnMYBJ基因的第3个色氨酸被谷氨酸(Glu,E),MnMYBJ和MnMYB4的第4个色氨酸分别被苯丙氨酸(Phe,F)和丝氨酸(Ser,S)取代,MnMYBB与MnMYBJ的第5个色氨酸分别被酪氨酸(Tyr,Y)和甲硫氨酸(Met,M)取代,这些保守位点的突变可能与MYB蛋白的功能有一定的联系。
2.2桑树MYB基因家族的聚类分析
为了推测8个桑树MYB蛋白的功能,构建了MYB蛋白氨基酸序列的系统进化树(图2)。桑树5个MYB蛋白可分别归入2个类群,均为类黄酮合成相关MYB基因。MnMYB11、MnMYB330、MnMYB308、MnMYB86与柿子DkMyb4(DiospyroskakiThunb.,AB503701)、葡萄VvMybPA1(Vitisvinifera,NM_001281231)、水稻C1 protein(Oryzasativa,CAA75509)及玉米P(Zeamays,AAK81903)归入Group Ⅰ类。MnMYB21与拟南芥(Arabidopsisthaliana)的PAP1(NP_176057)和PAP2(NP_176813)、苹果(Malusdomestica)的MdMYB10(ACQ45201)和MdMYB110a(BAJ24837)归入Group Ⅱ类。MnMYB4、MnMYBB和MnMYBJ没有归入2个类群,与保守性位点色氨酸残基突变有较高的一致性,可能参与类黄酮生物合成以外的其他代谢路径的调控。

表1 本研究所用引物
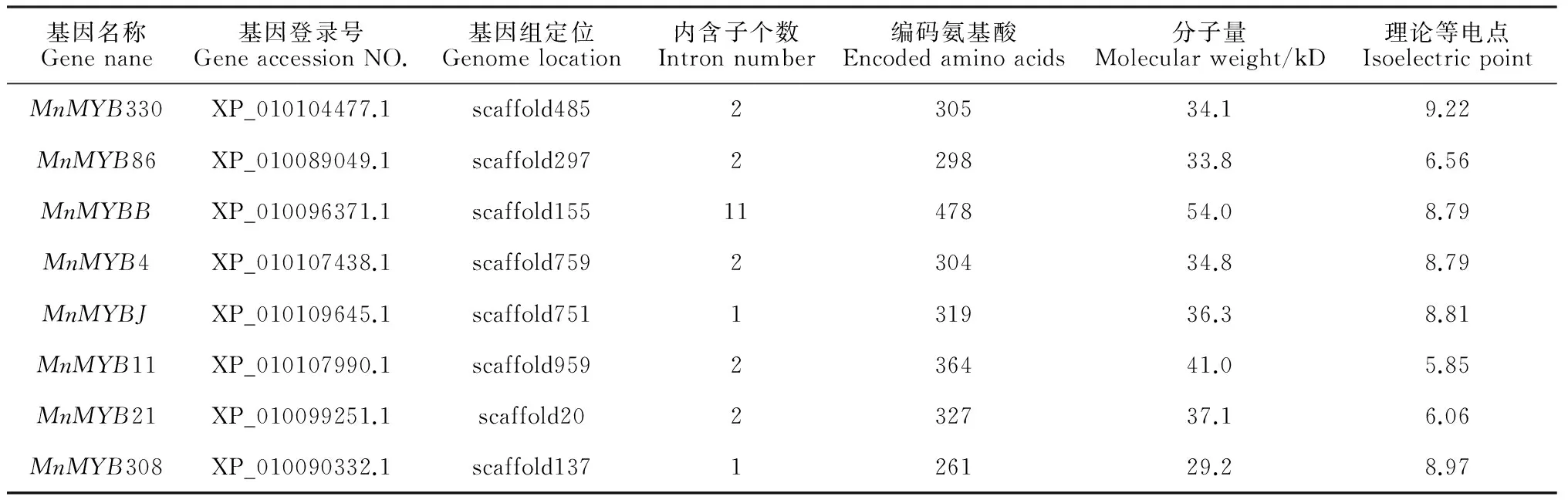
表2 桑树花青素生物合成相关MYB基因家族成员

横线标注为R2、R3蛋白结构域;黑色方框标注为保守的色氨酸(W)残基;MnMYBJ. 川桑(XP_010109645.1); MnMYBB. 川桑(XP_010096371.1);MnMYB21. 川桑(XP_010099251.1); MnMYB86. 川桑(XP_010089049.1); MnMYB4. 川桑(XP_010107438.1); MdMYB110a.苹果(BAJ24837); MdMYB1a. 苹果(ACQ45201); MnMYB330. 川桑(XP_010104477.1); MnMYB308. 川桑(XP_010090332.1); MnMYB11. 川桑(XP_010107990.1); DkMyb4. 柿子(AB503701); PAP1. 拟南芥(NP_176057); C1. 水稻(CAA75509);P. 玉米(AAK81903)图1 桑树MYB蛋白多序列比对The black lines indicated conserved R2 and R3 domain; conserved Try residues was shown by solid box; MnMYBJ. Morus notabilis (XP_010109645.1); MnMYBB. Morus notabilis (XP_010096371.1); MnMYB21. Morus notabilis (XP_010099251.1); MnMYB86.Morus notabilis (XP_010089049.1); MnMYB4. Morus notabilis (XP_010107438.1); MdMYB110a. Malus domestica L. (BAJ24837); MdMYB1a. Malus domestica L. (ACQ45201); MnMYB330. Morus notabilis (XP_010104477.1); MnMYB308. Morus notabilis (XP_010090332.1); MnMYB11. Morus notabilis (XP_010107990.1); DkMyb4. Diospyros kaki Thunb. (AB503701); PAP1.Arabidopsis thaliana (NP_176057); C1. Oryza sativa (CAA75509); P. Zea mays L. (AAK81903)Fig. 1 Protein muli-aligment of MYB genes in mulberry
2.3桑树MYB基因的转录组分析
通过对桑树转录组数据库的检索及分析,发现8个MYB基因在雌花中均有高量的表达(图3)。其中MnMYB86仅在雌花中大量表达,在其他组织中没有检测到转录本;MnMYBB在雌花及叶中表达量较高,在根、表皮及冬芽中表达量较低;MnMYB4在雌花中能检测到表达,在其他组织中表达量较低;MnMYBJ在表皮和雌花中检测到表达,在根、冬芽及叶中没有检测到;MnMYB11在雌花及叶中都具有较高的表达,在根、表皮和冬芽中表达较少;MnMYB21在雌花中大量表达,在表皮及叶中有少量的表达,根及冬芽没有检测到表达;MnMYB330在表皮及雌花中表达量较高;MnMYB308在雌花及叶中高量表达,表皮中有少量表达,根及冬芽中表达量较低。

图中分支点的数字表示基于1 000次重复该节点的自展支持率;标尺代表遗传距离图2 MYB基因家族进化关系The nodes in the figure show the bootstrap value on replications, and the scale represent the genetic distanceFig. 2 The phylogenetic tree of MYB gene family in mulberry
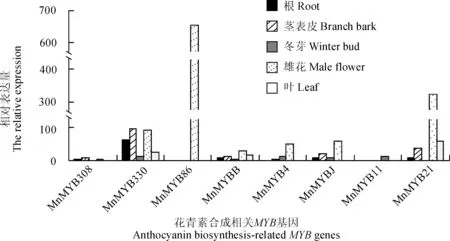
图3 桑树花青素相关MYB基因表达Fig. 3 Transcription analysis of anthocyanin related MYB genes in mulberry
2.4桑椹成熟过程中花青素含量的测定
桑椹是典型的聚花果,从授粉到果实完全成熟需要经历大约35~40 d,根据果实特征与果实外观将整个果实发育时期分为S0~S5等6个时期,其中S0为刚授粉完毕,S5为果实完全成熟,每个时期大概间隔7 d。通过测定不同时期花青素含量,发现从S0~S4的5 个时期中花青素的含量较低,而在S4~S5生长过程中,花青素含量变化了将近8倍,说明这个时期是花青素的快速合成时期(图4)。
2.5MYB基因家族在桑椹发育过程中的表达分析
为了进一步筛选与桑树花青素合成相关的MYB基因,通过实时荧光定量PCR分析基因在花青素合成较快的几个时期(S0、S3、S4和S5)的桑椹中的表达水平。结果显示8个基因呈现不同的表达模式(图5),MnMYB308在果实发育的4个时期都具有较高的表达,MnMYBJ和MnMYB4随着果实的发育呈现下调表达的趋势;MnMYB6在果实发育中呈现早期表达量高和晚期表达量较低;MnMYBB呈现先下调表达再上调表达的趋势;MnMYB330 在果实的发育过程中呈现上调表达,且在果实发育过程中增加了近3倍。
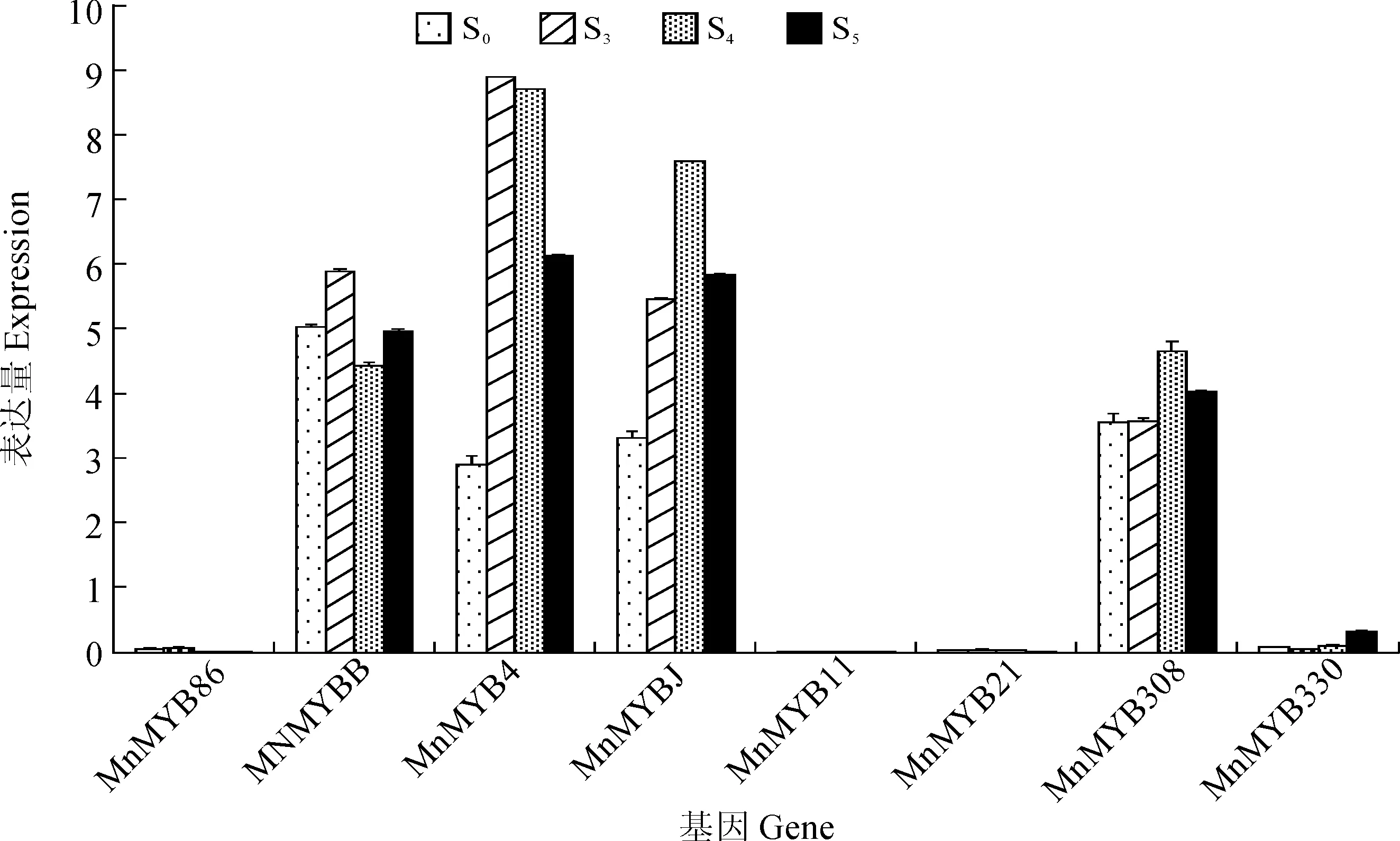
图5 桑树花青素相关MYB基因在果实发育过程中的表达分析Fig. 5 Expression analysis of anthocyanin related MYB genes in different stages of mulberry fruits

S0~S5为盛花后0、1、2、3、4和5周的果实;下同。(注意图中S的数字下标)图4 桑椹发育过程中花青素的含量S0-S5 represent 0, 1, 2, 3, 4, 5 and 6 weeks after full bloom of fruits;The same as belowFig. 4 The content of anthocyanins during the development of mulberry fruits
3讨论
桑椹在发育过程中经历了开花、受精、生长、脱绿、膨大、变红等形态变化过程,在变红过程之前花青素几乎没有合成,而变红时期的几天时间内花青素大量合成[16]。因此,桑椹中花青素的积累取决于果实生长后期关键酶及调控基因表达模式的改变。MYB转录因子是植物中最重要的转录因子家族之一,由4R-MYB、3R-MYB、R2R3-MYB及MYB-related 4个亚类组成[17]。研究表明R2R3-MYB转录因子参与了次生代谢的调控、细胞分化及细胞周期的控制、生物和非生物胁迫的响应等多种生理生化过程[18]。在花青素生物合成的调控中,WD40、bZIP、R2R3-MYB、bHLH及HY5等转录因子可能形成多种复合体,并与结构基因侧翼序列中的顺式作用元件结合,从而抑制或者激活相关基因的表达,调控花青素在植物中的积累[19]。本研究从桑树基因组数据库中鉴定出6个与花青素合成相关的MYB家族候选基因具有典型的R2R3结构。聚类分析发现MnMYB11、MnMYB330和MnMYB308与已经报道的与花青素合成相关的MYB基因DkMyb4[20]、VvMybPA1[21]聚为一类,它们可能是桑树花青素合成的调控基因之一。MYB不仅包括正调控的成员(矮牵牛AN2、AN4),也发现了一些负调控的MYB蛋白(AtMYBL2)[22]。
草莓的FaMYB1蛋白C端具有一个基序pdLNLD/ELXiG/S,可能与一些正调控因子竞争结合靶基因,从而达到调控花青素合成的目的[23]。本研究鉴定出的花青素合成相关的6个R2R3-MYB候选基因在果实发育过程中呈现不同的表达模式。MnMYBJ和MnMYB4随着果实的发育呈现下调表达的趋势,分别下调至1/6和1/8,且在聚类分析中没有和其他植物中类黄酮合成相关的MYB基因聚为一类,其中因此它们可能是桑树花青素合成的负调控基因;MnMYB330 在果实的发育过程中呈现显著上调表达,且在果实发育过程中增加了3倍,可能是桑树花青素合成的正调控基因之一。因此桑树MYB基因家族对花青素的合成与苹果、草莓一样都存在正调控与负调控两种机制,但是参与的MYB基因成员存在较大的差异。然而,由于缺少有效的桑树转基因体系,桑树花青素相关MYB因子的功能有待进一步的验证。
参考文献:
[1]KOSE R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways [J].TrendsinPlantScience, 2005, 10(5): 236-242.
[2]KONCZAK I, ZHANG W. Anthocyanins-more than nature’s colours [J].JournalofBiomedicineandBiotechnology, 2004, 2004(5): 239-240.
[3]程秀玮,魏玮. 响应面优化超声波辅助提取桑葚花色苷工艺的研究[J]. 中国酿造, 2014,(6): 123-127.
[4]KOPONEN J M, HAPPONEN A M, MATTILA P H,etal. Contents of anthocyanins and ellagitannins in selected foods consumed in Finland [J].JournalofAgriculturalandFoodChemistry, 2007, 55(4): 1 612-1 619.
[5]MÜLLER D, SCHANTZ M, RICHLING E. High performance liquid chromatography analysis of anthocyanins in blueberries corymbosum, bilberries (VacciniummyrtillusL.), and corresponding Juices [J].JournalofFoodScience, 2012, 77(4): C340-345.
[6]HASSIMOTTO N M, GENOVESE M I, LAJOLO F M. Antioxidant activity of dietary fruits, vegetables, and commercial frozen fruit pulps [J].JournalofAgriculturalandFoodChemistry, 2005, 53(8): 2 928-2 935.
[7]KANG T H, HUR J Y, KIM H B,etal. Neuroprotective effects of the cyanidin-3-O-beta-d-glucopyranoside isolated from mulberry fruit against cerebral ischemia[J].NeuroscienceLetters, 2006, 391(3): 122-126.
[8]HA U S, BAE W J, KIM S J,etal. Protective effect of cyanidin-3-O-beta-D-glucopyranoside fraction from mulberry fruit pigment against oxidative damage in streptozotocin-induced diabetic rat bladder[J].NeurourologyandUrodynamics, 2013, 32(5): 493-499.
[9]PENG C H, LIU L K, CHUANG C M,etal. Mulberry water extracts possess an anti-obesity effect and ability to inhibit hepatic lipogenesis and promote lipolysis [J].JournalofAgriculturalandFoodChemistry, 2011, 59(6): 2 663-2 671.
[10]CHANG J J, HSU M J, HUANG H P,etal. Mulberry anthocyanins inhibit oleic acid induced lipid accumulation by reduction of lipogenesis and promotion of hepatic lipid clearance [J].JournalofAgriculturalandFoodChemistry, 2013, 61(25): 6 069-6 076.
[11]LI J, LÜ R H, ZHAO A C,etal. Isolation and expression analysis of anthocyanin biosynthetic genes inMorusalbaL.[J].BiologiaPlantarum, 2014, 58(4): 618-626.
[12]DELA G, OR E, OVADIA R,etal. Changes in anthocyanin concentration and composition in ‘Jaguar’ rose flowers due to transient high-temperature conditions [J].PlantScience, 2003, 164(3): 333-340.
[13]ESPLEY R V, HELLENS R P, PUTTERILL J,etal. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYB10 [J].PlantJournal, 2007, 49(3): 414-427.
[14]PAZARES J, GHOSAL D, SAEDLER H. Molecular analysis of the C1-I allele fromZeamays: a dominant mutant of the regulatory C1 locus [J].Embo.Journal, 1990, 9(2): 315-321.
[15]RABINO I, MANCINELLI A L. Light, temperature, and anthocyanin production[J].PlantPhysiology, 1986, 81(3): 922-924.
[16]QI X, SHUAI Q, CHEN H,etal. Cloning and expression analyses of the anthocyanin biosynthetic genes in mulberry plants [J].MolecularGeneticsandGenomics, 2014, 289(5): 783-793.
[17]DAVIDSON C J, TIROUVANZIAM R, HERZENBERG L A,etal. Functional evolution of the vertebrate myb gene family[J].Genetics, 2005, 169(1): 215-229.
[18]ZHANG L, LIU G, ZHAO G,etal. Characterization of a wheat R2R3-MYB transcription factor gene,TaMYB19, involved in enhanced abiotic stresses inArabidopsis[J].PlantandCellPhysiology, 2014, 55(10): 1 802-1 812.
[19]RAMSAY N A, GLOVER B J. MYB-bHLH-WD40 protein complex and the evolution of cellular diversity [J].TrendsinPlantScience, 2005, 10(2): 63-70.
[20]AKAGI T, TSUJIMOTO T, IKEGAMI A,etal. Effects of seasonal temperature changes onDkMyb4 expression involved in proanthocyanidin regulation in two genotypes of persimmon (DiospyroskakiThunb.) fruit [J].Planta, 2011, 233(5): 883-894.
[21]BOGS J, JAFFÉ F W, TAKOS A M,etal. The grapevine transcription factorVvMYBPA1 regulates proanthocyanidin synthesis during fruit development [J].PlantPhysiology, 2007, 143(3): 1 347-1 361.
[22]KYOKO M, YOSHIMI U, MASARU O T. AtMYBL2, a protein with a single MYB domain, acts as a negative regulator of anthocyanin biosynthesis inArabidopsis[J].PlantJournal, 2008, 55(6): 954-67.
[23]AHARONI A, DE VOS C H, WEIN M,etal. The strawberryFaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco [J].PlantJournal, 2001, 28(3): 319-332.
(编辑:宋亚珍)
文章编号:1000-4025(2016)06-1110-07
doi:10.7606/j.issn.1000-4025.2016.06.1110
收稿日期:2016-01-05;修改稿收到日期:2016-05-09
基金项目:贵州省社会发展攻关项目(黔科合SY[2015]3030);贵阳中医学院博士基金
作者简介:李军(1986-),男,博士,副教授,主要从事植物功能基因研究。E-mail: speker@163.com *通信作者:余茂德,教授,博士生导师,主要从事桑树遗传育种研究。E-mail: yumd@163.com
中图分类号:Q786
文献标志码:A
Identification and Function Analysis of Anthocyanin Biosynthesis Related MYB Genes in Mulberry
LI Jun1, ZHAO Aichun2, LIU Changying2, LÜ Ruihua2, LIU Xiaoqing1, YU Maode2*
(1. Guiyang college of Traditional Chinese Medicine, Guiyang 550025,China; 2. Collage of Biotechnology of Southwest University, Chongqing 400715,China)
Abstract:In our study, 8 anthocyanins biosynthesis related MYB candidate genes were identified by using bioinformatics technologies and the expression profiles in different tissues and stages of fruits during the development and determined by transcriptome data and real time PCR. Phylogenetic analysis indicated that 4 MYB genes were closed to MYB genes from Vitis vinifera L., Oryza sativa and Zea mays L., while only 1 MYB gene was grouped into one cluster with those from Arabidopsis thaliana and Malus domestica L.. High level of transcripts of major genes in male flower was determined by transcriptome data. Continuous down-regulation expressions of MnMYBJ and MnMYB4 during the development of mulberry fruits were confirmed, while MnMYB330 had a continuous up-regulation expression. Therefore, MYB genes have positive regulation and negative regulation during the accumution of anthocyanins.
Key words:mulberry; anthocyanins; transcription factors; regulation; expression analysis

